Method Article
Parallel-Platten-Flow-Kammer und Continuous Flow Circuit endothelialen Vorläuferzellen unter Laminar Flow Schubspannung Bewerten
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Methode, um unter adhärenten Zellen eine laminare Strömung Schubspannung in einem sterilen kontinuierlichen Kreislauf. Die Zellen "Haftung kann Morphologie durch die transparente Kammer untersucht werden, Proben aus der Schaltung für Metabolit-Analyse und-Zellen nach Scher-Belastung für zukünftige Experimente oder Kultur geerntet wurden.
Zusammenfassung
Das übergeordnete Ziel dieser Methode ist es, eine Technik, um anhaftenden Zellen zu Laminar-Flow-Bedingungen unterliegen und bewerten ihre Reaktion auf gut quantifizierbar Flüssigkeit Schubspannungen 1 beschreiben.
Unsere Flow-Design und Flow-Schaltung (Bild 1) enthält eine transparente Anzeige Region, die Erprobung von Zell-Adhäsion und Bildgebung von Zell-Morphologie ermöglicht unmittelbar vor Strömung (Abb. 11A, B), zu verschiedenen Zeitpunkten während der Strömung (Abb. 11C) und nach Strömung (Abb. 11D). Diese Experimente sind mit humanen Nabelschnur dargestellt Blut gewonnene endothelialen Vorläuferzellen (EPC) und Schweinen EPCs 2,3.
Diese Methode ist auch anwendbar auf andere Anhänger Zelltypen, wie zB glatten Muskelzellen (SMC) oder Fibroblasten.
Die Kammer und alle Teile der Schaltung sind leicht mit Dampf Autoklavieren sterilisiert. Im Gegensatz zu anderenKammern, kann z. B. Mikrofluid Kammern, eine große Anzahl von Zellen (> 1 Mio. je nach Größe der Zellen) nach dem Flow Experiment unter sterilen Bedingungen für die Zellkultur oder andere Experimente, zB DNA-oder RNA-Extraktion oder Immunhistochemie (Abb. 11E) wiederhergestellt werden, oder Rasterelektronenmikroskopie 5. Die Schubspannung kann durch Variation der Strömungsgeschwindigkeit des Perfusat, der Viskosität der Flüssigkeit oder des Kanals in Höhe und Breite angepasst werden. Letzteres kann zu reduzieren Flüssigkeitsvolumen oder Zelle muss gleichzeitig sicherstellen, dass eindimensionale Tempo beibehalten wird. Es ist nicht notwendig, Kammer Höhe zwischen den Experimenten zu messen, da die Kammer Höhe nicht auf die Verwendung von Dichtungen, das erhöht die Leichtigkeit von mehreren Experimenten ab. Darüber hinaus das Schaltungsdesign leicht ermöglicht die Sammlung von Perfusat Proben für die Analyse und / oder Quantifizierung von Stoffwechselprodukten von Zellen unter Schubspannung Exposition ausgeschieden, z. B. Stickstoffmonoxid (Abb. 12) 6
Protokoll
1. Endotheliale Vorläuferzellen Zellisolation
- Vor einer Sammlung von peripheren menschlichen Blutes, senden Sie Ihre Forschungs-Protokoll, um Ihren Institutional Review Board (IRB), und nach dessen Zustimmung erhalten die freiwilligen Spendern "informed consent (periphere Blutentnahme und EPC isoliert war von der Duke University IRB und genehmigt wurden ist in voller Übereinstimmung mit den US-regulatorischen Anforderungen in Bezug auf den Schutz der menschlichen Forschung Teilnehmer).
- Bei der Arbeit mit tierischen EPCs haben Ihre Forschung Protokoll von Ihrem Institutional Animal Care genehmigt und Verwenden Committee (IACUC). Alle unsere Schweine Experimente war von der Duke University IACUC genehmigt worden und wurden in Übereinstimmung mit den höchsten Standards der humanen Pflege durchgeführt.
- Für die Isolierung von endothelialen Vorläuferzellen, sammeln 50 ml peripheren Blut über Standard-Aderlass-Technik aus einer Einwilligung freiwillig Spender in Blutentnahme Taschen mit dem Antikoagulans Citrat gefüllte-Phosphat Dextrose und verdünnt die Lösung 1:1 mit gepufferter Salz Hank-Lösung (ohne CaCl 2, MgCl 2, MgSO 4) und Schicht auf gleiche Volumina Histopaque klar definierte Schichten zu erstellen.
- Zentrifuge (30 min, 740 g, niedrige Break-Einstellung) und sammeln die mononukleären Zellen (MNC) (Buffy-Coat-Schicht). Resuspendieren und waschen MNCs x 3 mit Dulbeccos Phosphate Buffered Saline (DPBS) mit 10% fötalem Rinderserum (FBS) x 10 min, 515 g, vor dem Ausplattieren in zwei 12-Well-Platten in voller EPC Wachstumsmedium (MCDB-131 Medium mit 5 ml 200 mM L-Glutamin, 10% FBS und EGM-2 SingleQuots) bei 37 ° C, 5% CO 2.
- Langsam Medium alle 24 Stunden für die ersten 7 Tage, dann jeden zweiten Tag zu ändern. EPC Kolonien können nach einer durchschnittlichen Zeit von 14 Tagen auf ihren kopfsteingepflasterten Morphologie identifiziert werden. Sobald EPCs in der Kultur abdecken ¼ der 12-Well-Oberfläche erweitern Zellen und bestätigen EPC Identität mit der Durchflusszytometrie durch die Prüfung auf das Vorhandensein von OberflächenmarkerCD31 und das Fehlen von CD14, CD45, wie zuvor 6 beschrieben. Andere Tests, die durchgeführt werden können Zellmorphologie und Markierung mit DiI-Ac-LDL.
- Für die hier beschriebenen Experimente, erweitern isolierten EPCs, bis sie fast konfluent in 3 T-75 Zellkulturflaschen in EPC-Medium in einem befeuchteten Inkubator bei 37 ° C, 5% CO 2.
2. Schubspannung Berechnung
- Wir empfehlen, dass diese Berechnungen vor der Fertigung der Kammer und den Kanal, um ein gründliches Verständnis der Bedingungen, die erreicht werden können durchgeführt werden. Berechnen Sie die Strömungsgeschwindigkeit des Perfusat in Ihrer Schaltung auf den gewünschten Schub Basis betont, um die Zellen gemäß Gleichung 1 1 angewendet werden,

wo Q die gewünschte Durchfluss wird, ist τ das Ziel shören Beanspruchung tangential auf die Zellen, w die Breite der Flusskammer ist, ist h die Höhe der Flusskammer und μ ist die Viskosität des Perfusat (Fördermedium).
- Ein typischer Wert der Viskosität (μ) für Medium beträgt 0,9 cP (0,009 g cm -1 s -1). Beachten Sie, dass die Viskosität kann auch durch Verwendung von hochmolekularen Dextran, wenn so 7 gewünscht erhöht werden. Ein typischer Wert von target Schubspannung (τ) verwendet ist 15 Dyn / cm 2, (typisch arterielle Schubspannung) bzw. 100 dyn / cm 2, wenn supra-physiologischen Schubspannung gewünscht ist. Unsere Kammer hat typischerweise eine Breite (w) von 1,9 cm und Höhe (h) im Bereich von 166 bis 267 um.
3. Durchlaufkammer Fertigung
- Schneiden Sie die oberen und unteren Platten von the Kammer aus Aluminiumlegierung 6061 rechteckige Lager mit Top-Dimension 7 x 2 x 0,5 "und unten Abmessungen von 7 x 2 x 0,25".
- Recess die obere Platte in den mittleren Bereich bis 0,125 "tief, so dass 0,950" per Ende für 1,375 "breit x 0,3125" deep Flüssigkeitsbehälter.
- Drill 1 / 16 "wide x 0.625" lange Schlitze auf der Unterseite, um das Reservoir auf dem Zufluss und Abfluss endet eindringen.
- Am Ende eines jeden Kopfplatte, bohren Sie ein zentral gelegenes 10/32 "Spuren pro Zoll (TPI) Loch für Polypropylen 1 / 8" Schlauchtülle mit dem Fluidreservoir eindringen. Auf den Zufluss Ende, erstellen Sie eine Seite Stecker mit 10/32 "TPI durch das Loch für Polypropylen 1 / 8" Schlauchtülle.
- Taper oben Unterseite von der Flüssigkeit Zulauf zur Sichtfenster auf 0,518 Grad für eine ausreichende Durchmischung der Flüssigkeit.
- Schneiden Sie einen Objektträger aus Glas Fenster in die Bodenplatte im Einklang mit den Top-Sichtfenster. Mit Aquarium Zement, Leim einem Glasträger in die Kammer. Lassen Sie für mindestens 24 Stunden aushärten.Stellen Sie sicher, dass das Sichtfenster so vertieft ist, dass ein 75 x 25 x 1 mm Mikroskop Objektträger wird bündig in die Kammer.
- Erstellen Sie eine Aussparung für einen O-Ring um die Unterseite des oberen und unteren Platten, so dass sie voneinander entfernt sind um 0,02 Abstand. "Legen Sie die Gummi-O-Ringe.
- Drill 10 passenden 8 / 32 "TPI Löcher in Ober-und Unterseite Kammern für die Verwendung mit 8 / 32" Flachkopfschrauben.
4. Flow-Schaltung Montage
- Montieren Sie den gesamten Fluss Kreislauf, dann mit deren Sterilisierung fort.
- Bringen Sie einen 36 "-Segment der harten Schlauch an einem Ende der Pulsationsdämpfer (via 1 / 8"-Anschluss). Um das andere Ende, fügen Sie einen 18 "-Segment von weichen Schläuchen.
- Legen Sie ein 1 / 8 "männlichen Luer-Adapter am Ende der 18" weichen Schlauch Abschnitt in Schritt 4.2. Verbinden Sie den männlichen Luer zu einer 1 / 8 "female Luer-Adapter. Bringen Sie den Luer einen neuen 18"-Segment weichen Schlauch.
- Bohren Sie drei Löcher in einem 250 ml Becherglas Kappe, um Schläuche passen. Ichnsert einem 1,5 "-Segment von weichen Schlauch (als Entlüfter) in ein Loch und die freien Enden der harten und weichen Schlauch durch die anderen 2 Löcher in den Deckel in die 250 ml Glasflasche (als Reservoir) (Abb. 2). Stellen Sie sicher, dass die harte Schlauch den Boden des Behälters reicht (wie Abfluss-Schlauch aus dem Reservoir).
- Sterilisieren Sie die oben genannten Teile durch Dampf Autoklavieren bei 121 ° C für 60 min. Zusätzlich Autoklaven eine komplette Flusskammer, 3 x 2 "Segmente weichen Schlauch, 1 Rüde und 1 Hündin 1 / 8" Luer-Adapter, 4 x ½ "und 6 x 5 / 16" 8-32 Flachkopfschrauben, 1 Pinzette , eine 75 x 25 x 1 mm Glasplatte (oder einem anderen gewünschten Zelloberfläche Material), und 2 OP-Handtücher.
- Legen Sie sterile Tücher in Laminarströmungshaube. Setzen Sie den Flow-Schaltung, Flusskammer, 4 x 4-Wege-Hähne, 1 x 1-Wege-Hahn, und all die sterilisierten Teile aus Schritt 4.5 auf diese sterilen Bereich.
- Nun können Sie sterile Handschuhe, zwei 4-Wege-Hähne zu verbinden. Legen Kappen auf dem offenen Probe-Ports.
- Lösen Sie die männlichen und weiblichen Luer-Adapter Befestigung der beiden Soft-Schlauch Segmente des flow-Schaltung und legen Sie die angeschlossenen Hähne (Abb. 3).
- Befestigen Sie den weichen Schlauch in den Tank zu einer 30 ml Spritze eingesetzt und entfernen Sie die Spritze Kolben. Füllen Sie die Flasche mit 125 ml EPC Medium (Abb. 4).
- Legen Sie eine sterile Spritze Filter in die Entlüftung (Abb. 4).
- Bewegen Sie den Flow-Schaltung in einem befeuchteten Inkubator bei 37 ° C, 5% CO 2.
- Klemmen Sie den harten Rohr in die Rollen-Pumpenkopf für den Einsatz mit dieser Art von Schläuchen (Abb. 5) angegeben. Stellen Sie sicher, dass der Schlauch nicht mit der Walze Pumpenbefestigung Tracks überschneiden. Mark den Schlauch, wo es aus dem Pumpenkopf auf beiden Seiten mit einem Filzstift.
- Stellen Sie sicher, dass alle Hähne aus in Richtung der Probe Ports geschlossen und öffnen Sie entlang des Flusses Schaltung. Starten Sie die Pumpe. Überprüfen Sie die Richtung des Flusses. Das Perfusat bewegen sollte from das Glas Reservoir durch die harte Schlauch in den Pulsationsdämpfer.
5. EPC Fluoreszenzmarkierung
- Während der Fluss Schaltung erwärmt sich auf 37 ° C, bereiten die Zellen für die Aussaat auf die Folie. Beachten Sie, dass Fluoreszenzmarkierung erforderlich ist, wenn Zellen werden auf undurchsichtige Materialien, zB Titan (Ti) visualisiert werden.
- Erstellen Sie eine 1 mM Stammlösung von Cell Tracker Orange (CTO) durch Verdünnung 50 ug CTO Pulver mit 90 ul Dimethylsulfoxid (DMSO). Achten Sie darauf, diese Mischung aus Belichtung (ausschalten Licht beim Arbeiten unter Abzugshaube) zu schützen.
- Erstellen Sie eine 2 uM funktionierende Lösung von CTO durch Verdünnung 36 ul des CTO Stammlösung in 18 ml serumfreiem MCDB-131 Medium.
- Spülen Sie EPCs in 3 nahe konfluenten T-75 Zellkulturflaschen mit 10 ml DPBS (ohne Ca oder Mg).
- 6 ml der 2 uM CTO funktionierende Lösung zu jeder Flasche. Inkubieren für 15 min bei 37 ° C. Spülen Sie jede Flasche x 2 mit 10 ml DPBS (ohne Ca oder Mg).
- 4 ml Trypsin in jeden Kolben. Bei 37 ° C für 3 min. Neutralisieren mit 8 ml Trypsin Neutralisation Solution.
- Wash durch Zentrifugation x 5 min bei 600 g und Resuspendieren in 5 ml Medium EPC.
6. Zell-Aussaat von slide vor Kammeranordnung flow
- Eine Folie aus Glas, Titan oder anderen Materialien verwendet werden, und der Gleitfläche kann durch Spin-Coating mit Polymer modifiziert werden oder das Hinzufügen einer Schicht aus Metall. Legen Sie die Folie in einen sterilen rechteckigen Vier-Kammer-Zellkulturschale (oder Gewebekulturen slide Kolben, wenn Polystyrol-Oberfläche gewünscht wird). Zählen von Zellen und Samen 1,5 x 10 6 Zellen auf den Objektträger in 5 ml Medium EPC x 6 hr, wenn eine konfluente Zellschicht zu Beginn der Strömung (Abb. 11A) gewünscht wird.
- Um Zellausbreitung und Haftung unter Schubspannung Test, erlauben 3 x 10 6 Zellen für nur 15 min vor Beginn der Strömung (quick-Seeding) einzuhalten ( Bild. 11B).
7. Flow-Kammeranordnung
- Mit sterilen Handschuhen, schließen Sie ein 2 "weichen Schlauch-Segment zu einem 1 / 8" female Luer-Adapter. Connect 2 weitere "weiche Schläuche Segment zu einer 1 / 8" männlichen Luer-Adapter.
- Befestigen Sie die 2 "Soft-Schlauch mit Luer-Adapter, um den Zufluss-Port. Schließen Sie die 2" Soft-Schlauch mit Luer den Abfluss-Anschluss. Bringen Sie 4-Wege-Hähne, diese beiden Luer-Adapter. Schließen Sie die restlichen 2 "soft Schlauchstück an der Seite-Anschluss kommen aus der Blasenfalle und fügen Sie eine 1-Wege-Hahn (Abb. 6).
- Mit einer sterilen Pinzette, entfernen Sie die Zell-seeded Folie aus der Zellkulturschale (oder bei Verwendung einer Folie Kolben, entfernen Sie den Kolben auf Folie) und legen Sie sie in die Aussparung auf der Bodenplatte der Flusskammer. Stellen Sie sicher, dass die Folie mit dem Zell-seeded Seite nach oben gelegt wird.
- Pipettieren von 10 ml warmem EPC Medium auf die Folie. Lassen Sie das Medium, um die Dia-und Flusskammer, b Deckelut nicht verschütten das Medium über den O-Ring auf der Bodenplatte.
- Legen Sie die obere Platte der Flusskammer auf die Bodenplatte, richten Sie die Schraubenlöcher. Achten Sie darauf, um Luftblasen in die Kammer eingeführt bei diesem Schritt, indem sie die beiden Platten parallel.
- Screw Platten zusammen (ein automatischer Akkuschrauber beschleunigt diesen Prozess).
- Entfernen Sie Luftblasen aus Zufluss Blasenfalle durch Öffnen der 1-Wege-Hahn an der anströmseitigen Blasenfalle Hafen und schonend spülen den Zustrom Schlauch mit EPC-Medium mit einem 10-ml-Spritze. Dann schließen Sie dieses Hahn und Kappe es (Abb. 7).
- Jetzt entfernen Sie Luftblasen aus der Kammer-Kanal durch das Öffnen der Ausströmöffnung 4-Wege-Hahn und durch vorsichtiges Spülen EPC Medium durch die Strömungskammer, erneut mit einer 10 ml Spritze. Wenn große Blasen bleiben, erhöhen den Abfluss Ende der Kammer zu einem Winkel von 45 ° (Abb. 8).
- Cap allen der 4-Wege-Hahn-Verbindungen und schließensie ab. Bewegen Sie die Flusskammer in den Brutschrank mit den versammelten Flow-Schaltung (Abb. 9).
- Pause den Fluss-Pumpe. Schließen Sie die Strömung Schaltung Hähne in der Fließrichtung, um ein Auslaufen zu verhindern und zu halten, die im Inneren der Kammer steril. Transport der Flusskammer aus der Werkbank, um den Fluss Schaltung. Schließen Sie die Flusskammer, um den Fluss Schaltung. Öffnen Sie die Hähne in der Fließrichtung. Fortsetzen der Strömungspumpe. Stellen Sie sicher, dass das Perfusat in die richtige Richtung fließt. Stellen Sie den Durchfluss auf den gewünschten Scherbeanspruchung.
- Während der Fluss Experiment kann der Flusskammer aus dem Kreislauf zu Bild werden die Zellen über Licht-oder Fluoreszenzmikroskopie entfernt. Um dies zu tun, trennen Sie die Flusskammer aus dem Fluss Schaltung an der Hahn-Hahn-Verbindungen. Um der Aufrechterhaltung der Sterilität der Kammer, in der Nähe vom Fluss Schaltung Hähne und Flusskammer Hähne in der Fließrichtung und Kappe alle Hähne vor dem Entfernen des Strömungskreisaus dem Inkubator (Abb. 9).
8. Perfusat Probenentnahme
- Für eine einfache Sammlung von Perfusat Proben für die Analyse (zB Stickoxid-Synthese), erste Pause der Pumpe.
- Schließen Sie den Hahn am nächsten an der Pulsationsdämpfer. Entfernen Sie die Schutzkappe und legen Sie eine kleine Spritze, z. B. 3-ml-Spritze, in die Probe-Port. Halten Sie Kappe und sicherzustellen, dass sie nicht, indem sie auf den Kopf kontaminiert werden.
- Schließen Sie den Hahn in Richtung der Flusskammer, halten die Probe Hafen und Schaltung in die Richtung der Pulsationsdämpfer öffnen.
- Draw gewünschte Menge der Probe, z. B. 150 ul, aus dem Kreislauf. Schließen Sie den Wasserhahn auf die Probe Hafen vor dem Entfernen der Spritze. Bewahren Sie das Perfusat Probe in ein beschriftetes Fläschchen und frieren bei - 80 ° C (für Stickstoffmonoxid Bestimmung zu einem späteren Zeitpunkt).
- Recap der Probe Hafen und sicherzustellen, dass alle Hähne offen vor Beginn werden flow.
9. Repräsentative Ergebnisse
Mit unserem Quick-Seed-Methode können menschlichem Blut gewonnene endothelialen Vorläuferzellen auf Titan Folien für 15 Minuten ausgesät werden und haften unter physiologischen (arterielle) Scherkräfte von 15 Dyn / cm 2.
Wie in Abbildung 10 dargestellt, EPCs unter dem Einfluss der Strömung von 210 ± 11,4 um 2 verteilt, sofort nach der Aussaat auf 657 ± 39,1 um 2 nach 3 Stunden, und bis 1152 ± 55,3 um 2 nach 24 Stunden von Flüssigkeit Schubspannung von 15 Dyn / cm 2 (Unterschied zwischen den Gruppen ist statistisch signifikant mit p <0,0001, 1-Wege-ANOVA). Parallel zum Anstieg der Zell-Bereich, die durch die transparente Kammer mit Licht-oder Fluoreszenz-Mikroskop abgebildet werden können, die Rundheit nach Gleichung 2 6 berechnet
/ Files/ftp_upload/3349/3349eq2.jpg "/>
sank von 878 x 10 -3 ± 5,9 x 10 -3, sofort nach der Aussaat bis 671 x 10 -3 ± 19,2 x 10 -3 nach 3 Stunden und 526 x 10 -3 ± 19,2 x 10 -3 nach 48 Stunden der gleichen Flüssigkeit Schubspannung Exposition (Unterschied zwischen den Gruppen wieder statistisch signifikant mit p <0,0001, 1-Wege-ANOVA).
Abbildung 11D zeigt, dass EPCs ausrichten und orientieren in der Fließrichtung nach 48 Stunden von Flüssigkeit Scherspannung bei 15 dyn / cm 2 im Hinblick auf ihre zufällige Orientierung nach einer statischen Aussaat Zeitraum von 6 Stunden, wie in Abbildung 11A gezeigt, verglichen.
Unsere Methode ermöglicht es auch für den Erhalt einer Probe des Perfusat an vorbestimmten Zeitpunkten für die Analyse und / oder Quantifizierung von sekretierten Zelle Metaboliten. Als repräsentatives Beispiel bilden wir die ProduktionTION von Nitrit (NO 2 -) während einer 48 Stunden Flow Experiment mit Schweinen EPCs in Abbildung 12. Wir direkt gemessen diese primäre Oxidationsprodukt von Stickstoffmonoxid (NO) als Surrogat-Marker für die NO in Medium-Proben aus dem Fluss Schaltung an den verschiedenen Zeitpunkten gesammelt auf 12,0 nmol 6 Stunden, 13,1 nmol in 12 Stunden, 16,3 nmol bei 24 werden Stunden, und 24,6 nmol nach 48 Stunden für 1 x 10 6 Zellen bei 15 dyn / cm 2 6.
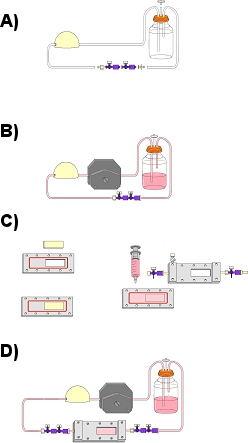
Abbildung 1. Schematische Darstellung einen Überblick über die Strömungskreis Montage und Flow Experiment. (A) Flow-Schaltung Montage ohne Flusskammer. Hier sind das Reservoir, Pulsationsdämpfer, harte Schläuche, weichen Schlauch, 4-Wege-Hähne und mit Luer-Adapter, sowie Luftfilter enthalten. (B) anschließen Flusskammer über das harte Rohr-Segment, um den Fluss Pumpenkopf. (C) In Einschiebung des EPC-seeded Abgleiten in die Bodenplatte der Flusskammer (D). Komplette Montage der Strömung Schaltung mit dem Strömungsraum.

Abbildung 2. Komplett montiert Strömungskreis für die Sterilisation.
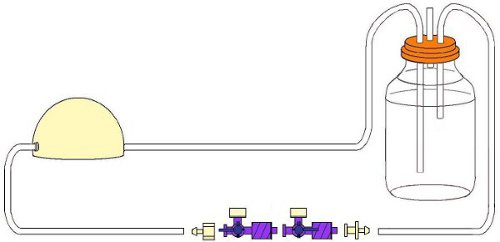
Abbildung 3. Assembled flow Schaltung nach der Sterilisation mit Hähnen enthalten.
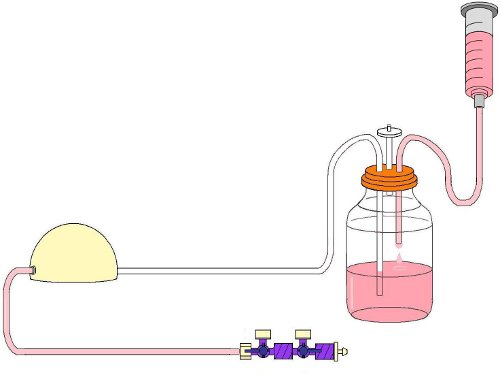
Abbildung 4. Füllung des Glases Reservoir mit 125 ml EPC Medium.
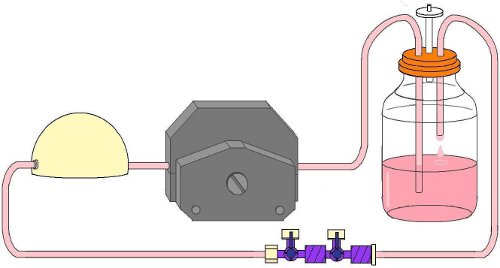
Abbildung 5. Flow-Schaltung geklemmt in den Fluss Pumpenkopf vor Flusskammer Insertion.
jpg "/>
Abbildung 6. Top Kammerplatte Montage.
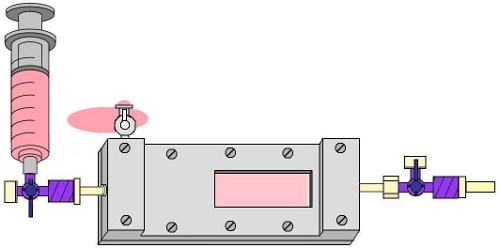
Abbildung 7. Flushing der Blasenfalle mit EPC mittel-bis Blasen aus Anströmseite der Kammer zu entfernen.
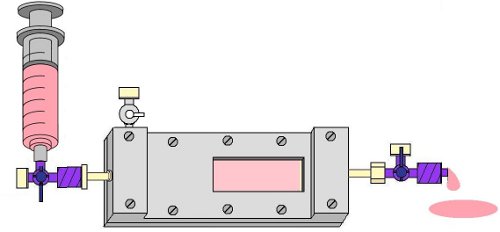
Abbildung 8. Flushing der Kammer mit EPC mittel-bis Blasen aus der Folie und Abfluss Seite der Kammer zu entfernen.
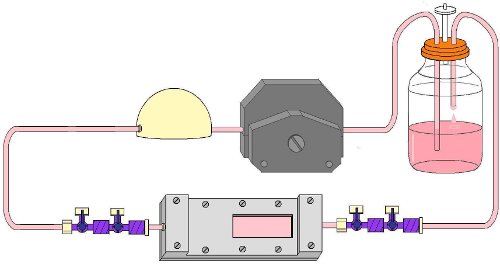
Abbildung 9. Komplett Flow-Schaltung mit eingefügt Flusskammer während einer Flow Experiment aufgebaut.
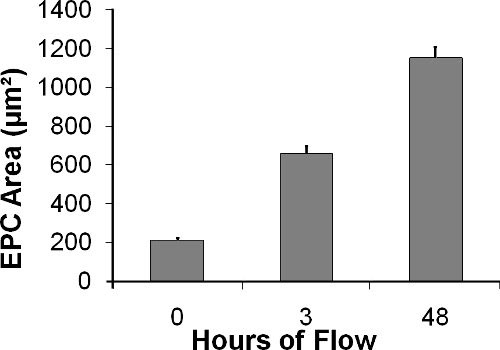
Abbildung 10. EPC-Bereich (in &mgr; m 2) erhöht sich im Laufe der Zeit Verlauf der Strömung zu experimentieren.
files/ftp_upload/3349/3349fig11.jpg "/>
Abbildung 11. (A) Lichtmikroskopische Aufnahme HUCB EPCs auf eine Fibronektin beschichteten Objektträger x 6 Stunden vor der Flow bei 100-facher Vergrößerung ausgesät. (B) HUCB EPCs beschriftet mit CTO und schnell ausgesät auf eine Ti slide x 15 min vor dem Fluss, visualisiert mit Fluoreszenz-Mikroskopie bei 100-facher Vergrößerung. (C) Das gleiche Ti Rutsche mit HUCB EPCs wie unter (B), nach 3 Stunden flow bei 100 dyn / cm 2 und abgebildet durch den transparenten Kammer bei 100-facher Vergrößerung. Beachten Sie die Ausbreitung von Zellen, aber immer noch zufällige Orientierung nach 3 Stunden fließen. (D) Das gleiche Ti Rutsche, jetzt nach 48 Stunden fließen Exposition bei 100-facher Vergrößerung. EPCs mit CTO und Zellkerne sind mit Hoechst-Farbstoff (blau) nach flow gebeizt beschriftet. Beachten Sie die Ausrichtung der Zellen in der Fließrichtung. (E) Porcine EPCs zum Vergleich auf Ti nach 48 Stunden fließen und 15 dyn / cm 2 der Schubspannung Exposition. Zellgrenzen wurden mit anti-PECAM-Färbung (grün) und Zellkerne mit Sytox orange Nucleic Acid-Färbung gefärbt. Beachten Sie die Ausrichtung der Zellen in die Richtung des Flusses.
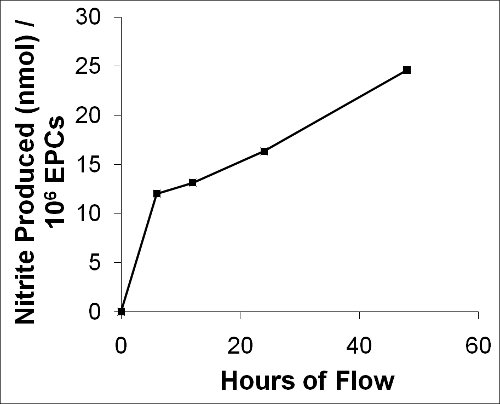
Abbildung 12. Graph zeigt die NO-Produktion von Schweine-EPCs während 48 Stunden fließen. Ein primäres Oxidationsprodukt von NO, Nitrit (NO 2 -), wurde als Surrogat-Marker für die NO von mittel-Proben zu verschiedenen Zeitpunkten während des Fließens gesammelt gemessen.
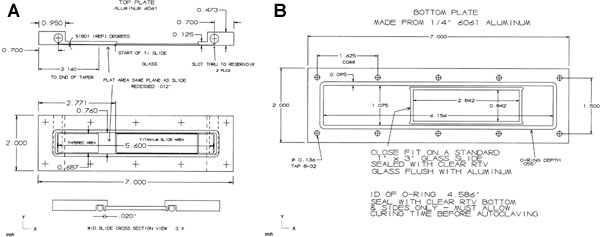
Abbildung 13. Die Flusskammer aus Aluminiumlegierung 6061 rechteckige Lager, mit dem oberen Teil (A) 0,5 "x 2" x 7 "und der untere Abschnitt (B) 0,25" x 2 "x 7" in der Dimension. Die Oberseite istgeplant auf ihrer Unterseite O-Ring-Kontaktfläche auf 0,45 ", um Ebenheit zur Abdichtung zu gewährleisten. Der obere Teil in seinem Mittelteil ist auf 0,125 versenkt", die Blätter 0,95 "per Ende für eine 0,3125" x 1,375 "Ausgleichsbehälter. Die Oberteil ist Reservoir 3/8-24 TPI und 0,25 "tief mit Gewinde Edelstahl-Stecker erhalten gefädelt. Slots Messung 1 / 16 "x 0,625" wurden in der Unterseite, die das Reservoir eindringen bearbeitet. Die Anströmseite Stecker hat einen 10/32 "durch das Loch für eine Polypropylen 1 / 8" Schlauchtülle an einen Hahn zu befestigen. Jede Einheit Ende hat ein zentral gelegenes Gewinde 10/32 TPI um 0,25 "deep Teil für eine Polypropylen 1 / 8" Schlauchtülle in den 0,45 "x 2" zu beenden. Die Enden mit einem 0,07 "Bohrung von der Unterseite der Fäden durch das Reservoir eindringen. Die Unterseite des oberen Abschnitt hat eine konische Fläche 0,6875" breit, 0,518 Grad von der Mitte eines LH-Slot für eine Distanz von 1,460 ". Diese Verjüngung Mischungen auf eine ebene Fläche 0,6875 "breit x 0,0118" tief und 0,590 "aus dem Ende des Glas-s (oder einer anderen Oberfläche, z. B. Titan Folie) Aussparung. Diese Wohnung muss bündig mit dem Glas (oder einer anderen Oberfläche, z. B. Titan schieben), wenn die Rutsche installiert ist. Die Verjüngung und flach sind poliert. Die Oberfläche der Folie ist 0,0118 "von der Unterseite Oberfläche eingelassen. Die 0,0118" Vertiefung weiterhin das Reservoir Steckplatz auf der RH zu beenden. Ein O-Ring ist komplett um-Steckplätze und schieben Sie verlassen 0,020 "der ursprünglichen Oberfläche zwischen den O-Ring-Nut und Schieber versenkt. Die oberen und unteren Einheiten für zehn Löcher gebohrt. Der obere Abschnitt hat Durchgangslöcher für 8 / 32 TPI Senkschrauben Schrauben. Der untere Teil hat Löcher platziert Anpassung der oberen Löcher und Gewinde 8 / 32 TPI. Die untere Einheit hat eine klare Glasscheibe Fenster bündig mit der Oberfläche, über die Zelloberfläche Glasträger (oder Titan Folie) befindet. Die Einheit hat eine O-Ring-Nut, welche Slots umfasst in der oberen Einheit mit einer Breite bis 0,04 leave "von Original-Oberfläche zwischen dem unteren Schlitten und den inneren O-Ring-Nut. Die O-Rings sind rot Silikon AS568A, Dash Nummer 044 für den oberen Teil und 046 für den unteren Abschnitt.
Diskussion
Unsere Flow-Schaltung und Flusskammer es uns ermöglichen, adhärente Zellen, z. B. EPC, definiert Flüssigkeit Schubspannungen Thema. Da die Kammer oben und unten sind transparent, Zelladhäsion und Morphologie kann entweder in Echtzeit ausgewertet werden, durch die Kammer selbst, oder nach einer Flow Experiment und Demontage der Flusskammer. An diesem Punkt können die Zellen unter sterilen Bedingungen geerntet und entweder neu verchromt oder verwendet werden, um ihre DNA oder RNA, etc., zur weiteren Analyse zu sammeln.
Um dies zu erreichen laminare Strömung, muss der Aufbau der Kammer sein, dass mehrere Bedingungen erfüllt sind.
Erstens muss die Strömung laminar, die durch die Berechnung ihrer Reynolds-Zahl (Re), die das Verhältnis der Trägheitskräfte zu viskosen Kräften überprüft werden kann. (Wenn viskosen Kräfte dominieren, ist Re klein und die Strömung laminar oder "voll entwickelt" - in der Regel für Re <2300.Wenn Trägheitskräfte überwiegen, die Strömung mehr und mehr zufällig wird, bis es turbulent wird, wie es der Fall für Re> 4000). Wir berechnen Re nach Gleichung 3 8,

Wo ρ die Dichte der Flüssigkeit ist, Q die Flussrate, μ die Viskosität ist, werden w und h die Breite und die Höhe der Kammer, bzw., und D h ist der hydraulische Durchmesser, definiert nach Gleichung 4 8,
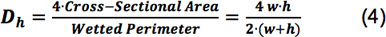
Die Reynolds-Zahl von unseren drei Strömungskammern, mit Höhen zwischen 166 bis 267 mu m, Reichweite von 13,9 bis 34,6 bei Flussraten cerechnet zu einer Schubspannung von 15 dyn / cm 2 zu erhalten. Bei Flussraten für eine Schubspannung von 100 dyn / cm 2 berechnet, lagen die Reynolds-Zahl der Kammern von 90,4 bis 234. Alle diese Reynolds-Zahlen sind viel niedriger als 2300 und das Kriterium für die laminare Strömung.
Zweitens, für die Geschwindigkeit ein und Schubspannung werden unabhängig von der Entfernung entlang der Strömungskanal (dh voll entwickelten), der Abstand von der Fluideinlass zu rutschen muss länger sein als der Eingang Länge, L e. Dies kann durch die Berechnung der Eingang Länge zufrieden sein, nach Gleichung 5 9.

Für die oben aufgeführten Werte liegt der Eingang Länge von 0,01 bis 0,25 cm.
Drittens, um sicherzustellen, dass die Geschwindigkeit und Schubspannung in der seitlichen Richtung nicht ändernwesentlich von dem Wert für eindimensionale Gerinne (Δ Ph / 2L), muss das Verhältnis h / w sehr viel weniger als 1 ist. Für den durchschnittlichen Wandschubspannung unter zweidimensionalen Strömungsverhältnisse zu 95% der Wandschubspannung unter eindimensionale fließen kann, muss h / w gleich 0,10, und für die Wandschubspannung unter zweidimensionalen Strömungsverhältnisse zu sein 97,5% der Wandschubspannung unter eindimensionale fließen kann, muss h / w gleich 0,05. Mit den Dimensionen unserer konzipiert Flusskammer 1,7 cm in der Breite und 166 bis 267 mu m Höhe, sind diese Kriterien erfüllt.
Der Druck wird nur unterschiedlich in der Fließrichtung, wenn es keine seitlichen Druckgradienten am Eingang sind. Dies kann unter Verwendung von Farbstoffen oder Partikel in den Strömungsweg werden. Weitere, für die stetigen Versuche, ist ein Pulsationsdämpfer in den Fluss Schaltung eingefügt. Die Pulsationsdämpfer nimmt den größten Teil der pulsgibt Auskunft über die durch die Rollenpumpe in der Schaltung, und ermöglicht es uns, etwa die Übernahme der stetigen Fluss. Zu beachten ist, sollte der Pulsationsdämpfer eingesetzt werden mit der Pumpe und Schlauch in der Schaltung verwendet, so dass es effektiv beseitigen können Pulsationen in den Förderstrom für die spezifischen Frequenzen der Rollenpumpe. In unserer Demonstration der Masterflex L / S Pulsationsdämpfer erreicht laminare Strömung, wenn auf der Druckleitung mit einem Masterflex L / S-Serie Pumpe (0 bis 600 RPMs) und I / P 26 Schläuche. Für pulsatilen Fluss kann eine programmierbare Pumpe verwendet, um verschiedene Wellenformen erzeugen.
Für pulsatilen Fluss kann eine programmierbare Pumpe verwendet, um verschiedene Wellenformen erzeugen.
Darüber hinaus ist die Schaltung so, dass Proben von Perfusat konzipiert leicht zu unterschiedlichen Zeitpunkten, ohne die Gefahr einer Verunreinigung der Zellen oder Flow Medium gesammelt werden. In unserem Beispiel ist die Konzentration von NO 2 - wurde durch Chemilumineszenz mit gemessenenein Ionics / Sievers Stickstoffoxid Analyzer (NOA 280, Sievers Instruments, Boulder, CO), wie zuvor 10 beschrieben. Das Reduktionsmittel für Nitrit-Analyse verwendet wurde Kaliumiodid in Essigsäure (14,5 M Essigsäure und 0,05 M KI), die das Reduktionspotenzial zu Nitrit zu NO konvertiert hat, aber nicht ausreicht, um einem höheren Stickstoffoxide wie Nitrat zu reduzieren und somit relativ spezifisch für Nitrit. Der Gesamtbetrag Nitrit produziert wurde als das Produkt der Konzentration produziert und das Gesamtvolumen der Schaltung berechnet während der Einstellung für die Lautstärke verloren während der Einnahme von Proben 6.
Die folgenden Schritte sind entscheidend für die erfolgreiche Durchführung von Flow-Experimente:
- Es ist wünschenswert, um eine Blasenbildung während des Durchflusses Set-up zu vermeiden, da Blasen das Potenzial zum Abreißen Zellen von ihrer Oberfläche besitzen. Dies kann durch die Betreuung bei der Platzierung im oberen Teil der Flusskammer auf das Unterteil, das am besten vermieden werdenerreicht, indem sie beide parallel zueinander und Senken der Spitze auf den Boden in einer Bewegung ohne Anpassungen. Dabei kleinen Luftbläschen, die vorhanden sein und / oder variabel in den Strömungskanal kann, wird in den Blasenfallen an jedem Ende des Aluminium-Gehäuse abgeleitet werden.
- Es ist wichtig, um sicherzustellen, dass der Abfluss-Schlauch in den Behälter nach unten reicht, um das Reservoir der Unterseite. Andernfalls kann Luft in den Schlauch, die aus dem Reservoir in die Kammer führt, wenn das Perfusat sinkt leicht unter dem Schlauchende angesaugt werden.
- Die Forscher sollten mit der Leitung von der Pumpe fließen, so dass die Pumpe nicht versehentlich in die entgegengesetzte Richtung mit Beginn der Strömung, die würden in Luft in den Kreislauf und gesaugt Ergebnis führen.
- Zur Vermeidung der Bildung von Schaum (wegen denaturierter Proteine im Serum enthalten sind), raten wir Absenken der Rohre, die von der Kammer zum Reservoir führt zu etwa einem Zentimeter über dem perfusate Ebene innerhalb des Reservoirs. Allerdings halten sie über den Fluss mittlerer Ebene können Sie fließen in das Reservoir während des Experiments zu überprüfen.
- Beim Einschrauben der Kammer Teile zusammen, ist es wichtig, fest zu ergreifen das Gehäuse mit einer Hand während des Betriebs der elektrischen Schraubenzieher mit der anderen Hand. Beachten Sie, dass die Bewegung der elektrischen Schraubendreher in Drehmoment, welches das Potenzial zu "werfen die Kammer rund ', wenn die Schraube angezogen hat, wird übersetzt werden.
- Zur Vermeidung von Druckwellen die Bildung von in der Schaltung und heben Zellen aus ihrer Oberfläche, sicherzustellen, dass alle Hähne offen vor Beginn der Strömung sind.
- Besonders für längerfristige Flow-Studien (> 48 Stunden) empfehlen wir die Verwendung der härter und widerstandsfähiger Schlauch in den Pumpenkopf eingesetzt werden, um zu verhindern Bruch der Rohre.
- Es ist möglich, dass der Schlauch "wandert" im Innern der Pumpe Kopf durch schlecht eingestellten Pumpenkopf Zähne. Deshalb empfehlen wir, mit Aufmerksamkeit, wie die WanneIng. ist in den Pumpenkopf gesichert und Kennzeichnung jedes Ende des Schlauches mit einem Filzstift, so dass Sie leicht feststellen, ob der Schlauch "eingezogen" oder verdrängt während des Experiments.
- Immer sorgfältig prüfen jeden einzelnen Anschluss der Schaltung und Kammer vor Beginn der Perfusion, um Austreten von Perfusat während eines Experiments durch eine fehlerhafte Verbindung zu verhindern. Dies ist besonders wichtig für die Zu-und Abfluss-Anschlüsse der Pulsationsdämpfer!
- Denken Sie daran, Belichtung Limit, wenn Sie Fluoreszenzmarkierungen verwenden.
Eine mögliche Einschränkung unserer Flusskammer ist, dass die Höhe von der Höhe des Kanals maschinell in die Aluminium befestigt ist. Dies hat jedoch den Vorteil, nicht zu überprüfen, und stellen Sie die Höhe des Kanals vor jedem Experiment und vereinfacht somit die Schubspannung Berechnungen lediglich die Anpassung der Pumpenleistung auf den gewünschten Wert. Abhängig von Ihrer Forschungsziele, kann es wünschenswert sein,Erhöhung der Schubspannung ohne Erhöhung Pumpendrehzahl. In diesem Fall werden wir die Erhöhung der Perfusat die Viskosität zu empfehlen, indem z. B. Dextran, um das Medium 11.
Eine mögliche Einschränkung der Strömung Schaltung ist die große Menge des verwendeten Mediums, was problematisch sein kann, wenn versucht wird, um sehr kleine Konzentrationen von Zelle Metaboliten zu quantifizieren. Obwohl hier nicht gezeigt, ist es möglich, eine deutliche Senkung der Schaltung Volumen durch einen kleineren Behälter und Pulsationsdämpfer und Abnahme Schlauch Länge und Durchmesser.
Darüber hinaus gibt es mehrere andere kommerziell erhältliche Systeme, die verwendet werden, um Flüssigkeit Schubspannung an Zellen in Kultur gelten kann. Mikrofluidik-basierten Systemen, wie zB die BIOFLUX System von Fluxion, ermöglichen die gleichzeitige Analyse von Zellen in verschiedenen mikrofluidischen Strömungskanäle mit Lösung in Well-Platten, die als Input-und Output Reservoirs für diese Kanäle 12,13,14 geladen. Doch diese und andere Mikro-Fluidik-Systeme sind nicht kompatibel mit Standard-Mikroskop-Objektträger und nicht für die Wiederherstellung einer ausreichend großen Anzahl von Zellen für weitere Experimente, wie z. B. RT-PCR oder Western Blot zu ermöglichen. Außerdem sind sie weniger benutzerfreundlich, kostengünstig ein Minimum von $ 40.000 und kann insgesamt mehr als $ 100.000 zu erreichen, abhängig von Zusatzgeräten.
Zwei macrofluidic Systeme aus der Flexcell International Corporation, die Flexcell Streamer und die FlexFlow Systeme wurden erfolgreich eingesetzt, um Endothelzellen 15,16,17, menschliche Zellen Ringraum 18 und Fibroblasten 19 unter Strömung Bedingungen zu studieren. Ein drittes System, erhältlich durch GlycoTech, wurde verwendet, um Tumorzelladhäsion 20 und Leukozytenadhäsion 21 bis endothelialen Monolayer zu studieren.
Die Streamer-System ermöglicht mehrere Seiten unter den gleichen Schubspannung Bedingungen auf einmal ausgeführt werden, aber es fehlt ein Sichtfenster und - im Gegensatz zu unserenDesign - nicht für Echtzeit-Visualisierung von Zellen unter fließen zu lassen.
Die FlexFlow System hat ein Sichtfenster, sondern erfordert eine aufrechte Mikroskop, das nicht dem Standard-Mikroskop in den meisten Labors verwendet werden könnte. Weiterhin erfordert die FlexFlow System einer Zelle beschichtete Deckglas invertiert, wenn in die Strömungskammer platziert werden. Dies schließt Visualisierung von fluoreszierenden Zellen auf einer undurchsichtigen Oberfläche, wie Titan-beschichteten Gläsern, die wir zeigen in unserer Studie. Schließlich müssen die spezialisierten Deckgläser speziell für den FlexFlow System, das in der multi-Tausend-Dollar-Preisklasse ist, ähnlich wie die Flexcell Streamer-System erworben werden.
GlycoTech bietet runden und rechteckigen Platte-Platte Strömungskammern, die deutlich weniger teuer, aber gefertigt aus Acryl, die nicht bequem Stammzellen wie unsere Kammer autoklaviert werden. Zu beachten ist, an andere Strömungskammern, die beschrieben worden sind autoklavierbarerscheinen nicht praktikabel, weil sie spezielle mikroskopische Linsen 22,23 erfordern. Die GlycoTech System nutzt Silizium Gummidichtungen zwischen oberen und unteren Platten dazwischen, die in der Dicke bei wiederholter Anwendung zu ändern und wird sich daher ändern Kammer Höhe im Laufe der Zeit (der Hersteller empfiehlt den Kauf neuer, nachdem alle zehn verwendet). Unsere Aluminium-Kammer mit integriertem O-Ringe ermöglicht eine vollständige Gegenüberstellung von oberen und unteren Platten und sorgt für eine konstante Kammer Höhe zwischen den Experimenten. Schließlich sind Vakuumpumpen erforderlich sind, um eine auslaufsichere Dichtung in vielen Flusskammer Designs, einschließlich der GlycoTech Kammern, die nicht in unser Design notwendig zu erreichen.
Während hier nicht gezeigt, kann die Flusskammer unter einem Mikroskop während des gesamten Flow Experiment zur Echtzeit-Bildgebung von Zell-Adhäsion und / oder Verhalten gehalten werden. Wenn dies gewünscht ist, empfehlen wir die Verwendung einer Wärmelampe oder ein Heizkissen unter die Kammer zu dem Perfusat Temperatur bei 37 ° C zu halten Pelzdort können die Rollenpumpe mit einer Spritze Pumpe ersetzt werden, wenn keine "Rückführung" von Zellen oder Metaboliten oder Prüfpräparate oder Agenten 24 gewünscht wird.
Es ist auch möglich, unterschiedlich markierter Zellen über adhärente Zellen, z. B. fluoreszierende Thrombozyten über eine Schicht von konfluenten EPCs (mit Hilfe der Thrombozyten-Assay durch Achneck et al. 6,25) fließen, um Zell-zu-Zell-Interaktion unter Schubspannung bewerten. Unsere Flusskammer kombiniert wertvolle Funktionen von anderen verfügbaren Strömungskammern, wie ein Perfusat Probenahme-Port und ein Sichtfenster und hat den wichtigen Vorteil der Kompatibilität mit einer umgekehrten oder aufrechten Mikroskop. Es ist voll autoklavierbar und ermöglicht wiederholten Versuchen bei konstanter Kammer Höhe und ohne die Notwendigkeit von Vakuumpumpen, um eine dichte Abdichtung zu erreichen.
Offenlegungen
Produktions-und Free Access dieses Video-Artikel ist von Cole-Parmer Instrument Co. gesponsert
Danksagungen
Die Autoren bedanken sich bei Joe Owen in der biomedizinischen Instrumenten-und Machine Shop danken für seinen unermüdlichen Einsatz bei der Bearbeitung und Montage der Flusskammer Teile und Matt Maudsley von Leica Microsystems zur Unterstützung in Techniken zur Bild-Zellen durch Strömungskammern. Wir danken Kevin Collins von der Duke Perfusion Services und Dr. Steve Wallace in der Abteilung für Biomedizinische Technik für hilfreiche Anregungen fließen Schaltungsdesign. Wir möchten auch die National Science Foundation Graduate Research Fellowship Program zur Unterstützung von Alexandra Jantzen und der NIH für die Unterstützung durch Grant "Autologe EPC-Futter auf die Biokompatibilität von Herz-Kreislauf verbessern assist devices" RC1HL099863-01 danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Produkte / Reagenzien | Firma | Product # | |
| 10 ml Spritze | Cole Parmer Instrument Co. | 07940-12 | |
| 1-Way Stopcoks | Cole Parmer Instrument Co. | 30600-00 | |
| 30 ml Spritze | BD Medical | 309650 | |
| 4-Way Hähne | Cole Parmer Instrument Co. | 30600-04 | |
| Aluminum Alloy | N / A | 6061 | |
| Cell-Culture Dishes (4-gut, rechteckig) | Thermo Scientific, Nunc | 267061 | |
| Zell-Tracker orange | Invitrogen | C34551 | |
| DMSO | Research Organics | 2162D | |
| DPBS (-/-) | Invitrogen | 14190-144 | |
| EGM-2 Singlequots | Lonza | CC-4176 | |
| Female Luer-Adapter | Cole Parmer Instrument Co. | SI-45500-04 | |
| Fibronectin | Sigma | F0895-2MG | |
| Glasflasche (250ml) mit Cap | Cole Parmer Instrument Co. | 34594-24 | |
| Harte Tubing | Cole Parmer Instrument Co. | 06508-16 | |
| HBSS | Sigma | H8264-500ML | |
| Histopaque | Sigma | H8889-500ML | |
| Hoechst Färbelösung | Sigma | H6024 | |
| Hyclone FBS | Thermo Scientific | SH30071.01 | |
| L-Glutamin | Lonza | 17-605E | |
| Luer-Adapter | Cole Parmer Instrument Co. | EW-45505-04 | |
| MCDB-131, 1x Medium | CellGro | 15 bis 100-CV | |
| Barbed Polypropylen Fittings | Cole Parmer Instrument Co. | 06365-90 | |
| O-Ringe | N / A | AS568A | |
| Pulse-Dämpfer | Cole Parmer Instrument Co. | 07596-20 | |
| Pump-Drive (Masterflex L / S mit variabler Drehzahl Sparkurs) | Cole Parmer Instrument Co. | 7524-40 | |
| Pump-Head (Masterflex Easy Load Pumpenkopf) | Cole Parmer Instrument Co. | 07518-60 | |
| Rutsche | Cole Parmer Instrument Co. | 48500-00 | |
| Soft-Tubing | Cole Parmer Instrument Co. | 96400-16 | |
| Spritzenfilter | Cole Parmer Instrument Co. | 02915-12 | |
| Sytox orange Nucleic Acid Stain | Invitrogen | S-11368 | |
| Trypsin EDTA | Lonza | CC-5012 | |
| Trypsin neutralisierende Lösung | Lonza | CC-5002 |
Referenzen
- Bhat, V. D., Truskey, G. A., Reichert, W. M. Fibronectin and avidin-biotin as a heterogeneous ligand system for enhanced endothelial cell adhesion. J. Biomed. Mater. Res. 41, 377-385 (1998).
- Broxmeyer, H. E. Cord blood stem and progenitor cells. Methods Enzymol. 419, 439-473 (2006).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Brown, M. A., Wallace, C. S., Angelos, M., Truskey, G. A. Characterization of umbilical cord blood-derived late outgrowth endothelial progenitor cells exposed to laminar shear stress. Tissue. Eng. Part. A. 15, 3575-3587 (2009).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc. Res. Tech. 73, 71-76 (2010).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Rinker, K. D., Prabhakar, V., Truskey, G. A. Effect of contact time and force on monocyte adhesion to vascular endothelium. Biophys. J. 80, 1722-1732 (2001).
- Truskey, G. A., Yuan, F., Katz, D. F., Horton, M. J. Ch. 2. Transport Phenomena in Biological Systems. , (2004).
- Truskey, G. A., Yuan, F., Katz, D. F., Horton, M. J. Ch. 2. Transport Phenomena in Biological Systems. , (2009).
- Allen, J. D. Plasma nitrite response and arterial reactivity differentiate vascular health and performance. Nitric Oxide. 20, 231-237 (2009).
- Xiao, Y., Truskey, G. A. Effect of receptor-ligand affinity on the strength of endothelial cell adhesion. Biophys. J. 71, 2869-2884 (1996).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet Adhesion and Aggregation Under Flow using Microfluidic Flow Cells. J. Vis. Exp. (32), e1644-e1644 (2009).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. W. e. l. l. plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Conant, C. G. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J. Lab. Autom. 16, 148-152 (2011).
- Metaxa, E. Nitric oxide-dependent stimulation of endothelial cell proliferation by sustained high flow. Am. J. Physiol. Heart. Circ. Physiol. 295, H736-H742 (2008).
- Radel, C., Carlile-Klusacek, M., Rizzo, V. Participation of caveolae in beta1 integrin-mediated mechanotransduction. Biochem. Biophys. Res. Commun. 358, 626-631 (2007).
- Wang, X. L., Fu, A., Spiro, C., Lee, H. C. Proteomic Analysis of Vascular Endothelial Cells-Effects of Laminar Shear Stress and High Glucose. J. Proteomics. Bioinform. 2, 445-445 (2009).
- Elfervig, M. K., Minchew, J. T., Francke, E., Tsuzaki, M., Banes, A. J. IL-1beta sensitizes intervertebral disc annulus cells to fluid-induced shear stress. J. Cell. Biochem. 82, 290-298 (2001).
- Archambault, J. M., Elfervig-Wall, M. K., Tsuzaki, M., Herzog, W., Banes, A. J. Rabbit tendon cells produce MMP-3 in response to fluid flow without significant calcium transients. J. Biomech. 35, 303-309 (2002).
- Patton, J. T., Menter, D. G., Benson, D. M., Nicolson, G. L., McIntire, L. V. Computerized analysis of tumor cells flowing in a parallel plate chamber to determine their adhesion stabilization lag time. Cell. Motil. Cytoskeleton. 26, 88-98 (1993).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009-e1009 (2009).
- Kaper, H. J., Busscher, H. J., Norde, W. Characterization of poly(ethylene oxide) brushes on glass surfaces and adhesion of Staphylococcus epidermidis. J. Biomater. Sci. Polym. Ed. 14, 313-324 (2003).
- Bakker, D. P., Plaats, A. v. a. n. d. e. r., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Angelos, M. G. Dynamic adhesion of umbilical cord blood endothelial progenitor cells under laminar shear stress. Biophys. J. 99, 3545-3554 (2010).
- Baker, G. R., Sullam, P. M., Levin, J. A simple, fluorescent method to internally label platelets suitable for physiological measurements. Am. J. Hematol. 56, 17-25 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten