Method Article
Параллельные пластины палаты потока и непрерывной цепи потока для оценки эндотелиальных клеток-предшественников при ламинарном Стресс сдвиговом потоке
В этой статье
Резюме
Мы описываем метод подвергать прилипшие клетки для ламинарного потока напряжения сдвига в стерильных непрерывную цепь потока. Адгезию клеток, морфология могут быть изучены через прозрачную камеру, образцы, полученные из схемы для метаболита анализа и клеток, полученных после сдвига экспозиции для будущих экспериментов или культуры.
Аннотация
Общая цель этого метода состоит в описании техники подвергать прилипшие клетки к условиям ламинарного потока и оценить их реакцию на хорошо количественно жидкости касательные напряжения 1.
Наш поток конструкции камеры и поток цепи (рис. 1) содержит прозрачную область просмотра, что позволяет проводить тестирование адгезии клеток и визуализации морфологии клетки непосредственно перед течения (рис. 11А, Б), в различные моменты времени, в течение течения (рис. 11С) , а после потока (рис. 11г). Эти эксперименты иллюстрируют с человеческой пуповинной крови происхождения эндотелиальных клеток-предшественников (EPC) и свиного ЕРС 2,3.
Этот метод также применим и к другим приверженцем типов клеток, например, гладкомышечных клеток (ГМК) или фибробластов.
Камеру и все части схемы легко стерилизуются паром в автоклаве. В отличие от другихкамер, например, микрофлюидных камер, большое количество клеток (> 1 млн в зависимости от размера ячейки) могут быть восстановлены после потока эксперимент в стерильных условиях на культуре клеток или иным опытам, например, ДНК или РНК, добыча, или иммуногистохимии (рис. 11E), или сканирующей электронной микроскопии 5. Касательное напряжение можно регулировать, изменяя скорость потока перфузат, вязкость жидкости, или высоту и ширину канала. Последняя может уменьшить объем жидкости или клеточные потребности, обеспечивая при этом одномерного потока сохраняется. Не стоит измерять высота камеры между экспериментами, так как высота камеры не зависит от использования прокладок, что значительно повышает удобство нескольких экспериментов. Кроме того, схемотехники позволяет легко коллекция перфузат образцов для анализа и / или количественного метаболитов выделяется клеток под воздействием сдвига жидкости стресс, например, оксид азота (рис. 12) 6
протокол
1. Эндотелиальных клеток-предшественников изоляции
- До любой коллекции периферической крови человека, представить свое исследование протокола к Институциональным наблюдательным советом (IRB), и после его утверждения, получить добровольцев доноров обоснованного согласия (периферическая для сбора крови и EPC изоляции был одобрен IRB Университета Дьюка и находится в полном соответствии с американскими нормативные требования, связанные с защитой человеческой участников исследования).
- При работе с животного происхождения ЕРС, ваш протокол исследования утвержденным вашего Уходу за животными и использованию комитета (IACUC). Все наши эксперименты свиньи были одобрены Университета Дьюка IACUC, и проводилось в соответствии с высочайшими стандартами гуманной помощи.
- Для изоляции эндотелиальных клеток-предшественников, собирают 50 мл периферической крови по стандартной методике кровопускания из согласился добровольно донорами в кровь сбор мешков с антикоагулянтами citratэлектронной фосфата декстрозы и разбавьте раствор 1:1 с буферном растворе соли Хэнка (без CaCl 2, MgCl 2, MgSO 4) и слоем на равных объемов Histopaque для создания четко определенных слоев.
- Центрифуга (30 мин, 740 г, низкие настройки перерыва) и собирать мононуклеарных клеток (МНК) (лейкомассы) слой. Ресуспендируют и мыть МНК х 3 с фосфат Дульбеко буферном растворе (DPBS) с 10% эмбриональной телячьей сыворотки (FBS) х 10 мин, 515 г, до покрытия на два 12-луночных планшетах в полной EPC среднего роста (MCDB-131 среде с 5 мл 200 мМ L-глутамина, 10% FBS и EGM-2 SingleQuots) при 37 ° C, 5% СО 2.
- Медленно изменение среды каждые 24 часа в течение первых 7 дней, затем через день. EPC колонии могут быть выявлены после среднее время от 14 дней в зависимости от их булыжником морфологии. Как только ЕРС в культуре покрытие четверть 12-а площадью поверхности, расширить клетки и подтвердить EPC идентичность с проточной цитометрии путем проверки на наличие поверхностных маркеровCD31 и отсутствие CD14, CD45, как описано выше 6. Другие тесты, которые могут быть выполнены включает морфологию клеток и маркировка с DII-Ac-ЛПНП.
- Для проведения экспериментов, описанных здесь, расширить изолированных ЕРС, пока они почти сливающийся в 3-х Т-75 культура клеток в колбах EPC среды в увлажненном инкубаторе при температуре 37 ° C, 5% СО 2.
2. Shear расчета стресса
- Мы рекомендуем, чтобы эти расчеты выполнены до изготовления камеры и канала иметь глубокое понимание условий, которые могут быть достигнуты. Рассчитайте расход перфузат в вашей схеме на основе желаемого напряжения сдвига, которые должны применяться к клеткам в соответствии с уравнением 1 1,

где Q является требуемый расход, τ является целевой ыслышать напряжение, действующее касательной на клетки, ш-ширина потока камера, ч-высота проточную камеру, а μ-вязкость перфузат (потока среды).
- Типичное значение вязкости (μ) для используемой среды составляет 0,9 сП (0,009 г-см -1 с -1). Обратите внимание, что вязкость может быть поднят также при помощи большого молекулярного веса декстрана, по желанию 7. Типичное значение целевой напряжения сдвига (τ), используемые в 15 дин / см 2, (типичный артериальная напряжение сдвига) или 100 дин / см 2, если выше-физиологического напряжения сдвига желательно. Наша камера обычно имеет ширину (W) в 1,9 см и высота (H) в диапазоне 166 - 267 мкм.
3. Производство Поток камеры
- Отрежьте верхнюю и нижнюю пластины йэлектронная камера из алюминиевого сплава 6061 прямоугольную акции с верхней размерности 7 х 2 х 0,5 "и нижней размеры 7 х 2 х 0,25".
- Перерыв верхней пластине в центральной части до 0,125 "глубокий, оставляя 0,950" в конце для 1,375 "ширина х 0,3125" глубокий резервуар для жидкости.
- Дрель 1 / 16 "в ширину х 0,625" длинные слоты от нижней, чтобы проникнуть в резервуар на приток и отток концах.
- В конце каждой верхней пластине, просверлите в центре города 10/32 "дорожек на дюйм (TPI) отверстие для полипропилена 1 / 8" штуцером для шланга, чтобы проникнуть в резервуар с жидкостью. На приток целью создания сторону вилку 10/32 "ТПИ через отверстие для полипропилена 1 / 8" штуцером для шланга.
- Конический верхней нижней из жидкости приток окно смотровое стекло на 0,518 градусов для адекватного смешивания жидкости.
- Вырезать окна стекло в нижней пластины в соответствии с верхнего окна просмотра. Использование аквариума цемент, клей стекло в камеру. Дайте лекарство не менее 24 часов.Убедитесь, что окно просмотра утоплена так, чтобы 75 х 25 х 1 мм стекло микроскопа будет заподлицо в камере.
- Создать выемкой для уплотнительного кольца вокруг нижней части верхней и нижней пластин, что они находятся на расстоянии друг от друга на 0,02 ". Вставьте резиновые уплотнительные кольца.
- Дрель 10 соответствующих 8 / 32 "TPI отверстия в верхней и нижней камер для использования с 8 / 32" с плоской головкой.
4. Схема сборки потока
- Соберите весь кругооборот потоков, а затем приступить к его стерилизации.
- Прикрепите 36 "сегменте жестких трубы к одному концу импульса демпфера (через 1 / 8" соединение). К другому концу, приложите 18 "сегменте мягких труб.
- Место 1 / 8 "мужской Luer адаптер в конце 18" мягких разделе трубы, упомянутых в пункте 4.2. Подключите мужчин Луер к 1 / 8 "женский Luer адаптер. Подсоедините гнездовой Luer на новый 18" сегменте мягких труб.
- Просверлите три отверстия в 250 мл стакан крышкой стеклянной, чтобы соответствовать труб. Явставляйте 1,5 "сегмент мягкой трубки (как вентиляционное отверстие) в одно отверстие и свободные концы жесткие и мягкие трубки через другие 2 отверстия в крышке на 250 мл стеклянной бутылке (в водохранилище) (рис. 2). Убедитесь, что жесткие трубки достигает дна водоема (как отток трубы из резервуара).
- Стерилизовать выше частей паром в автоклаве при 121 ° С в течение 60 мин. Кроме того автоклаве один полный камере поток, 3 х 2 "сегментов мягких труб, 1 мужчина и 1 женщина 1 / 8" Luer адаптер, 4 х ½ "и 6 х 5 / 16" 8-32 с потайной головкой, 1 пинцет , один 75 х 25 х 1 мм стекло (или другой требуемый материал клеточной поверхности), и 2 хирургических полотенца.
- Место стерильные полотенца в ламинарным укрытием потока. Место поток цепи, проточную камеру, 4 х 4-х кранов, 1 х 1-путь краном, и все стерилизованные, начиная с шага 4,5 на эту стерильную области.
- Теперь используйте стерильные перчатки, чтобы соединить два 4-х кранов. Место колпачки на открытые порты образца.
- Отсоедините мужского и женского Луер адаптеры крепления два мягких сегментов трубки потока цепи и вставить связанные кранами (рис. 3).
- Прикрепите мягкие трубки вставляется в резервуар 30 мл шприц и удалите шприц поршень. Заполнить бутылку с 125 мл EPC среды (рис. 4).
- Место стерильный фильтр шприца в вентиляционное отверстие (рис. 4).
- Перемещение потоков контура в увлажненном инкубаторе при температуре 37 ° C, 5% СО 2.
- Зажим жесткие трубки в голову валик насоса указаны для данного типа труб (рис. 5). Убедитесь, что трубка не перекрывается с роликом для установки насосов треков. Марка трубы, где она выходит из насоса голову на обе стороны с маркером.
- Убедитесь, что все краны закрыты направились образца порты и открытые вдоль потока цепи. Запустите насос. Убедитесь в направлении потока. Перфузат должны двигаться птом стекло резервуара через трубку в жестких демпфер импульсов.
5. EPC флуоресцентные маркировки
- В то время как поток схему прогревается до 37 ° С, подготовить клетки для посева на слайде. Обратите внимание, что флуоресцентные маркировки не требуется, если клетки должны быть визуализированы на непрозрачных материалов, например, титана (Ti).
- Создать 1 мМ исходный раствор сотовый Tracker Orange (КТО) путем разбавления 50 мкг технический директор порошок с 90 мкл диметилсульфоксида (ДМСО). Будьте уверены, чтобы оградить эту смесь от освещенности (выключить свет, работающий под капотом потока).
- Создайте 2 мкМ рабочего раствора CTO путем разбавления 36 мкл исходного раствора технический директор в 18 мл бессывороточной MCDB-131 среды.
- Промыть ЕРС в 3 вблизи сливной Т-75 клеточную культуру колбы с 10 мл DPBS (без Са и Mg).
- Добавить 6 мл 2 мкМ технический директор рабочего раствора в каждую колбу. Инкубируйте в течение 15 мин при 37 ° C. Промыть каждую колбу х 2 по 10 DPBS мл (без Са и Mg). Добавить 4 мл трипсина в каждую колбу. Инкубировать при 37 ° С в течение 3 мин. Нейтрализовать с 8 мл раствора нейтрализации трипсина.
- Вымойте центрифугированием х 5 мин при 600g и ресуспендируют в 5 мл среды EPC.
6. Сотовые посев слайд до проточную камеру сборки
- Слайд сделаны из стекла, титана и других материалов могут быть использованы, и слайд поверхность может быть изменен спина покрытие с добавлением полимера или слой металла. Место скользить в стерильных прямоугольной четырехкамерные культуре клеток сосудов (или использования культуры тканей слайд колбу, если полистирола поверхность желательно). Граф клеток и семян 1,5 х 10 6 клеток на слайд в 5 мл среды EPC х 6 часов, если сливной слоя клеток желательно на начало течения (рис. 11А).
- Для того, чтобы испытательной камере распространения и адгезии под жидкости напряжение сдвига, позволяющие 3 х 10 6 клеток придерживаться в течение 15 мин до начала потока (быстрого посева) ( Рис. 11В).
7. Поток сборки камеры
- Использование стерильных перчаток, подключите один 2 "мягкого сегмента трубы в 1 / 8" женский Luer адаптер. Подключить еще 2 «мягкой сегмента трубы к 1 / 8" мужской Luer адаптер.
- Приложите 2 "мягкие трубки с внутренней Luer адаптер для притока порта. Установите 2" мягкие трубки с наружной Луер к оттоку порт. Приложите 4-х кранов на оба этих Луер адаптеров. Подключить оставшиеся 2 "мягкий кусок трубы к разъему левого борта сходит пузырь ловушку и прикрепить 1-путь краном (рис. 6).
- Использование стерильного пинцета, удалить ячейки односемянных слайд с судна клеточных культур (или если вы используете слайд колбу, снимите колбу на слайде) и поместите его в выемку на нижней панели проточную камеру. Убедитесь, что слайд помещается с сотовым посеяны стороной вверх.
- Внесите 10 мл теплой EPC среды на слайде. Разрешить среда для покрытия слайдов и проточную камеру, бут не проливать среды на уплотнительное кольцо на нижней пластине.
- Место верхней пластине проточную камеру на нижнюю пластину, совместив отверстия для винтов. Будьте осторожны, чтобы не вводить пузырьков воздуха в камеру во время этого шага, сохраняя две пластины параллельно.
- Винт пластины вместе (автоматическая батарейках отверткой ускоряет этот процесс).
- Удалить пузырьки воздуха из притока ловушку пузыря, открывая 1-полосный кран прилагается к притоку порта на стороне ловушки пузырь и аккуратно промыть приток труб с EPC среде с помощью 10 мл шприц. Затем закрыть эту кран и крышка его (рис. 7).
- Теперь удалить пузырьки воздуха из камеры, открыв канал оттока порт 4-ходовой кран и, аккуратно промывки EPC среды, через проточную камеру, опять же используя 10 мл шприц. Если большие пузыри остаются, повысить отток конце камеры под углом 45 ° (рис. 8).
- Cap всех 4-х соединений крана и закройтеих. Перемещение потоков в камере инкубатора с собранным поток цепи (рис. 9).
- Пауза насоса контура. Закрыть краны потока замыкание в направлении потока, чтобы предотвратить утечку и держать внутри камеры стерильными. Транспорт проточную камеру от потока капот, чтобы поток цепи. Подключите камеру потока к потоку контура. Откройте запорные краны в направлении потока. Возобновление потока насоса. Убедитесь, что перфузат потоки в правильном направлении. Отрегулируйте расход в желаемое напряжение сдвига.
- В течение эксперимента, проточную камеру может быть удален из цепи изображений клеток с помощью света или люминесцентной микроскопии. Для того, чтобы сделать это, отключите проточную камеру от потока замыкание на кран-кран соединений. Для поддержания стерильности камеру, закрыть поток схему кранами и кранами проточную камеру в направлении потока и шапку все краны до удаления потока схемаиз инкубатора (рис. 9).
8. Перфузат пробы
- Для удобства коллекция перфузат образцов для анализа (например, синтеза оксида азота), первая пауза насоса.
- Закрыть кран расположен ближе всего к демпфер импульсов. Удалить ее защитный колпачок и вставить небольшой шприц размера, например, 3 мл шприц, в образец порт. Держите крышку и убедитесь, что он не будет загрязняться, поместив его с ног на голову.
- Закрыть кран в направлении потока камеру, держа порт образца и замыкания в направлении импульса демпфера открыта.
- Нарисуйте нужное количество образца, например, 150 мкл, из схемы. Закрыть кран на образце порт, прежде чем снимать шприц. Магазин перфузат образца помечены флакон и замерзает при - 80 ° С (для азотной определения оксида на более позднем этапе).
- Отчет образец порта и гарантировать, что все запорные краны открыты до начала потока.
9. Представитель результаты
Используя наши быстрого семян методом, человеческой крови полученных эндотелиальные клетки-предшественники могут быть посеяны на титан слайды в течение 15 минут и придерживаться в физиологических (артериальное) поперечных сил от 15 дин / см 2.
Как показано на рисунке 10, ЕРС распространение под влиянием потока от 210 ± 11,4 мкм 2, сразу после посева, до 657 ± 39,1 мкм 2 после 3 часов, а до 1152 ± 55,3 мкм 2 после 24 часов жидкости напряжение сдвига от 15 дин / см 2 (разница между группами статистически значимы при р <0,0001, 1-дисперсионного анализа). Параллельно с увеличением область ячеек, которые могут быть отображены через прозрачную камеру с света или флуоресцентного микроскопа, округлость рассчитывается по формуле 2 6
/ Files/ftp_upload/3349/3349eq2.jpg "/>
снизилась с 878 х 10 -3 ± 5,9 х 10 -3, сразу после посева, до 671 х 10 -3 ± 19,2 х 10 -3 через 3 часа, а до 526 х 10 -3 ± 19,2 х 10 -3 после 48 часов одного и того же воздействия напряжения сдвига жидкости (разница между группами статистически значимых раз при р <0,0001, 1-дисперсионного анализа).
Рис 11D показывает, что ЕРС выровнять и сориентироваться в направлении потока после 48 часов жидкости напряжение сдвига на 15 дин / см 2 по сравнению с их случайной ориентацией после статического период посева 6 часов, показанный на рисунке 11А.
Наш метод также позволяет получить образцы перфузат в заданные моменты времени для анализа и / или количественного секретируемых метаболитов клетки. Как представитель примере мы изображают производствоТион нитритов (NO 2 -) в ходе 48-часовой поток экспериментировать с свиного ЕРС на рисунке 12. Мы напрямую измерять этот первичный продукт окисления оксида азота (NO) в качестве суррогатного маркера NO в средних проб из потока замыкание на различные моменты времени, чтобы быть 12,0 нмоль на 6 часов, 13,1 нмоль на 12 часов, 16,3 нмоль на 24 часов, и 24,6 нмоль после 48 часов 1 х 10 6 клеток на 15 дин / см 2 6.
Рисунок 1. Схематическое изображение обзор сборки потока цепи и поток эксперимента. () Расход схема сборки без проточную камеру. Сюда входят водохранилища, пульс демпфера, жесткие трубы, мягкие трубки, 4-краны и связанные Луер адаптеров, а также воздушный фильтр. (В) Подключение через проточную камеру жесткий сегмент трубы по голове насоса. (C) В утверждении, о EPC-посеян скользить в нижнюю часть потока камера (D). Полная сборка потока цепи с проточную камеру.

Рисунок 2. Полностью собранный поток схему для стерилизации.
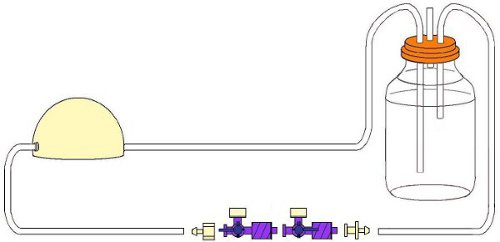
Рисунок 3. Собранные поток цепи после стерилизации с кранами включены.
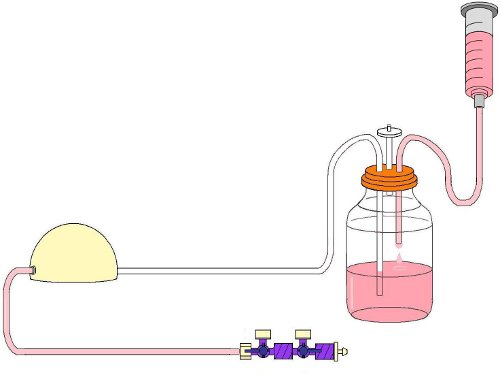
Рисунок 4. Заполнение стекло резервуара с 125 мл среды EPC.
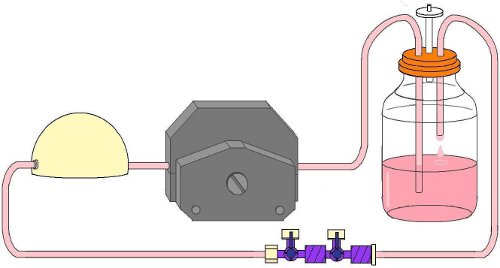
Рисунок 5. Поток цепь зажимается в голове насоса до поток вставки камеры.
JPG "/>
Рисунок 6. Вернуться к началу сборки пластины камеры.
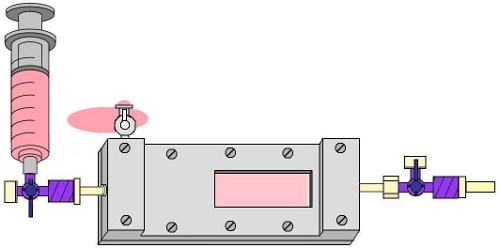
Рисунок 7. Промывка пузырь ловушки со средним EPC, чтобы удалить пузырьки от притока сторону камеры.
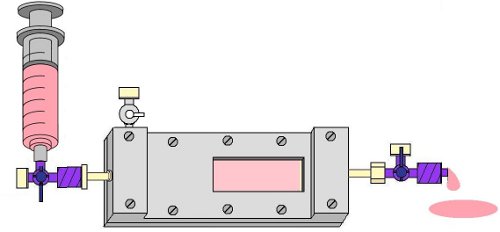
Рисунок 8. Промывка камеры со средним EPC, чтобы удалить пузырьки из слайдов и отток сторону камеры.
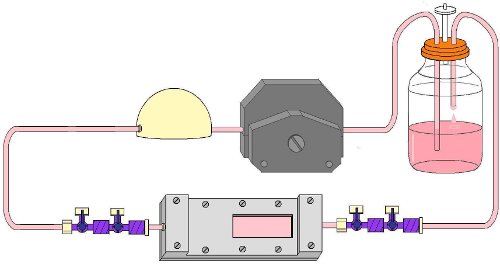
Рисунок 9. Полностью в сборе потока цепь со вставленной проточную камеру во время поток эксперимента.
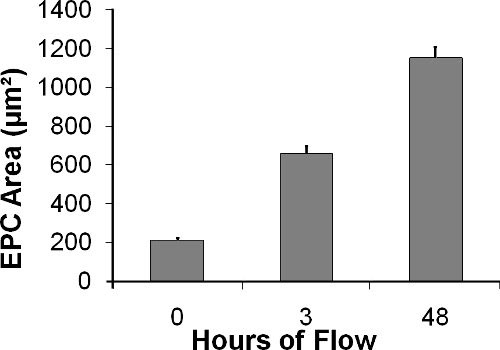
Рисунок 10. EPC площадь (в мкм 2) увеличивается с течением времени ход потока эксперимента.
files/ftp_upload/3349/3349fig11.jpg "/>
Рисунок 11. () Легкий изображения микроскопа HUCB ЕРС посеянных на фибронектин покрытием предметное стекло х 6 часов до потока при 100-кратном увеличении. (B) HUCB ЕРС помечены технический директор и быстро посеяны на слайд Ti х 15 мин до потока, визуализируются с флуоресцентной микроскопии при 100-кратном увеличении. (C) и тот же слайд Ti с ЕРС HUCB как под (Б), через 3 часа потока на 100 дин / см 2 и отображение через прозрачную камеру при 100-кратном увеличении. Обратите внимание, распространение клеток, но все еще случайную ориентацию через 3 часа потока. (D) и тот же слайд Ti, теперь, после 48 часов поток экспозиции при 100-кратном увеличении. ЕРС помечены технический директор и ядра клеток окрашиваются красителем Hoechst с (синий цвет), после потока. Обратите внимание на выравнивание ячеек в направлении потока. (E) Свиной ЕРС для сравнения на Ti после 48 часов поток и 15 дин / см 2 сдвига воздействия стресса. Сотовые границы были окрашены анти-PECAM пятна (зеленый) и ядер с Sytox оранжевой нуклеиновых кислот пятно. Обратите внимание на выравнивание ячеек в направлении потока.
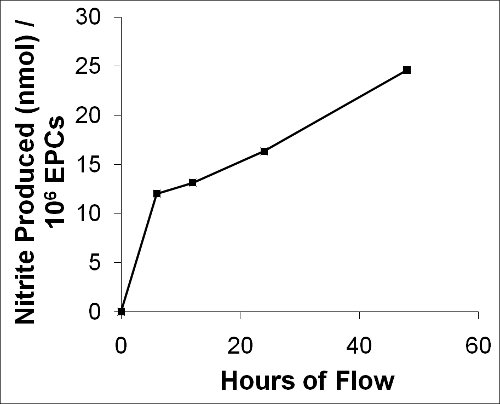
Рисунок 12. График изображает НЕТ производству ЕРС свиней в течение 48 часов после потока. Первичный продукт окисления NO, нитриты (NO 2 -), была измерена в качестве суррогатного маркера для NO от средней пробы в различные моменты времени в течение потока.
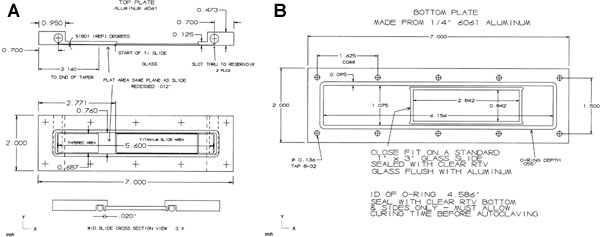
Рисунок 13. Потоком камеры выполнен из алюминиевого сплава 6061 прямоугольную акций с верхней части (А) соответствует 0,5 "х 2" х 7 ", а нижняя часть (B) 0,25" х 2 "х 7" в размерности. ВершинаПланируется на его нижней стороне уплотнительного кольца контактной поверхности до 0,45 ", чтобы застраховать плоскостности для герметизации. верхняя часть утоплена в его центральной части до 0,125", что оставляет 0,95 "в конце для 0,3125" х 1,375 "резервуар для жидкости. водохранилища верхней секции с резьбой 3/8-24 ТПИ и 0,25 "глубоко, чтобы получить резьбовые пробки из нержавеющей стали. Слоты измерения 1 / 16 "х 0,625" были обрабатывается в нижней, которые проникают в резервуар. Плагин приток сторона 10/32 "через отверстие для полипропилена 1 / 8" штуцером для шланга для подключения к краном. Каждый блок имеет конца центре города резьбовых 10/32 TPI на 0,25 "глубокую часть для полипропилена 1 / 8" штуцером для шланга в 0,45 "х 2" конца. Концы использовать 0,07 "дыру в нижней части нити через проникнуть в резервуар. Нижней верхней части имеет коническую область 0,6875" широкий, 0,518 градусов от центра слот LH на расстоянии 1,460 ". Этот конус смесей для плоской области 0,6875 "ширина х 0,0118" глубокий и 0,590 "с конца Glasс (или другой поверхности, например, слайд титана) перерыва. Эта квартира должна быть на одном уровне с стекла (или другой поверхности, например, титана слайд), как только слайд установлен. Конических и плоских полируются. Поверхность слайд 0,0118 "встраиваемые от нижней поверхности. 0,0118" перерыва продолжает водохранилище слот RH конца. Уплотнительное кольцо утоплена полностью вокруг слотов и слайд оставляя 0,020 "оригинальных поверхности между уплотнительным кольцом паз и слайдов. Верхняя и нижняя единиц сверлятся в течение десяти отверстий. Верхняя часть имеет сквозными отверстиями для 8 / 32 TPI потайной плоской головкой. Нижняя секция имеет отверстия размещены соответствующие верхние отверстия и резьбовые 8 / 32 TPI. дно блок имеет четкую стекло окна встраиваемые заподлицо с ее поверхностью расположена над стеклянной поверхности клетки слайд (или титана слайд). единицу имеет уплотнительное кольцо, которое охватывает паз слота верхнего блока с шириной оставить 0,04 "оригинальных поверхности между слайд дно и внутреннюю уплотнительное кольцо паз. О-ринGS красные силиконовые AS568A, Dash Количество 044 для верхней части и 046 для нижней части.
Обсуждение
Наша схема потока и камеры позволяют нам подвергнуть прилипшие клетки, например, ЕРС, чтобы определить напряжения сдвига жидкости. С верхней и нижней камеры являются прозрачными, клеточной адгезии и морфологии можно оценить либо в режиме реального времени, через камеру себе, так и после эксперимента потока и разборки проточную камеру. В этот момент клетки могут быть собраны в стерильных условиях и либо повторное покрытие, или использовать для сбора их ДНК или РНК, и т.д., для дальнейшего анализа.
Для достижения ламинарного потока, дизайн камеры должны быть такими, что несколько условий.
Во-первых, поток должен быть ламинарным, которая может быть проверена путем вычисления его числа Рейнольдса (Re), который представляет собой отношение сил инерции к силам вязкости. (Если силы вязкости преобладают, Re мал и поток ламинарный или «полностью развитой" - как правило, для Re <2300.Если силы инерции преобладают, поток становится все более и более случайным, пока не будет бурной, как это имеет место для Re> 4000). Мы можем рассчитать Re согласно уравнению 3 8,

Где ρ есть плотность жидкости, Q является скорость потока, μ-вязкость, т и ч, ширина и высота камеры, соответственно, и D ч является гидравлический диаметр, определяется в соответствии с уравнением 4 8,
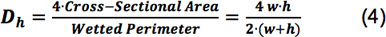
Число Рейнольдса из трех наших камерах поток, с высотами от 166 - 267 мкм, в диапазоне от 13,9 - 34,6 при скоростях потока сalculated для получения напряжения сдвига от 15 дин / см 2. На расход рассчитывается для напряжения сдвига в 100 дин / см 2, число Рейнольдса камер колебалась от 90,4 - 234. Все эти числа Рейнольдса намного ниже, чем 2300 и отвечать критерию для ламинарного потока.
Во-вторых, для поля скорости и напряжения сдвига не зависит от расстояния вдоль потока канала (т.е. полностью разработан), расстояние от жидкости входе слайдов должно быть больше, чем вход длина, L е. Это могут быть удовлетворены путем вычисления длины входа, в соответствии с уравнением 5 9.

Для значений, перечисленных выше, вход длина колеблется от 0,01 до 0,25 см.
В-третьих, для того, чтобы гарантировать, что скорости и напряжения сдвига в боковом направлении не меняютсязначительно отличается от значения для одномерного течения в канале (Δ Ф / 2 л), соотношение H / W должна быть много меньше 1. Для среднего напряжения сдвига стены под двумерный условиях потока составляет 95% от напряжения сдвига стены под одномерного течения, ч / б должен быть равен 0,10, а для напряжения трения на стенке в двумерной условиях потока будет 97,5% от напряжения на стенке под одномерного течения, ч / б должен быть равен 0,05. С размерами нашей разработан проточную камеру 1,7 см в ширину и 166 - 267 мкм в высоту, эти критерии выполняются.
Давление будет меняться только в направлении потока если Есть нет боковых градиентов давления на входе. Это можно оценить с помощью красителей или частиц в потоке пути. Кроме того, для постоянных экспериментов потока импульса демпфера вставляется в поток цепи. Импульса демпфера занимает большую часть пулыatility вызванных валик насоса в цепи, и позволяет нам приблизиться предположении установившегося течения. Следует отметить, что демпфер импульсов использована должна быть совместима с насоса и трубки, используемые в схеме, так что она может эффективно устранить пульсации выходного потока для конкретных частот валик насоса. В нашей демонстрации Masterflex L / S пульс достигает демпфера ламинарного потока при использовании на нагнетательной линии с любым Masterflex L / S насос серии (0 - 600 RPM) и I / P-26 трубок. Для пульсирующего потока, программируемый насос может быть использован для создания различных сигналов.
Для пульсирующего потока, программируемый насос может быть использован для создания различных сигналов.
Кроме того, схема разработана так, что образцы перфузат может быть легко собрано в различные моменты времени, не рискуя загрязнения клетками или потока среды. В нашем примере, концентрация NO 2 - измерялась с ХЛАйоникс / Сиверс Азотная анализатор азота (NOA 280, Сиверс инструменты, Boulder, CO), как описано выше 10. Восстановителя используется для анализа нитрита калия йодида в уксусной кислоте (14,5 М уксусной кислоты и 0,05 М КИ), который имеет потенциал сокращения преобразовать нитриты до NO, но недостаточно, чтобы уменьшить любые высшие окислы азота, такие как нитраты и, следовательно, относительно , специфичные для нитрита. Общий объем производства нитрит был рассчитан как произведение концентрации производства и общего объема схемы во время настройки для объема теряется при отборе проб 6.
Следующие шаги имеют важнейшее значение для успешного выполнения потока экспериментов:
- Желательно, чтобы избежать образования пузырьков в потоке ввода в эксплуатацию, так как пузырьки имеют потенциал, чтобы оторвать клетки с их поверхности. Этого можно избежать, взяв на себя при оформлении верхней части проточную камеру на нижней части, которая лучше всегоосуществляется хранение и параллельно друг другу и опускание верхней на нижнюю одним движением, без корректировок. При этом мелкие пузырьки воздуха, которые могут присутствовать и / или плавает в потоке канала, будет направлена в пузырь ловушки на любом конце алюминиевый корпус.
- Важно, чтобы гарантировать, что отток трубы в резервуаре достигает до нижнего водохранилища. В противном случае, воздух может быть всасывается в трубку, которая ведет из резервуара в камеру, если перфузат снижении уровня чуть ниже трубки конца.
- Исследователь должен быть знаком с направлением насоса так, чтобы насос не случайно запустить в обратном направлении после начала потока, что приведет в воздухе втягиваться в цепи и камеры.
- Чтобы избежать образования пены (из-за денатурированные белки, содержащиеся в сыворотке крови), мы советуем снижение трубки, которая ведет от камеры резервуара примерно на один дюйм выше perfusaТе уровня внутри резервуара. Однако, держа его над уровнем потока среды позволяет проверить течь в резервуар во время эксперимента.
- При ввинчивании камере части вместе, важно твердо усвоить корпус с одной стороны, в то время как операционная электрическая отвертка с другой рукой. Обратите внимание, что движение электрической отвертки будут переведены на момент, который имеет потенциал, чтобы "бросить камеру вокруг 'когда-то винт затягивается.
- Для того чтобы избежать какого-либо давления волн от формирования в контуре и поднятия клетки с их поверхности, убедитесь, что все запорные краны открыты до начала потока.
- Специально для долгосрочного исследования потока (> 48 часов) мы рекомендуем использовать тяжелее и более устойчивы трубки должен быть вставлен в головку насоса для предотвращения разрыва трубы.
- Вполне возможно, что трубка "мигрирует" внутри головки насоса из-за плохого с поправкой на зубах насос голову. Поэтому мы предлагаем уделять пристальное внимание тому, как ванныING закреплен в головку насоса и маркировка каждого конца трубки с маркером, что вы можете легко заметить, если трубка 'тянут в' или выбили во время эксперимента.
- Всегда тщательно проверяйте каждый разъем цепи и камеры перед началом перфузии в целях предотвращения утечки перфузат во время эксперимента из-за неисправного соединения. Это особенно важно для притока и оттока разъемы импульсных демпферы!
- Помните ограничить освещенности, если вы используете флуоресцентные метки.
Возможное ограничение нашего потока камеры является то, что высота устанавливается высота канала обрабатываются в алюминий. Однако это преимущество не имея для проверки и регулировки высоты канала до каждого эксперимента и, следовательно, упрощает расчеты сдвига стресс, просто регулировка насоса на требуемую величину. В зависимости от ваших целей исследования, может быть желательно, чтобыувеличение напряжения сдвига без увеличения скорости насоса. В этом случае мы рекомендуем увеличить вязкость перфузат это, например, добавление декстрана в среду 11.
Возможном ограничении потока схема большого объема используемой среды, что может быть проблематичным при попытке количественно очень малых концентрациях клеточных метаболитов. Хотя это и не показано здесь, можно существенно сократить цепь тома с помощью меньшего водохранилища и импульса демпфера и уменьшение длины труб и диаметра.
Кроме того, Есть несколько других коммерчески доступных систем, которые могут быть использованы для применения жидкости напряжение сдвига в клетки в культуре. Микрофлюидных-систем, например, система BioFlux от флюксия, включить одновременный анализ клеток в разных микрофлюидных каналов поток загружен раствора в луночных выступает в качестве входных и выходных емкостей для этих каналов 12,13,14. Тем не менее, эти и другие микро-жидкостный системы не совместимы со стандартными слайдами микроскопа и не допускают восстановления достаточно большое количество клеток для дальнейших экспериментов, например, RT-PCR и Вестерн-блот. Кроме того, они менее удобным для пользователей, стоимость не менее $ 40 000 и может достигать в общей сложности более $ 100 тысяч, в зависимости от дополнительного оборудования.
Два macrofluidic систем, доступных из Flexcell International Corporation, Streamer Flexcell и FlexFlow систем, которые были успешно использованы для изучения клеток эндотелия 15,16,17, клетки человеческого кольца 18 и 19 фибробластов под жидкости условиях потока. Третья система, через GlycoTech, была использована для изучения адгезии клеток опухоли 20 и адгезии лейкоцитов от 21 до эндотелиальных монослоев.
Streamer система позволяет несколько слайдов для запуска на тех же условиях сдвига стресс сразу, но испытывает недостаток в окне просмотра и - в отличие от нашихдизайн - не позволяет в режиме реального времени визуализации клеток в потоке.
FlexFlow система обзорное окно, но требует прямой микроскоп, который не может быть стандартным микроскоп используется в большинстве лабораторий. Кроме того, система требует FlexFlow ячейки покрытые покровным стеклом для получения обратной матрицы, когда помещается в проточную камеру. Это препятствует визуализации флуоресцентных клеток на непрозрачной поверхности, например, с титановым покрытием стекла, которые мы демонстрируем в нашем исследовании. И наконец, специализированные скользит крышка должны быть куплены специально для FlexFlow системы, которая в несколько тысяч долларов, ценовой диапазон, по аналогии с системой Streamer Flexcell.
GlycoTech предлагает круглого и прямоугольного плоского потока камер, которые значительно дешевле, но изготовлены из литой акриловый, которые не могут быть удобно стволовых автоклавного как наши камеры. Следует отметить, что другие камеры потоков, которые были описаны для автоклавированияпоявляются нецелесообразно, так как они требуют специального микроскопических линз 22,23. Система использует GlycoTech кремния резиновые прокладки, расположенный между верхней и нижней пластин, которые будут изменяться в толщину при повторном использовании и, следовательно, изменение высоты камеры с течением времени (производитель рекомендует приобретать новые после каждых десяти использует). Наши алюминиевые камеры со встроенными уплотнительными кольцами, позволяющая полностью оппозиции верхней и нижней пластин и обеспечивает постоянную высоту камеры между экспериментами. Наконец, вакуумные насосы, необходимые для достижения герметичного уплотнения во многих исполнениях камере поток, в том числе GlycoTech камеры, которые не нужны в нашем проекте.
В то время здесь не показано, проточную камеру можно держать под микроскопом в течение всего эксперимента поток в режиме реального времени изображения адгезии клеток и / или поведения. Если это требуется, мы рекомендуем использовать лампы высокой температуры или подогревом площадку под камеру для поддержания перфузат температуры при 37 ° C. Мехтам, роликовый насос может быть заменен на шприцевой насос, если нет "рециркуляции" либо клеток или метаболитов или исследуемых препаратов или агентов желательно 24.
Кроме того, можно поступать по-разному меченых клеток в течение прилипшие клетки, например, люминесцентные тромбоцитов над слоем сливной ЕРС (при использовании тромбоцитов анализа описывается Achneck и соавт. 6,25), чтобы оценить клетка-клетка взаимодействия в жидкости напряжение сдвига. Наши проточную камеру сочетает ценные признаки других доступных камер потока, таких как порт перфузат отбора проб и смотровое окно и важным преимуществом совместимости с любым перевернутый или прямой микроскоп. Он полностью автоклавируемый и позволяет повторять эксперименты на постоянной высоте камеры и без вакуумных насосов для достижения герметичности.
Раскрытие информации
Производство и свободного доступа этого видео-статью спонсируется Коул-Parmer машиностроительный завод
Благодарности
Авторы хотели бы поблагодарить Джо Оуэн в биомедицинские инструменты и машины Магазин за его неустанные усилия в механической обработке и сборке проточную камеру частей и Мэтт Модсли от Leica Microsystems для оказания помощи в методы изображения клеток через поток камер. Мы в долгу перед Кевин Коллинз из служб герцога перфузии и д-р Стив Уоллес в кафедрой биомедицинской инженерии за полезные предложения по дизайну поток цепи. Мы также хотели бы поблагодарить Национальный научный фонд исследований Высшей Программа стипендий для поддержки Александра Jantzen и NIH за их поддержку через Грант "Аутологичная EPC подкладкой для улучшения биосовместимости кровообращения помощи устройств" RC1HL099863-01.
Материалы
| Name | Company | Catalog Number | Comments |
| Продукция / Реагенты | Компания | Продукт # | |
| 10 мл шприцев | Коул Parmer машиностроительный завод | 07940-12 | |
| 1-полосная Stopcoks | Коул Parmer машиностроительный завод | 30600-00 | |
| 30 мл шприцев | BD Медицинские | 309650 | |
| 4-Way Краны | Коул Parmer машиностроительный завод | 30600-04 | |
| Алюминиевый сплав | N / A | 6061 | |
| Cell-культуры блюда (4-хорошо, прямоугольные) | Thermo Scientific; Nunc | 267061 | |
| Сотовые Tracker Оранжевый | Invitrogen | C34551 | |
| ДМСО | Исследования Organics | 2162D | |
| DPBS (-/-) | Invitrogen | 14190-144 | |
| EGM-2 Singlequots | Lonza | CC-4176 | |
| Женский Luer адаптер | Коул Parmer машиностроительный завод | SI-45500-04 | |
| Фибронектин | Сигма | F0895-2 мг | |
| Стеклянная бутылка (250 мл) с крышкой | Коул Parmer машиностроительный завод | 34594-24 | |
| Жесткий труб | Коул Parmer машиностроительный завод | 06508-16 | |
| HBSS | Сигма | H8264-500ML | |
| Histopaque | Сигма | H8889-500ML | |
| Hoechst Пятно решение | Сигма | H6024 | |
| Hyclone FBS | Thermo Scientific | SH30071.01 | |
| L-глютамин | Lonza | 17-605E | |
| Мужской Luer адаптер | Коул Parmer машиностроительный завод | EW-45505-04 | |
| MCDB-131, 1X среднего | Cellgro | 15-100-CV | |
| Колючая фитинги полипропиленовые | Коул Parmer машиностроительный завод | 06365-90 | |
| O-Ring | N / A | AS568A | |
| Импульсно-демпфера | Коул Parmer машиностроительный завод | 07596-20 | |
| Насос-Drive (Masterflex L / S с переменной скоростью экономики привод) | Коул Parmer машиностроительный завод | 7524-40 | |
| Насос-Head (Masterflex Легкий насос нагрузка) | Коул Parmer машиностроительный завод | 07518-60 | |
| Слайд | Коул Parmer машиностроительный завод | 48500-00 | |
| Мягкие трубы | Коул Parmer машиностроительный завод | 96400-16 | |
| Шприц фильтр | Коул Parmer машиностроительный завод | 02915-12 | |
| Sytox оранжевой нуклеиновых кислот пятно | Invitrogen | S-11368 | |
| Трипсин ЭДТА | Lonza | CC-5012 | |
| Трипсин нейтрализующим раствором | Lonza | CC-5002 |
Ссылки
- Bhat, V. D., Truskey, G. A., Reichert, W. M. Fibronectin and avidin-biotin as a heterogeneous ligand system for enhanced endothelial cell adhesion. J. Biomed. Mater. Res. 41, 377-385 (1998).
- Broxmeyer, H. E. Cord blood stem and progenitor cells. Methods Enzymol. 419, 439-473 (2006).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Brown, M. A., Wallace, C. S., Angelos, M., Truskey, G. A. Characterization of umbilical cord blood-derived late outgrowth endothelial progenitor cells exposed to laminar shear stress. Tissue. Eng. Part. A. 15, 3575-3587 (2009).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc. Res. Tech. 73, 71-76 (2010).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Rinker, K. D., Prabhakar, V., Truskey, G. A. Effect of contact time and force on monocyte adhesion to vascular endothelium. Biophys. J. 80, 1722-1732 (2001).
- Truskey, G. A., Yuan, F., Katz, D. F., Horton, M. J. Ch. 2. Transport Phenomena in Biological Systems. , (2004).
- Truskey, G. A., Yuan, F., Katz, D. F., Horton, M. J. Ch. 2. Transport Phenomena in Biological Systems. , (2009).
- Allen, J. D. Plasma nitrite response and arterial reactivity differentiate vascular health and performance. Nitric Oxide. 20, 231-237 (2009).
- Xiao, Y., Truskey, G. A. Effect of receptor-ligand affinity on the strength of endothelial cell adhesion. Biophys. J. 71, 2869-2884 (1996).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet Adhesion and Aggregation Under Flow using Microfluidic Flow Cells. J. Vis. Exp. (32), e1644-e1644 (2009).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. W. e. l. l. plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Conant, C. G. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J. Lab. Autom. 16, 148-152 (2011).
- Metaxa, E. Nitric oxide-dependent stimulation of endothelial cell proliferation by sustained high flow. Am. J. Physiol. Heart. Circ. Physiol. 295, H736-H742 (2008).
- Radel, C., Carlile-Klusacek, M., Rizzo, V. Participation of caveolae in beta1 integrin-mediated mechanotransduction. Biochem. Biophys. Res. Commun. 358, 626-631 (2007).
- Wang, X. L., Fu, A., Spiro, C., Lee, H. C. Proteomic Analysis of Vascular Endothelial Cells-Effects of Laminar Shear Stress and High Glucose. J. Proteomics. Bioinform. 2, 445-445 (2009).
- Elfervig, M. K., Minchew, J. T., Francke, E., Tsuzaki, M., Banes, A. J. IL-1beta sensitizes intervertebral disc annulus cells to fluid-induced shear stress. J. Cell. Biochem. 82, 290-298 (2001).
- Archambault, J. M., Elfervig-Wall, M. K., Tsuzaki, M., Herzog, W., Banes, A. J. Rabbit tendon cells produce MMP-3 in response to fluid flow without significant calcium transients. J. Biomech. 35, 303-309 (2002).
- Patton, J. T., Menter, D. G., Benson, D. M., Nicolson, G. L., McIntire, L. V. Computerized analysis of tumor cells flowing in a parallel plate chamber to determine their adhesion stabilization lag time. Cell. Motil. Cytoskeleton. 26, 88-98 (1993).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009-e1009 (2009).
- Kaper, H. J., Busscher, H. J., Norde, W. Characterization of poly(ethylene oxide) brushes on glass surfaces and adhesion of Staphylococcus epidermidis. J. Biomater. Sci. Polym. Ed. 14, 313-324 (2003).
- Bakker, D. P., Plaats, A. v. a. n. d. e. r., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Angelos, M. G. Dynamic adhesion of umbilical cord blood endothelial progenitor cells under laminar shear stress. Biophys. J. 99, 3545-3554 (2010).
- Baker, G. R., Sullam, P. M., Levin, J. A simple, fluorescent method to internally label platelets suitable for physiological measurements. Am. J. Hematol. 56, 17-25 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены