Method Article
Músculo Esquelético dimorfismo de género de Proteómica
En este artículo
Resumen
Un conjunto de straight-forward de los métodos para aislar y determinar la identidad de las proteínas más abundantes se expresa en el músculo esquelético. Cerca de 800 puntos se vislumbran en un gel bidimensional de los músculos de 10 mg, lo que permite la determinación de los específicos de género expresión de la proteína. Estos métodos dan resultados equivalentes en la mayoría de los tejidos.
Resumen
Contracción bruto en el músculo esquelético está determinada principalmente por un número relativamente pequeño de las proteínas contráctiles, sin embargo, este tejido es también muy adaptable a los factores ambientales, tales como un ejercicio de resistencia por la hipertrofia y atrofia por desuso. Es lo que muestra la remodelación y adaptación a los factores de estrés (calor, isquemia, metales pesados, etc.) 2,3. El daño puede ocurrir en el músculo por músculo ejerce una fuerza, mientras que el alargamiento, el 4 llamado contracción excéntrica. Las proteínas contráctiles puede ser dañado en tales esfuerzos y necesita ser reparado, degradados y / o resintetizado, estas funciones no son parte de las proteínas contráctiles, sino de otras proteínas y mucho menos abundantes en la célula. Para determinar qué subconjunto de proteínas está implicada en la mejora de este tipo de daño, el proteoma global debe ser establecido antes del ejercicio 5 y luego seguir como consecuencia del ejercicio para determinar el diferencialexpresión de la proteína y por lo tanto poner de relieve las proteínas candidatas en las adaptaciones a los daños y su reparación. Además, la mayoría de los estudios de los músculos esqueléticos se han realizado en el macho de la especie y por lo tanto puede no ser representativa de músculo femenino.
En este artículo se presenta un método para extraer las proteínas de los músculos de forma reproducible hombres y mujeres, y los separa por electroforesis bidimensional en gel seguido de imágenes de alta resolución digital 6. Esto proporciona un protocolo de puntos (y de las proteínas identificadas posteriormente), que muestran una diferencia estadísticamente significativa (p <0,05) de dos veces el aumento o disminución, aparecen o desaparecen del estado de control. Estos se extirpa, se digieren con tripsina y se separaron por cromatografía líquida de alta presión, acoplado a un espectrómetro de masas (LC / MS) para la identificación de proteínas (LC / MS / MS) 5. Esta metodología (Figura 1) se puede utilizar en muchos tejidos con poca o ninguna modificación (hígado, cerebro, oídot etc.).
Protocolo
1. Preparación de la muestra
- El uso de tejido fresco, congelado o en flash RNAlater tratos de los ratones como material de partida. Blot a la basura cualquier exceso con un conservante Kimwipe antes de proceder.
- Eliminar todos los tendones y la fascia alrededor del músculo y el tejido con pelos en las hojas de afeitar solo filo para los 2 minutos en placas de vidrio enfriado en un cuarto frío (4 ° C) hasta que el tejido está bien picado o en polvo. Recoger la muestra en un tubo de microcentrífuga previamente pesado y determinar el peso del tejido. No utilice más de 10 mg de tejido como material de partida.
- Añadir 45 l de tampón de extracción (8 M urea, 50 mM DTT, CHAPS 4%, 0,2% anfolitos transportista 5.8, 0,0002% bromofenol azul) por mg de tejido una picada, a temperatura ambiente. Si el volumen es superior a 350 l, 350 l añadir inicialmente y homogeneizar (paso 1.4), a continuación, añadir el resto del buffer para minimizar las salpicaduras.
- Homogeneizar el tejido siete veces con un mazo motorizado (Kontes Corp) durante 15 segundos a4 ° C, con dos minutos de enfriamiento en hielo entre cada homogenización.
- Centrifugar las muestras a 15.600 xg durante 30 minutos a 4 ° C. Guardar el sobrenadante y medir su volumen. Los restos de sedimento de células se descarta.
- Precipitar las proteínas en el sobrenadante con helado de acetona de grado reactivo (3 veces v: relación v). Vortex los tubos durante 15 segundos. Centrífuga para 15.600 xg durante 10 segundos para formar pellets y resuspender en tampón de extracción con el motor y barras de polipropileno Kontes agitación (BioSpec Prod)
- Repita el paso 1.6.
- O bien proceder a la estimación de concentración de proteínas de las muestras o almacenarlos a -20 ° C.
2. Proteína estimación de concentración
Use el ensayo de Lowry 7 o el ensayo BCA 8 (Pierce), objetivo de unos 4,5 mg ml -1.
3. Isoelectroenfoque
- Quitar una tira IPG ReadyStrip (11 cm, pH 5.8, Bio-Rad)desde -20 ° C y deje que se equilibre a temperatura ambiente durante 10-15 min.
- Vortex la muestra y la pipeta 600-800 mg (volumen total 200 l) de la muestra de la proteína en una línea recta en el borde posterior de un canal en la bandeja de rehidratación de la muestra, dejando aproximadamente 1 cm en cada extremo.
- Con unas pinzas, retire la tapa de plástico de la tira IPG - Asegúrese de manejar sólo los extremos de la banda y evitar cualquier contacto con el gel. Nota final básicos de la tira y colocarla en el lado izquierdo de la bandeja. Coloque la tira IPG gel hacia abajo en la parte superior de la muestra, evite la retención de burbujas debajo. Deje que se rehidratan durante una hora.
- Superposición con 2,5 ml de aceite mineral (BioRad). Cubra la bandeja con la tapa, y dejar hidratar durante la noche a temperatura ambiente.
- Coloque una mecha de papel en ambos extremos del canal de la bandeja de enfoque y húmeda cada uno con 10 l de agua Millipore.
- Saque la tira IPG y sosténgalo de forma vertical durante unos 10 segundos el desagüe el aceite. Seque la b de plásticoACKing con un Kimwipe.
- Coloque el lado de la tira de gel IPG abajo y con fines básicos de la izquierda en la bandeja de enfoque. Cubrir la franja con 2,5 ml de aceite mineral.
- Coloque la bandeja en la célula PROTEAN IEF (Bio-Rad) y el programa de un protocolo de 3 pasos (Tabla 1) a la temperatura de celda predeterminado de 20 ° C, una corriente máxima de 50 mA / tira, y no hay tiempo de rehidratación.
Voltaje Tiempo Volt-Horas Rampa Paso 1 250 20 min Lineal Paso 2 8000 2,5 horas Lineal Paso 3 8000 40.000 Rápido Total 6,5 horas 40.000 Tabla 1. Tres pasos del protocolo de Protean IEF celular de 11 cm IPG tiras.
- Tome las tiras IPG fuera de la célula del IEF con el fórceps. Seque el respaldo de plástico con un Kimwipe y coloque el lado tira de gel IPG en una bandeja de rehidratación limpia. Puede cubrir la bandeja de rehidratación y envolverlo con papel plástico y almacenar a - 80 ° C o proceder.
4. SDS electroforesis en gel de poliacrilamida
- Transferencia de la franja (hasta gel de lado) en una bandeja de 11 cm de equilibrio.
- Agregar 4 ml de tampón de reducción (6 M urea, 2% SDS, 0,05 M de Tris / HCl pH 8,8, 20% de glicerol, 2% TDT) para el canal y equilibrar la tira durante 10 minutos con agitación suave.
- Eliminar el buffer de reducción, añadir 4 ml de tampón de alquilación (6 M urea, 2% SDS, 0,05 M de Tris / HCl pH 8,8, 20% de glicerol, un 2,5% yodoacetamida) y equilibrar la tira durante 10 minutos con agitación suave.
- Enjuague la tira IPG por inmersión del STRIp brevemente en 1 X tampón SDS funcionamiento (25 mM Tris, 192 mM glicina, 0,1% SDS, pH 8,2).
- Coloque el lado del gel de la tira para arriba sobre la placa posterior de los 11 cm Criterio prefabricados 10,5% y un 14% Tris-HCl en gel de poliacrilamida SDS (Bio-Rad) y presione suavemente en el modo que se haga pleno contacto con el gel de SDS; asegurarse de que no haya burbujas atrapadas entre las dos superficies de gel.
- Superposición de la tira IPG con 1 ml de solución de agarosa fundida (0,5% de agarosa, 25 mM Tris, 192 mM glicina, SDS 0,1%, azul de bromofenol) y dejar solidificar la agarosa durante 5 minutos.
- Carga de 5 l de proteína marcadora 10-225 kDa (USB, P / N: 76740) en el único pozo como estándares de peso molecular.
- Ejecute el gel de SDS buffer (25 mM Tris, 192 mM glicina, 0,1% SDS, pH 8.2) a 200 V a temperatura ambiente o en un cuarto frío (4 ° C), utilizando el azul de bromofenol migración frente tinte para controlar la electroforesis.
- Quitar el gel de la fundición de plástico y mancha la noche agitando suavemente en azul brillante de CoomassieR-250 mancha (45,5% de metanol, el 45,5% dH2O, el 9,0% de ácido acético, 0,25% Coomassie Brilliant Blue R-250).
- Agite el gel en una solución Destain (45,5% de metanol, el 45,5% dH 2 O, 9,0% de ácido acético) dos veces durante 3 horas cada uno y en Destain 2 (5% de metanol, 90% dH 2 O, 5% de ácido acético) durante la noche. Guarde el gel en el 7% de ácido acético para el análisis.
5. Gel de imágenes y análisis
- Capturar imágenes de los geles utilizando la cantidad Un programa de software que opera el sistema de imágenes VersaDoc (BioRad). Cultivos las áreas de imagen de manera uniforme para todos los geles en su experimento.
- Cargar las imágenes recortadas en el programa PDQuest software 8.0 para crear un conjunto de experimentos. Siga el asistente de configuración experimento para definir los parámetros para la detección de puntos y el punto correspondiente a través de los geles. Revisar y perfeccionar el lugar correspondiente los resultados manualmente si es necesario.
- Realizar un análisis cuantitativo y estadístico de los geles para detectar manchas de proteínas emparejado con twdiferencias estadísticamente significativas o veces o más en la expresión entre los dos grupos de gel. Crear un análisis conjunto de estos puntos de interés y recortarlas utilizando un cortador lugar EXQuest (BioRad) para la digestión de la tripsina y la LC-MS-basado en la identificación de proteínas.
6. En-gel tríptico digestión
Para este paso un Pierce modificado en gel tríptico Compendio Kit (# 89871X, Pierce) se utiliza el protocolo.
- Añadir 200 l de solución decolorante (25 mM de bicarbonato de amonio, el 50% de acetonitrilo) a los enchufes de gel. Agitar e incubar las muestras a 37 ° C durante 30 minutos con agitación. Retire con cuidado y deseche la solución.
- Repita el paso 6.1.
- Añadir 30 l de tampón recién preparado la reducción (50 mM Tris [2-carboxietil] fosfina, un 22,5 mM de bicarbonato de amonio) a los tubos con los tapones de gel e incubar a 60 ° C durante 10 minutos.
- Permita que las muestras que se enfríe, luego retirar y desechar el buffer de la reducción.
- Añadir 30 l de tampón de alquilación (100 mM yodoacetamida, 20 mM de bicarbonato de amonio, preparada inmediatamente antes de su uso en tubos envueltos en papel de aluminio. Incubar las muestras en la oscuridad a temperatura ambiente durante 1 hora.
- Retire y deseche el buffer de alquilación. Lave los tapones de gel mediante la adición de 200 l de solución de decoloración de cada tubo. Incubar las muestras a 37 ° C durante 15 minutos.
- Retire y deseche la solución decolorante y repetir el lavado.
- Añadir 50 l de acetonitrilo a los tapones de gel e incubar por 10 minutos a temperatura ambiente para permitir que se contraigan en seco, a continuación, retire con cuidado el acetonitrilo.
- Repita el paso 6.8, una vez más. Piezas de gel debe verse blanca y pequeña.
- Permiten que las piezas de gel se seque en un concentrador de CentriVap (Labconco, modelo EX1245) durante 10 minutos.
- Engrosar las piezas de gel mediante la adición de 10 l de solución de tripsina activada (10 tripsina ng / l, 25 mM de bicarbonato de amonio). Incubar a temperatura ambiente durante 15 minutos.
- Añadir 25 l tampón de digestión (25 mM de bicarbonato de amonio) a los tubos. Incubar las muestras a temperatura ambiente durante la noche con agitación.
- Sonicar las muestras durante 10 minutos (Branson, modelo baño sonicador 2510) y el giro hacia abajo antes de retirar el sobrenadante a un tubo nuevo. Guardar el sobrenadante.
- A fin de extraer los péptidos, se añaden 10 l de 0,1% de ácido fórmico y se incuba durante 5 minutos a temperatura ambiente con agitación. Sonicar las muestras durante 10 minutos, recoge el sobrenadante y se combinan con sobrenadante guardado en el paso 6.13.
7. Desalación microescala de los extractos peptídicos
- Eliminar el bicarbonato de amonio y otras sales en los extractos peptídicos con la ayuda de PepClean C-18 columnas de centrifugado (ThermoFisher) de acuerdo con las instrucciones del fabricante.
- Péptidos eluir dos veces con 20 l de acetonitrilo 70%, se evaporan las muestras secas por centrifugación en el Concentrador CentriVap durante 1 hora y resuspenderlos péptidos en 10 l de ácido fórmico al 0,1% para el análisis de MS.
8. La identificación de proteínas por HPLC-espectrometría de masas acoplada
- Independiente de 5 l de la mezcla de péptidos en un cromatógrafo de líquidos de alta eficacia (HPLC) de más de 40 minutos, utilizando un gradiente lineal de 20 a 50% de acetonitrilo con 0,2% de ácido fórmico en una Pepswift monolítica PS-DVB columna (Dionex) acoplado a un nanospray I de origen en un espectrómetro de trampa de iones de masas (LCQ Deca XP Max, Thermo Fisher Scientific) con un caudal de 400 nL / min en la punta.
- Detectar péptido MS1 señales entre 400 a 1400 m / z y permiten los 3 picos de iones más intensos que ser aislado para MS2 secuenciación por CID con la exclusión dinámica.
- Para la identificación de proteínas, análisis de los resultados de péptidos a través de una búsqueda de base de datos de referencia del ratón Sequest (BioWorks software Thermo-Fisher Scientific) con una modificación de la cisteína estática alquiladas y modificaciones dinámicas de la fosforilación (serina, treonina, tirosina), metilaciónción (histidina), oxidación (metionina), ADP-ribosilación (arginina), y la acetilación N-terminal. Aplicar criterios de coincidencia conservadora (por ejemplo, la tolerancia péptido establece en 2 UMA y 1,00 tolerancia fragmento, proteínas contienen al menos dos péptidos pasar un Xcorr vs Estado de carga del filtro [z = 1 / x = 1.5, z = 2 / x = 2.00, z = 3 / x = 2.50, z = 4 / x = 3,00] y una probabilidad de p <0,05) y cinco inspeccionar manualmente los espectros de MS para la identificación de proteínas confianza.
9. Los resultados representativos:
Hombres y mujeres no ejercidas, el músculo esquelético murino (bíceps braquial) se extrae y se separa en un mapa en dos dimensiones 5, el primer nivel del músculo comparativo del proteoma (Figura 2). Una vez visualizado el uso de alta resolución de imágenes digitales, cerca de 800 puntos de la proteína fueron detectados en cada uno. Utilizando el mapa del proteoma masculina como una línea de base, está claro que hay numerosos lugares que el cambio en la abundancia en el proteoma de las mujeres. La intensidad de mancha se medidas del cambio en las cantidades de proteínas (Figura 3). Las identidades de las manchas de proteínas que cambian más de dos veces (hacia arriba o hacia abajo) y son estadísticamente significativas (p <0,05) con un n = 5 ratones, se determinó mediante análisis de la secuencia de aminoácidos utilizando cromatografía líquida-espectrometría de masas acoplada. Estos resultados muestran que las mujeres demuestran una disminución de la abundancia de las enzimas de azúcar en el metabolismo energético y en la enzima creatina quinasa (CK) isoformas, un sistema de suministro de energía diferentes en los músculos. Los seres humanos y animales muestran mayores niveles séricos de CK macho en reposo y después del ejercicio 9,10, pero los niveles séricos de CK no se corresponden necesariamente con la cantidad de interrupciones miofibrilar 11,12. Este dimorfismo de género en la abundancia celular de CK en el músculo bíceps braquial murino es una novela finding5 y puede responder a las fisiológicamente diferentes niveles séricos de CK.
Cifras:
g1.jpg "/>
Figura 1. Un esquema general del protocolo para la proteómica comparativa. El protocolo se divide en tres grupos: preparación de muestras, análisis de la muestra, y, la identificación de proteínas. Los extremos de cada uno de estos tres grupos de protocolos también están haciendo una pausa razonable lugares, aunque los mejores resultados se obtuvo, si el protocolo general se lleva a cabo sin parar.
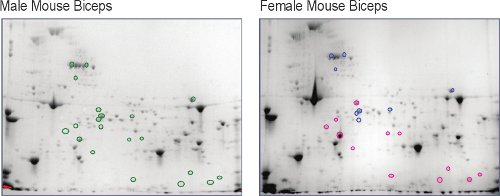
Figura 2. Comparación de las mujeres proteína murina bíceps braquial puntos en relación con los puntos idénticos en bíceps braquial masculino (verde o círculos). Puntos que el aumento mayor o igual a dos veces en las mujeres con un círculo rojo (o) y los que bajaron menos que o igual a dos veces con un círculo azul (o).

Figura 3 Punto Gel Análisis de Intensidad:. Del eje X, las mujeresantes del ejercicio (control, n = 5), eje Y, las mujeres solteras que pelea 0 grupo de puntos de horas de tiempo (n = 5). Línea de regresión: coeficiente de correlación = 0,919; pendiente = 0,976; interceptar = -0.0293. Puntos por encima de la línea roja y por debajo de la línea azul cambiar más de + / - dos veces.
Discusión
El método de LC / MS proteómica que aquí se presenta es un protocolo más fiable y reproducible para un análisis rápido del primer nivel del proteoma del músculo esquelético. Además, permite una comparación razonable expediente de la especificidad de género. Proteínas de baja abundancia que requieren un fraccionamiento de la muestra de músculo para eliminar la mayor cantidad de proteínas contráctiles como sea posible, lo que aumenta las proteínas de baja abundancia. Adaptar el perfil de proteoma se puede lograr con diferentes tiras IPG rango de pH y un suplente geles de gradiente porcentaje si así lo desea. Colorantes fluorescentes más sensibles existen, pero se recomienda que cada laboratorio determine la linealidad de estas manchas en su sistema. Para un análisis más riguroso de la expresión proteica del sistema DIGE (bidimensional en gel de electroforesis sistema, GE Healthcare Life Sciences) se puede utilizar, sin embargo esto se le añade un nivel de complejidad de la metodología. Además, el protocolo descrito en este documento se puede utilizar con la mayoría de los animalestejidos mal para el que ha sido una secuencia del genoma, así como de secuenciación de novo de una proteína a partir de cualquier fuente, siempre y cuando se puede resolver en un gel de dos dimensiones, ya que se superponen fragmentos enzimática se puede generar el uso de enzimas de alta pureza, además de a la tripsina. Las muestras de tejido de otras fuentes pueden requerir algunas modificaciones en la metodología de extracción, especialmente si busca proteínas de la membrana e hidrofóbicas, sin embargo, hemos tenido buenos resultados con este protocolo con el corazón, el hígado, los riñones y los tejidos del cerebro. Otras modificaciones post-traduccionales se pueden detectar mediante la modificación del espectro de masas criterios de búsqueda de base de datos. En resumen, hemos presentado un protocolo inicial razonablemente detallado para el análisis de perfiles proteoma.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a Yutian Gan para el uso de la figura 3. Este trabajo fue apoyado por la Fundación Nacional de Ciencias 0420971, el Smith College Blakeslee, Wilens y los fondos de Holmes, y el Howard Hughes Medical Institute.
Materiales
| Name | Company | Catalog Number | Comments | |
| Nombre del reactivo | Tipo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|---|
| PepClean C-18 Giro Columnas | Consumible | ThermoFisher Científico | PI-89870 | |
| Monolítica Pepswift columna (100um x 5 cm) | Consumible | Dionex | 162348 | |
| Criterio prefabricado 10,5% y un 14% Tris-HCl SDS geles de poliacrilamida | Consumible | BioRad | 345-0106 | |
| Readystrip tiras IPG | Consumible | BioRad | Diferentes pH rangos de | |
| Ácido acético | Reactivo | Fisher Scientific | A465-1 | |
| Acetona | Reactivo | Pharmco | 329000 | |
| Acetonitrilo | Reactivo | Fisher Scientific | A955 | |
| Agarose | Reactivo | BioRad | 163-2111 | Superposición solución |
| De bicarbonato de amonio | Reactivo | Fluka | 40867 | |
| Azul de bromofenol | Reactivo | Fisher Scientific | BP114 | |
| Bio-Lyte anfolitos | Reactivo | BioRad | Diferentes pH rangos de | |
| CHAPS | Reactivo | USB | 13361 | |
| Commassie blue R-250 | Reactivo | ThermoFisher Científico | 20278 | |
| Ditiotreitol (DTT) | Reactivo | USB | 15395 | |
| Ácido fórmico | Reactivo | ThermoFisher Científico | 28905 | |
| Glicerol | Reactivo | Sigma-Aldrich | G6279 | |
| Glicina | Reactivo | USB | 16407 | |
| Yodoacetamida | Reactivo | Sigma-Aldrich | I6125 | |
| Metanol | Reactivo | Fisher Scientific | A452 | |
| De aceite mineral | Reactivo | BioRad | 163-2129 | |
| Dodecilsulfato de sodio | Reactivo | Sigma-Aldrich | L6026 | |
| Tris base | Reactivo | Sigma-Aldrich | 93349 | |
| Tris [2-carboexyethyl] fosfina | Reactivo | ThermoFisher Científico | 77720 | |
| Tripsina endoproteinasa, TPCK tratada, MS grado | Reactivo | Atravesar | 90055 | modificado |
| Urea | Reactivo | USB | 75826 | |
| De agua | Reactivo | Burdick & Jackson | 365 | |
| CentriVap Concentrador | TOOL | Labconco | ||
| Exquest cortador de lugar | Herramienta | BioRad | ||
| LCQ Deca XP Max ion espectrómetro de masas de trampa | Herramienta | ThermoFisher Científico | ||
| Motorizados maja | Herramienta | Kontes Corp | ||
| Polipropileno agitando | Herramienta | BioSpec Prod | ||
| barras | ||||
| PROTEAN IEF celular | Herramienta | BioRad | ||
| Sonicator | Herramienta | Branson | ||
| Además HPLC Surveyor sistema | Herramienta | ThermoFisher Científico | ||
| VersaDoc imágenes sistema | Herramienta | BioRad |
Referencias
- Fehrenbach, E., Mooren, F. C., Völker, K. . Molecular and Cellular Exercise Physiology. , 199-217 (2005).
- Mooren, F. C., Mooren, F. C., Völker, K. The Cell. Molecular and Cellular Exercise Physiology. , 3-18 (2005).
- Thompson, H. S., Clarkson, P. M., Scordilis, S. P. The repeated bout effect and heat shock proteins: intra-muscular HSP27 and HSP70 expression following two bouts of eccentric exercise in humans. Acta. Physiol. Scand. 174, 47-56 (2002).
- McHugh, M. P. Recent advances in the understanding of the repeated bout effect: the protective effect against muscle damage from a single bout of eccentric exercise. Scand. J. Med. Sci. Sports. 13, 88-97 (2003).
- Metskas, L. A., Kulp, M., Scordilis, S. P. Gender Dimorphism in the Exercise-Naïve Murine Skeletal Muscle Proteome. Cell Molec. Biol. Lett. 15, 507-516 (2010).
- Lopez, J. L. Two-dimensional electrophoresis in proteome expression analysis. J. Chromatogr. B. 849, 190-202 (2007).
- Lowry, O. H., Rosenburg, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193, 265-275 (1951).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of Protein Using Bicinchoninic Acid. Anal. Biochem. 150, 76-85 (1985).
- Norton, J. P., Clarkson, P. M., Graves, J. E., Litchfield, P. L., Kirwan, J. Serum creatine kinase activity and body composition in males and females. Hum. Biol. 57, 591-598 (1985).
- Amelink, G. J., Kamp, H. H., Bär, P. R. Creatine kinase isoenzyme profiles after exercise in the rat: sex-linked differences in leakage of CK-MM. Pflügers. Arch. 412, 417-421 (1988).
- Kendall, B., Eston, R. Exercise-induced muscle damage and the potential protective role of estrogen. Sports Med. 32 (2), 103-123 (2002).
- Tiidus, P. M. Can oestrogen influence skeletal muscle damage, inflammation, and repair?. Br. J. Sports Med. 39, 251-253 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados