Method Article
Skeletal Muscle Gender Dimorphismus von Proteomics
In diesem Artikel
Zusammenfassung
Eine geradlinige Reihe von Methoden zur Isolierung und Bestimmung der Identität der am häufigsten vorkommenden Proteine in der Skelettmuskulatur exprimiert. Etwa 800 Plätze sind auf einem zweidimensionalen Gel aus 10 mg Muskel zu erkennen, dies ermöglicht die Bestimmung des Geschlechts-spezifische Protein-Expression. Diese Methoden werden gleichwertige Ergebnisse in den meisten Geweben.
Zusammenfassung
Gross Kontraktion im Skelettmuskel vor allem durch eine relativ kleine Anzahl von kontraktilen Proteinen bestimmt, aber dieses Gewebes ist auch bemerkenswert anpassungsfähig auf Umweltfaktoren 1 wie Hypertrophie durch Krafttraining und Atrophie durch Nichtgebrauch. Es zeigt dabei Umbau und Anpassungen an Stressoren (Hitze, Ischämie, Schwermetalle, etc.) 2,3. Schäden können zu Muskel durch einen Muskel Kraftaufwand auftreten, während die Verlängerung der sogenannten exzentrischen Kontraktion 4. Die kontraktilen Proteine können in solche Anstrengungen beschädigt und muss repariert, abgebaut und / oder resynthetisiert werden; diese Funktionen sind nicht Bestandteil der kontraktilen Proteine, sondern auch von anderen viel weniger reichlich Proteine in der Zelle. Um festzustellen, welche Gruppe von Proteinen in die Verbesserung der diese Art von Schäden handelt, muss eine globale Proteomanalyse vor hergestellt werden bis 5 ausüben und dann folgte im Anschluss an die Übung, um das Differential zu bestimmenProteinexpression und damit Highlight Kandidaten-Proteine in der Anpassung an Schäden und deren Reparatur. Darüber hinaus haben die meisten Studien der Skelettmuskulatur auf die Männchen der Gattung durchgeführt und kann daher nicht repräsentativ für die weibliche Muskulatur werden.
In diesem Artikel präsentieren wir eine Methode zur Extraktion von Proteinen reproduzierbar aus männlichen und weiblichen Muskeln und trennt sie durch zweidimensionale Gelelektrophorese durch hochauflösende digitale Bildbearbeitung 6 an. Dies bietet ein Protokoll für die Spots (und in der Folge identifizierten Proteine), die zeigen eine statistisch signifikante (p <0,05) zweifache erhöhen oder zu verringern, erscheinen oder verschwinden aus dem Schaltzustand. Diese werden dann ausgeschnitten, mit Trypsin verdaut und getrennt durch Hochdruck-Flüssigchromatographie gekoppelt mit einem Massenspektrometer (LC / MS) für die Identifizierung von Proteinen (LC / MS / MS) 5. Diese Methode (Abbildung 1) kann auf vielen Geweben mit wenig bis gar keine Modifikation verwendet werden (Leber, Gehirn, hörent etc.).
Protokoll
1. Probenvorbereitung
- Verwenden Sie frische, schockgefroren oder RNAlater behandelten Gewebe von Mäusen als Ausgangsmaterial. Blot entfernt überschüssiges Konservierungsmittel mit einem Kimwipe bevor Sie fortfahren.
- Entfernen Sie alle Sehnen und Faszien um die Muskel-und Hackfleisch, das Gewebe mit einschneidig Rasierklingen für 2 min auf gekühlten Glasplatten in einem kalten Raum (4 ° C), bis das Gewebe ist gut gehackt oder pulvrig. Sammeln Sie die Probe in einem vorher gewogenen Mikrozentrifugenröhrchen und bestimmen das Gewicht des Gewebes. Verwenden Sie nicht mehr als 10 mg des Gewebes als Ausgangsmaterial.
- Add 45 ul Extraktionspuffer (8 M Harnstoff, 50 mM DTT, 4% CHAPS, 0,2% Trägerampholyte 5 / 8, 0,0002% Bromphenolblau) pro 1 mg zerkleinerte Gewebe, bei Raumtemperatur. Wenn das Volumen größer ist als 350 &mgr; l, 350 &mgr; l hinzufügen und homogenisieren zunächst (Schritt 1,4), dann den Rest des Puffers zu spritzen zu minimieren.
- Homogenisieren des Gewebes sieben Mal mit einem motorisierten Stößel (Kontes Corp) für 15 Sekunden bei4 ° C, mit 2 Minuten auf Eis zwischen den einzelnen Homogenisierung.
- Zentrifugieren Sie die Proben bei 15.600 xg für 30 Minuten bei 4 ° C. Speichern Sie den Überstand und messen das Volumen. Die Zelltrümmer Pellet wird verworfen.
- Fällung der Proteine im Überstand mit eiskaltem Reagenz-grade Aceton (3 mal v: v-Verhältnis). Beide Röhrchen für 15 Sekunden. Zentrifuge für 15.600 xg für 10 Sekunden, um Pellets zu bilden, und resuspendieren in Extraktionspuffer mit dem Kontes Motor-und Polypropylen-Rührstäbe (BioSpec Prod)
- Wiederholen Sie Schritt 1.6.
- Entweder mit Proteinkonzentration Schätzung der Proben gehen oder speichern Sie sie bei -20 ° C.
2. Protein-Konzentration Schätzung
Verwenden Sie das Lowry-Assay 7 oder dem BCA-Assay 8 (Pierce); Ziel für etwa 4,5 mg ml -1.
3. Die isoelektrische Fokussierung
- Entfernen einer ReadyStrip IPG-Streifen (11 cm, pH 5-8, Bio-Rad)von -20 ° C und lassen Sie ihn bei RT für 10-15 min äquilibriert.
- Vortex der Probe und Pipette 600-800 pg (Gesamtvolumen 200 mL) von Protein Probe in einer geraden Linie an der hinteren Kante des Kanals in der Probe Rehydratation Fach, so dass etwa 1 cm an jedem Ende.
- Mit einer Pinzette, ziehen Sie die Plastikabdeckung der IPG-Streifen - stellen Sie sicher, dass nur die Enden des Streifens Griff und vermeiden jeden Kontakt mit dem Gel. Beachten Sie die grundlegenden Ende des Streifens und positionieren Sie es auf der linken Seite des Fachs. Legen Sie die IPG-Streifen-Gel-Seite nach unten auf der Oberseite der Probe zu vermeiden Trapping Blasen darunter. Lassen Sie es eine Stunde rehydrieren.
- Overlay mit 2,5 ml Mineralöl (BioRad). Decken Sie die Schale mit dem Deckel und lassen Sie über Nacht rehydrieren bei Raumtemperatur.
- Ein Papier-Docht an beiden Enden der Schwerpunkt-Fach-Kanal und nass jeweils mit 10 l Millipore-Wasser.
- Nehmen Sie IPG-Streifen und vertikal halten für etwa 10 Sekunden den Öl ablassen. Blot der Kunststoff-backing mit einem Kimwipe.
- Legen Sie die IPG-Streifen Gel nach unten und mit grundlegenden Ende nach links in die Fokussierung Fach. Bedecken Sie den Streifen mit 2,5 ml Mineralöl.
- Legen Sie das Fach in den PROTEAN IEF-Zelle (Bio-Rad) und Programmierung einer 3-Schritt-Protokoll (Tabelle 1) bei Standard-Zell-Temperatur von 20 ° C, einem maximalen Strom von 50 uA / Streifen und keine Rehydrierung Zeit.
Spannung Zeit Volt-Hrs Rampe Schritt 1 250 20 min Linear Schritt 2 8.000 2,5 h Linear Schritt 3 8.000 40.000 Schnell Gesamt 6,5 Std. 40.000 Tabelle 1. Drei-Schritt-Protokoll PROTEAN IEF-Zelle für 11 cm IPG-Streifen.
- Nehmen Sie die IPG-Streifen aus dem IEF-Zelle mit einer Pinzette. Blot die Kunststoff-Abdeckung mit einem Kimwipe und Ort der IPG-Streifen-Gel nach oben in eine saubere Rehydratation Fach. Sie können decken die Rehydratation Tablett und wickeln Sie es mit Plastikfolie bedecken und bei - 80 ° C oder fortzufahren.
4. SDS-Polyacrylamidgelelektrophorese
- Übertragen Sie die Streifen (Gel-Seite nach oben) in einen 11 cm Equilibrierung Fach.
- 4 mL Reduktion Puffer (6 M Harnstoff, 2% SDS, 0,05 M Tris / HCl pH 8,8, 20% Glycerin, 2% DTT), um den Kanal und Äquilibrierung der Streifen für 10 min mit einer leichten Schütteln.
- Entfernen Sie die Reduktion Puffer, 4 ml Alkylierung Puffer (6 M Harnstoff, 2% SDS, 0,05 M Tris / HCl pH 8,8, 20% Glycerin, 2,5% iodoacetamide) und äquilibrieren der Streifen für 10 Minuten mit milden Schütteln.
- Spülen Sie den IPG-Streifen durch Eintauchen des strip kurz in 1 X SDS Laufpuffer (25 mM Tris, 192 mM Glycin, 0,1% SDS, pH 8,2).
- Legen Sie den Streifen-Gel nach oben auf die Rückwand des 11 cm Criterion pre-cast 10,5% -14% Tris-HCl SDS-Polyacrylamidgel (Bio-Rad) und mit leichtem Druck, so dass er vollen Kontakt mit dem SDS-Gel macht; sicherstellen, dass keine Luftblasen zwischen den beiden Geloberflächen gefangen sind.
- Overlay der IPG-Streifen mit 1 ml geschmolzene Agarose-Lösung (0,5% Agarose, 25 mM Tris, 192 mM Glycin, 0,1% SDS, Bromphenolblau) und lassen Sie die Agarose für 5 Minuten erstarren.
- Legen Sie 5 ul Protein-Marker 10-225 kDa (USB, P / N: 76.740) in den einzelnen sowie Molekulargewicht-Standards.
- Führen Sie das Gel in SDS-Puffer (25 mM Tris, 192 mM Glycin, 0,1% SDS, pH 8,2) bei 200 V bei Raumtemperatur oder in einem kalten Raum (4 ° C) mit Hilfe der Bromphenolblau Farbstoff vor der Migration auf die Elektrophorese zu überwachen.
- Entfernen Sie das Gel aus dem Plastikbehälter gegossen und Flecken über Nacht unter leichtem Schütteln in Coomassie Brilliant BlueR-250-Färbung (45,5% Methanol, 45,5% dH2O, 9,0% Essigsäure, 0,25% Coomassie Brilliant Blue R-250).
- Schütteln Sie das Gel in Entfärben 1-Lösung (45,5% Methanol, 45,5% dH 2 O, 9,0% Essigsäure) zweimal für jeweils 3 Stunden und in Entfärben 2 (5% Methanol, 90% dH 2 O, 5% Essigsäure) über Nacht. Bewahren Sie das Gel in 7% Essigsäure für die Analyse.
5. Gel Imaging und Analyse
- Machen Sie Bilder der Gele mit der Quantity One-Software-Programm, das VersaDoc Imaging-System (BioRad) betreibt. Schneiden Sie das Bild Bereichen einheitlich für alle Gele in Ihr Experiment.
- Laden Sie das beschnittene Bilder auf der PDQuest 8.0 Software-Programm, ein Experiment zu erstellen. Folgen Sie dem Experiment Setup-Assistenten, um die Parameter für Spot-Erkennung und Spotmatching über die Gele zu definieren. Überprüfen und verfeinern die Stelle passenden Ergebnisse manuell, wenn nötig.
- Führen Sie quantitative und statistische Analyse der Gele angepasst Proteinspots mit tw erkenneno-fach oder höher statistisch signifikanten Unterschiede in der Expression zwischen den beiden Gruppen Gel. Erstellen Sie eine Analyse mit diesen Stellen von Interesse setzen und schneiden Sie sie mit einem EXQuest Spot Cutter (BioRad) für Trypsinverdauung und LC-MS-basierten Protein-Identifizierung.
6. In-Gel-tryptischen Verdau
Für diesen Schritt eine modifizierte Pierce In-Gel Tryptic Digest Kit (# 89871X, Pierce)-Protokoll verwendet wird.
- Geben Sie 200 ul der Entfärbelösung (25 mM Ammoniumhydrogencarbonat, 50% Acetonitril) auf das Gel Stecker. Vortex und Inkubation der Proben bei 37 ° C für 30 Minuten unter Schütteln. Entfernen und entsorgen Sie die Lösung.
- Wiederholen Sie Schritt 6.1.
- Add 30 ul frisch zubereiteten reduzierendem Puffer (50 mM Tris [2-carboxy] Phosphin, 22,5 mM Ammoniumhydrogencarbonat), um die Rohre mit dem Gel-Stecker und Inkubieren bei 60 ° C für 10 Minuten.
- Die Proben zu kühlen, dann entfernen und die Verringerung der Puffer.
- Add 30 ul Alkylierung Puffer (100 mM iodoacetamide, 20 mM Ammoniumhydrogencarbonat, unmittelbar vor der Verwendung in Folie Röhrchen vorbereitet. Inkubieren Sie die Proben im Dunkeln bei Raumtemperatur für 1 Stunde.
- Entfernen und entsorgen Sie die Alkylierung Puffer. Waschen Sie die Gel-Stecker durch Zugabe von 200 ul der Entfärbelösung in jedes Röhrchen. Inkubieren Sie die Proben bei 37 ° C für 15 Minuten.
- Entfernen und Entsorgen der Entfärbelösung und wiederholen Sie die Wäsche.
- Add 50 ul Acetonitril auf das Gel Stecker und inkubieren Sie sie 10 Minuten bei Raumtemperatur, damit sie zu schrumpfen trocken, dann vorsichtig den Acetonitril.
- Wiederholen Sie Schritt 6,8 Mal mehr. Gel Stücke aussehen soll weiß und klein.
- Lassen Gelstücke in einem CentriVap Concentrator (Labconco, Model EX1245) für 10 Minuten trocknen lassen.
- Swell Gel Stücke durch Zugabe von 10 ul der aktivierten Trypsin-Lösung (10 ng / ul Trypsin, 25 mM Ammoniumhydrogencarbonat). Inkubieren bei Raumtemperatur für 15 minuten.
- Add 25 ul Verdauung Puffer (25 mM Ammoniumhydrogencarbonat), um die Rohre. Inkubieren Sie die Proben über Nacht bei Raumtemperatur unter Schütteln.
- Beschallen die Proben für 10 Minuten (Branson, Ultraschallbad Modell 2510) und Spin sie nieder, bevor Sie den Überstand in ein frisches Röhrchen. Speichern Sie den Überstand.
- Zur weiteren Auszug Peptide, mit 10 &mgr; l 0,1% iger Ameisensäure und Inkubation für 5 Minuten bei Raumtemperatur unter Schütteln. Beschallen die Proben für 10 Minuten, den Überstand und verbinden sich mit gespeichert Überstand in Schritt 6.13.
7. Microscale Entsalzung von Peptid-Extrakte
- Entfernen Ammoniumbicarbonat und andere Salze in der Peptid-Extrakte mit Hilfe von PepClean C-18 Spin Columns (ThermoFisher) nach Anweisungen des Herstellers.
- Eluieren Peptide zweimal mit je 20 ul 70% Acetonitril, verdunsten die Proben trocken durch Zentrifugation in der CentriVap Concentrator für 1 Stunde und resuspendierendie Peptide in 10 ul 0,1% Ameisensäure für MS-Analyse.
8. Protein Identifikation mittels HPLC-gekoppelte Massenspektrometrie
- Separate 5 ul der Peptidmischung auf einem Hochleistungs-Flüssigchromatographie (HPLC) über 40 Minuten, mit einem linearen 2-50% Acetonitril-Gradienten mit 0,2% iger Ameisensäure auf einer Pepswift monolithischen PS-DVB-Säule (Dionex), um eine Nanospray gekoppelt I Quelle auf eine Ionenfallen-Massenspektrometer (LCQ Deca XP Max, Thermo Fisher Scientific) bei einer Flussrate von 400 nl / min an der Spitze.
- Detect-Peptid MS1 Signale zwischen 400 bis 1400 m / z und lassen für die 3 stärksten Ionenpeaks für MS2 Sequenzierung von CID mit dynamischen Ausschluss isoliert werden.
- Für Protein-Identifizierung, Analyse der Peptid-Ergebnisse über eine Sequest Maus Referenzdatenbank Suche (BioWorks Software, Thermo-Fisher Scientific) mit einer statischen alkylierten Cystein Modifikation und dynamische Änderungen für die Phosphorylierung (Serin, Threonin, Tyrosin), Methylierungnung (Histidin), Oxidation (Methionin), ADP-Ribosylierung (Arginin) und N-terminale Acetylierung. Übernehmen konservativen Matching-Kriterien (zB Peptid-Toleranz auf 2 AMU und 1,00 Fragment Toleranz, Proteine enthalten mindestens 2 Peptide Übergabe eines Xcorr vs Charge State-Filter [z = 1 / x = 1,5, z = 2 / x = 2,00, z = 3 / x = 2,50, z = 4 / x = 3,00] und einer Wahrscheinlichkeit von p <0,05) 5 und manuell überprüfen Sie die MS-Spektren für die selbstbewusste Identifizierung von Proteinen.
9. Repräsentative Ergebnisse:
Männliche und weibliche unexercised wurde murinen Skelettmuskel (Bizeps) extrahiert und in eine zweidimensionale Karte 5, die erste Stufe des Muskels vergleichenden Proteomanalyse (Abbildung 2). Sobald visualisiert mittels hochauflösender Digital Imaging, ca. 800 Proteinspots wurden in jedem erkannt. Die männliche Proteom Karte als Grundlage, ist es klar, dass es zahlreiche Punkte, die in Hülle und Fülle Veränderung in der weiblichen Proteom. Der Spot-Intensitäten werden Maßnahmen der Veränderung des entsprechenden Proteins Mengen (Abbildung 3). Die Identität der Protein-Spots, die mehr als zwei-fach (nach oben oder unten) zu ändern und sind statistisch signifikant (p <0,05) mit einem n = 5 Mäusen werden durch Aminosäure-Sequenz-Analyse mit Flüssigchromatographie-gekoppelte Massenspektrometrie ermittelt. Diese Ergebnisse zeigen, dass Frauen eine Fülle Rückgang der Zucker Energiestoffwechsel Enzyme und der Kreatinkinase-Enzym (CK)-Isoformen, eine andere Energieversorgung in den Muskeln zu demonstrieren. Mensch und Tier Display höhere männliche Serum CK-Werte in Ruhe und nach dem Training 9,10, aber CK-Werte nicht unbedingt mit der Höhe der myofibrillären Störung 11,12 korrelieren. Diese geschlechtsspezifischen Dimorphismus in der zellulären Fülle von CK in murine biceps brachii ist ein neuartiges finding5 und kann die physiologisch verschiedene CK-Werte zu beantworten.
Fakten:
g1.jpg "/>
Abbildung 1. Eine allgemeine Schema des Protokolls für die vergleichende Proteomik. ; Analyse von Proben, und Identifizierung von Proteinen Probenvorbereitung: Das Protokoll ist in drei Gruppen unterteilt. Die Enden jeder dieser drei Gruppen von Protokollen sind auch angemessene Pausen Orten, obwohl die besten Ergebnisse sammelte werden, wenn die gesamte Protokoll wird ohne Unterbrechung durchgeführt.
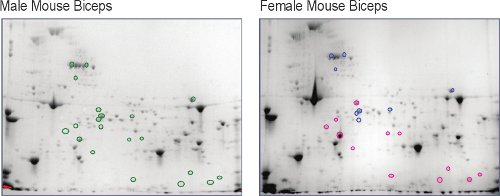
Abbildung 2. Vergleich der weiblichen Maus Bizeps Proteinspots gegenüber der identischen Stellen im männlichen Bizeps (grüne Kreise o). Spots, die größer oder gleich zweifach bei Frauen erhöht werden eingekreist rot (o) und diejenigen, die weniger als oder gleich zweifach zurückgegangen sind eingekreist blau (o).

Abbildung 3 Gel Spot Intensity Analysis:. X-Achse, weiblichvor dem Training (Kontrollgruppe, n = 5); Y-Achse, weiblich einzigen Kampf 0 Std. Zeitpunkt Gruppe (n = 5). Regressionsgerade: Korrelationskoeffizient = 0,919; Steigung = 0,976; abzufangen = -0,0293. Spots über der roten Linie und unterhalb der blauen Linie zu ändern mehr als + / - zwei-fach.
Diskussion
Die LC / MS Proteomik hier vorgestellte Methode ist eine sehr zuverlässige und reproduzierbare Protokoll für eine schnelle Analyse der ersten Ebene der Skelettmuskulatur Proteom. Es ermöglicht eine einigermaßen sinnvoll Vergleich der Besonderheiten der Geschlechter. Low Fülle Proteine würde eine Fraktionierung des Muskels Probe, da viele der kontraktilen Proteine wie möglich zu entfernen, wodurch die geringe Häufigkeit Proteine. Tailoring des Proteoms Profil kann mit unterschiedlichen pH-Bereich IPG-Streifen und alternative Prozentsatz Gradientengele erreicht werden, wenn gewünscht. Mehr empfindliche fluoreszierende Flecken vorhanden sind, aber wir empfehlen, dass jedes Labor die Linearität dieser Flecken in Ihr System zu bestimmen. Für eine genauere Analyse der Proteinexpression der DIGE System (zweidimensionale In-Gel-Elektrophorese-System von GE Healthcare Life Sciences) verwendet werden kann, aber das bedeutet fügen Sie eine Ebene der Komplexität der Methodik. Darüber hinaus kann das Protokoll beschrieben mit den meisten ani verwendet werdenmal Geweben, für die ein Genom sequenziert wurde, sowie de novo Sequenzierung eines Proteins aus einer beliebigen Quelle, solange es sich auf einem zweidimensionalen Gel aufgelöst werden, da überlappende enzymatische Fragmente können unter Verwendung von hochreinen Enzymen zusätzlich werden zu Trypsin. Proben aus anderen Quellen Gewebe erfordern einige Änderungen in der Gewinnung Methodik, vor allem, wenn auf der Suche nach Membran und hydrophobe Proteine, aber wir hatten gute Ergebnisse mit diesem Protokoll mit Herz-, Leber-, Nieren-und Hirngewebe zu haben. Andere post-translationale Modifikationen kann durch Modifikation des Massenspektrums Datenbank Suchkriterien erkannt werden. In Summe haben wir eine recht ausführliche ersten Protokoll für Proteom-Profiling-Analyse vorgestellt.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Yutian Gan für die Verwendung von Abbildung 3. Diese Arbeit wurde vom National Science Foundation 0420971 unterstützt, die Smith College Blakeslee, Wilens und Holmes Fonds und dem Howard Hughes Medical Institute.
Materialien
| Name | Company | Catalog Number | Comments | |
| Name des Reagenzes | Typ | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|---|
| PepClean C-18 Spin Columns | Verbrauchsmaterial | ThermoFisher Wissenschaftlich | PI-89870 | |
| Pepswift monolithischen Spalte (100um x 5 cm) | Verbrauchsmaterial | Dionex | 162348 | |
| Criterion pre-cast 10,5% -14% Tris-HCl SDS Polyacrylamidgelen | Verbrauchsmaterial | BioRad | 345-0106 | |
| Readystrip IPG-Streifen | Verbrauchsmaterial | BioRad | Unterschiedliche pH reicht | |
| Essigsäure | Reagens | Fisher Scientific | A465-1 | |
| Aceton | Reagens | Pharmco | 329000 | |
| Acetonitril | Reagens | Fisher Scientific | A955 | |
| Agarose | Reagens | BioRad | 163-2111 | Auflage Lösung |
| Ammoniumbicarbonat | Reagens | Fluka | 40867 | |
| Bromphenolblau | Reagens | Fisher Scientific | BP114 | |
| Bio-Lyte Ampholyte | Reagens | BioRad | Unterschiedliche pH reicht | |
| CHAPS | Reagens | USB | 13361 | |
| Commassie Blau R-250 | Reagens | ThermoFisher Wissenschaftlich | 20278 | |
| Dithiothreitol (DTT) | Reagens | USB | 15395 | |
| Ameisensäure | Reagens | ThermoFisher Wissenschaftlich | 28905 | |
| Glycerol | Reagens | Sigma-Aldrich | G6279 | |
| Glycine | Reagens | USB | 16407 | |
| Iodacetamid | Reagens | Sigma-Aldrich | I6125 | |
| Methanol | Reagens | Fisher Scientific | A452 | |
| Mineralöl | Reagens | BioRad | 163-2129 | |
| Natriumdodecylsulfat | Reagens | Sigma-Aldrich | L6026 | |
| Tris-Base | Reagens | Sigma-Aldrich | 93349 | |
| Tris [2-carboexyethyl] Phosphin | Reagens | ThermoFisher Wissenschaftlich | 77720 | |
| Trypsin Endoproteinase, TPCK behandelt, MS grade | Reagens | Durchstechen | 90055 | geändert |
| Harnstoff | Reagens | USB | 75826 | |
| Wasser | Reagens | Burdick & Jackson | 365 | |
| CentriVap Concentrator | Tool | Labconco | ||
| Exquest Ort cutter | Werkzeug | BioRad | ||
| LCQ Deca XP Max-Ionen Trap-Massenspektrometer | Werkzeug | ThermoFisher Wissenschaftlich | ||
| Motorisierte Pistill | Werkzeug | Kontes Corp | ||
| Polypropylen Rühren | Werkzeug | BioSpec Prod | ||
| Stangen | ||||
| PROTEAN IEF Zelle | Werkzeug | BioRad | ||
| Sonicator | Werkzeug | Branson | ||
| Surveyor Plus-HPLC System | Werkzeug | ThermoFisher Wissenschaftlich | ||
| VersaDoc Bildgebung System | Werkzeug | BioRad |
Referenzen
- Fehrenbach, E., Mooren, F. C., Völker, K. . Molecular and Cellular Exercise Physiology. , 199-217 (2005).
- Mooren, F. C., Mooren, F. C., Völker, K. The Cell. Molecular and Cellular Exercise Physiology. , 3-18 (2005).
- Thompson, H. S., Clarkson, P. M., Scordilis, S. P. The repeated bout effect and heat shock proteins: intra-muscular HSP27 and HSP70 expression following two bouts of eccentric exercise in humans. Acta. Physiol. Scand. 174, 47-56 (2002).
- McHugh, M. P. Recent advances in the understanding of the repeated bout effect: the protective effect against muscle damage from a single bout of eccentric exercise. Scand. J. Med. Sci. Sports. 13, 88-97 (2003).
- Metskas, L. A., Kulp, M., Scordilis, S. P. Gender Dimorphism in the Exercise-Naïve Murine Skeletal Muscle Proteome. Cell Molec. Biol. Lett. 15, 507-516 (2010).
- Lopez, J. L. Two-dimensional electrophoresis in proteome expression analysis. J. Chromatogr. B. 849, 190-202 (2007).
- Lowry, O. H., Rosenburg, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193, 265-275 (1951).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of Protein Using Bicinchoninic Acid. Anal. Biochem. 150, 76-85 (1985).
- Norton, J. P., Clarkson, P. M., Graves, J. E., Litchfield, P. L., Kirwan, J. Serum creatine kinase activity and body composition in males and females. Hum. Biol. 57, 591-598 (1985).
- Amelink, G. J., Kamp, H. H., Bär, P. R. Creatine kinase isoenzyme profiles after exercise in the rat: sex-linked differences in leakage of CK-MM. Pflügers. Arch. 412, 417-421 (1988).
- Kendall, B., Eston, R. Exercise-induced muscle damage and the potential protective role of estrogen. Sports Med. 32 (2), 103-123 (2002).
- Tiidus, P. M. Can oestrogen influence skeletal muscle damage, inflammation, and repair?. Br. J. Sports Med. 39, 251-253 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten