Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Disección y Cultura de ratón dopaminérgico estriatal en explantes y tridimensionales ensayos matriz de colágeno
En este artículo
Resumen
Los explantes procedentes del sistema de la dopamina mesencéfalo y el cuerpo estriado se utilizan en un ensayo para la matriz de colágeno In vitro Análisis del desarrollo y la vía mesoestriatales estriatonigral. En este ensayo crecimiento axonal y orientación puede ser manipulado y cuantificados. También se puede modificar para evaluar otras regiones o señales moleculares.
Resumen
La dopamina del cerebro medio (MDDA) neuronas se proyectan a través del haz medial del cerebro anterior hacia varias áreas en el telencéfalo, incluyendo el cuerpo estriado 1. Recíprocamente, las neuronas espinosas medias en el cuerpo estriado que dan lugar a la estriatonigral (directa) y la vía inervan la sustancia negra 2. El desarrollo de estas extensiones del axón depende de las acciones de combinatorias de una gran cantidad de crecimiento de los axones y las señales de orientación que incluyen moléculas que se liberan por neuritas o por regiones de destino (nivel intermedio) de 3,4. Estos factores solubles pueden ser estudiados in vitro por MDDA cultivo y / o explantes estriatales en una matriz de colágeno que proporciona un sustrato tridimensional para los axones que imitan el entorno extracelular. Además, la matriz de colágeno permite la formación de gradientes relativamente estables de proteínas liberadas por explantes otras células y colocados en la proximidad (por ejemplo, véanse las referencias 5 y 6). Aquí se describen los métodos para las comficación de colágeno de cola de rata, microdisección de los explantes dopaminérgicos del cuerpo estriado, y, de su cultura en geles de colágeno y su posterior análisis inmunohistoquímico y cuantitativo. En primer lugar, los cerebros de embriones de ratón E14.5 están aislados y dopaminérgico estriatal y los explantes se microdissected. Estos explantes son entonces (co) cultivadas en geles de colágeno en cubreobjetos de 48 a 72 horas in vitro. Posteriormente, las proyecciones axonales se visualizan utilizando marcadores neuronales (por ejemplo, la tirosina hidroxilasa, DARPP32 o tubulina βIII) y crecimiento de los axones y las respuestas de los axones atractivas o repulsivas son cuantificados. Esta preparación neuronal es una herramienta útil para los estudios in vitro de los mecanismos celulares y moleculares de crecimiento de los axones y mesoestriatales estriatonigral y orientación durante el desarrollo. Utilizando este ensayo, también es posible evaluar otros (intermedio) objetivos para los axones dopaminérgicos y estriado o para probar específicos señales moleculares.
Protocolo
1. Preparación de colágeno de rata cola
- Recoger 6-10 colas de rata adulta (es posible almacenar las colas a -20 ° C hasta su uso).
- Remoje las colas en el 95% de etanol durante la noche a temperatura ambiente (RT).
La disección de las colas de rata (en la campana de cultivo de tejidos):
(Mantener las herramientas en el 70% de etanol, cuando no usarlos y asegúrese de que todas las soluciones, herramientas y material de vidrio se utilizan en este procedimiento son estériles)
- Para recoger los tendones de las colas, corte la punta de la cola. Mantener el extremo grande de la cola con un par de fórceps. Utilice otro par de pinzas para tocar, doblar y romper la cola cerca de las pinzas de otros. Separe y los tendones se quedará atrás (Figura 1A, B).
- Recoge los tendones en el H 2 O estéril, y después de recoger todos los tendones que mueven a una placa petri estéril de nuevo con H 2 O.
- Tome 2-3 tendones y destrucción de todos con 2 pares de lasetas en una placa petri estéril de nuevo con H 2 O. Retire el tendón no tejidos, tales como las venas (tejido del tendón es brillante y reflectante; Figura 1C). Después de la eliminación de todos los tejidos no-tendón, cada cola rinde aproximadamente 100-150 mg de tendones.
- Transferir los tendones a 300 ml de estéril de ácido acético al 3% y se agita lentamente durante la noche a 4 ° C.
- Añadir un adicional de 200 ml de agua estéril de ácido acético al 3% y se agita lentamente durante la noche a 4 ° C.
- Centrifugar la solución de ácido acético que contiene los tendones a ~ 2700 xg durante 120 min a 4 ° C a pellets no disueltos tendones y tejido no-tendón.
- Durante la centrifugación preparar tubo de diálisis:
- cortar piezas de 40 cm
- mM EDTA hervir en 500 durante 5 minutos
- fresco en estériles H 2 O
- Atar un nudo en un extremo del tubo de diálisis y llenar el tubo con el sobrenadante de la solución centrifugada tendón en hielo en la campana de cultivo de tejidos utilizando un sistema automático pipeteeE y una pipeta de 25 ml. Evitar la producción de burbujas. Nudo el otro extremo del tubo y el tubo almacén en papel de aluminio estéril sobre hielo hasta que todas las piezas de tubo se llena (Figura 1D).
- Preparar 10 l de MEM estéril 0,1 X, pH 4,0, en la campana de cultivo de tejidos. Añadir flotador a las piezas de tubo y añadirlos a la solución MEM pre-enfriado 0,1 X en un vaso de precipitados de 10 l. Dializar durante la noche a 4 ° C mientras se revuelve lentamente. Esto elimina el exceso de ácido de diálisis mientras se mantiene el pH bajo.
- Vuelva a colocar con el nuevo pre-enfriado de 10 l 0,1 x MEM y agitación durante una noche a 4 ° C.
- Repita el paso anterior mediante la sustitución con el nuevo pre-enfriado de 10 l 0,1 x MEM y agitación durante una noche a 4 ° C.
- Alícuota de solución de colágeno en estériles tubos de 50 ml. Alícuotas se almacenan a 4 ° C. Mantenga los 6-12 meses, sólo manejan el stock de colágeno en la campana de cultivo de tejidos.
- Es importante para comprobar si el colágeno purificado debe ser diluido (en 0,1 x MEM) para obtener resultados óptimos en la MATR colágenoix ensayo. Por lo tanto, generar una serie de dilución de colágeno (colágeno sin diluir, 1:1, 1:2 y se diluyó 1:5) y realizar ensayos de colágeno de la matriz como se describe a continuación para determinar la dilución óptima de colágeno.
2. La disección del cerebro medio dopaminérgico 7,8
- Diseccionar E14.5 embriones de ratón desde el útero de la madre y mantener en medio L15 en hielo hasta que se necesite.
Todas las etapas subsiguientes de disección se realiza en medio L15 en hielo.
- Diseccionar el cerebro.
- Retire el telencéfalo cortando a lo largo de la parte medial de cada vesícula telencefálica (use las vesículas telencefálicas para los explantes de cuerpo estriado).
- Quite la envoltura meníngea.
- Haga un corte dorsoventral solo rostral de la flexura mesencefálica.
- Haga otro corte dorsoventral acaba de caudal de la flexura mesencefálica.
- Haga un corte a lo largo de rostrocaudal la línea media dorsal utilizando un microdissection un cuchillo para exponer el tejido subyacente cerebro medio ventral. Tenga cuidado de no golpear el tejido del cerebro medio ventral, ya que contiene las neuronas dopaminérgicas (Figura 2).
- Haga dos cortes rostrocaudal lateral y paralela a la línea media ventral para extraer tejido mesencéfalo dorsal.
- Divide el resto de tejido del cerebro medio ventral en explantes con un cuchillo microdisección.
- Guarde los explantes en medio L15 conteniendo FBS al 5% en hielo hasta su uso.
3. La disección del cuerpo estriado
Todos los pasos de disección se realiza en medio L15 en hielo.
- Utilice vesículas telencefálicas disecadas durante la disección del cerebro medio.
- Retire el tálamo mediante la reducción de entre el tálamo y el cuerpo estriado el uso de fórceps.
- Haga un corte medio lateral rostral en el cuerpo estriado para eliminar las estructuras rostrales, como el bulbo olfatorio. Repita este paso para el tejido situado caudalmente en el cuerpo estriado.
- Posiciónla rebanada restante para obtener una vista coronal del cuerpo estriado (Figura 2).
- El cuerpo estriado puede ser reconocida como una parte ligeramente menos denso (más transparente) de tejido. Diseccionar el cuerpo estriado y corte en explantes utilizando un cuchillo de microdisección. Evitar el cierre del tejido ligeramente más oscuro que la línea media, que contiene las neuronas que migran de la eminencia ganglionar medial y lateral.
- Guarde los explantes en medio L15 conteniendo FBS al 5% en hielo hasta su uso.
4. Asamblea matriz de colágeno ensayos
Preparación del colágeno (todos los pasos sobre el hielo, usar puntas de pipeta enfriada)
- Mezclar 860 l de colágeno diluido con 100 l de MEM 10x y 40 l de bicarbonato de sodio 1M (NaHCO 3) y mantener en hielo. Si en este punto que el colágeno se calienta hasta que se solidifique.
- Añadir una gota de 20 l (aproximadamente 5 mm de diámetro) de colágeno preparados para un cubreobjetos en un pozo de una placa de Nunc de 4 pocillosy se deja reposar en una incubadora de CO 2 a 37 ° C y 5% de CO 2 durante 30 minutos (ambiente concentración de O 2 es suficiente). Durante esta incubación, el colágeno se gelatiniza.
Instalación de co-cultivo en gel de colágeno
- Después de que el colágeno se ha gelatinizado, utilice una pipeta con una punta 200 l para transferir un explante dopaminérgica o estriado con el colágeno.
- Mueva los explantes en estrecha proximidad entre sí mediante una aguja. Mantenerlos separados a una distancia de aproximadamente el diámetro de un explante (aproximadamente 200-300 micras) (Figura 2).
- Eliminar el exceso de medio y se añaden 20 l de colágeno preparada en la parte superior de los explantes. A menudo, esto hará que los explantes para moverse. Vuelva a colocar los explantes utilizando una aguja como se describe en 4.4.
- Que el colágeno solidificar durante 15 min a temperatura ambiente seguido por 30 min a 37 ° C y 5% de CO 2.
- Después de que el colágeno se ha puesto, añadir 400 l de correomedio xplant y crecer durante 2-3 días en una incubadora de CO 2 a 37 ° C y 5% de CO 2.
5. El análisis por inmunohistoquímica y la cuantificación
La inmunohistoquímica
- Para solucionar los explantes, suavemente añadir 400 l de 8% paraformaldehído (PFA) en PBS a 400 l de medio (con lo que la dilución de la PFA al 4%) y dejar reposar durante 1 hora a temperatura ambiente.
- Lavar 3x 15 min en PBS a temperatura ambiente.
- Incubar en tampón de bloqueo (BB; PBS + 1% de FBS + 0,1% de Triton X-100) durante 2 horas.
- Incubar toda la noche con el anticuerpo primario en BB a 4 ° C. Para los axones dopaminérgicos uso de anti-tirosina hidroxilasa anticuerpos (1:1000) 7, para los axones del cuerpo estriado anti-DARPP32 anticuerpos (1:500) y 9 para la visualización de todos los axones de lucha contra la βIII tubulina (1:3000) 7.
- Lavar 5x 1 hora en PBS a temperatura ambiente.
- Incubar con el anticuerpo secundario conjugado con el fluoróforo apropiado (1:500) en BB durante la noche a 4° C. Desde este paso en minimizar la exposición de los explantes a la luz (por ejemplo, los cubre con papel de aluminio).
- Lavar la noche en PBS a 4 ° C seguido por varios lavados durante el día siguiente.
- Monte explantes en portaobjetos utilizando Prolongue reactivo Antifade medio de montaje. Añadir una gota de ~ 10 l en un portaobjetos de vidrio. Tome el cubreobjetos y suavemente coloca sobre la gota de medio de montaje con la cara hacia abajo explante. Evitar que queden atrapadas en el aire de cubreobjetos con mucho cuidado por que la reducción en la gota de medio de montaje.
La cuantificación mediante el cálculo de P / D
- Adquirir imágenes digitales de los explantes utilizando un microscopio epifluorescente (Figura 3).
- El uso de estas imágenes, dividir cada explante en cuadrantes para generar un cuadrante proximal (es decir, parte del explante más cercana a la explante adyacente) y un cuadrante distal (parte del explante más alejado de la explicación adyacentent) (Figura 2, 4).
- Medir la longitud de 20 largas neuritas que salen de la explante tanto en los cuadrantes proximal y distal.
- Utilice la duración media de las 20 más largas neuritas para calcular el cociente P / D por cada explante individual. AP / relación D> 1 indica que la atracción del axón, mientras que una proporción <1 indica que la repulsión del axón.
- En algunos casos, el crecimiento de neuritas densa impide la evaluación de la longitud de las neuritas individuo. En estas situaciones, la cuantificación se puede realizar mediante la medición de la distancia entre el borde del explante y el frente principal de crecimiento del axón en los cuadrantes proximal y distal.
6. Imágenes representativas
Después de un cultivo con éxito de explantes dopaminérgicos y estriatal un gran número de axones son accesibles mediante microscopía de campo claro o como visualizaron por inmunocitoquímica anti-tubulina βIII (no mostrado). Un subconjunto de estos axones será dopaminérgica o s axones triatal como visualizaron utilizando inmunocitoquímica (Figura 3). La división de los explantes en cuadrantes como se ha descrito y la determinación de P / D proporciones, un efecto axón putativo atracción o de repulsión se puede cuantificar (Figura 3E).

Figura 1. Fotos ilustran la preparación de colágeno de los tendones de cola de rata. A) separando la cola de rata expone a los tendones. B) Los tendones son visibles como la cuerda-como paquetes. C) Los tendones son fáciles de distinguir de las venas por su aspecto blanco y brillante. D) Después de disolver los tendones en ácido acético, la solución se transfiere a un tubo de diálisis. Para mantener el frío colágeno disuelto, los tubos se colocan en una lámina de aluminio estéril sobre hielo.
e 2 "src =" / files/ftp_upload/3691/3691fig2.jpg "/>
Figura 2. Esquema indicando las diferentes etapas del procedimiento. Las regiones cerebrales apropiadas se disecan y corte para generar los explantes. Una sola mesencéfalo y explante estriatal se encuentra en las proximidades en una matriz de colágeno y deja crecer durante 48-72 horas a 37 ° C. Los axones son visualizados mediante técnicas de inmunohistoquímica de fluorescencia y un ratio de P / D se calcula para cuantificar las respuestas quimiotrópicas.
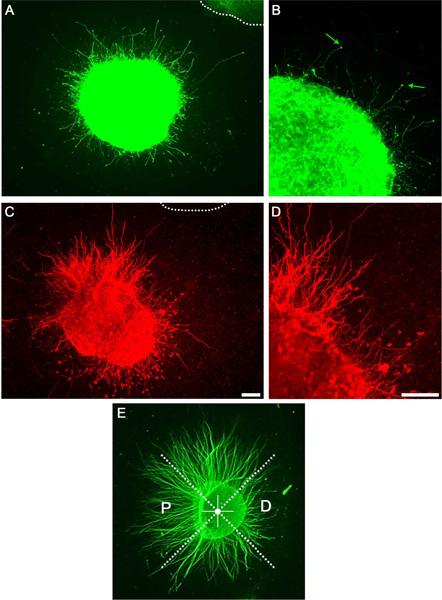
Figura 3. Los resultados representativos que muestran el crecimiento del axón en una cultura matriz de colágeno. A) explante mesencéfalo teñidas con anti-tirosina hidroxilasa anticuerpos revela axón. La línea punteada indica explante adyacente. B) ampliación de un neuritas que muestran individuales y los conos de crecimiento (flechas). C) explante estriatal teñidas con anti-DARPP32. D) Ampliación de la C que muestra neuritas individuales. E) Ejemplo deP / D cuantificación. Los explantes se dividen en cuadrantes iguales. El cuadrante proximal se enfrenta el explante mientras que el cuadrante adyacente distal se enfrenta lejos de ella. Las barras de escala indican 100 micras.
Discusión
El ensayo de matriz de colágeno se describe aquí se ha utilizado y mejorado por muchos laboratorios diferentes en las últimas décadas para investigar una variedad de moléculas de guiado de los axones neuronales y sistemas (por ejemplo, véanse las referencias 5-8). Estos estudios han demostrado que este ensayo es una poderosa herramienta para estudiar los efectos y la regulación de las moléculas de orientación axón secretadas por diferentes tejidos diana (intermedio).
Sin embargo, d...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
El ensayo de matriz de colágeno se ha desarrollado y mejorado por el trabajo de muchos grupos de investigación durante los últimos dos o tres décadas. Los enfoques descritos aquí para explantes dopaminérgicos del cuerpo estriado, y se benefician enormemente de estos estudios. Además, los autores desean agradecer a Asheeta Prasad por su ayuda en la creación de culturas del cuerpo estriado de explantes. El trabajo en el laboratorio fue financiado por la organización del programa Human Frontier Science (Premio a la Trayectoria para el Desarrollo), la Organización Holandesa de Investigación en Salud y el Desarrollo (ZonMW-VIDI y ZonMW TOP), la Unión Europanian (MDDA-NeuroDev, FP7/2007-2011 , Grant 222999) (para RJP), y la Organización Holandesa de Investigación Científica (TopTalent; de ERES).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| De suero fetal bovino | BioWhittaker | 14-801F | |
| Glutamina (200 mM) | PAA | M11-004 | |
| Hepes | VWR International | 441476L | |
| β-mercaptoetanol | Merck | 444203 | |
| Mínimos medios esenciales (MEM) | Gibco | 61100-087 | |
| Neurobasal | Gibco | 21103-049 | |
| B27 | Gibco | 17504-044 | |
| Leibovitz medio L-15 | Gibco | 11415-049 | |
| La penicilina-estreptomicina | Gibco | 15070-063 | |
| Prolongar reactivo Antifade Oro | Invitrogen | P36930 | |
| Diálisis tubo | Spectrum Labs | 132660 | |
| De conejo anti-tirosina hidroxilasa | Pel-Freez | P40101-0 | |
| Conejo anti-Darpp32 (H-62) | Santa Cruz | Sc-11365 | |
| Mouse anti-tubulina βIII | Sigma | T8660 | |
| Alexa Fluor etiqueta secundaria de anticuerpos | Invitrogen |
Referencias
- van den Heuvel, D. M., Pasterkamp, R. J. Getting connected in the dopamine system. Prog. Neurobiol. 85, 75-93 (2008).
- Lobo, M. K. Molecular profiling of striatonigral and striatopallidal medium spiny neurons past, present, and future. Int. Rev. Neurobiol. 89, 1-35 (2009).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298, 1959-1964 (2002).
- Chilton, J. K. Molecules mechanisms of axon guidance. Dev. Biol. 292, 13-24 (2006).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Tessier-Lavigne, M., Placzek, M., Lumsden, A. G., Dodd, J., Jessel, T. M. Chemotropic guidance of developing axons in the mammalian central nervous system. Nature. 336, 775-778 (1988).
- Kolk, S. M., Gunput, R. A., Tran, T. S., van den Heuvel, D. M., Prasad, A. A., Hellemons, A. J., Adolfs, Y., Ginty, D. D., Kolodkin, A. L., Burbach, J. P., Smidt, M. P., Pasterkamp, R. J. Semaphorin 3F is a bifunctional guidance cue for dopaminergic axons and controls their fasciculation, channeling, rostral growth, and intracortical targeting. J. Neurosci. 29, 12542-12557 (2009).
- Fenstermaker, A. G., Prasad, A. A., Bechara, A., Adolfs, Y., Tissir, F., Goffinet, A., Zou, Y., Pasterkamp, R. J. Wnt/planar cell polarity signaling controls the anterior-posterior organization of monoaminergic axons in the brainstem. J. Neurosci. 30, 16053-16064 (2010).
- Arlotta, P., Molyneaux, B. J., Jabaudon, D., Yoshida, Y., Macklis, J. D. Ctip2 controls the differentiation of medium spiny neurons and the establishment of the cellular architecture of the striatum. J. Neurosci. 28, 622-632 (2008).
- De Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
- Gähwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends Neurosci. 20, 471-477 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados