Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Вскрытие и культуры мышь дофаминергической и стриатуме эксплантов в трехмерных Анализы коллагеновой матрице
В этой статье
Резюме
Эксплантов из системы мозга дофамина и стриатуме используются в анализе коллагеновой матрицы для В пробирке Анализ mesostriatal и striatonigral путь развития. В данном анализе аксонального результат и рекомендации можно манипулировать и количественно. Она также может быть модифицирован для оценки других регионов или молекулярных сигналов.
Аннотация
Мозге дофамина (mdDA) нейронов проект по медиальной пучка переднего мозга на несколько областей, в конечном мозге, в том числе стриатуме 1. Взаимно, средних колючих нейронов в полосатом теле, которые приводят к striatonigral (прямой) путь иннервируют черной субстанции 2. Развитие этих аксонов путей зависит от комбинаторного действия множества роста аксонов и руководство в том числе сигналы молекул, которые выпущены невриты или (промежуточные) целевые регионы 3,4. Эти растворимые факторы могут быть изучены в лабораторных на mdDA культивирования и / или полосатой эксплантов в коллагеновой матрицы, которая обеспечивает трехмерную подложку для аксонов имитируя внеклеточной среде. Кроме того, коллагеновые матрицы позволяет формирование относительно стабильного градиенты белков выпущен других эксплантов или клетки помещаются в непосредственной близости (см., например, ссылки 5 и 6). Здесь мы опишем методы PURкации крысы хвост коллагена, микродиссекции дофаминергической и полосатой эксплантов, их культуры в коллаген гели и последующего иммуногистохимического и количественного анализа. Во-первых, мозг эмбриона мыши E14.5 изолированы и дофаминергической и полосатой эксплантов которые микродиссекции. Эти эксплантов затем (со) культивировали в коллагеновых гелей на покровные 48 до 72 часов в лабораторных условиях. Впоследствии аксонального проекции визуализируется использованием нейронных маркеров (например, тирозин гидроксилазы, DARPP32 или βIII тубулина) и рост аксонов и притяжения или отталкивания ответы аксона количественно. Это нейронов подготовки является полезным инструментом для лабораторного исследования клеточных и молекулярных механизмов mesostriatal и striatonigral рост аксонов и руководства в процессе разработки. С помощью этого анализа, можно также оценить другие (промежуточные) цели дофаминергической и полосатой аксонов или для проверки специфических молекулярных сигналов.
протокол
1. Подготовка крысы хвост Коллаген
- Соберите 6-10 взрослых крыс хвосты (это можно хранить хвосты при -20 ° C до использования).
- Замочите хвосты в 95% этаноле в течение ночи при комнатной температуре (RT).
Препарирование крысиные хвосты (в ткани капот культура):
(Держать инструменты в 70% этанола, если не используете их и убедиться, что все решения, инструменты и изделия, используемые в этой процедуре являются стерильными)
- Для сбора сухожилия с хвостами, отрезать кончик хвоста. Держите большой конце хвоста с парой щипцов. Используйте другую пару щипцов держать, согнуть и сломать хвост рядом с другими щипцами. Растащить и сухожилий будет оставлен позади (рис. 1а, б).
- Соберите сухожилия в стерильной H 2 O и после сбора всех сухожилий переместить их на новый petridish стерильной H 2 O.
- Возьмите 2-3 сухожилий и перерабатывать их с помощью 2-х пар дляБелые грибы в новом petridish стерильной H 2 O. Удалить без сухожилия ткани, такие как вены (сухожилия ткани блестящие и отражающие, рисунок 1С). После удаления всех не сухожилия ткани, каждый хвост дает примерно 100-150 мг сухожилий.
- Передача сухожилия до 300 мл стерильной 3% уксусной кислоты и помешивать в течение ночи при 4 ° C.
- Добавить еще 200 мл стерильной 3% уксусной кислоты и помешивать в течение ночи при 4 ° C.
- Центрифуга раствор уксусной кислоты, содержащие сухожилия на ~ 2700 мкг в течение 120 мин при 4 ° С для осаждения нерастворимой сухожилия и не сухожилия ткани.
- Во время центрифугирования подготовить диализа трубку:
- нарезанные кусочки 40 см
- кипятить в 500 мкМ ЭДТА в течение 5 мин
- прохладно в стерильной H 2 O
- Завяжите узел на одном конце трубы диализа и заполнить трубопровод с супернатант центрифугируют решение сухожилия на льду в капюшоне культуры тканей с использованием автоматического pipettе и 25 мл пипетки. Избегайте производить пузырьки. Узел на другом конце трубки и трубки магазина на стерильную алюминиевую фольгу на льду, пока все части трубки заполнены (рис. 1D).
- Подготовить 10 л стерильной 0.1X MEM, рН 4,0, в капюшоне культуре ткани. Добавить плавающий на куски труб и добавить их в предварительно охлажденный 0.1X решение MEM в 10 л стакан. Диализировать ночи при 4 ° С, медленно помешивая. Это диализ удаляет избыток кислот, сохраняя при этом низкий рН.
- Заменить на новую предварительно охлажденный 10 л 0.1X MEM и перемешать в течение ночи при 4 ° C.
- Повторите предыдущий шаг, заменив новыми предварительно охлажденный 10 л 0.1X MEM и перемешать в течение ночи при 4 ° C.
- Алиготе раствора коллагена в стерильные 50 тюбиков мл. Магазин аликвот при 4 ° C. Держите 6-12 месяцев, только с коллаген акции в капюшоне культуре ткани.
- Важно, чтобы проверить, является ли очищенный коллаген необходимо разбавлять (в 0.1x MEM), чтобы получить оптимальный результат в коллаген matrIX анализа. Таким образом, создает ряд коллагена разбавления (неразбавленный коллагена, 1:1, 1:2 и 1:5 разбавленный) и выполнять тесты коллагеновой матрицы, как описано ниже, чтобы определить оптимальное разведение коллагена.
2. Препарирование мозга дофаминергической 7,8
- Проанализируйте E14.5 эмбрионов мышей из матки матери и держать в L15 среды на лед, пока это необходимо.
Все последующие шаги вскрытия проводятся в L15 среды на льду.
- Проанализируйте из мозга.
- Удалить конечного мозга путем разрезания вдоль средней части каждой telencephalic пузырьков (используйте telencephalic пузырьки для полосатой эксплантов).
- Удалить менингеальные оболочки.
- Сделать дорсовентральной сокращение только ростральной из среднего мозга изгиб.
- Сделайте еще дорсовентральной сокращение только хвостовой из среднего мозга изгиб.
- Сделать rostrocaudal разрез по средней линии спины помощью microdissectioя нож, чтобы выставить основные вентральной ткани мозга. Будьте осторожны, чтобы не ударить брюшной ткани мозга, поскольку он содержит дофаминергических нейронов (рис. 2).
- Сделайте два rostrocaudal сокращения боковых и параллельно брюшной средней линии, чтобы удалить ткань спинного мозга.
- Разделите оставшиеся вентральной ткани мозга в использовании эксплантов микродиссекции ножом.
- Хранить в эксплантов L15 среде, содержащей 5% FBS на льду до использования.
3. Препарирование Стриатум
Все рассечение шаги выполняются в L15 среды на льду.
- Используйте telencephalic пузырьки расчлененный во время вскрытия мозга.
- Удалить таламуса, сокращая между таламуса и полосатого тела с помощью щипцов.
- Сделать медиолатеральной сокращение ростральной в полосатом теле, чтобы удалить ростральной структур, таких как обонятельной луковицы. Повторите этот шаг для ткани, расположенной каудально в полосатом теле.
- Положениеоставшаяся часть для получения короны вид полосатого тела (рис. 2).
- Стриатуме может быть признан чуть менее плотной (более прозрачной) часть ткани. Проанализируйте из полосатого тела и нарезать эксплантов помощью микродиссекции ножом. Избегайте немного темнее ткани близко к средней линии, которая содержит мигрирующие нейроны латеральной и медиальной ганглиозные возвышения.
- Хранить в эксплантов L15 среде, содержащей 5% FBS на льду до использования.
4. Ассамблея коллагеновой матрицы Анализы
Подготовка коллагена (все шаги на льду, используют охлаждение наконечники)
- Смешать 860 мкл разведенной коллагена с 100 мкл 10x MEM и 40 мкл 1М раствором бикарбоната натрия (NaHCO 3) и держать на льду. Если в этот момент коллаген нагревается он застынет.
- Добавить капли 20 мл (около 5 мм в диаметре), подготовленных коллаген покровное в скважине 4-а Nunc блюдои пусть он стоит в CO 2 инкубаторе при температуре 37 ° С и 5% CO 2 в течение 30 минут (температура окружающей среды концентрация O 2 достаточно). В течение этого инкубационного коллаген студень.
Настройка совместной культуры в коллагеновый гель
- После того, как коллаген был желатинизированный, используйте пипетку с 200 мкл наконечник для передачи дофаминергических или полосатой эксплантов в коллаген.
- Перемещение эксплантов в непосредственной близости друг к другу с помощью иглы. Держите их друг от друга на расстоянии примерно одного диаметра эксплантов (~ 200-300 мкм) (рис. 2).
- Удалите излишки раствора и добавьте 20 мкл подготовленных коллагена в верхней части эксплантов. Это часто приводит к эксплантов передвигаться. Расположите эксплантов с помощью иглы, как описано в 4.4.
- Пусть укрепит коллагена в течение 15 мин при комнатной температуре, затем 30 мин при 37 ° С и 5% CO 2.
- После того, как коллаген установил, добавьте 400 мкл электроннойсредний xplant и расти в течение 2-3 дней в CO 2 инкубаторе при температуре 37 ° С и 5% CO 2.
5. Анализ иммуногистохимии и количественной
Иммуногистохимия
- Чтобы исправить эксплантов, осторожно добавить 400 мкл 8% параформальдегид (PFA) в PBS до 400 мкл среды (тем самым разбавляя PFA до 4%) и дать постоять в течение 1 часа при комнатной температуре.
- Вымойте 3x 15 мин в PBS при комнатной температуре.
- Инкубируйте в блокирующем буфере (BB, PBS + 1% FBS + 0,1% Тритон Х-100) в течение 2 часов.
- Выдержите в течение ночи с первичными антителами в ВВ при 4 ° C. Для аксонов дофаминергических использовать анти-тирозингидроксилазы антител (1:1000) 7, для полосатой аксонов анти-DARPP32 антител (1:500) 9 и для визуализации всех аксонов анти-βIII тубулина (1:3000) 7.
- Вымойте 5x 1 час в PBS при комнатной температуре.
- Инкубируйте с вторичными антителами конъюгированных с соответствующим флуорофора (1:500) в BB ночи при 4° C. С этого шага на минимизацию воздействия на эксплантов к свету (например, покрыть их алюминиевой фольгой).
- Вымойте ночь в PBS при 4 ° С с последующим нескольких стирок в течение следующего дня.
- Установите эксплантов на микроскоп слайды, используя продлить Antifade реагент монтаж среды. Добавить каплю ~ 10 мкл на предметное стекло стеклом. Возьмите покровное и аккуратно положите его на падение монтаж среды эксплантатов вниз. Избегайте любого захвата воздуха под покровное де по очень осторожно опуская его на падение монтаж среды.
Количественное путем расчета P / D соотношение
- Приобретайте цифровые изображения эксплантов использованием эпифлуоресцентной микроскопа (рис. 3).
- С помощью этих изображений, разделите каждый эксплантов в секторах для создания проксимальных квадранте (т.е. части эксплантов ближе к соседним эксплантов) и дистальной четверти (часть эксплантатов дальше от соседних объяснениеп) (рис. 2, 4).
- Измерьте длину от 20 длинный невриты, выходящих из эксплантов как в проксимальных и дистальных квадранта.
- Используйте среднюю длину 20 длинный невриты для расчета P / D соотношение для каждого эксплантов. AP / D соотношение> 1 указывает аксона притяжения, в то время как коэффициент <1 указывает на аксон отталкивания.
- В некоторых случаях, плотный рост нейритов препятствует оценке отдельных длина аксонов. В таких ситуациях, количественное может быть выполнена путем измерения расстояния между краем эксплантов и переднего фронта аксона роста в проксимальных и дистальных квадранта.
6. Представитель изображения
После успешной культуры дофаминергических и полосатой эксплантов большое количество аксонов видны используя яркие области микроскопии или визуализировать анти-βIII тубулина иммуноцитохимии (не показано). Часть этих аксонов будет дофаминергических или с triatal аксонов, как визуализируются с использованием иммуноцитохимии (рис. 3). Разделив эксплантов в секторах, как описано и определения P / D отношений, предполагаемый аксона притяжения или отталкивания эффект может быть количественно (рис. 3Е).

Рисунок 1. Фотографии иллюстрирующие подготовку коллагена из сухожилий крысиного хвоста. А) Тяговая кроме крысиного хвоста подвергает сухожилия. Б) Сухожилия видны как веревка, как пучки. C) сухожилия легко отличить от вен их блестящими белыми внешний вид. D) После растворения сухожилия в уксусной кислоте, решение передается на диализе трубопровода. Чтобы сохранить растворенного холодного коллагена, трубы находятся на стерильную алюминиевую фольгу на льду.
е 2 "SRC =" / files/ftp_upload/3691/3691fig2.jpg "/>
Рисунок 2. Схема с указанием различных этапов процедуры. Соответствующие участки мозга расчленены и сократить для получения эксплантов. Один мозга и полосатое эксплантов расположены в непосредственной близости в коллагеновой матрице и оставили расти в течение 48-72 часов при температуре 37 ° C. Аксоны визуализируются с помощью флуоресцентной иммуногистохимии и P / D соотношение рассчитывается количественное chemotropic ответов.
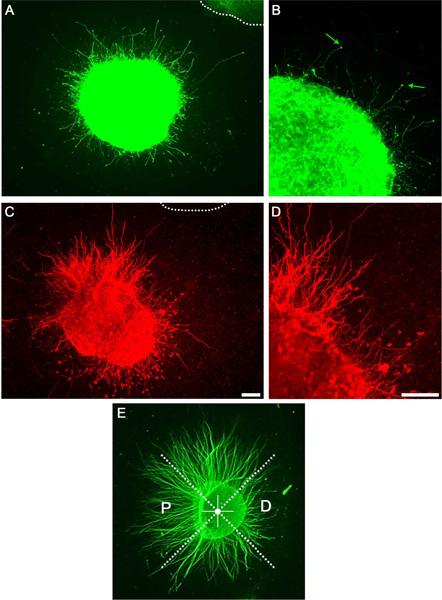
Рисунок 3. Представитель результаты, показывающие рост аксонов в культуре матрицы коллагена. А) мозга эксплантов окрашенных анти-тирозингидроксилазы антител выявление аксона результат. Пунктирная линия указывает на соседний эксплантов. Б) увеличение на показ отдельных невриты и роста конусов (стрелки). C) в стриатуме эксплантов окрашенных анти-DARPP32. D) Увеличение С показ отдельных невриты. E) ПримерP / D соотношение количества. Экспланты делятся на равных секторов. Проксимальный квадрант перед соседними эксплантов, а дистальный квадрант отворачивается от него. Масштаб полоски указывают на 100 мкм.
Обсуждение
Анализ коллагеновой матрицы, описанные здесь были использованы и улучшены различные лаборатории в последние десятилетия, чтобы исследовать различные аксона руководством молекул и нейронных систем (например, см. ссылки 5-8). Эти исследования показали, что этот анализ является мощным ин?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Анализ коллагеновой матрицы была разработана и улучшена работа различных исследовательских групп в течение последних двух-трех десятилетий. Подходов, описанных здесь, дофаминергических и полосатой эксплантов большую пользу от этих исследований. Кроме того, авторы хотели бы поблагодарить Asheeta Прасад за помощь в создании полосатого культурами эксплантов. Работа в лаборатории была профинансирована по правам границы Научная программа организации (премия развития карьеры), Нидерландская организация по научным исследованиям и развитию (ZonMw-VIDI и ZonMw-TOP), Europanian союза (mdDA-NeuroDev, FP7/2007-2011 , грант 222 999) (для RJP) и Нидерландская организация по научным исследованиям (TopTalent, в ERES).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Эмбриональной телячьей сыворотки | BioWhittaker | 14-801F | |
| Глютамин (200 мм) | ПАА | M11-004 | |
| Hepes | VWR International | 441476L | |
| β-меркаптоэтанол | Merck | 444203 | |
| Минимальные основные медиа (MEM) | Гибко | 61100-087 | |
| Neurobasal | Гибко | 21103-049 | |
| B27 | Гибко | 17504-044 | |
| L-15 Лейбовиц в средней | Гибко | 11415-049 | |
| Пенициллин, стрептомицин | Гибко | 15070-063 | |
| Продлить Золото реагентов Antifade | Invitrogen | P36930 | |
| Диализ трубы | Spectrum Labs | 132660 | |
| Кролик против тирозингидроксилазы | Pel-Freez | P40101-0 | |
| Кролик против Darpp32 (Н-62) | Санта-Крус | Sc-11365 | |
| Мышь против βIII тубулина | Сигма | T8660 | |
| Alexa Fluor меченых вторичных антител | Invitrogen |
Ссылки
- van den Heuvel, D. M., Pasterkamp, R. J. Getting connected in the dopamine system. Prog. Neurobiol. 85, 75-93 (2008).
- Lobo, M. K. Molecular profiling of striatonigral and striatopallidal medium spiny neurons past, present, and future. Int. Rev. Neurobiol. 89, 1-35 (2009).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298, 1959-1964 (2002).
- Chilton, J. K. Molecules mechanisms of axon guidance. Dev. Biol. 292, 13-24 (2006).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Tessier-Lavigne, M., Placzek, M., Lumsden, A. G., Dodd, J., Jessel, T. M. Chemotropic guidance of developing axons in the mammalian central nervous system. Nature. 336, 775-778 (1988).
- Kolk, S. M., Gunput, R. A., Tran, T. S., van den Heuvel, D. M., Prasad, A. A., Hellemons, A. J., Adolfs, Y., Ginty, D. D., Kolodkin, A. L., Burbach, J. P., Smidt, M. P., Pasterkamp, R. J. Semaphorin 3F is a bifunctional guidance cue for dopaminergic axons and controls their fasciculation, channeling, rostral growth, and intracortical targeting. J. Neurosci. 29, 12542-12557 (2009).
- Fenstermaker, A. G., Prasad, A. A., Bechara, A., Adolfs, Y., Tissir, F., Goffinet, A., Zou, Y., Pasterkamp, R. J. Wnt/planar cell polarity signaling controls the anterior-posterior organization of monoaminergic axons in the brainstem. J. Neurosci. 30, 16053-16064 (2010).
- Arlotta, P., Molyneaux, B. J., Jabaudon, D., Yoshida, Y., Macklis, J. D. Ctip2 controls the differentiation of medium spiny neurons and the establishment of the cellular architecture of the striatum. J. Neurosci. 28, 622-632 (2008).
- De Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
- Gähwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends Neurosci. 20, 471-477 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены