Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Dopaminerjik ve Üç Boyutlu Collagen Matrix Tahliller striatal Eksplantlarından diseksiyonu ve Kültür
Bu Makalede
Özet
Ortabeyin dopamin sistemi ve striatum gelen Eksplantlarından için bir kollajen matris deneyde kullanılır In vitro analizi. Bu deneyde aksonal üremeyi ve rehberlik manipüle ve ölçülebilir. Aynı zamanda diğer bölgeler veya moleküler ipuçlarını değerlendirmek için modifiye edilebilir.
Özet
Striatum 1 dahil telencephalon çeşitli alanlarda, doğru medial ön beyin demeti ile orta beynin dopamin (mdDA) nöronlar projesi. Karşılıklı olarak, striatonigral (direkt) yol yol striatumda orta dikenli nöron substantia nigra 2 innerve. Bu akson yollarının geliştirilmesi akson büyüme ve neurites veya (orta) hedef bölgelerde 3,4 ile yayımlanan moleküllerini içeren rehberlik ipuçları bir bolluk kombinatoryal eylemleri bağlıdır. Bu faktörler çözünebilir ekstraselüler ortamı taklit aksonlardan için bir üç-boyutlu yüzey sağlar kollajen bir matris içinde kültürlenmesi mdDA ve / veya striatal eksplantları tarafından in vitro olarak ele alınabilir. Buna ek olarak, kolajen matris civarı (örn. referanslar 5 ve 6'ya bakınız) yerleştirilir, diğer aşılar veya hücreler tarafından yayımlanan proteinlerin nispeten kararlı gradyanlar oluşumu için olanak sağlar. Burada pur için yöntemler tarifkollajen jeller ve sonraki immünohistokimyasal ve kantitatif analiz, fare kuyruk kolajeni, dopaminerjik ve striatal eksplantlarının mikrodiseksiyon, kendi kültür ification. Birincisi, E14.5 fare embriyolarının beyin izole ve dopaminerjik ve striatal eksplant microdissected edilir. Bunlar daha sonra eksplantları (CO), in vitro 48-72 saat boyunca lamelleri üzerine kollajen jeller kültürlenmiştir. Daha sonra, aksonal projeksiyonlar nöronal belirleyicileri (örneğin tirozin hidroksilaz, DARPP32 veya βIII tubulin) ve akson büyüme ve çekici veya itici akson yanıtları sayılabilir ve kullanarak canlandırırlar. Bu nöronal hazırlık gelişimi sırasında mesostriatal ve striatonigral akson büyüme ve rehberlik hücresel ve moleküler mekanizmalar in vitro çalışmalar için yararlı bir araçtır. Bu tahlil kullanarak, dopaminerjik ve akson striatal için diğer (ara) hedefler değerlendirmek için ya da belirli bir moleküler kuyrukları test etmek de mümkündür.
Protokol
1. Fare kuyruk kolajeni hazırlanması
- 6-10 yetişkin sıçan kuyrukları (kullanıma kadar -20 ° C'de kuyrukları saklamak mümkündür) toplayın.
- Oda sıcaklığında (RT) 'de bir gece% 95 etanol içinde kuyrukları emmek.
Sıçan kuyrukları Diseksiyonu (doku kültürü kaputu):
(Kullanmadığınız zaman% 70 etanol araçları tutmak ve bu işlem boyunca kullanılan tüm çözümler, araçlar ve cam eşyalar steril olduğundan emin olun)
- Kuyrukları gelen tendonların toplamak için, kuyruğunun ucunu kesti. Forseps bir çift kuyruk büyük ucunu tutun. , Tutun eğmek ve diğer forseps yakın kuyruk kırmak için forseps başka bir çift kullanın. Dışında çekin ve tendonlar (Şekil 1A, B) geride kalacak.
- Steril H 2 O tendonlar toplayın ve tüm tendonları topladıktan sonra steril H 2 O ile yeni bir petridish taşıyın
- 2-3 tendonlar alın ve 2 çift için kullanarak onları parçalamakSteril H 2 O. sahip yeni bir petridish in CEPS Bu damarlar (; Şekil 1C tendon dokusunun parlak ve yansıtıcı) gibi non-tendon dokusunun çıkarın. Olmayan tüm tendon dokusunun çıkarılmasından sonra, her kuyruk tendonların yaklaşık 100-150 mg verir.
- Steril% 3 asetik asit 300 ml tendonlar aktarılır ve 4 de yavaş yavaş gece boyunca karışmaya ° C.
- Steril% 3 asetik asit ilave bir 200 ml ilave edilir ve 4 de yavaş yavaş gece boyunca karışmaya ° C.
- 4 120 dakika için 2700 x g'de ~ tendonları içeren asetik asit solüsyonu ° C'de santrifüje pelet çözünmemiş tendonları ve non-tendon dokuya.
- Santrifüj sırasında diyaliz boru hazırlamak:
- 40 cm adet kesilmiş
- 5 dakika boyunca 500 uM EDTA kaynamaya
- Steril H 2 O serin
- Diyaliz boru bir ucunda bir düğüm ve bir otomatik pipett kullanılarak doku kültürü davlumbaz içinde buz üzerinde santrifüje tendonu çözeltisi süpernatant ile tüp dolgue ve 25 ml pipetle. Kabarcıkları üreten kaçının. Knot tüp tüm parçaları (Şekil 1D) buz üzerinde steril alüminyum folyo üzerine boru ve mağaza Tüpün diğer ucunu dolana kadar.
- Doku kültürü kaputu steril 0.1x MEM, pH 4.0, 10 l hazırlayın. Hortumun parçalara Şamandıra ekleyin ve bir 10 l beher içinde önceden soğutulmuş 0.1x MEM çözeltisine bu ekleyin. Yavaş yavaş karıştırılarak ° C iken 4 geceleme Dialyze. PH düşük tutarken Bu diyaliz aşırı asit kaldırır.
- Yeni ön soğutmalı 10 l 0.1x MEM ile değiştirin ve 4 gece boyunca karışmaya ° C
- Yeni ön soğutmalı 10 l 0.1x MEM ile değiştirerek önceki adımı yineleyin ve 4 gece boyunca karışmaya ° C
- Steril 50 ml tüpler içine tablet kollajen çözüm. 4 ° C de saklayınız alikotları 6-12 ay tutun, sadece doku kültürü kaputu kollajen stok anlaştım.
- Bu saf kolajen kollajen MATR en iyi sonucu elde etmek için (0.1x MEM'de) seyreltilerek gerekip gerekmediğini test etmek önemlidirix testi. Bu nedenle, bir kollajen inceltilmiş serileri oluşturmak (seyreltilmemiş kolajen, 1:1, 1:2 ve 1:5 seyreltilmiş) ve optimal kollajen seyreltme belirlemek için aşağıda tarif edildiği gibi kollajen matris deneyleri gerçekleştirmek.
2. Dopaminerjik orta beyin 7,8 diseksiyonu
- Annenin rahim E14.5 fare embriyoları inceleyin ve gerekli kadar buz üzerinde L15 ortamda saklayın.
Tüm sonraki diseksiyon adımlar buz üzerinde L15 ortamda yapılmaktadır.
- Beynin parçalara ayır.
- Her telencephalic vezikül (striatal eksplantları için telencephalic veziküller kullanın) medial kısmı boyunca keserek telencephalon çıkarın.
- Meningeal kılıf çıkarın.
- Mezensefalik eğme sadece rostral bir dorsoventral kesim olun.
- Mezensefalik eğme sadece kaudal başka dorsoventral kesim olun.
- Bir microdissectio kullanarak dorsal orta hat boyunca bir rostro kesim olunn bıçak yatan ventral orta beyin dokusunun açığa. Bu dopaminerjik nöronların (Şekil 2) içerir ventral orta beyin dokusu vurmak için dikkatli olun.
- İki rostro kesimler lateral ve dorsal orta beyin doku kaldırmak için ventral orta hat paralel olun.
- Bir mikrodiseksiyon bıçak kullanarak eksplantları içine kalan ventral orta beyin dokusu bölün.
- Kullanılana dek buz üzerinde% 5 FBS içeren L15 ortamda eksplantlarının depolamak.
3. Striatum disseksiyonu
Bütün Diseksiyon adımları buz üzerinde L15 ortamda gerçekleştirilir.
- Orta beyin diseksiyonu sırasında disseke telencephalic veziküller kullanın.
- Talamus ve forseps kullanarak striatum arasında keserek talamus çıkarın.
- Bu koku ampul gibi rostral yapıları kaldırmak için striatum bir mediolateral kesim rostral olun. Striatum kaudaline bulunan doku için bu adımı yineleyin.
- Pozisyonstriatum bir koronal görünümü elde etmek için, geri kalan dilimli (Şekil 2).
- Striatum bir doku (daha şeffaf) biraz daha az yoğun bir parçası olarak kabul edilebilir. Bir mikrodiseksiyon bıçak kullanarak eksplantları içine striatum ve kesip parçalara ayır. Lateral ve medial ganglionik eminens göç nöron içeren orta hatta biraz daha koyu doku yakın, kaçının.
- Kullanılana dek buz üzerinde% 5 FBS içeren L15 ortamda eksplantlarının depolamak.
4. Meclis Kollajen Matrix Tahliller
Kollajen hazırlanması (buz üzerinde tüm adımları, pipet uçları soğutmalı kullanın)
- 10x MEM 100 ul ve 1M sodyum bikarbonat 40 ul (NaHCO 3) ile seyreltilmiş kolajen 860 ul karıştırın ve buz üzerinde tutun. Bu noktada kollajen ısınır Eğer pekiştireceğiz.
- Bir 4-de Nunc çanak iyi bir coverslip üzere hazırlanmış kolajen 20 ul'lik bir damla (çapı yaklaşık olarak 5 mm) ekleyinve bu 37 azından bir CO2 inkübatöründe bekletilir ° C'de ve% 5 dakika 30 (ortam O 2 konsantrasyonunun yeterli olduğu) için CO 2. Bu kuluçka sırasında kollajen jölelemek olacaktır.
Kollajen jel Kurulum ko-kültür
- Kollajen jelatinize sonra kollajen bir dopaminerjik veya striatal eksplant aktarmak için 200 ul ucu ile bir pipet kullanın.
- Bir iğne ile birbirine yakın eksplantlarının taşıyın. Bir eksplant (~ 200-300 um) (Şekil 2) yaklaşık çapı bir mesafede birbirinden biraz tutmak.
- Aşırı orta çıkarın ve eksplant üstüne hazırlanmış kollajen 20 ul ekleyin. Bu genellikle eksplantlarının etrafında hareket etmesine neden olacaktır. 4.4 'te açıklandığı gibi bir iğne kullanılarak eksplantlarının konumlandırmak.
- Kollajen 37 ° C'de ve% 5 CO2 azından 30 dakika takiben oda sıcaklığında 15 dakika boyunca katılaşmaya edelim.
- Kollajen kurdu sonra, e 400 ul ekleyinxplant orta ve 37 bir CO2 inkübatöründe 2-3 gün büyümeye ° C'de ve% 5 CO2.
5.. İmmünohistokimya ve Niceleme tarafından Analizi
İmmünohistokimya
- Eksplantları düzeltmek için, yavaşça orta 400 ul (böylece% 4 PFA sulandırarak) ile PBS içinde% 8 paraformaldehit 400 ul (PFA) ekleyin ve oda sıcaklığında 1 saat bekletin.
- RT de PBS 3x 15 dakika yıkayın.
- Tampon engelleme inkübe (BB; PBS +% 1 FBS +% 0.1 Triton X-100) 2 saat boyunca.
- 4 ° C'de BB primer antikor ile bir gece boyunca inkübe Dopaminerjik aksonlar striatal akson anti-DARPP32 antikorlar (1:500) 9 ve tüm aksonlar anti-βIII tubulin (1:3000) 7 görselleştirmek için anti-tirozin hidroksilaz antikor (1:1000) 7, kullanın.
- RT de PBS ile 5x 1 saat yıkayın.
- 4 'de bir gece BB uygun fluorofor (1:500) ile konjuge sekonder antikor ile birlikte inkübe° C. Bu adımdan eksplantlarının maruziyeti en aza indirmek için ışık (örneğin, alüminyum folyo ile bunları kapatın).
- 4 de, PBS içerisinde gece boyunca yıkanır ° C sonraki gün içinde birkaç yıkama izledi.
- Mikroskopta eksplantlarında Dağına Antifade reaktif orta montaj Prolong kullanarak kayar. Cam bir mikroskop lamı üzerine ~ 10 ul bir damla ekleyin. Coverslip alın ve yavaşça aşağı bakacak eksplant tarafı montaj orta damla üzerine yerleştirin. Çok nazik montaj orta damla üzerine düşürerek de coverslip altında herhangi bir hava yakalama kaçının.
P / D oranı hesaplanarak Sayısallaştırma
- Bir Epifloresans mikroskobu (Şekil 3) kullanarak eksplantlarının dijital görüntüler elde edin.
- Bu görüntüleri kullanarak, proksimal kadran (bitişik eksplant en yakın eksplant yani parçası) ve distal kadran (bitişik expla en uzak eksplant parçası üretmek için parçaya bölünür, her eksplant bölmeknt) (Şekil 2, 4).
- Proksimal ve distal kadranda hem eksplant çıkan 20 uzun neurites uzunluğunu ölçün.
- Her eksplant için P / D oranı hesaplamak için 20 en uzun neurites ortalama uzunluğu kullanın. Bir oran <1 akson itme gösterir iken AP / D oranı> 1, akson cazibe gösterir.
- Bazı durumlarda, neurites ile yoğun bir büyüme bireysel nörit uzunluğunun değerlendirmesi önler. Bu durumlarda, nicel eksplant kenarı ve proksimal ve distal kadranlardaki akson büyüme öncü ön arasındaki mesafenin ölçülmesi ile gerçekleştirilebilir.
6. Temsilcisi Görüntüler
Dopaminerjik ve striatal eksplantlarının başarılı bir kültürden sonra akson çok sayıda (gösterilmemiştir) parlak saha mikroskobu kullanılarak görünür ya da anti-βIII tübülin immünsitokimya tarafından olarak görüntülenmiştir vardır. Bu aksonlar bir alt dopaminerjik veya s olacak görüntülenmiştir kullanarak immünsitokimya olarak triatal aksonlar (Şekil 3). Açıklandığı gibi parçaya bölünür eksplantlarının bölünmesi ve P / D oranları belirlenerek, varsayılan bir akson çekici veya itici etkisi (Şekil 3E) ölçülebilir.

Şekil 1. Sıçan kuyruk tendon gelen kollajen hazırlanması gösteren Foto. Sıçan kuyruğu dışında Çekme A) tendonları ortaya koyar. B) Tendonlar halat benzeri paketler olarak görülebilir. C) tendonları kendi parlak beyaz görünüme damarları ayırt etmek kolaydır. D) asetik asit içinde çözülmesi tendonlar sonra, çözelti diyaliz boru transfer edilir. Çözünmüş kollajen soğuk tutmak için, tüpler buz üzerine steril alüminyum folyo yerleştirilir.
e 2 "src =" / files/ftp_upload/3691/3691fig2.jpg "/>
Şekil 2. Prosedürünün farklı adımları gösteren şematik. Uygun beyin bölgelerinde disseke ve eksplant oluşturmak için kesilir. A tek bir orta beyin ve striatal eksplant kollajen bir matris olarak yakın bir şekilde konumlandırılır ve 37 ° C'de 48-72 saat boyunca büyümeye bırakılmıştır Aksonlar floresans immünohistokimyasal canlandırırlar ve bir P / D oranı chemotropic tepkileri ölçmek için hesaplanır.
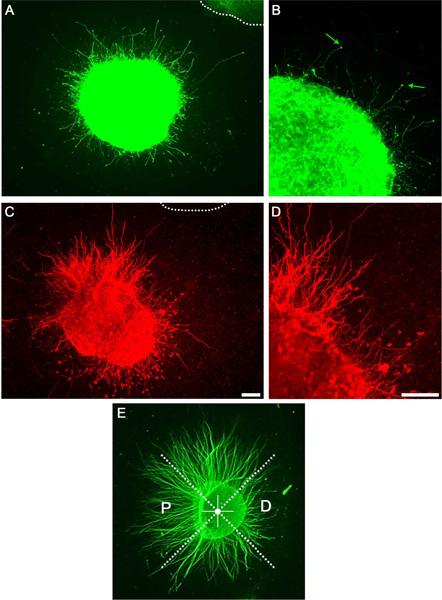
Şekil 3. Bir kollajen matriks kültür akson büyüme gösteren Temsilcisi sonuçları. A) orta beyin eksplant anti-tirozin hidroksilaz antikor akson akıbet ifşa ile boyandı. Noktalı çizgi bitişik eksplant gösterir. A gösteren bireysel neurites ve büyüme konileri (oklar) B) Büyütme. C) striatal eksplant anti-DARPP32 ile boyandı. D) C Büyütme bireysel neurites gösteriyor. D) ÖrnekP / D oranı ölçümü. Eksplantlarından eşit parçaya bölünür ayrılır. Distal kadranda ondan karşı karşıya iken proksimal kadranda bitişik eksplant ile karşı karşıyadır. Ölçek çubukları 100 mikron göstermektedir.
Tartışmalar
Kollajen matriks testi burada açıklanan (örneğin referanslar 5-8 bakınız) akson rehberliği moleküller ve nöronal sistemler çeşitli araştırmak için geçmiş yıllarda pek çok farklı laboratuvarlar tarafından kullanılmış ve geliştirilmiştir. Bu çalışmalar bu testte etkileri ve farklı (orta) hedef dokular tarafından salgılanan akson rehberliği moleküllerin düzenlenmesi çalışmaları için güçlü bir araç olduğunu göstermiştir.
Bununla birlikte, kolajen mat...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Kollajen matriks testi son iki üç yılda pek çok farklı araştırma gruplarının çalışmaları ile geliştirilmiş ve iyileştirilmiştir. Dopaminerjik ve striatal eksplant için buraya açıklanan yaklaşımlar büyük ölçüde bu çalışmalar yarar. Ayrıca, yazarlar striatal eksplant kültürleri kurarken ona yardım için Asheeta Prasad teşekkür etmek istiyorum. Laboratuvarda çalışmalar İnsan sınır Bilim Programı Örgütü (Kariyer Geliştirme Ödülü) tarafından finanse edildi, Sağlık Araştırma ve Geliştirme Hollanda Örgütü (ZonMW-VIDI ve ZonMW-TOP), Europanian Birliği (mdDA-NeuroDev, FP7/2007-2011 Grant 222.999) (RJP için) ve Bilimsel Araştırma Hollanda Örgütü (TopTalent; ERES için).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Fötal Buzağı Serumu | Biowhittaker | 14-801F | |
| Glutamin (200mm) | PAA | M11-004 | |
| Hepes | VWR International | 441476L | |
| β-merkaptoetanol | Merck | 444203 | |
| Minimum Essential Medya (MEM) | Gibco | 61100-087 | |
| Neurobasal | Gibco | 21103-049 | |
| B27 | Gibco | 17504-044 | |
| Leibovitz L-15 Orta | Gibco | 11415-049 | |
| Penisilin-Streptomisin | Gibco | 15070-063 | |
| Altın Antifade Reaktif Prolong | Invitrogen | P36930 | |
| Diyaliz boru | Spektrum Labs | 132660 | |
| Tavşan anti-Tirozin hidroksilaz | Pel-Freez | P40101-0 | |
| Tavşan anti-Darpp32 (H-62) | Santa-Cruz | Sc-11.365 | |
| Fare anti-βIII tübülin | Sigma | T8660 | |
| Alexa Fluor sekonder antikorlar etiketli | Invitrogen |
Referanslar
- van den Heuvel, D. M., Pasterkamp, R. J. Getting connected in the dopamine system. Prog. Neurobiol. 85, 75-93 (2008).
- Lobo, M. K. Molecular profiling of striatonigral and striatopallidal medium spiny neurons past, present, and future. Int. Rev. Neurobiol. 89, 1-35 (2009).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298, 1959-1964 (2002).
- Chilton, J. K. Molecules mechanisms of axon guidance. Dev. Biol. 292, 13-24 (2006).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Tessier-Lavigne, M., Placzek, M., Lumsden, A. G., Dodd, J., Jessel, T. M. Chemotropic guidance of developing axons in the mammalian central nervous system. Nature. 336, 775-778 (1988).
- Kolk, S. M., Gunput, R. A., Tran, T. S., van den Heuvel, D. M., Prasad, A. A., Hellemons, A. J., Adolfs, Y., Ginty, D. D., Kolodkin, A. L., Burbach, J. P., Smidt, M. P., Pasterkamp, R. J. Semaphorin 3F is a bifunctional guidance cue for dopaminergic axons and controls their fasciculation, channeling, rostral growth, and intracortical targeting. J. Neurosci. 29, 12542-12557 (2009).
- Fenstermaker, A. G., Prasad, A. A., Bechara, A., Adolfs, Y., Tissir, F., Goffinet, A., Zou, Y., Pasterkamp, R. J. Wnt/planar cell polarity signaling controls the anterior-posterior organization of monoaminergic axons in the brainstem. J. Neurosci. 30, 16053-16064 (2010).
- Arlotta, P., Molyneaux, B. J., Jabaudon, D., Yoshida, Y., Macklis, J. D. Ctip2 controls the differentiation of medium spiny neurons and the establishment of the cellular architecture of the striatum. J. Neurosci. 28, 622-632 (2008).
- De Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
- Gähwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends Neurosci. 20, 471-477 (1997).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır