Method Article
Parásito inducido genéticamente Impulsado enfermedad autoinmune de Chagas en el modelo de Pollo
En este artículo
Resumen
La inoculación de Trypanosoma cruzi En los huevos fértiles antes de la incubación hace que el parásito de KDNA minicircle la integración en el genoma de las células del embrión. Cruzamiento revela la transferencia vertical de las mutaciones a la descendencia. El KDNA se integra en las regiones de codificación en varios cromosomas, y los pollos mueren de una enfermedad inflamatoria autoinmune del corazón.
Resumen
Las infecciones por Trypanosoma cruzi agudas adquiridas en la infancia y la niñez parecen asintomática, pero aproximadamente un tercio de los casos con infección crónica muestran la enfermedad de Chagas hasta tres décadas o más tarde. Autoinmunidad y la persistencia del parásito son las teorías que compiten para explicar la patogenia de la enfermedad de Chagas 1, 2. Para los roles desempeñados por separado la persistencia del parásito y la autoinmunidad en la enfermedad de Chagas que inocular a la T. cruzi en la cámara de aire de los huevos fertilizados. El sistema de pollo inmune madura es una barrera fuerte biológica contra T. cruzi y la infección está erradicada en el desarrollo de su sistema inmunológico por el final de la primera semana de crecimiento del 3. Los polluelos son libres de parásitos en la trama, pero conservan integrada del parásito mitocondrial ADN del cinetoplasto (kDNA) minicircle dentro de su genoma que se transmiten a su progenie. La documentación de la integración KDNA minicircle en el genoma de la gallina se obtuvo por un TargETED primer TAIL-PCR, hibridaciones Southern, la clonación y secuenciación de 3, 4. El KDNA minicircle integraciones rotura marcos de lectura abierta para la transcripción y factores del sistema inmunológico, la fosfatasa (GTPasa), adenilatociclasa y fosforilasas (PKC, el NF-kappa B activador, PI-3K) asociado con la fisiología celular, el crecimiento y la diferenciación 3, 5 - 7, y otras funciones de genes. Miocarditis grave debido al rechazo de las fibras del corazón diana por los linfocitos citotóxicos efectores se ve en los pollos kDNA mutados, mostrando una miocardiopatía inflamatoria similar a la observada en la enfermedad de Chagas humana. En particular, la insuficiencia cardíaca y la debilidad del músculo esquelético están presentes en los pollos adultos con rotura KDNA del gen de la distrofina en el cromosoma 1 8. Similares alteraciones genotípico están asociados con la destrucción del tejido realizado por efectores CD45 + y + y CD8γδ CD8α linfocitos. Así, esta infección protozoaria puede inducir la enfermedad autoinmune genéticamente accionado.
Protocolo
1. El crecimiento de los parásitos
- Crecer formas tripomastigotes de T. Berenice cruzi y el T. β-galactosidasa de expresión de Tulahuen cruzi MHOM/CH/00 C4 en células del músculo murino (L6) cultivadas en medio mínimo esencial de Dulbecco con un 10% FSB, 100 UI / ml de penicilina, estreptomicina 100 mg / ml, y 250 nM de L-glutamina (pH 7,2), 5% de CO 2 a 37 ° C. Los tripomastigotes que nadan libremente en el medio sobrenadante se utilizaron para inocular los huevos de gallina.
- Crecer Leishmania braziliensis (Lb) LTB300 de valores cultivados en DMEM con FBS al 20%. La forma promastigote Lb en la fase de crecimiento exponencial se utilizó para inocular huevos 9.
2. Parásito inoculación en huevos de gallina fertilizados
- Se inoculan una suspensión de 100 T. cruzi tripomastigotes en 10 l de medio de cultivo a través de un orificio de diámetro de 2 mm en la cáscara del huevo en la parte superior de la cámara de aire de la etapaX huevos fértiles. La invasión y la replicación de los parásitos virulentos en las células del embrión se muestran en vídeo S1. Los grupos de control son las siguientes: a pollos de control), b) los huevos simulados de control reciben 10 l de medio de cultivo, y c) Etapa X huevos fértiles inoculados con una suspensión de 100 promastigotos Lb en 10 l de medio de cultivo de T.. cruzi y Lb pertenecen a la familia kinetoplástido. Respectivamente, estos protozoos crecen libres en el citoplasma o en la vacuola de 10 células huésped.
- Sellar los agujeros con cinta adhesiva.
- Incubar la T. cruzi huevos infectados y las muestras de control de simulacros y no infectados a 37,5 ° C y 65% de humedad durante 21 días.
- Mantenga a los polluelos que nacen en la incubadora durante 24 horas y, posteriormente, a 32 ° C durante tres semanas.
3. La obtención de muestras para la extracción de ADN
- Las células mononucleares de sangre periférica se obtuvieron de pollos: a)nacidas de T. los huevos inoculados cruzi, b), c) los controles se burla de que recibieron 10 l de medio de cultivo; d) nacido de huevos inoculados Lb, células blancas de la sangre de los pollos son procesadas para la extracción de ADN de acuerdo con un protocolo estándar de 11.
- Extraer el ADN también de esperma de gallos, y de los ovocitos infértiles (<5 mm) obtenidos de gallinas nacidas de huevos inoculados con T. cruzi, y de las gallinas de los huevos eclosionados de control 3, 4.
- Extracto KDNA de la T. cruzi epimastigotes se forma y, también, de promastigotos Lb, como se ha descrito en otra parte 9.
4. Primers y sondas utilizadas
Los cebadores utilizados para amplificaciones por PCR y las condiciones térmicas se muestran en la Tabla 1.
Las sondas utilizadas en hibridaciones Southern blot fueron:
- De tipo salvaje minicircle (~ 1,4 kb) secuencias de PuriFied de T. cruzi epimastigotes formas;
- Minicircle fragmentos (362 pb) obtenidos por NsiI resúmenes de tipo salvaje KDNA;
- Nuclear ADN (ADNn) secuencia repetitiva (188 pb) obtenidos por la amplificación del ADN parásito con los cebadores Tcz1 / 2. Las sondas se purificaron a partir de 1% geles de agarosa al 3.
- De tipo salvaje (~ 0,820 minicircle kb) secuencias de promastigotes Lb.
5. Los análisis PCR
- Ejecutar el procedimiento estándar de PCR con ADN genómico de los pollos infectados y no infectados y se burlan de los controles de uso de T. cruzi ADNn Tcz1 / 2 12 y 13 cebadores S35/S36 KDNA. Además, realizar la PCR con ADN genómico de los pollos nacidos de los huevos de Lb infectada con el protozoo específicos LB3 y LB5 cebadores (Tabla 1).
- Hacer mezcla de reacción con 100 ng de ADN molde, 0,4 mM de cada par de cebadores, 2 U de Taq DNA polimerasa, 0,2 mM dNTP, y 1,5 mM de MgCl 2 en un volumen final 25 l.
- Establecer programa del termociclador de 95 ° C durante 5 min, 30 ciclos de 30 segundos a 95 ° C/30 seg a 68 ° C / 1 min a 72 ° C con una extensión final de 5 minutos antes de la refrigeración.
- Analizar los productos de amplificación en 1,3% en gel de agarosa, que se transfiere a una membrana de nylon cargado positivamente (GE Life Sciences) por el método alcalino para la hibridación con sondas específicas marcadas con [α-32 P] dATP utilizando aleatorio imprimación Etiquetado Kit (Invitrogen , Carlsbad, CA).
6. Genómica transferencias de Southern
- Utilizar Mbo I y / o con Eco RI (Invitrogen), enzimas que hacen cortes individuales en minicircles integrados en muestras de ADN de los tejidos corporales.
- ADN Digest de los pollos de control no infectados y de los pollos nacidos de huevos inoculados con el virus virulento T. cruzi forma.
- Someter la digiere de ADN de T. cruzi ya partir de muestras de ensayo de pollo a electroforesis en gel de agarosa al 0,8% a 50 V durante la noche a 4 ° C.
- Transferir separados bandas de ADN a la membrana de nylon cargado positivamente.
- Las bandas de ADN se hibridan con la sonda marcada de radio KDNA.
- Lavar la membrana dos veces durante 15 min a 65 ° C con SSC 2X y SDS al 0,1%, dos veces durante 15 min a 65 ° C cada uno con 0,2 X SSC y SDS al 0,1%, y autorradiografía durante períodos variables de tiempo.
7. Dirigido Primer TAIL-PCR
- Obtener la amplificación de la KDNA minicircle integrado en el genoma de pollo por una modificación COLA-PCR técnica, que combina cebadores kDNA con cebador específico establece 2 en tres cabina de ciclos de PCR anidados, como se muestra en la Figura 1.
- Ciclo de Primaria: Cada reacción incluye 200 ng de DNA plantilla, 2,5 mM MgCl 2 y 0,4 M de KDNA cebadores (S34 o S67), 0,2 mM dNTPs, 2,5 U Taq Platinum (Invitrogen, Carlsbad, CA). Utilice los cebadores KDNA en combinación con 0,04 M de Gg de cebadores (GG1 de Gg6, Tabla 1), por separado. Ajuste la temperatura 57,9 a 60,1 ° C durante KDNA cebadores y 59,9 a 65,6 ° C durante CR-1 cartilla. Obsérvese que estas temperaturas son más altas que las (~ 45 ° C) requerido para los cebadores degenerados arbitrarios utilizados en el 10 TAIL-PCR. Use la temperatura y los ciclos (MyCycle termociclador, Bio-Rad Laboratories, Hercules, CA) que se describen en un trabajo anterior 3.
- Ciclo de Secundaria: Diluir los productos PCR de un ciclo de primaria de 1:40 (v / v) en agua. KDNA cebadores S35 y S35 antisentido sustituye los anteriores, junto con los cebadores Gg mismos.
- Ciclo terciario: Diluir productos PCR de ciclo secundario 1:10 (v / v) en agua y se combinan con cebadores Gg S67 antisentido o S36, por separado.
- Clonar los productos de PCR terciarias ciclo: Clon directamente en vector pGEM T Easy (Promega, Madison, WI)los productos de amplificación pasada que hibridan con la sonda KDNA.
- Seleccione clones por hibridación con la sonda y la secuencia KDNA.
- Validar la tpTAIL-PCR en una mezcla de 300 pg de Radio KDNA de T. cruzi con 200 ng de ADN de las aves de control nunca expuesta a KDNA. Los ciclos de temperatura y la amplificación son el mismo utilizado para el ADN de las aves de ensayo.
8. Clínica de la Enfermedad de Chagas Manifestación
- Controlar el crecimiento y el desarrollo de los pollos nacidos de T. cruzi infecta los huevos y de los controles sanos nacidos de huevos infectados que no todos los días para la mortalidad y la semana durante manifestaciones de la enfermedad.
- Detectar anomalías clínicas en los pollos (Figura 2) y hacer electrocardiograma (ECG) para evaluar las grabaciones de los ejes eléctricos, la frecuencia cardíaca y las arritmias 3.
- Asunto KDNA-mutado y controla pollos mensuales a los registros de ECG de ventricular aumentada de las Naciones Unidasipolar lleva aVF (pierna izquierda), AVL (brazo izquierdo), y aVR (brazo derecho), y para evaluar la desviación del eje eléctrico medio a la izquierda, que es sugestivo de agrandamiento del corazón 3.
9. Los análisis de patología y de inmunoquímica
- Registro del corazón y los índices de peso corporal después de la muerte natural de los pollos kDNA mutados (Figura 3). Obtener índices también para los pollos de control de la misma edad y género.
- Tome las secciones del corazón, el esófago, los intestinos, el músculo esquelético, pulmones, el hígado y los riñones.
- Fijar los tejidos en formol al 10% tamponada (pH 7,4), integrar en parafina y se corta a 4 micras de espesor secciones de hematoxilina-eosina (HE) y la tinción análisis histológicos (Figura 3).
- Tejidos de cosecha y bisect de embriones han nacido de huevos inoculados con parásitos que expresan β-galactosidasa, y sujeto a X-Gal-la mancha. 9
- Fijar la otra mitad de los tejidos embrionarios en 10% de formalina, pH 7,4 y proceder como en el paso 9,3.
- Cortar 4μm delgada de parafina incrustado sección de tejido y se montan en portaobjetos de vidrio para el examen microscópico.
- Incubar las secciones que muestran X-Gal-células teñidas de color azul con antisuero humano chagásica (1:1024 dilución) contra el anti-T cruzi antígeno.
- Lavar secciones santiamén con PBS, pH 7,4, 5 minutos cada uno.
- Mancha de células azules en los tejidos de embriones por segunda incubación con un conejo conjugado con fluoresceína anti-IgG humana.
- Lavar las secciones con PBS (paso 8), montaje con el cubreobjetos y observar las células de color azul claro hasta verde en el examen con luz ultravioleta a la longitud de onda nm 502, 200 aumentos, por colocalizing T. cruzi en células embrionarias.
10. Las células del sistema inmunológico fenotipo en las lesiones del corazón
- Las células inmunes efectores fenotipo en las secciones de tejido del corazón de KDNA-positivo y de control de Radio KDNA-negativos pollos.
- Colocar los portaobjetos contejido sección embebido en parafina a 65 ° C durante 30 minutos para fundir la cera anterior a la presentación en cuatro lavados en xileno 100% al 70% y luego en etanol absoluto PBS durante 5 minutos cada uno.
- Enjuague los portaobjetos en agua destilada, el aire seco, y tratar con anticuerpos monoclonales específicos (con fluoresceína o R-ficoeritrina-anticuerpos monoclonales conjugados) obtenidos a partir de SouthernBiotech, Birmingham, AL.
- Utilice el ratón anti-pollo Bu-1 (Bu-1 y un BU-1 alelos b, Mr 70-75 kDa) Mab AV20 reconocer determinante monomórfica en los antígenos de las células B de pollos puras.
- Utilice el ratón anti-CD45 de pollo, isotipo Ig κ IgM1 específica a las células de pollo timo linaje (D. 190 a la variante 215-kDa).
- Utilice el ratón anti-pollo TCRγδ + (90-kDa Sr. heterodímero) AcM específico para las células del timo dependientes CD8α + T.
- Utilice el ratón anti-pollo Mab de CD-8 específica a los pollos de la cadena α (Mr 34 kDa) reconocer ºe las células CD8 en timocitos, el bazo, el corazón y otros tejidos.
- Utilice el ratón anti-pollo KuL01 a reconocer exclusivamente monocitos y macrófagos del sistema fagocítico.
- Lavar el portaobjetos tres veces con PBS 0,1 M, pH 7,4, 5 min después de cada incubación con anticuerpos específicos anti-fenotipo anticuerpo durante 90 minutos en una cámara húmeda.
- Monte la diapositiva con glicerina tamponada para el examen bajo un microscopio de luz fluorescente con filtro de emisión de longitud de onda 567 nm y 502, respectivamente, para detectar las células marcadas con fluorescencia de color rojo y verde (Figura 4).
11. Los análisis de datos
- Utilice la base de datos de genoma de la gallina ( http://www.ncbi.nlm.nih.gov/genome/seq/BlastGen/BlastGen.cgi?taxid=9031 ) para el análisis de la secuencia BLASTN.
- Utilice alineaciones CLUSTALW para determinar el valor de e-cuentas.
- Emplear el GIRepetición de RI algoritmo de enmascaramiento CENSOR ( http://girinst.org/censor/index.php ) para la localización de las diferentes clases de repeticiones de secuencias quiméricas.
- Emplear la Inserción Kinetoplastid y Secuencia de eliminación Herramienta de Búsqueda (KISS) para identificar posibles gRNAs en las secuencias de perfiles de bandas, con la ayuda de WU-Blastn modificado de matriz 3.
- Utilice T. cruzi secuencias http://www.biomedcentral.com/content/supplementary/1471-~~HEAD=NNS 2164-8-133-s1.fas para buscar en gRNAs en las quimeras de ADN de acogida KDNA. 11.6) El Uso de la t, y las pruebas Kolmorov-Smirnov, respectivamente, para detectar diferencias significativas entre las desviaciones de los ejes eléctricos y por los índices de peso del corazón / cuerpo obtenidos en los grupos experimental y control, y para detectar las tasas de mortalidad diferencias significativas entre los grupos de pollos nacidos a partir de T. cruzi Inoculated huevos y de los controles.
12. Los resultados representativos
La inoculación de 100 virulenta T. tripomastigotes cruzi en la cámara de aire de los huevos de gallina fértiles no reduce significativamente los ratios de pollitos nacidos vivos. Aproximadamente el 60% nacen los pollos sanos y el 40% puede sufrir licuefacción de embriones o la muerte del embrión en la trama. Los polluelos que sobreviven retener la secuencia minicircle KDNA integrado en el genoma. Sin embargo, se espera que algunas chicas se mueren con cardiomegalia y el fracaso en las semanas después de la eclosión. Los pollos restantes crecerán hacia el exterior a los adultos sanos. En todas las etapas de la vida del ADN extraído de las células mononucleares de la sangre producirá la amplificación por PCR de Radio KDNA, pero no ADNn. El selectivo de alto riesgo TAIL-PCR 3, 4 productos que son clonados y secuencia mostrará el KDNA minicircles integrarán principalmente en las regiones codificantes de macrocromosomas de 1 a 5. Los pollos muestran KDNA múltiples integrations en genes que codifican para el crecimiento y la diferenciación celular, inmunes factores de regulación del sistema, y la reparación del ADN son candidatos a someterse rechazo de tejidos diana auto (Figura 3). Por ejemplo, el pollo que muestra la mutación KDNA con la ruptura del gen de la distrofina (Figura 5), que codifica una proteína que se une al citoesqueleto a la membrana celular, es un candidato para desarrollar miocardiopatía inflamatoria autoinmune y el fracaso.
Estas modificaciones genómicas no se ven en pollitos salidos de huevos infectados Lb. Hay diferencias entre T. cruzi y Lb minicircles KDNA; El T. cruzi k ADN minicircle promedio de 1,4 kb con estructura de cuatro región variable (RV) intercalados con regiones conservadas (CR) de cada presentación, los CSB1 CSB2 y regiones csb3, en los que se consideran CA-ricos ADN doblados sitios específicos para la iniciación de la replicación, transcripción, recombinación, y para la transferencia de ADN lateral 3, 4. En contraste, el Lb KDNA minicircle (tamaño medio de 820 pb) contiene un solo CR seguido por VR. CR ha conservado CSB1 (GGGCGT) y CSB2 (CCCCGTTC) bloques, que son diferentes de los de la T. cruzi minicircles 15, 16 y 17. Teniendo en cuenta que Lb csb3 (GGGGTTGGTGTA) muestra homología 12 nts de la T. cruzi es concebible que sea el Lb KDNA minicircle integra en una frecuencia mucho más baja, lo cual puede no ser visible por las técnicas utilizadas, o que puede, posiblemente no, integrar en el genoma de pollo en absoluto.
| Cartilla | ADN diana | Secuencia | TM * |
| S 34 | T. cruzi KDNA | 5 'ACA CCA CCA CAC ATC GAA CC 3' | 57,9 |
| S 67 | T.cruzi KDNA | 5 'GGT TTT GGG AGG GG (G / C) (G / C) (T / G) TC 3' | 60,1 |
| S 35 | T. cruzi KDNA | 5 'ATG ATA TAC GGG (T / G) GA GAT GC 3' | 59,4 |
| S 36 | T. cruzi KDNA | 5 'GGT TCG ATT GGG GTT GGT G 3' | 57,9 |
| LB3 | Lb KDNA | 5 'GGG GTT GGT GTA ATA TAG TGG G 3' | 55,9 |
| LB5 | Lb KDNA | 5 'CTA ATT GTG CAC GGG GAG G 3' | 61,4 |
| GG 1 | Gallus gallus | 5 'AGC AGG TGA TCC TAA GAC AGC 3' | 60,1 |
| GG2 | G. gallus | 5 'CTG AGC TGC CTCTTT GAA A 3 ' | 56,8 |
| GG3 | G. gallus | 5 'TTT CAA GGC AGC AGA TCG G 3' | 60,1 |
| GG4 | G. gallus | 3 'TCG CTG CCT TTA TCA TCG GGA 5' | 64,2 |
| GG5 | G. gallus | 3 'CAG AAC TCA GCG TCC CAC TT 5' | 62,3 |
| Gg6 | G. gallus | 3 'CTG TTA ACG TGA GGC TTC ACA A 5' | 60,4 |
Primes Tabla 1. Se utiliza en las amplificaciones de PCR. * Tm = temperatura media de recocido ° C.
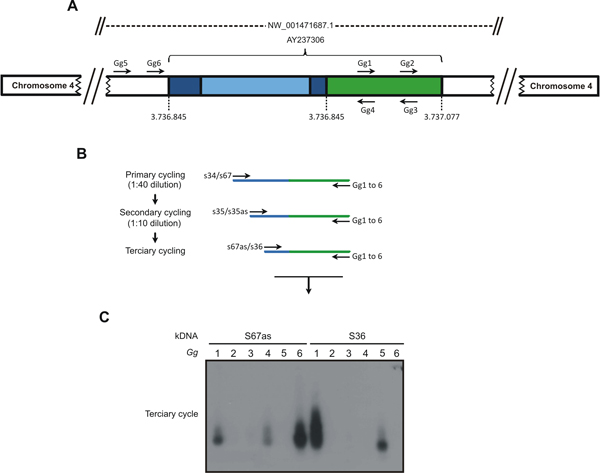
Figura 1. El TP COLA-PCR estrategia utilizada para la detección de Trypanosoma cruzi, la integración en el genoma de Radio KDNA la especie Gallus gallus. A) Una secuencia quimérica con un fragmento de KDNA minicircle conservadas (azul oscuro) y variable (luz azul) regiones integradas en el locus NW_001471687.1 en el cromosoma 4 (AY237306) del pollo 10 genoma (verde) se utilizó para obtener el host conjuntos de cebadores específicos (GG1 de Gg6). B) Los tp TAIL-PCR amplificaciones se iniciaron (ciclo primario) por el recocido de los minicircle-S34 o S67 específicos cebadores en combinación con los de pollo específicos GG1 Gg6 de cebadores. Productos diluidos plantilla proporcionada para el ciclo de secundaria con el S35 (sentido / antisentido) cebadores y las combinaciones de cebadores Gg. En el ciclo terciario una dilución de los productos secundarios se sometió a amplificación con KDNA S36 o S67 cebadores antisentido en combinación con el cebador Ggs. C) Estos productos de amplificación se separaron en geles de agarosa al 1% y se transfirieron a una membrana de nylon, se hibridó con la sonda específica KDNA. Las muestras que muestran señal positiva se utilizaron para la clonación para determinar el punto de integración. Las combinaciones de KDNA y dirigidos a GG1 Gg6 se muestran en la parte superior del gel. Las sucesivas reacciones de PCR amplificados host de destino KDNA-secuencias de ADN con KDNA minicircles (azul) y la secuencia aviar (verde). (Tomado de PLoS Neglected Tropical Diseases 3).

Figura 2. Las manifestaciones clínicas de la función cardíaca deteriorada en un pollo de 9 meses de edad, modificado genéticamente mediante la integración de la mitocondrial KDNA minicircle de T. cruzi. La mala oxigenación de la sangre del pollo KDNA mitocondrial mutado que muestra los contrastes de color púrpura peine con el peine de color rojo brillante del control de 9 meses de edad, chicken libre de daño al corazón. (Modificado de PLoS Neglected Tropical Diseases 3).
Figura 3. Gross y patología microscópica de la especie Gallus gallus con mutaciones Radio KDNA. A) cardiomegalia en la gallina de 9 meses de edad, que murió de insuficiencia cardíaca. B) El control del corazón de una no infectada de 9 meses de edad, soltero. C) El rechazo de las células del corazón diana por los linfocitos citotóxicos: Una unidad de rechazo mínimo con lisis de las células diana por los linfocitos inmunes se representa (círculo). D) Control de la histología del corazón (Modificado de PLoS Neglected Tropical Diseases 3).
Figura 4. Análisis inmunocitoquímico de las células del sistema inmune que infiltran el corazón de KDNA-mutado pollo se muestra en la Figura 3. A) CD45 + linfocitos identificados (flechas) en el corazón-le-siones por un ficoeritrina marcado con anticuerpo monoclonal específico. B) CD8 + delta gamma linfocitos inmunes (flechas) que participan en la destrucción severa del corazón. C) La abundancia de CD8α + células T presentes en las lesiones graves con lisis de células del corazón. Las inserciones muestran la ausencia de células del sistema inmune en el centro de control de pollo infectado (Modificado de PLoS Neglected Tropical Diseases 3).

Figura 5. La enfermedad de Chagas, como miocardiopatía dilatada inflamatoria en una progenie F2 con la integración de KDNA en el gen de la distrofina. A) el corazón dilatado en un pollo de 10 meses de edad, ocupando la mayor parte de la cavidad torácica (peso del corazón = 16 g). B) Dark se infiltra en células mononucleares redondas y destruye el miocardio de la gallina KDNA-mutados. C) corazón de tamaño normal (peso 7 g) de un pollo de control de 10 meses de edad. D) la histología normal de un corazón de pollo de control. (Modificado de PLoS Neglected TropicalAl Enfermedades 3).
Figura 6. Patología Comparada en Radio KDNA-mutado de pollo y en la enfermedad de Chagas. A) la miocarditis severa y lisis de células diana del corazón en el pollo KDNA-mutado. B) la miocarditis severa y lisis de células diana por los linfocitos inmunes en el caso de la cardiopatía chagásica. C) El rechazo de las células del corazón por los linfocitos inmunes en el pollo KDNA-mutado. D) El rechazo de las células del corazón por los linfocitos inmunes en la enfermedad de Chagas. Manchado por hematoxilina y eosina. (Modificado de Memorias del Instituto Oswaldo Cruz, Río de Janeiro, 14).
Discusión
En contraste con los mamíferos susceptibles a la vida a lo largo T. cruzi, los pollos son refractarios a la T. cruzi. La ventaja principal del sistema de modelo de pollo es la eliminación de la infección temprana en el desarrollo del sistema inmune embrionario. Así, el ADN del parásito único que queda dentro del cuerpo que el pollo esté integrado en varios loci.
El uso de la cantidad óptima de virulenta T. cruzi tripomastigotes para inocular huevo fértil es el paso crucial hacia la obtención de la integración de la minicircles KDNA en el genoma del embrión de pollo. La tasa de incubar pollitos en vivo a partir de huevos inoculados con 100 tripomastigotes es cuatro veces mayor que la obtenida con 500 parásitos. Se debe tener cuidado para inocular la suspensión parásitos en 10 l de medio de cultivo en la cámara de aire del huevo. No debe haber ninguna fuga de clara de huevo. Bajo condiciones óptimas, la infección parasitaria intracelular se lleva a cabo widelgada unas pocas horas después de la multiplicación de incubación y el parásito dentro de las células huésped producto durante una semana; posteriormente la infección se elimina por la inmunidad innata. La integración KDNA requiere una infección de estar, y la inoculación de minicircles desnudas en los primeros huevos de embrión de pollo no da lugar a la integración. Los embriones KDNA-positivos y los controles deben ser alojados bajo condiciones controladas a 37,5 ° C y 65% de humedad. Los pollos se mantienen en jaulas de dos semanas a 33 ° C de temperatura ambiente. Posteriormente, los pollos se mantienen en jaulas suspendidas en bastidores separados por pasillos de 1,5 metros de anchura en una habitación a 22 ° C con aire filtrado y presión positiva en el agotamiento constante para asegurar condiciones de bienestar animal. Los adultos se alimentan de pollo-chow y beber agua potable corriente para lograr un crecimiento y madurez, poniendo los huevos a los cinco meses de edad. Mantenimiento de los procedimientos de higiene son esenciales para la reproducibilidad de los resultados cuando se trabaja con T. cruzi inoculadosen huevos de gallina fértiles.
En el modelo de sistema de pollo de la T. cruzi son erradicadas tras el desarrollo del sistema inmune en el período inicial de crecimiento del embrión. Además de ser libre de infección, los polluelos que salen de T. cruzi inocularon huevos, en la falta de anticuerpos específicos, son tolerantes a los antígenos del parásito. El rechazo de las células diana del corazón por linfocitos citotóxicos (unidad mínima rechazo, Figura 3) se ve en los pollos KDNA-mutados que muestran modificaciones genotipo y de la descomposición de la vigilancia inmunológica 3. Los genotípicamente células T modificadas presentan rechazo acelerado de los tejidos auto en el cuerpo. El sitio de la lesión principal es el corazón, que es un sello distintivo de la enfermedad de Chagas. El paso de una fisiológica (vigilancia) a un estado fisiopatológico se ve en el pollo KDNA-mutado mostrando clonalmente proliferación de los linfocitos citotóxicos 3.
Tsu sistema modelo transkingdom muestra un parásito inducida, genéticamente impulsada enfermedad autoinmune (Figura 6), derivado de modificaciones del genoma de la T. cruzi KDNA minicircle integraciones. Estas modificaciones no se ven en pollitos salidos de huevos inoculados Lb.
Este fenómeno sugiere que el tratamiento experimental de la miocardiopatía inflamatoria autoinmune en perfiles de bandas de pollos mutantes pueden exigir la supresión de la droga de las células progenitoras de médula ósea de células T específicas fenotipo infiltrarse en el miocardio, y el trasplante de médula ósea sana histocompatible para prevenir el rechazo de uno mismo-tejido.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Estamos en deuda con Nancy R. Sturm, Departamento de Inmunología, Microbiología y Biología Molecular, Escuela David Geffen de Medicina de la Universidad de California en Los Ángeles, para la lectura crítica del manuscrito. El Consejo Nacional de Investigaciones-CNPq y la Fundación para el Desarrollo de la Investigación-FAPDF, Brasil, con el apoyo del estudio. Damos las gracias a la ayuda técnica de Alejandro O. Souza, María C. Guimaro, Ciro Cordeiro, Ana Rosa de Cassia, Alves Roseneide, y Andrade Rafael, de la Universidad de Brasilia, Brasil.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Taq polimerasa de ADN recombinante | Invitrogen | 11615-010 | |
| Platinum Taq DNA Polimerasa | Invitrogen | 10966-030 | |
| Los cebadores de ADN al azar un sistema de etiquetado | Invitrogen | 18187-013 | |
| Eco RI | Invitrogen | 15202-021 | |
| Mbo I | Invitrogen | 15248-016 | |
| Juego de dNTP, Soluciones de 100mm | GE Healthcare | 28-4065-51 | |
| Amersham Hybond - N + - Cat. n. | GE Healthcare | RPN303B | |
| PlasmidPrep mini kit de Giro | GE Healthcare | 28-9042-70 | |
| NsiI | SIGMA-ALDRICH | R5884 1Ku | |
| ADN, sal sódica esperma de peces | AMRESCO | 0644-10G | |
| Ratón anti-pollo de Bu-1b | SouthernBiotech | 8370-02 | |
| Mouse anti-CD45 de pollo | SouthernBiotech | 8270-08 | |
| Ratón anti-pollo TCRγδ | SouthernBiotech | 8230-08 | |
| Ratón anti-pollo CD8α | SouthernBiotech | 9220-02 | |
| Ratón anti-pollo de monocitos / macrófagos | SouthernBiotech | 8420-02 | |
| MyCycle termociclador | Bio-Rad Laboratories | 580BR 5501 |
Referencias
- Teixeira, A. R. Pathogenesis of chagas' disease: parasite persistence and autoimmunity. CMR. 24, 592-630 (2011).
- Teixeira, A. R. Chagas disease. Postg. Med. J. 82, 788-798 (2006).
- Teixeira, A. R. Trypanosoma cruzi in the chicken model: Chagas-like heart disease in the absence of parasitism. PLoS Negl. Trop. Dis. 5, e1000 (2011).
- Hecht, M. M. Inheritance of DNA transferred from American trypanosomes to human hosts. PLoS One. 5, e9181 (2010).
- Xing, Z. Roles of the ERK MAPK in the regulation of proinflammatory and apoptotic responses in chicken macrophages infected with H9N2 avian influenza virus. J. Gen. Virol. 91, 343-351 (2010).
- Kim, H. B. NIK and IKKbeta interdependence in NF-kappaB signalling--flux analysis of regulation through metabolites. Biosystems. 99, 140-149 (2010).
- Karakhanova, S. ERK/p38 MAP-kinases and PI3K are involved in the differential regulation of B7-H1 expression in DC subsets. Eur. J. Immunol. 40, 254-266 (2010).
- Finsterer, J. The heart in human dystrophinopathies. Cardiology. 99, 1-19 (2003).
- Nitz, N. Heritable integration of kDNA minicircle sequences from Trypanosoma cruzi into the avian genome: insights into human Chagas disease. Cell. 118, 175-186 (2004).
- Simpson, L. Kinetoplast DNA in trypanosomid flagellates. Int. Rev. Cytol. 99, 1-19 (1986).
- Bonney, K. M. Heat-killed Trypanosoma cruzi induces acute cardiac damage and polyantigenic autoimmunity. PLoS One. 6, e14571 (2011).
- Moser, D. R. Detection of Trypanosoma cruzi by DNA amplification using the polymerase chain reaction. J. Clin. Microbiol. 27, 1477-1482 (1989).
- Sturm, N. R. Sensitive detection and schizodeme classification of Trypanosoma cruzi cells by amplification of kinetoplast minicircle DNA sequences: use in diagnosis of Chagas' disease. Mol. Biochem. Parasitol. 33, 205-214 (1989).
- Teixeira, A. R. Evolution and pathology in chagas disease--a review. Mem. Inst. Oswaldo Cruz. 101, 463-491 (2006).
- Yurchenko, V. Y. Structure of Leishmania minicircle kinetoplast DNA classes. J. Clin. Microbiol. 37, 1656-1657 (1999).
- Simpson, L. The genomic organization of guide RNA genes in kinetoplastid protozoa: several conundrums and their solutions. Mol. Biochem. Parasitol. 86, 133-141 (1997).
- Thomas, S. A non-universal transcription factor? The Leishmania tarentolae TATA box-binding protein LtTBP associates with a subset of promoters. Int J. Parasitol. 36, 1217-1226 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados