Method Article
Parasite Induzida geneticamente guiadas Doenças Auto-Imunes do Coração Chagas no Modelo de Frango
Neste Artigo
Resumo
A inoculação de Trypanosoma cruzi Em ovos férteis para incubação anteriores torna o parasita minicírculos do kDNA integração no genoma de células de embriões. Cruzamento revela a transferência vertical das mutações à progenitura. O kDNA integra em regiões codificantes em vários cromossomos e as galinhas morrer com uma doença cardíaca inflamatória auto-imune.
Resumo
As infecções agudas do Trypanosoma cruzi adquiridos na infância parecem assintomáticas, mas aproximadamente um terço dos casos cronicamente infectados apresentam a doença de Chagas até três décadas ou mais tarde. Autoimunidade e persistência parasita estão competindo teorias para explicar a patogênese da doença de Chagas 1, 2. Para papéis distintos desempenhados por parasita persistência e auto-imunidade na doença de Chagas nos inocular o T. cruzi na câmara de ar de ovos fertilizados. O sistema imunológico maduro frango é uma barreira biológica apertado contra T. cruzi e que a infecção é erradicada sobre o desenvolvimento da sua sistema imunitário, até ao final da primeira semana de crescimento 3. Os filhotes são parasita-livre em eclosão, mas eles mantêm integrados parasita mitocondrial DNA do cinetoplasto (kDNA) minicírculos dentro de seu genoma que são transferidos aos seus descendentes. Documentação da integração kDNA minicírculo no genoma de galinha foi obtido por um targeted principal TAIL-PCR, hibridização do Sul, clonagem, sequenciamento e 3, 4. O kDNA minicírculos integrações ruptura quadros de leitura aberta para a transcrição e factores do sistema imunitário, fosfatase (GTPase), adenilato ciclase e fosforilases (PKC, NF-kappa B activador, PI-3K) associado com a fisiologia da célula, o crescimento, diferenciação e 3, 5 - 7, e as funções de outros genes. Miocardite grave devido a rejeição de fibras de coração do alvo por efectores linfócitos citotóxicos é visto nas galinhas kDNA mutados, mostrando uma cardiomiopatia inflamatória semelhante à observada na doença de Chagas humana. Notavelmente, a insuficiência cardíaca e fraqueza muscular esquelética estão presentes em frangos adultos com kDNA ruptura do gene da distrofina no cromossoma 1 8. Similares alterações genotípicas estão associados com a destruição do tecido realizado por efectores CD45 +, CD8γδ + e CD8a linfócitos. Assim, esta protozoose pode induzir geneticamente orientada doença auto-imune.
Protocolo
1. Crescimento de Parasitas
- Crescer formas tripomastigotas de T. cruzi Berenice eo β-galactosidase-expressando Tulahuen T. cruzi MHOM/CH/00 C4 na célula muscular murino (L6) cultivadas em meio mínimo essencial de Dulbecco com FSB 10%, 100 UI / ml de penicilina, estreptomicina 100 ug / ml, e 250 nM de L-glutamina (pH 7,2), 5% CO 2 a 37 ° C. Os tripomastigotas livre de natação no meio sobrenadante foram utilizados para inocular os ovos de galinha.
- Crescer Leishmania braziliensis (Lb) LTB300 estoque cultivadas em DMEM com SFB 20%. A forma promastigota Lb na fase de crescimento exponencial foi utilizado para inocular 9 ovos.
2. Parasite Inoculação em ovos de galinha fertilizados
- Inocule uma suspensão de 100 T. cruzi tripomastigotas em 10 uL de meio de cultura através de um orifício de diâmetro de 2 mm na casca do ovo na parte superior da câmara de ar de faseX ovos férteis. A invasão e replicação dos parasitas virulentos para as células de embriões são mostrados na S1 vídeo. Os grupos de controlo são as seguintes: a) frangos de controlo; b) Os ovos de controlo simulados receptora 10 uL de meio de cultura; estádio C) X ovos férteis inoculados com uma suspensão de 100 promastigotas lb em 10 uL de meio de cultura T.. cruzi e Lb pertencem à família de parasitas cinetoplastidas. Respectivamente, tais protozoários crescer livre no citoplasma ou no vacúolo parasitóforo de células hospedeiras 10.
- Selar buracos com fita adesiva.
- Incubar a T. cruzi infectadas ovos e amostras de controlo de simulação e não infectadas a 37,5 ° C e uma humidade de 65% durante 21 dias.
- Manter os pintainhos que chocam na incubadora durante 24 horas e, seguidamente, a 32 ° C durante três semanas.
3. Obtenção de amostras para extração de DNA
- As células mononucleares do sangue periférico foram obtidos a partir de galinhas: a)incubados de T. ovos cruzi inoculados, b), c) controles zomba receberam 10 ul de meio de cultura; d) provenientes de ovos inoculados Lb; células brancas do sangue de galinhas são processadas para extração de DNA de acordo com um protocolo padrão 11.
- Extrair DNA também do sêmen coletado de galos, e a partir de oócitos inférteis (<5 mm) coletados de galinhas provenientes de ovos inoculados com T. cruzi, e de galinhas eclodidos de ovos de controlo 3, 4.
- Extrair kDNA do T. cruzi epimastigota formas e, também, a partir de promastigotas Lb, conforme já descrito 9.
4. Primers e sondas usadas
Os iniciadores utilizados para amplificações por PCR e as condições térmicas são mostrados na Tabela 1.
As sondas utilizadas na hibridações Southern blot foram:
- Tipo selvagem minicírculo (~ 1,4 kb) sequências puricados a partir de T. formas cruzi epimastigotas;
- Minicírculos fragmentos (362 pb), obtidos por Nsi I digere de tipo selvagem kDNA;
- Nuclear DNA (nDNA) sequência repetitiva (188 pb), obtido através da amplificação do DNA do parasita com os iniciadores Tcz1 / 2. As sondas foram purificados a partir de agarose a 1% géis 3.
- Tipo selvagem minicírculos (~ 0,820 kb) seqüências de promastigotas lb.
5. Análises de PCR
- Execute o procedimento padrão de PCR com DNAs genômicos de pintos infectados e controles não infectados e zombar com T. cruzi nDNA Tcz1 / 2 12 e kDNA S35/S36 13 primers. Além disso, execute PCR com DNAs genômicos de galinhas eclodido a partir de Lb infectado de ovos utilizando os protozoários específicos Lb3 e Lb5 primers (Tabela 1).
- Fazer a mistura de reacção com 100 ng de DNA molde, 0,4 mM de cada par de primers, 2 U de polimerase de DNA Taq, 0,2 mM de dNTP, e 1,5 mM de MgCl 2 em um volume de 25 uL final.
- Definir programa termociclador para 95 ° C durante 5 min, 30 ciclos de 30 seg a 95 ° C/30 seg a 68 ° C / 1 min a 72 ° C, com 5 min de extensão final antes de refrigeração.
- Analisar os produtos de amplificação em 1,3% gel de agarose, que é transferido para uma membrana de nylon carregada positivamente (GE Life Sciences) pelo método alcalino para a hibridação com sondas específicas marcadas com [α-32 P] dATP usando aleatória Primer Labeling Kit (Invitrogen , Carlsbad, CA).
6. Genômicas Southern blots
- Use Mbo I e / ou com Eco RI (Invitrogen) As enzimas que fazem cortes simples em minicírculos integrados amostras de DNA de tecidos do corpo.
- Digest DNA de frangos de controle não infectados e de frangos provenientes de ovos inoculados com T. virulento cruzi forma.
- Objecto da digere de DNA a partir de T. cruzi ea partir de amostras de teste de frango à eletroforese em gel de agarose a 0,8% a 50 V durante a noite a 4 ° C.
- Transferir as bandas de ADN separadas a carregada positivamente membrana de nylon.
- Hibridizar as bandas de DNA com rádio de nome kDNA sonda.
- Lava-se a membrana por duas vezes durante 15 min a 65 ° C com SSC 2X e 0,1% de SDS, duas vezes durante 15 min a 65 ° C, cada um com 0,2 X SSC e SDS a 0,1%, e autorradiograf ia, por períodos de tempo variáveis.
7. Destinado Prime TAIL-PCR
- Obter a amplificação do kDNA minicírculos integrado no genoma do frango por uma técnica modificada TAIL-PCR, que combina os primers kDNA com primer específico define 2 em três cabina de ciclos de PCR aninhados, como mostrado na Figura 1.
- Ciclo primário: Cada reacção inclui 200 ng de DNA molde, 2,5 mM de MgCl2, e 0,4 mM de kDNA primers (S34 ou S67), 0,2 mM de dNTPs, 2,5 U de Taq Platinum (Invitrogen, Carlsbad, CA). Use os iniciadores kDNA em combinação com 0,04 mM de Gg primers (GG1 para Gg6, Tabela 1), separadamente. Definir temperaturas 57,9-60,1 ° C durante kDNA iniciadores e 59,9-65,6 ° C durante CR-1 primer. Note-se que estas temperaturas são mais elevados do que aqueles (~ 45 ° C) necessária para os iniciadores arbitrários degenerados utilizados no 10 TAIL-PCR. Use temperatura e ciclos (MyCycle Termociclador, Bio-Rad Laboratories, Hercules, CA), descritos em um artigo anterior 3.
- Ciclo secundário: Diluir a partir de produtos de PCR primário ciclo 1:40 (v / v) em água. kDNA iniciadores S35 e S35 antisense substituído os anteriores, juntamente com os iniciadores Gg mesmos.
- Ciclo terciário: Diluir produtos de PCR a partir de ciclo secundário 1:10 (v / v) em água e combinar iniciadores GG com S67 antisense ou S36, separadamente.
- Clonar os produtos de PCR ciclo terciário: Clone diretamente no vetor pGEM T easy (Promega, Madison, WI)os produtos de amplificação passada que hibridizam com kDNA sonda.
- Selecione clones de hibridização com sonda de kDNA e seqüência.
- Validar o tpTAIL-PCR em um mix de 300 pg de kDNA de T. cruzi com 200 ng de DNA a partir de aves de controlo nunca expostos a kDNA. Os ciclos de temperatura e amplificação são os mesmos usados para o DNA das aves teste ".
8. Manifestação Clínica de Doenças de Chagas
- Monitorar o crescimento e desenvolvimento dos frangos incubados de T. cruzi infectadas ovos e de controles saudáveis nascidas de ovos não-infectados diariamente para a mortalidade e semanalmente para as manifestações da doença.
- Detectar anormalidades clínicos em aquelas galinhas (Figura 2) e fazer de electrocardiógrafo (ECG) gravações para avaliar os eixos eléctricas, as taxas de cardíaca e arritmias 3.
- Assunto kDNA-mutante e controla frangos mensais para gravações de ECG ventricular aumentada unipolar leva aVF (perna esquerda), aVL (braço esquerdo), e aVR (braço direito), e para avaliar o desvio de eixo elétrico médio para a esquerda, o que é sugestivo de aumento do coração 3.
9. Análises Patologia e Imunoquímica
- Coração registro e os índices de peso corporal após mortes naturais das galinhas mutantes kDNA (Figura 3). Obter índices também para frangos de controle da mesma idade e sexo.
- Tome seções do coração, esôfago, intestino, músculo esquelético, pulmões, fígado e rins.
- Fixar o tecido em formalina a 10% tamponada (pH 7,4), incorporar em parafina e cortada para 4 mm de secções espessas para Hematoxilina-Eosina (HE) e análises histológicas (Figura 3).
- Colheita e bisect tecidos de embriões provenientes de ovos inoculados com parasitas que expressam β-galactosidase, e sujeitas a X-Gal-mancha 9.
- Fixar a outra metade dos tecidos embrionários em 10% de formalina, pH 7,4 e proceder como no passo 9.3.
- Corte 4μm fina de parafina secção de tecido incorporado e montar em lâmina de vidro para exame microscópico.
- Incubar seções mostrando X-Gal-células coradas com azul humana chagásica anti-soro (diluição 1:1024) contra anti-T. antigénio cruzi.
- Lavar secções trice com PBS, pH 7,4, 5 min cada.
- Corar as células azuis nos tecidos embrionários por incubação com um segundo coelho com fluoresceína conjugado anti-IgG humana.
- Lave seções com PBS (passo 8), montagem com lamínula e observar as células de cor azul-verde até ao exame sob luz UV a 502 nm, aumento de 200x, para colocalizing T. cruzi em células embrionárias.
10. Células Fenótipo Sistema Imunológico em lesões cardíacas
- Células imunes efetores Fenótipo em cortes de tecido do coração de kDNA-positiva e de controle de kDNA-negativas galinhas.
- Colocar as lâminas comsecção de tecido embebido em parafina a 65 ° C durante 30 min para derreter cera anterior para apresentação em quatro lavagens em 100% a 70% de xileno e, em seguida, em etanol absoluto PBS durante 5 min cada.
- Lavam-se as lâminas em água destilada, ar seco, e trata-se com anticorpos monoclonais específicos (fluoresceína ou R-ficoeritrina-anticorpos monoclonais conjugados) obtidos a partir de SouthernBiotech, Birmingham, AL.
- Use o mouse anti-galinha Bu-1 (Bu-1 e um BU-1 alelos b, Sr. 70-75 kDa) Mab AV20 reconhecer determinante monomórfico sobre os antígenos de células B de galinhas puras.
- Utilização do rato anti-CD45 de galinha, Ig isotipo IgM1 κ específico para células de galinha timo linhagem (Mr 190-215-kDa variante).
- Use o mouse anti-galinha TCRγδ + (Mr 90 kDa-heterodímero) Mab específico para dependentes de células do timo CD8a + T.
- Use o mouse anti-galinha Mab CD-8 específico para a cadeia de frango α (Mr 34 kDa) reconhecer the CD8 células em timócitos, baço, coração e outros tecidos.
- Use KuL01 de ratinho anti-galinha para reconhecer exclusivamente monócitos / macrófagos do sistema fagócito.
- Lava-se a lâmina três vezes com PBS 0,1 M, pH 7,4, 5 min de cada incubação depois com anticorpo anti-fenótipo específico durante 90 min numa câmara húmida.
- Montar a lâmina com glicerina tamponada para exame sob um microscópio de luz fluorescente com filtro de emissão de comprimentos de onda 567 e 502 nm, respectivamente, para detectar vermelho e verde células de fluorescência-rotulados (Figura 4).
11. Análise de Dados
- Use o banco de dados de genoma da galinha ( http://www.ncbi.nlm.nih.gov/genome/seq/BlastGen/BlastGen.cgi?taxid=9031 ) para análise de sequências blastn.
- Use alinhamentos ClustalW para determinar e valor pontuações.
- Empregar o GIRI algoritmo mascaramento repetição CENSOR ( http://girinst.org/censor/index.php ) para a localização de diferentes classes de repetições em seqüências quiméricas.
- Empregar a Inclusão e Exclusão de parasitas cinetoplastidas Ferramenta de Busca de seqüência (KISS) para identificar potenciais gRNAs nas seqüências de kDNA, com a ajuda de WU-blastn modificação de matriz 3.
- Use T. seqüências cruzi http://www.biomedcentral.com/content/supplementary/1471-~~HEAD=NNS 2164-8-133-s1.fas para pesquisar em gRNAs nas quimeras kDNA-host DNA. 11,6 t) Estudante Uso e os testes Kolmorov-Smirnov, respectivamente, para detectar diferenças significativas entre os desvios de eixos elétricos e entre os índices de coração / peso corporal obtidos nos grupos experimental e controle, e detectar as taxas de mortalidade diferenças significativas entre os grupos de frangos nascidos a partir de T. cruzi inoculated ovos e de controlos.
12. Os resultados representativos
A inoculação de 100 T. virulenta tripomastigotas cruzi para a câmara de ar de ovos de galinha férteis não reduz significativamente os rácios de pintos nascidos vivos. Cerca de 60% eclodem pintos saudáveis e 40% podem sofrer liquefação embrião ou morte do embrião na incubação. Os pintos sobreviventes reter a sequência minicírculo kDNA integrado no genoma. No entanto, espera-se que alguns pintos morrerão com cardiomegalia e insuficiência nas semanas após a eclosão. Os filhotes restantes vai crescer para adultos aparentemente saudáveis. Em todas as fases da vida do ADN extraído de células mononucleares de sangue suas irá produzir a amplificação por PCR de kDNA, mas não nDNA. O alvo prime-TAIL-PCR 3, 4 produtos que são clonados ea sequência mostrará o kDNA minicírculos integrados principalmente nas regiões codificadoras de macrocromossomos 1 a 5. As galinhas mostrando kDNA múltipla integrations em genes que codificam para o crescimento e diferenciação celular, os factores de regulação do sistema imune, e reparação de ADN são candidatos a sofrer rejeição de tecidos-alvo auto (Figura 3). Por exemplo, o frango mostrando mutação kDNA com ruptura do gene da distrofina (Figura 5), que codifica uma proteína que se liga o citoesqueleto para a membrana celular, é um candidato para desenvolver cardiomiopatia inflamatória auto-imune e fracasso.
Essas modificações genômicas não são vistos em pintos nascidos de ovos infectados Lb. Existem diferenças entre T. cruzi e Lb kDNA minicírculos; O T. cruzi k DNA minicírculo média 1,4 kb estrutura com quatro região variável (VR) intercaladas por regiões conservadas (CR) cada uma apresentando CSB1 e CSB2, e CSB3 regiões, em que CA-DNA rico dobrada são considerados locais específicos para a iniciação da replicação, transcrição, recombinação, e para a transferência de DNA laterais 3, 4. Em contraste, o Lb kDNA minicírculo (tamanho médio 820 pb) contém CR único seguido pelo VR. CR conservou CSB1 (GGGCGT) e CSB2 (CCCCGTTC) blocos, que são diferentes das do T. cruzi minicírculos 15, 16 e 17. Considerando-se que Lb CSB3 (GGGGTTGGTGTA) mostra homologia 12 nts ao T. cruzi, é concebível que tanto o Lb kDNA minicírculo integra em uma frequência muito baixa, o que pode não ser visível através das técnicas utilizadas, ou que pode, possivelmente, não integrar no genoma de galinha em tudo.
| Cartilha | DNA alvo | Seqüência | Tm * |
| S 34 | T. cruzi kDNA | 5 'ACA ACC CCA CCA ATC GAA CC 3' | 57,9 |
| S 67 | T.cruzi kDNA | 5 'TTT GGT GGG AGG GG (G / C) (G / C) (T / G) TC 3' | 60,1 |
| S 35 | T. cruzi kDNA | 5 'ATG TAC GGG ATA (T / G) GA GAT GC 3' | 59,4 |
| S 36 | T. cruzi kDNA | 5 'GGT TCG ATT GGG GTT GGT G 3' | 57,9 |
| Lb3 | Lb kDNA | 5 'GGG GTT GGT GTA ATA TAG TGG G 3' | 55,9 |
| Lb5 | Lb kDNA | 5 'ATT CTA GAG GTG CAC GGG G 3' | 61,4 |
| 1 Gg | Gallus gallus | 5 'AGC TCC TGA TAA CAG AGG AGC 3' | 60,1 |
| Gg2 | G. gallus | 5 'TGC CTC CTG AGCTTT GAA A 3 ' | 56,8 |
| Gg3 | G. gallus | 5 'TTT CAA AGC GGC AGA TCG G 3' | 60,1 |
| Gg4 | G. gallus | 3 'GCT CTG CCT TTA GCT GGA TCA 5' | 64,2 |
| Gg5 | G. gallus | 3 'AGC AAC TCA ACC GCG TCC TT 5' | 62,3 |
| Gg6 | G. gallus | 3 'CTG TTA GCA TGA GGC TTC ACA A 5' | 60,4 |
Primes Tabela 1. Usado nas amplificações da PCR. * Tm = temperatura média de recozimento ° C.
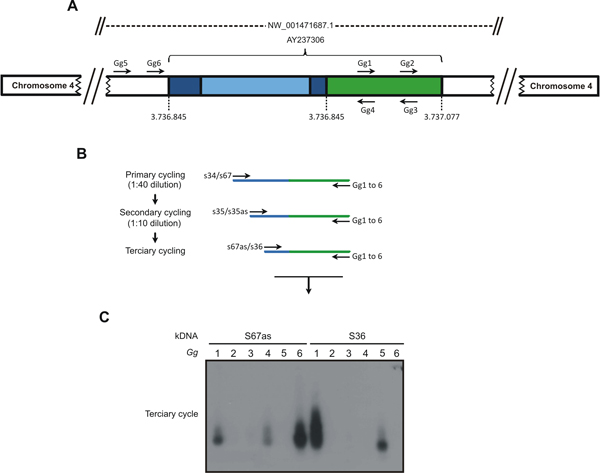
Figura 1. A estratégia tp TAIL-PCR utilizados para detectar Trypanosoma cruzi integração kDNA no genoma Gallus gallus. A) Uma sequência quimérica com um fragmento de kDNA minicírculos conservadas (azul escuro) e variável (luz azul) regiões integrados no locus NW_001471687.1 no cromossomo 4 (AY237306) do genoma de galinha 10 (verde) foi usado para obter o hospedeiro conjuntos específicos de primer (GG1 para Gg6). B) Os tp TAIL-PCR amplificações foram iniciadas (ciclo primário) por recozimento dos minicírculo específicos S34 S67 ou iniciadores, em combinação com a galinha específicos para GG1 Gg6 iniciadores. Produtos diluídos modelo fornecido para o ciclo secundário com o S35 (sentido / anti-sentido) iniciadores e as combinações de primers Gg. No ciclo terciário uma diluição dos produtos secundários foi submetido a amplificação com kDNA S36 S67 ou iniciadores anti-sentido em combinação com o iniciador Ggs. C) Estes produtos de amplificação foram separados em géis de agarose a 1% e transferido para membrana de nylon, hibridado com a sonda de kDNA específico. As amostras que evidenciem sinais positivos foram usados para a clonagem para determinar o ponto de integração. As combinações de kDNA e orientadas para gg1 Gg6 são mostrados no topo do gel. As reações seqüenciais de PCR amplificado sequências alvo kDNA-host de DNA com kDNA minicírculos (azul) ea seqüência aviária (verde). (Reproduzido da PLoS Neglected Tropical Diseases 3).

Figura 2. As manifestações clínicas da função cardíaca comprometida em uma galinha 9 meses de idade geneticamente modificado pela integração do kDNA mitocondrial minicírculos a partir de T. cruzi. A oxigenação do sangue do frango kDNA mitocondrial mutante mostrando alguns contrastes pente roxo com o pente vermelho brilhante do controle de 9 meses de idade Chicken isentos de ataques de coração. (Modificado de PLoS Neglected Tropical Diseases 3).
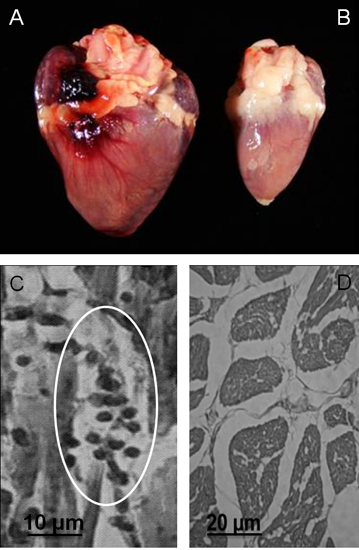
Figura 3. Macroscópica e microscópica patologia em Gallus gallus com mutações de kDNA. A) Cardiomegalia em uma galinha de 9 meses de idade que morreu de insuficiência cardíaca. B) Controle coração de uma galinha de 9 meses de idade, não infectados. C) Rejeição de células cardíacas alvo por linfócitos citotóxicos: Uma unidade de rejeição mínima com lise das células alvo por linfócitos imunes está representado (círculo). D) Controle coração histologia (Modificado de PLoS Neglected Tropical Diseases 3).
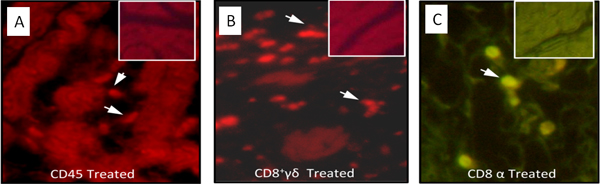
Figura 4. Análises imunocitoquímicos das células do sistema imunológico que infiltram o coração de kDNA-mutado galinha mostrado na Figura 3. A) linfócitos CD45 + identificadas (setas) no coração lesições por um ficoeritrina-rotulado anticorpo monoclonal específico. B) CD8 + γδ linfócitos imunes (setas) envolvidas na destruição grave do coração. C) abundantes CD8a + células T presentes em lesões graves com lise de células cardíacas. As inserções mostram a ausência de células do sistema imune, no coração de galinha controle não infectados (Modificado de PLoS Neglected Tropical Diseases 3).

Figura 5. Chagas, como cardiomiopatia dilatada inflamatória em uma progênie F2 com kDNA integração no gene da distrofina. A) coração dilatada em uma galinha de 10 meses de idade, ocupando a maior parte da cavidade torácica (o peso do coração = 16 g). B) escuros redondos mononucleares infiltra e destrói células do miocárdio da galinha kDNA-mutante. C) o tamanho do coração normal (peso 7 g) de uma galinha de controle de 10 meses de idade. D) histologia normal de um coração de galinha de controlo. (Modificado de PLoS Neglected TropicalDoenças al 3).
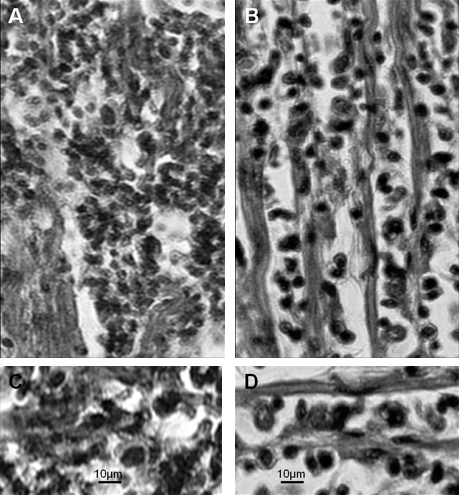
Figura 6. Comparativo patologia em kDNA-mutado de galinha e na doença de Chagas humana. A) miocardite grave e lise de células alvo do coração no frango kDNA-mutante. B) miocardite grave e lise da célula alvo por linfócitos do sistema imunológico em um caso de cardiopatia chagásica. C) Rejeição de células do coração por linfócitos imunes no frango kDNA-mutado. D) A rejeição das células do coração por linfócitos do sistema imunológico na doença de Chagas humana. Coradas por Hematoxilina e Eosina. (Modificado de Memórias do Instituto Oswaldo Cruz, Rio de Janeiro 14).
Discussão
In contrast to mammals susceptible to life-long T. cruzi infections, chickens are refractory to T. cruzi infection. The major advantage of the chicken model system is the elimination of the infection early in the development of the embryonic immune system. Thus, the only parasite DNA remaining within the chicken body is integrated at several loci.
Use of the optimal quantity of virulent T. cruzi trypomastigotes to inoculate fertile egg is the critical step towards obtaining integration of the kDNA minicircles into the chicken embryo genome. The rate of live chicks hatching from eggs inoculated with 100 trypomastigotes is four-fold higher than that obtained with 500 parasites. Care should be taken to inoculate the parasites suspension in 10 μL of culture medium into the egg air chamber. There should be no leakage of egg white. Under optimal conditions, the intracellular parasitic infection takes place within a few hours after incubation and parasite multiplication inside the host cells proceeds for one week; thereafter the infection is eliminated by the innate immunity. The kDNA integration requires a living infection, and the inoculation of naked minicircles into early embryo chicken eggs does not result in integration. The kDNA-positive embryos and controls should be housed under controlled conditions at 37.5 °C and 65% humidity. The chicks are kept in cages for two weeks at 33 °C room temperature. Thereafter the chickens are kept in cages on suspended racks separated by 1.5 meter width aisles in a room at 22 °C with filtered air and positive pressure under constant exhaustion to secure animal welfare conditions. The adults are fed chicken-chow and drink potable running water to achieve full growth and maturity, laying eggs at five months of age. Maintenance of hygienic procedures are essential for reproducibility of results when working with T. cruzi inoculated into fertile chicken eggs.
In the chicken model system the T. cruzi infections are eradicated after development of the immune system in the early period of embryo growth. Additionally to being infection-free, the chicks that hatch from T. cruzi inoculated eggs, in lack of specific antibodies, are tolerant to the parasite antigens. The rejection of the target heart cells by cytotoxic lymphocytes (minimal rejection unit, Figure 3) is seen in the kDNA-mutated chickens showing genotype modifications and breakdown of immunological surveillance 3. The genotypically modified T-cells present accelerated rejection of self tissues in the body. The main lesion site is the heart, which is a hallmark of Chagas disease. The passage from a physiologic (surveillance) to a physiopathologic state is seen in the kDNA-mutated chicken showing clonally proliferation of cytotoxic lymphocytes 3.
This transkingdom model system shows a parasite-induced, genetically-driven autoimmune disease (Figure 6), stemming from genome modifications by the T. cruzi kDNA minicircle integrations. These modifications are not seen in chicks hatched from Lb-inoculated eggs.
This phenomenon suggests that experimental treatment of the inflammatory autoimmune cardiomyopathy in kDNA-mutated chickens may require drug suppression of bone marrow progenitor of specific T-cell phenotype infiltrating the myocardium, and transplantation of histocompatible healthy bone marrow to prevent the rejection of self-tissue.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Somos gratos a Nancy R. Sturm, Departamento de Imunologia, Microbiologia e Biologia Molecular, David Geffen School of Medicine, Universidade da Califórnia em Los Angeles, para a leitura crítica do manuscrito. O Conselho Nacional de Pesquisa-CNPq, ea Fundação para o Desenvolvimento da Pesquisa-FAPDF, Brasil, apoiou o estudo. Agradecemos a ajuda técnica de Alessandro O. Souza, C. Maria Guimaro, Cordeiro Ciro, de Ana Cassia Rosa, Roseneide Alves e Rafael Andrade, da Universidade de Brasília, Brasil.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Taq DNA polimerase recombinante | Invitrogen | 11615-010 | |
| Platinum Taq DNA polimerase | Invitrogen | 10966-030 | |
| Aleatória Primers DNA Labeling Sistema | Invitrogen | 18187-013 | |
| Eco RI | Invitrogen | 15202-021 | |
| Mbo I | Invitrogen | 15248-016 | |
| dNTP Set, 100mM Solutions | GE Healthcare | 28-4065-51 | |
| Amersham Hybond - N + - Cat n. | GE Healthcare | RPN303B | |
| PlasmidPrep Mini spin kit | GE Healthcare | 28-9042-70 | |
| Nsi I | Sigma-Aldrich | R5884 1KU | |
| DNA, de sódio de esperma de peixe Sal | Amresco | 0644-10G | |
| De ratinho anti-galinha Bu-1b | SouthernBiotech | 8370-02 | |
| De ratinho anti-CD45 de galinha | SouthernBiotech | 8270-08 | |
| Rato anti-galinha TCRγδ | SouthernBiotech | 8230-08 | |
| De ratinho anti-CD8a galinha | SouthernBiotech | 9220-02 | |
| Rato monócitos anti-galinha / macrófagos | SouthernBiotech | 8420-02 | |
| MyCycle Termocycler | Bio-Rad Laboratories | 580BR 5501 |
Referências
- Teixeira, A. R. Pathogenesis of chagas' disease: parasite persistence and autoimmunity. CMR. 24, 592-630 (2011).
- Teixeira, A. R. Chagas disease. Postg. Med. J. 82, 788-798 (2006).
- Teixeira, A. R. Trypanosoma cruzi in the chicken model: Chagas-like heart disease in the absence of parasitism. PLoS Negl. Trop. Dis. 5, e1000 (2011).
- Hecht, M. M. Inheritance of DNA transferred from American trypanosomes to human hosts. PLoS One. 5, e9181 (2010).
- Xing, Z. Roles of the ERK MAPK in the regulation of proinflammatory and apoptotic responses in chicken macrophages infected with H9N2 avian influenza virus. J. Gen. Virol. 91, 343-351 (2010).
- Kim, H. B. NIK and IKKbeta interdependence in NF-kappaB signalling--flux analysis of regulation through metabolites. Biosystems. 99, 140-149 (2010).
- Karakhanova, S. ERK/p38 MAP-kinases and PI3K are involved in the differential regulation of B7-H1 expression in DC subsets. Eur. J. Immunol. 40, 254-266 (2010).
- Finsterer, J. The heart in human dystrophinopathies. Cardiology. 99, 1-19 (2003).
- Nitz, N. Heritable integration of kDNA minicircle sequences from Trypanosoma cruzi into the avian genome: insights into human Chagas disease. Cell. 118, 175-186 (2004).
- Simpson, L. Kinetoplast DNA in trypanosomid flagellates. Int. Rev. Cytol. 99, 1-19 (1986).
- Bonney, K. M. Heat-killed Trypanosoma cruzi induces acute cardiac damage and polyantigenic autoimmunity. PLoS One. 6, e14571 (2011).
- Moser, D. R. Detection of Trypanosoma cruzi by DNA amplification using the polymerase chain reaction. J. Clin. Microbiol. 27, 1477-1482 (1989).
- Sturm, N. R. Sensitive detection and schizodeme classification of Trypanosoma cruzi cells by amplification of kinetoplast minicircle DNA sequences: use in diagnosis of Chagas' disease. Mol. Biochem. Parasitol. 33, 205-214 (1989).
- Teixeira, A. R. Evolution and pathology in chagas disease--a review. Mem. Inst. Oswaldo Cruz. 101, 463-491 (2006).
- Yurchenko, V. Y. Structure of Leishmania minicircle kinetoplast DNA classes. J. Clin. Microbiol. 37, 1656-1657 (1999).
- Simpson, L. The genomic organization of guide RNA genes in kinetoplastid protozoa: several conundrums and their solutions. Mol. Biochem. Parasitol. 86, 133-141 (1997).
- Thomas, S. A non-universal transcription factor? The Leishmania tarentolae TATA box-binding protein LtTBP associates with a subset of promoters. Int J. Parasitol. 36, 1217-1226 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados