Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microscopía Multiphoton de cerebro de ratón Borrado Expresando YFP
En este artículo
Resumen
Microscopía multifotónica de órganos enteros de ratón es posible por ópticamente despejar el órgano antes de formación de imágenes, pero no todos los protocolos de preservar la señal fluorescente de proteínas fluorescentes. El uso de un método de compensación óptica con base de etanol y alcohol bencílico deshidratación: bencil benzoato de compensación, se muestran imágenes de alta resolución multifotónica de cerebro de ratón que expresa toda YFP.
Resumen
Microscopía multifotónica de generación armónica fluorescencia intrínseca y segundo (SHG) de órganos enteros de ratón se hace posible por ópticamente despejar el órgano antes de formación de imágenes. 1,2 Sin embargo, para los órganos que contienen las proteínas fluorescentes como GFP y YFP, protocolos ópticos de compensación que utilizan metanol deshidratación y clara usando bencil alcohol: benzoato de bencilo (BABB), mientras que no protegido de la luz 3 no preservan la señal fluorescente. El protocolo presentado aquí es una forma novedosa en la que realizar todo el órgano de compensación óptica en cerebro de ratón preservando al mismo tiempo la señal de fluorescencia de YFP expresan en las neuronas. Alterar el protocolo de intercambio de información óptica de tal manera que el órgano se deshidrata mediante una serie de etanol se ha encontrado para reducir el daño a las proteínas fluorescentes y preservar su señal fluorescente para formación de imágenes multifotónica. 4 Usando un método optimizado de compensación óptica con base de etanol y deshidratación cobro por parte BABBmientras protegida de la luz, se muestran imágenes de alta resolución multifotónica de proteína amarilla fluorescente (YFP) de expresión en las neuronas del cerebro de un ratón de más de 2 mm por debajo de la superficie del tejido.
Protocolo
1. Animal perfusión 5 y Compensación Total de cerebro de ratón
- La longitud total del procedimiento pueden variar dependiendo de la duración de tiempo utilizado por cada etapa de deshidratación, pero en total todo el proceso puede llevarse a cabo en dos días.
- Pesar ratones YFP y luego profundamente anestesiar con una inyección intraperitoneal de ketamina / xilazina (100 mg / kg: 10 mg / kg).
- Confirmar un plano quirúrgico de anestesia profunda antes de proceder a la cirugía. Entrada del animal cada 5 min para ver si reacciona a un dedo del pie firme o de pinzamiento del rabo. Si el animal reacciona, una dosis suplementaria (1/3 de la dosis original) de ketamina / xilazina se requiere.
- Una vez anestesiados profundamente, restringir el ratón por adhiriendo cada extremidad a un lecho quirúrgico usando una cinta de laboratorio a fin de que el ratón está en una posición supina (recumbancy dorsal), exponiendo su pecho para la cirugía. El lecho quirúrgico se hace generalmente de un metal o malla de plástico y se coloca en un fregadero o en la parte superior de un labio-pan de manera que la sangre y el fijadorresiduos pueden ser fácilmente recogidos.
- Para empezar, haga una incisión debajo de la apófisis xifoides. Corte a lo largo de la base de la caja torácica con unas tijeras y pinzas y tire hacia atrás la piel como se hace el corte. Haga dos cortes a lo largo de cada lado del esternón ratón (a través de las costillas) para crear un colgajo de tejido que se mantiene lejos de la cavidad torácica con una pinza hemostática para dejar expuesto el corazón.
- Insertar una aguja de 23 g en el ventrículo izquierdo del corazón y hacer una pequeña incisión en la pared muscular de la aurícula derecha para permitir que la sangre se escape. Por favor, consulte el artículo Jove 2497 de un vídeo de este procedimiento. 5
- Inmediatamente después de la aurícula derecha se corta, iniciar una perfusión con 4 ° C salina tamponada con fosfato, PBS, (pH 7,2) hasta que la sangre ya no se observa que sale de la aurícula derecha del corazón (30 - 40 ml a una velocidad de aproximadamente 5 ml / min).
- Una vez que toda la sangre ha sido drenado (fluido que sale de la aurícula derecha es clara), cambia el medio de perfusión a un 4% refrigeradosPFA solución. Perfuse hasta cuerpo del ratón se vuelve notablemente rígida y fría al tacto (aprox. 30 - 40 ml a una velocidad de aproximadamente 5 ml / min). (Concentrado 16% PFA solución se diluye según las instrucciones del fabricante y se añade NaOH hasta pH 7,2 se alcanza. Use guantes y bata de laboratorio y manipular y mezclar sustancias químicas dentro de una campana de extracción).
- Después de la perfusión, quitar el ratón desde el lecho quirúrgico y decapitar a comenzar la escisión del cerebro.
- Con unas pinzas y tijeras iris, retire el cráneo en pequeñas secciones a partir de la parte posterior del cráneo y seguir adelante. Hacer pequeños cortes cada 2 a 4 mm con las tijeras de todo el cráneo durante el uso de los fórceps para tirar cuidadosamente el hueso fuera del cerebro en pequeñas secciones. Hacer esto hasta que toda la superficie superior del cerebro está expuesto.
- Impuestos Especiales del cerebro del cráneo siguiendo una de 5 mm de ancho, espátula plana y coloque en un frasco de vidrio. Sumergir en PFA al 4% durante 6 horas a 4 ° C para posterior a la fijación.
- Después mensajefijación, lavar el cerebro dos veces en PBS temperatura ambiente mediante el vertido de la PFA de la ampolla de vidrio y reemplazándolo con PBS. Agitar el cerebro en solución de PBS antes de verter hacia fuera y sustituir con PBS para un segundo lavado.
- Deshidratar el cerebro a temperatura ambiente por una serie graduada de etanol incubaciones (una vez en 50%, 70%, 95%, y% dos veces en 100) a 2 hr por incubación, y luego 12 h de incubación para el etanol segundo 100%, a extraer el agua del tejido fijado. Para cada incubación, verter la solución de etanol anterior desde el vial de vidrio y reemplazarla con la solución posterior hasta que el cerebro está completamente sumergida.
- Después de la segunda incubación en 100% de etanol, se vierte la solución y sustituir con partes iguales de etanol y la solución de limpieza que contiene alcohol bencílico y benzoato de bencilo (1:2 vol: vol relación). Después de 2 horas de incubación, se decanta la solución y reemplazar con una solución 100% de alcohol bencílico y benzoato de bencilo (1:2 vol: vol relación). El REFRActive índice de la solución de limpieza es n = 1,54.
- Una vez en Babb, el cerebro se vuelven notablemente transparente, dentro de 4 - 5 horas. Para mejores resultados de compensación, dejar el cerebro para borrar durante 6 días a temperatura ambiente mientras se protegieron de la luz brillante.
2. Microscopio de configuración
- Una vez que el cerebro se borra y listo para la formación de imágenes, fijarlo a la parte inferior de una placa de Petri utilizando cianoacrilato. Permitir que se seque el adhesivo antes de proceder.
- Después de secar, se sumergen en el cerebro BABB y colocar la placa de Petri bajo el objetivo del microscopio para la formación de imágenes.
- Nosotros usamos un microscopio multifotónica que incorpora un Mai Tai titanio zafiro láser ajustable entre 710-990 nm de longitud de onda nm de excitación. La longitud de onda de excitación se utiliza para generar señales de YFP es de 886 nm. Potencia del láser varía de 30 - 100 MW dependiendo de la profundidad de imagen.
- Capturar la señal reflejada fluorescente usando un objetivo Nikon 5X (NA, 0,5) que permite grancampo de visión de imágenes (2 x 2 mm).
- Se filtra la señal reflejada fluorescente utilizando un filtro de 535/50 de paso de banda y recoger usando un PMT GaAsP (H7422PA-40, Hamamatsu, Bridgewater, New Jersey).
- Procesar imágenes utilizando el software ScanImage 6 a una resolución de 2048 x 2048 píxeles con una velocidad de barrido de 2 ms por línea para generar alta resolución, imágenes de YFP.
- Una vez que la imagen es completa, retire el cerebro de la placa de Petri con unas pinzas y guardar en BABB protegidos de la luz para obtener imágenes de futuro. Para las muestras pegadas, eliminar el tejido mediante la ejecución de una hoja de afeitar entre el pegamento y la placa de Petri en un ángulo no mayor de 30 grados. Hemos almacenado las muestras en BABB por hasta 1 año sin deterioro visible.
3. Los resultados representativos
Las imágenes representativas y videos mostrados aquí demuestran la alta resolución multifotónica capacidad de imagen posible gracias compensación óptica. Imágenes cerebrales completa permitepara YFP-etiquetados neuronas en las diferentes capas de la corteza y el hipocampo que sea claramente visible a una profundidad de 2 mm por debajo de la superficie del tejido. Figura 1 muestra una imagen representativa de una vista coronal correspondiente a las características anatómicas del hipocampo a 2,92 mm caudal a bregma 7. La profundidad de la formación de imágenes en la muestra fue de 1,94 mm. Parte de esta diferencia se debe a la eliminación del cerebelo en el extremo caudal del cerebro y el resto era debido a la contracción del proceso de deshidratación. Otra imagen de la pila muestra la capa V / VI neuronas piramidales de la neocorteza expresar YFP 2 mm por debajo de la superficie del tejido (Figura 2). Todas las imágenes fueron adquiridas utilizando el objetivo Nikon 5X y amplificación se realizó utilizando la función de zoom digital para adquisición de imágenes en software ScanImage.
Al hacer zoom sobre la neocorteza, los axones de neuronas individuales y organismos celulares de las neuronas piramidales de la capa V de la corteza cerebral son clarosLy distinguible de hasta 1,02 mm por debajo de la superficie del tejido (Figura 3). Uso de la pila de imágenes de la Figura 3, una reconstrucción en 3D de la región neurona se realizó utilizando el software ImageJ 8 (Figura 4).
La capacidad de alta resolución de MPM también nos permite presentar imágenes de las neuronas enteras e individuales. Aquí se muestra una reconstrucción de una neurona piramidal capa V de la corteza cerebral en la que los procesos individuales dendríticas son claramente visibles (Figura 5).

Figura 1 Imagen representativa de una pila de imágenes 1,2 mm (0,8 - 2 mm por debajo de la superficie del tejido). De cerebro de ratón que muestra toda neocórtex y las diferentes capas del hipocampo. Características del hipocampo son visibles 1,1 mm por debajo de la superficie del tejido y se han etiquetado con el seguimientoing código:. DG = giro dentado, GrDG capa granular de la DG =, = Lmol lacunosum moleculare capa, capa molecular Mol = DG, capa = O Oriens, PoDG = polimorfo capa DG, Py = capa de células piramidales, Rad = estrato radiado 7 La imagen es de 1,8 x 1,8 mm de tamaño, barra de escala = 200 m. El extremo rostral del cerebro se fijó a una placa de Petri con el extremo caudal hacia arriba hacia el objetivo. Esto facilitó formación de imágenes en el plano coronal.
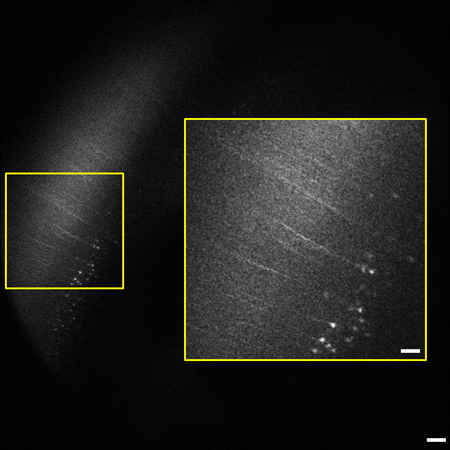
Figura 2 Marco Representante de la pila de imagen de 1,2 mm (0,8 - 2 mm por debajo de la superficie del tejido). Conjunto de cerebro de ratón destacando el neocórtex. Células piramidales y procesos que expresan YFP en la capa V / VI de la corteza son visibles 2 mm por debajo de la superficie del tejido. El grado de etiquetado es consistente con informes anteriores del etiquetado escaso en la corteza cerebral. Recuadro 9 (derecha) se amplía a partir de b oxed área a la izquierda. La imagen es 1,8 x 1,8 mm de tamaño, barra de escala = 200 m (50 micras recuadro).
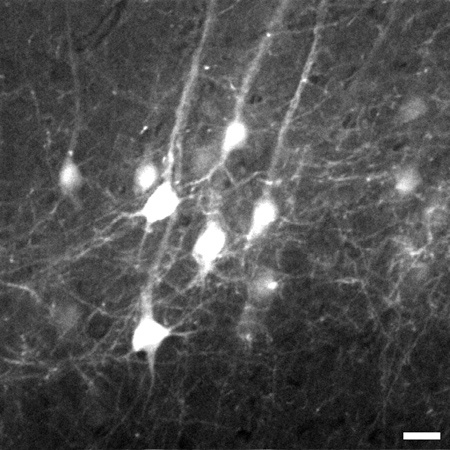
Figura 3. Marco representativas tomadas 774 micras debajo de la superficie del tejido de la pila de capa de imagen V neuronas piramidales de la corteza cerebral del cerebro. Stack va desde 700 micras a 1.020 micras por debajo de la superficie del tejido. Un 8x zoom digital se utiliza para capturar detalles como los procesos de calidad. Imagen es de 225 x 225 micras de tamaño, barra de escala = 20 micras.

Figura 4. Imagen representativa de la reconstrucción 3D (225 x 225 x 320 micras) de la pila de la imagen en la Figura 3. Imagen es de 225 x 225 micras de tamaño, barra de escala = 28 micras.
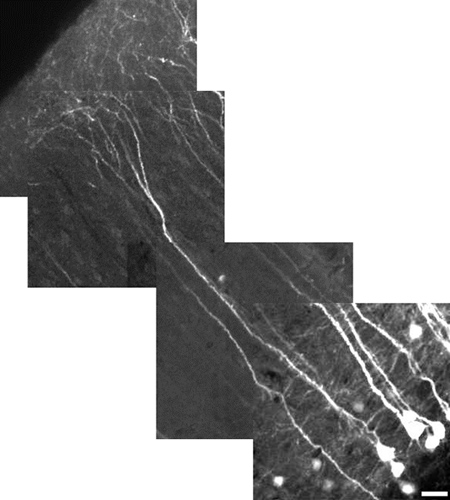
Figura 5. Alta resolución de imagen reconstruida de una neurona piramidal de la capa V de la corteza cerebral usando un zoom digital de 10X. Neurona mide 485 m de largo, barra de escala = 25 m. El campo de visión para cada mosaico de imagen es de 180 micras x 180 micras. Cada baldosa está a una profundidad diferente (z-nivel). Las dendritas apicales corticales no lo hacen, en general, YFP expreso, así como el soma. Para tener tanto en el mismo campo de visión, como se muestra aquí, la potencia se redujo para minimizar la saturación de soma, lo que hace que el proceso de dimmer buen aspecto. Nuestro énfasis aquí es en la demostración de campo de vista en lugar de los detalles finos. Para revelar los detalles más finos, utilizar un zoom digital, se centran en una región sin soma, y aumentar la potencia del láser.
Discusión
Mientras estándar colorantes orgánicos son compatibles con una amplia gama de disolventes orgánicos, y por lo tanto no suponen un reto particular para la limpieza de los protocolos, las proteínas fluorescentes a menudo son menos tolerantes a los cambios en el disolvente. 4 El objetivo del presente trabajo fue superar una limitación seria de anteriores protocolos de compensación óptica donde se perdió la fluorescencia de XFPs o gravemente degradada. Las imágenes que se presentan demuestran que la fluo...
Divulgaciones
Los experimentos con animales se realizaron de conformidad con las directrices y regulaciones establecidas por el animal de Atención Institucional de la Universidad de Yale y el empleo.
Agradecimientos
Nos gustaría dar las gracias a Jacob Solís por su ayuda en la edición de vídeo.
Este trabajo fue financiado en parte por un premio CARRERA NSF DBI-0953902 a MJ Levene.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | El número de catálogo | Comentarios |
| Phosphate Buffered Saline | Sigma-Aldrich, Inc. | D8537 | 500 ml, pH 7,2 |
| Paraformaldehído | Microscopía Electrónica de Ciencias | 15710 | 10 x 10 ml, paraformaldehído al 16% |
| Alcohol de etilo | Americana Bioanalytical | AB00515-00500 | 500 ml, 200 pruebas |
| Alcohol de etilo | Productos Pharmco, Inc. | 111000190 | 1 gal., 190 pruebas |
| Alcohol bencílico | Sigma-Aldrich, Inc. | 402834 | 500 ml, 99 +% |
| Benzoato de bencilo | Sigma-Aldrich, Inc. | B6630-IL | 500 ml, ≥ 99% |
| 5X/0.5 NA objetivo | Nikon | AZ Harina Plan de 5X | 15 WD |
Referencias
- Parra, S. G., Chia, T. H., Zinter, J. P., Levene, M. J. Multiphoton microscopy of cleared mouse organs. J. Biomed. Opt. 15, 036017 (2010).
- Vesuna, S., Torres, R., Levene, M. J. Multiphoton fluorescence, second harmonic generation, and fluorescence lifetime imaging of whole cleared mouse organs. J. Biomed. Opt. 16, 106009 (2011).
- Zucker, R. M. Whole insect and mammalian embryo imaging with confocal microscopy: Morphology and apoptosis. Cytometry. A69, 1143-1152 (2006).
- Sakhalkar, H. S. Functional imaging in bulk tissue specimens using optical emission tomography: Fluorescence preservation during optical clearing. Phys. Med. Biol. 52, 2035-2054 (2007).
- Dazai, J., Spring, S., Cahill, L. S., Henkelman, R. M. Multiple-mouse Neuroanatomical Magnetic Resonance Imaging. J. Vis. Exp. (48), e2497 (2011).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed. Eng. Online. 2, (2003).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M., Nerbonne, J. M., Lichtman, J. W., Sanes, J. R. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28, 41-51 (2000).
- Hama, H. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neuro. 14, 1481-1488 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados