Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Многофотонной микроскопии Сбрасывается мозга мыши выражая YFP
В этой статье
Резюме
Многофотонной микроскопии целые органы мыши можно оптически очистка органа перед изображениями, но не все протоколы сохранить флуоресцентного сигнала флуоресцентных белков. Использование оптического метода очистки этанола на основе обезвоживания и бензиловый спирт: бензилбензоат очистки, мы показываем высоким разрешением изображения многофотонной весь мозг мыши выражения YFP.
Аннотация
Многофотонной микроскопии собственной флуоресценции и генерации второй гармоники (SHG) целых органов мышей стало возможным благодаря оптическим очистка органа перед изображениями. 1,2 Однако, для органов, которые содержат флуоресцентные белки, такие как GFP и YFP, оптический протоколы очистки, которые используют метанол обезвоживания и ясно использованием бензилового спирта: бензил бензоат (Babb), а незащищенные от светло-3 не сохранить флуоресцентного сигнала. Протокол, представленные здесь, новый способ, в котором для выполнения целого органа оптического просветления на мозг мыши, сохраняя при этом сигнал флуоресценции от YFP выражается в нейронах. Изменение оптических протокол очистки, что орган обезвоживается использования этанола градуированных серии была найдена, чтобы уменьшить ущерб для флуоресцентных белков и сохранения их флуоресцентный сигнал для работы с изображениями многофотонная. 4 Использование оптимизированного метода оптической очистке этанола на основе обезвоживания и очистка от Babbв то время как защищено от света, мы показываем высокое разрешение изображения многофотонной желтый флуоресцентный белок (YFP) выражение в нейронах мозга мышей более чем на 2 мм ниже поверхности ткани.
протокол
1. Животное Perfusion 5 и всего посредничества мозга мыши
- По всей длине процедура может меняться в зависимости от времени использовались в обезвоживании шаг, но в целом весь процесс может быть проведен в течение двух дней.
- Взвешивание YFP мышей, а затем глубокую анестезию с внутрибрюшинного введения кетамина / ксилазина (100 мг / кг, 10 мг / кг).
- Подтвердите хирургического плоскости глубокий наркоз, прежде чем приступить к операции. Проверьте животное каждые 5 минут, чтобы увидеть, если он реагирует на ноги фирму или хвост шнура. Если животное реагирует, дополнительных доз (1/3 от первоначальной дозы) кетамина / ксилазина не требуется.
- Как только глубоко под наркозом, сдерживать мыши, придерживаясь каждой конечности к хирургическому слоем с использованием лаборатории ленту так, что мышь находится в положении лежа на спине (спинной recumbancy), подвергая свою грудь на операцию. Хирургические кровати, как правило, изготовлены из металлической или пластиковой сетки и помещают в раковину или на верхней губы-пан, так что кровь и фиксаторыотходы могут быть легко собрана.
- Для начала, сделайте разрез ниже xyphoid процесса. Разрежьте вдоль основания грудной клетки с помощью ножниц и пинцета и потяните кожу, как надрез. Сделайте два разрезами по бокам мыши грудины (через ребра), чтобы создать лоскут ткани, который проходит от грудной полости помощи кровоостанавливающего, чтобы оставить сердце подвергается.
- Вставьте 23 г иглу в левый желудочек сердца и сделать небольшой разрез в мышцах стенки правого предсердия, чтобы позволить крови к бегству. Пожалуйста, обратитесь к Юпитеру статью 2497 для видео этой процедуры 5.
- Сразу же после правого предсердия режется, начинают перфузии 4 ° C фосфатным буферным раствором, PBS (рН 7,2), пока кровь не наблюдается слив из правого предсердия сердца (30 - 40 мл в размере около 5 мл / мин).
- После того как все кровь слита (жидкость выхода из правого предсердия понятно), переключиться перфузии среды в охлажденном 4%PFA решение. Заливать, пока тело мыши становится заметно жесткой и холодной на ощупь (около 30 - 40 мл в размере около 5 мл / мин). (Концентрированный 16% PFA раствор разбавляют в соответствии с инструкцией завода-изготовителя и NaOH добавляют до рН 7,2 достигнут. Надевайте перчатки и лабораторный халат и обрабатывать и смешивать химические вещества внутри вытяжного шкафа).
- После перфузии, удалите мышь от хирургической кровати и обезглавить, чтобы начать удаление мозга.
- Используя щипцы и ножницы ирис, удалить черепа в небольших участков, начиная с задней части черепа и двигаться вперед. Сделать небольшие разрезы через каждые 2 - 4 мм с ножницами через череп, используя щипцы, чтобы осторожно потяните кость от мозга в небольших участков. Сделайте это, пока вся верхняя поверхность мозга подвергается.
- Акцизный мозг от черепа, используя 5 мм ширины, плоские шпателем и помещают в стеклянную пробирку. Погрузитесь в 4% PFA в течение 6 часов при температуре 4 ° C на пост фиксации.
- После сообщениюфиксации, мыть мозг в два раза при комнатной температуре PBS при заливке PFA из стеклянных флаконов и заменить его PBS. Swirl мозга в PBS решение перед заливкой и замены с PBS для второго мытья.
- Высушить мозга при комнатной температуре серии градуированных этанола инкубации (один раз в 50%, 70%, 95%, и дважды в 100%) на 2 ч на инкубацию, а затем 12 ч для второго 100% этанола инкубации, чтобы извлечь воду из фиксированных тканей. Для каждой инкубации, вылить предыдущее решение этанола из стеклянных флаконов и заменить его последующее решение, пока мозг полностью погружен в воду.
- После второй инкубации в 100% этанола, вылить раствор и заменить равных частей этилового спирта и информационно раствор, содержащий бензиловый спирт и бензил бензоат (1:2 Объем: т. отношение). Через 2 ч инкубации, переливать это решение и заменить со 100%-ным раствором бензилового спирта и бензилбензоат (1:2 Объем: т. отношение). Refractive индекс очистки решение п = 1,54.
- После того как в Babb, мозг станет заметно прозрачным, в течение 4 - 5 часов. Для достижения наилучших результатов очистки, оставьте мозг, чтобы очистить в течение 6 дней при комнатной температуре защищены от яркого света.
2. Микроскоп установки
- Как только мозг очищается и готов для работы с изображениями, наклеить ее на дно чашки Петри использованием цианоакрилата. Дайте клею высохнуть, прежде чем продолжить.
- После сушки, погрузить мозг в Babb и поместить чашку Петри под микроскопом цель для работы с изображениями.
- Мы используем многофотонного микроскопа, который включает Mai Tai титан сапфирового лазера регулируется в пределах от 710 нм до 990 нм, длина волны возбуждения. Длины волны возбуждения мы используем для создания YFP сигналы составляют 886 нм. Мощность лазера колеблется от 30 - 100 мВт в зависимости от глубины визуализации.
- Захват отраженный флуоресцентного сигнала с помощью Nikon 5X цели (NA, 0,5), что позволяет при большихполя-обзора изображения (2 х 2 мм).
- Фильтр отраженный флуоресцентного сигнала с использованием 535/50 полосовой фильтр и собрать его с помощью GaAsP PMT (H7422PA-40, Хамамацу, Бриджуотер, штат Нью-Джерси).
- Процесс изображений с помощью программного обеспечения ScanImage 6 при разрешении 2048 х 2048 пикселей с использованием скорости сканирования 2 мс на линию для получения высокого разрешения, YFP изображений.
- После завершения изображений, удалить мозг от чашки Петри с помощью пинцета и хранить в Babb защищены от света для будущего изображения. Для клееных образцов, удалить ткань, запустив лезвие бритвы между клеем и чашки Петри под углом не более 30 градусов. Мы хранятся образцы в Babb на срок до 1 года без видимого ухудшения.
3. Представитель Результаты
Представитель изображений и видео показано здесь демонстрируют высокое разрешение изображений многофотонной возможностей стало возможным благодаря оптического просветления. Всего изображений мозга позволяетдля YFP-меченных нейронов в различных слоях гиппокампа и коры, чтобы быть отчетливо видны на глубине 2 мм ниже поверхности ткани. рисунке 1 показано изображение представитель корональной вид, соответствующий анатомические особенности гиппокампа на 2,92 мм хвостовой брегмы 7. Глубина изображения в выборке составила 1,94 мм. Некоторые из этой разницы было связано с удалением мозжечка в каудальном конце головного мозга и баланс был из-за усадки от обезвоживания процесс. Другой образ из стека показывает слой V / VI пирамидальных нейронов неокортекса выражения YFP 2 мм ниже поверхности ткани (рис. 2). Все изображения были получены с помощью Nikon 5X объективных и увеличение было сделано с помощью функции цифрового масштабирования для получения изображения в ПО ScanImage.
По масштабирования на кору головного мозга, отдельных аксонов и тел нейронов клетки пирамидальных нейронов в слое V неокортекса ясноют различимы до 1,02 мм под поверхностью ткани (рис. 3). Использование изображений стек из рисунка 3, 3D-реконструкция региона нейрона была сделана с помощью программного обеспечения ImageJ 8 (рис. 4).
Высокой разрешающей способности MPM также позволяет нам представить образы целом, отдельных нейронов. Здесь мы показываем, реконструкция слоя V пирамидальных нейронов коры головного мозга, в которых отдельные процессы дендритных четко видны (рис. 5).

Рисунок 1 представитель изображение от 1,2 мм образа стека (0,8 - 2 мм ниже поверхности ткани). Целого мозга мыши показывает коры головного мозга и различных слоях гиппокампа. Особенности гиппокампа видны 1,1 мм ниже поверхности ткани и были помечены с использованием последующуюING код:. DG = зубчатой извилине, GrDG = зернистый слой DG, мкмоль = lacunosum moleculare слой, мол = молекулярный слой DG, OR = Oriens слой, PoDG = полиморф слой DG, Ру = пирамидальный слой клеток, Rad = слое radiatum 7 Изображение 1,8 х 1,8 мм по размеру, масштабу бар = 200 мкм. Ростральной конце мозга, проставленный на чашку Петри с хвостовым концом вверх к цели. Это способствовало изображения во фронтальной плоскости.
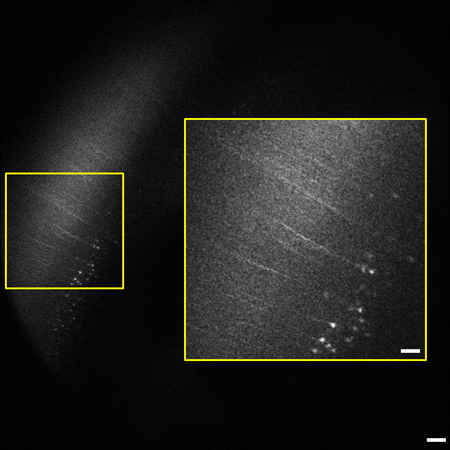
Рисунок 2 представителя кадр из 1,2 стека изображений мм (0,8 - 2 мм ниже поверхности ткани). Целого мозга мыши выделив коры головного мозга. Пирамидальных клеток и процессы, выразив YFP в слое V / VI коры видны на 2 мм ниже поверхности ткани. Степень маркировки согласуется с предыдущими сообщениями о редких маркировки в коре головного мозга. 9 Врезка (справа) увеличился с B oxed области слева. Изображение 1,8 х 1,8 мм по размеру, масштабу бар = 200 мкм (50 мкм вставка).
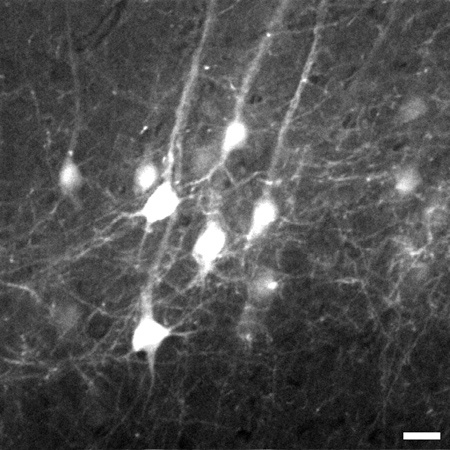
Рисунок 3. Представитель кадр принято 774 мкм под поверхностью ткани с изображения стека слоев V пирамидальных нейронов в коре головного мозга. Стек идет от 700 мкм до 1020 мкм под поверхностью ткани. 8-кратным цифровым зумом был использован для захвата детали, такие как штраф процессов. Изображения составляет 225 х 225 мкм, шкалы = 20 мкм.

Рисунок 4. Представитель изображения 3D-реконструкция (225 х 225 х 320 мкм) изображения стека на рисунке 3. Изображения составляет 225 х 225 мкм, шкалы = 28 мкм.
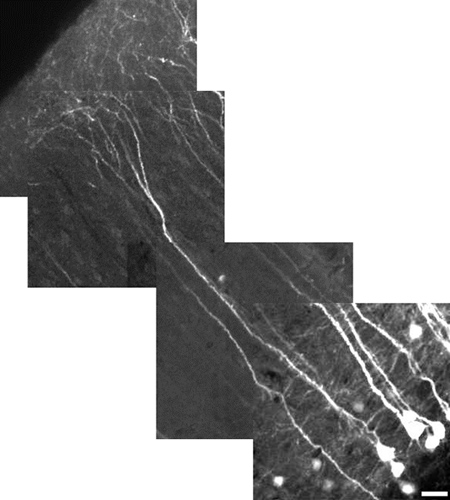
Рисунок 5. Высокого разрешения восстановленное изображение слоя V пирамидальных нейронов неокортекса использованием 10X цифровой зум. Нейрон меры 485 мкм в длину, шкалы = 25 мкм. Поле зрения для каждого изображения плитки составляет 180 мкм х 180 мкм. Каждая плитка на разной глубине (Z-уровне). Корковые апикальные дендриты этого не сделать, в общем, экспресс-YFP, а также сома. Для того, чтобы, как в том же поле зрения, как показано здесь, мощность была снижена, чтобы минимизировать насыщения сомы, что делает прекрасный вид диммера процесса. Наш акцент здесь был на демонстрации поля-обзора, а не мелкие детали. Чтобы выявить тонкие детали, использовать цифровой зум, фокус на регионе, не сомы, а также увеличить мощность лазера.
Обсуждение
В то время как стандартные органические красители, совместимые с различными органическими растворителями, и, следовательно, не представляют собой особую проблему для очистки протоколов, флуоресцентные белки часто являются менее терпимы к изменениям в растворителе. 4 Целью наст?...
Раскрытие информации
Эксперименты на животных были проведены в соответствии с руководящими принципами и правилами, установленными Институциональные животных Йельского университета уходу и использованию комитета.
Благодарности
Мы хотели бы поблагодарить Якова Солисом за помощь в редактировании видео.
Эта работа была частично финансируется за счет премии NSF КАРЬЕРА DBI-0953902 для MJ Левин.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Фосфатным буферным раствором | Sigma-Aldrich, Inc | D8537 | 500 мл, рН 7,2 |
| Параформальдегид | Электрон наук микроскопии | 15710 | 10 х 10 мл, 16% параформальдегида |
| Этиловый спирт | Американский Биоаналитическая | AB00515-00500 | 500 мл, 200 доказательство |
| Этиловый спирт | Pharmco Products, Inc | 111000190 | 1 галлон., 190 доказательство |
| Бензиловый спирт | Sigma-Aldrich, Inc | 402834 | 500 мл, 99 +% |
| Бензилбензоат | Sigma-Aldrich, Inc | B6630-IL | 500 мл, ≥ 99% |
| 5X/0.5 НС цели | Nikon | AZ план Мука 5X | 15 WD |
Ссылки
- Parra, S. G., Chia, T. H., Zinter, J. P., Levene, M. J. Multiphoton microscopy of cleared mouse organs. J. Biomed. Opt. 15, 036017 (2010).
- Vesuna, S., Torres, R., Levene, M. J. Multiphoton fluorescence, second harmonic generation, and fluorescence lifetime imaging of whole cleared mouse organs. J. Biomed. Opt. 16, 106009 (2011).
- Zucker, R. M. Whole insect and mammalian embryo imaging with confocal microscopy: Morphology and apoptosis. Cytometry. A69, 1143-1152 (2006).
- Sakhalkar, H. S. Functional imaging in bulk tissue specimens using optical emission tomography: Fluorescence preservation during optical clearing. Phys. Med. Biol. 52, 2035-2054 (2007).
- Dazai, J., Spring, S., Cahill, L. S., Henkelman, R. M. Multiple-mouse Neuroanatomical Magnetic Resonance Imaging. J. Vis. Exp. (48), e2497 (2011).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed. Eng. Online. 2, (2003).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M., Nerbonne, J. M., Lichtman, J. W., Sanes, J. R. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28, 41-51 (2000).
- Hama, H. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neuro. 14, 1481-1488 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены