Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microscopie multiphotonique de cerveau de souris Effacé Exprimant YFP
Dans cet article
Résumé
Microscopie multiphotonique des organes de souris entiers est possible par compensation optiquement l'organe avant l'imagerie, mais pas tous les protocoles de préserver le signal de fluorescence des protéines fluorescentes. En utilisant une méthode de compensation optique avec de l'éthanol à base de déshydratation et d'alcool benzylique: benzoate de benzyle compensation, nous montrons des images haute résolution multiphotoniques de cerveau de souris exprimant toute la YFP.
Résumé
Microscopie multiphotonique de fluorescence intrinsèque génération d'harmoniques et seconde (SHG) d'organes de souris entiers est rendue possible par l'organe optique de compensation avant l'imagerie. 1,2 Cependant, pour des organes qui contiennent des protéines fluorescentes comme la GFP et YFP, les protocoles de compensation optique utilisant du méthanol déshydratation et clair à l'alcool benzylique: benzoate de benzyle (BABB), tandis que la lumière non protégée de 3 ne conservent pas le signal fluorescent. Le protocole présenté ici est une nouvelle façon dans laquelle effectuer la compensation organe entier optique sur le cerveau de la souris tout en préservant le signal de fluorescence de la YFP exprimé dans les neurones. Modification du protocole de compensation optique telle que l'organe est déshydraté par une série d'éthanol à a été trouvé pour réduire les dommages causés aux protéines fluorescentes et de préserver leur signal fluorescent pour l'imagerie multiphotonique. 4 Utilisation d'une méthode optimisée de compensation optique avec de l'éthanol à base de déshydratation et compensation par BABBtandis abri de la lumière, nous montrons des images haute résolution multiphotoniques de jaune protéines (YFP) expression fluorescente dans les neurones d'un cerveau de souris plus de 2 mm sous la surface du tissu.
Protocole
1. 5 perfusion animale et entier de compensation cerveau de souris
- Toute la longueur de la procédure peut varier en fonction de la longueur de temps utilisé par l'étape de déshydratation, mais au total l'ensemble du processus peut être effectuée en deux jours.
- Peser souris YFP et profondément anesthésié par une injection intrapéritonéale de kétamine / xylazine (100 mg / kg: 10 mg / kg).
- Confirmer un plan chirurgical de l'anesthésie profonde avant de procéder à la chirurgie. Vérifiez l'animal toutes les 5 minutes pour voir si elle réagit à un orteil entreprise ou pincement de la queue. Si l'animal réagit, une dose supplémentaire (1/3 de la dose initiale) de la kétamine / xylazine est nécessaire.
- Une fois profondément anesthésié, restreindre la souris en adhérant à chaque membre un lit de chirurgie en utilisant du ruban laboratoire afin que la souris se trouve dans une position couchée (décubitus dorsal), exposant sa poitrine pour la chirurgie. La table d'opération est généralement constituée d'un métal ou d'un treillis en matière plastique et placé dans un évier ou sur le dessus d'un pan-lèvres de sorte que le sang et fixateurles déchets peuvent être facilement recueillies.
- Pour commencer, faites une incision sous le processus xiphoïde. Couper le long de la base de la cage thoracique à l'aide des ciseaux et des pinces à épiler et tirez la peau que la coupe est faite. Effectuer deux coupes, le long de chaque côté du sternum de la souris (à travers les nervures) pour créer un rabat de tissu qui se tient en dehors de la cavité thoracique à l'aide d'une pince hémostatique pour quitter le cœur exposé.
- Insérez une aiguille de 23 g dans le ventricule gauche du cœur et de faire une petite incision dans la paroi musculaire de l'oreillette droite pour permettre au sang de s'échapper. S'il vous plaît référer à Jové article 2497 pour une vidéo cette procédure. 5
- Immédiatement après l'oreillette droite est coupée, commencer une perfusion de 4 ° C une solution saline tamponnée de phosphate, PBS (pH 7,2) jusqu'à ce que le sang n'est plus observée vidange de l'oreillette droite du coeur (30 - 40 ml à un débit d'environ 5 ml / min).
- Une fois que tout le sang a été drainé (fluide sortant de l'oreillette droite est clair), passer le milieu de perfusion à un réfrigérées 4%Solution PFA. Perfuser jusqu'à ce que le corps de la souris devient nettement rigide et froid au toucher (environ 30 à 40 ml à un taux d'environ 5 ml / min). (Concentré solution à 16% PFA est dilué selon les instructions du fabricant et NaOH est ajouté jusqu'à pH 7,2 est atteint. Porter des gants et une blouse de laboratoire et à manipuler et mélanger les produits chimiques à l'intérieur d'une hotte.)
- Après la perfusion, retirer la souris à partir de la table d'opération et décapiter pour commencer l'excision du cerveau.
- En utilisant des pinces et ciseaux à iris, retirez le crâne en petites sections à partir de l'arrière du crâne et aller de l'avant. Faire de petites coupures toutes les 2 - 4 mm avec des ciseaux dans le crâne tout en utilisant la pince pour retirer avec précaution l'os loin du cerveau en petites sections. Continuez jusqu'à ce que toute la surface supérieure du cerveau est exposé.
- D'accise le cerveau du crâne à l'aide de 5 mm de large, spatule plate et placer dans un flacon en verre. Plonger dans 4% PFA pendant 6 heures à 4 ° C pour la fixation de poste.
- Après le postfixation, laver le cerveau deux fois dans du PBS température ambiante en versant la PFA du flacon en verre et en le remplaçant par du PBS. Agiter le cerveau dans une solution de PBS avant de la verser sur et le remplacer par du PBS pour un second lavage.
- Déshydrater le cerveau à température ambiante par une série graduée d'incubations d'éthanol (une fois dans 50%, 70%, 95%, et deux fois à 100%) à 2 h par incubation, puis de 12 heures d'incubation éthanol à 100% deuxièmement, extraire l'eau du tissu fixé. Pour chaque incubation, verser la solution éthanolique précédente de l'ampoule de verre et la remplacer par la solution suivante jusqu'à ce que le cerveau est complètement immergé.
- Après la seconde incubation dans de l'éthanol à 100%, verser la solution et remplacer avec de l'éthanol à parts égales et la solution de compensation contenant l'alcool benzylique et le benzoate de benzyle (1:2 vol: rapport volume). Après 2 heures d'incubation, décanter cette solution et la remplacer par une solution 100% d'alcool benzylique et le benzoate de benzyle (1:2 vol: rapport volume). Le REFRActive indice de la solution de compensation est n = 1,54.
- Une fois dans BABB, le cerveau devient sensiblement transparent, dans les 4 - 5 heures. Pour de meilleurs résultats compensation, laisser le cerveau pour effacer pendant 6 jours à la température ambiante pendant abri de la lumière.
2. Configuration microscope
- Une fois que le cerveau est effacé et prêt pour l'imagerie, le fixer sur le fond d'une boîte de Pétri à l'aide de cyanoacrylate. Laisser l'adhésif sécher avant de continuer.
- Après séchage, plonger dans le cerveau BABB et placez la boîte de Pétri sous l'objectif du microscope pour l'imagerie.
- Nous utilisons un microscope multiphotonique qui comprend un Mai Tai laser titane saphir réglable entre une 710 à 990 nm de longueur d'onde d'excitation nm. La longueur d'onde d'excitation que nous utilisons pour générer des signaux YFP à 886 nm. Puissance du laser varie de 30 à 100 mW en fonction de la profondeur d'imagerie.
- Capturer le signal réfléchi fluorescent à l'aide d'un Nikon objectif 5X (NA, 0,5) qui permet d'avoir unechamp de vision d'imagerie (2 x 2 mm).
- Filtrer le signal réfléchi fluorescent à l'aide d'un filtre 535/50 passe-bande et de les récupérer à l'aide d'un PMT GaAsP (H7422PA-40, Hamamatsu, Bridgewater, New Jersey).
- Traiter les images en utilisant le logiciel ScanImage 6 à une résolution de 2048 x 2048 pixels en utilisant une vitesse de balayage de 2 ms par ligne afin de générer de haute résolution, des images YFP.
- Une fois que l'imagerie est terminée, retirez le cerveau de la boîte de Petri en utilisant une pince et de stocker dans BABB abri de la lumière pour l'imagerie avenir. Pour les échantillons collés, enlever le tissu en cours d'exécution par une lame de rasoir entre la colle et la boîte de Pétri selon un angle non supérieur à 30 degrés. Nous avons stocké des échantillons dans BABB jusqu'à 1 an sans dégradation visible.
3. Les résultats représentatifs
Les images représentatives et vidéos présentés ici démontrent la haute résolution imagerie multiphotonique capacité rendue possible par compensation optique. L'imagerie cérébrale permet entierpour YFP marqué neurones dans les différentes couches de l'hippocampe et du cortex à être clairement visible aussi profond que 2 mm sous la surface du tissu. La figure 1 montre une image représentative d'une vue coronale correspondant aux caractéristiques anatomiques de l'hippocampe à 2,92 mm caudale au bregma 7. La profondeur de l'imagerie dans l'échantillon était de 1,94 mm. Une partie de cette différence est due à l'élimination du cervelet à l'extrémité caudale du cerveau et le solde est dû à un rétrécissement du processus de déshydratation. Une autre image de la pile montre la couche V / VI neurones pyramidaux du néocortex exprimant YFP 2 mm sous la surface du tissu (figure 2). Toutes les images ont été acquises avec le Nikon objectif 5X et d'agrandissement a été réalisé en utilisant la fonction de zoom numérique pour l'acquisition d'images dans le logiciel ScanImage.
En zoomant sur le néocortex, les axones individuels et les organismes cellulaires des neurones des neurones pyramidaux de la couche V du néocortex sont clairesly distingue jusqu'à 1,02 mm en dessous de la surface du tissu (figure 3). Utilisation de la pile d'images de la figure 3, une reconstruction 3D de la région de neuronal a été faite en utilisant le logiciel ImageJ 8 (Figure 4).
La capacité de haute résolution de MPM nous permet également de présenter des images de l'ensemble, les neurones individuels. Ici, nous montrons une reconstruction d'un neurone pyramidal couche V du néocortex dans lequel les processus dendritiques individuelles sont clairement visibles (figure 5).

La figure 1 représentant l'image à partir d'une pile d'images de 1,2 mm (0,8 - 2 mm en dessous de la surface de tissu). Ensemble de cerveau de souris présentant néocortex et les différentes couches de l'hippocampe. Caractéristiques de l'hippocampe sont visibles 1,1 mm en dessous de la surface du tissu et ont été marqués à l'aide du suiviment le code suivant:. DG = gyrus denté, GrDG couche granulaire de la DG =, = Lmol lacunosum moleculare couche, Mol = moléculaire couche DG, Ou = oriens couche, PoDG = polymorphe couche DG, Py = couche de cellules pyramidales, Rad = stratum radiatum 7 l'image est de 1,8 x 1,8 mm de taille, échelle bar = 200 um. L'extrémité rostrale du cerveau a été apposée sur une boîte de Pétri avec l'extrémité caudale vers le haut pour atteindre l'objectif. Cette facilité d'imagerie dans le plan coronal.
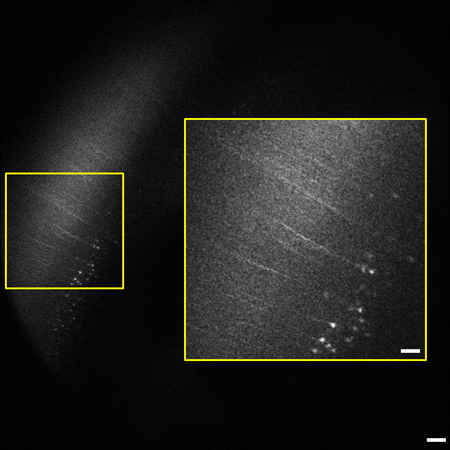
Figure 2 trame représentative de la pile 1,2 mm d'image (0,8 - 2 mm en dessous de la surface de tissu). Du cerveau de la souris tout en soulignant le néocortex. Cellules pyramidales et les processus exprimant YFP dans la couche V / VI de cortex sont visibles 2 mm sous la surface du tissu. Le degré d'étiquetage est conforme aux précédents rapports de l'étiquetage rares dans le néocortex. 9 médaillon (à droite) est agrandie de b oxed zone sur la gauche. L'image est de 1,8 x 1,8 mm, barre d'échelle = 200 um (50 um encadré).
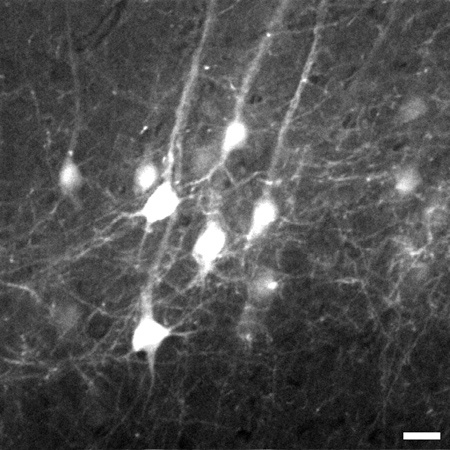
La figure 3. Trame représentative pris 774 um en dessous de la surface du tissu à partir de la pile d'images de neurones pyramidaux de la couche V de la néocortex du cerveau. Empilement passe de 700 um à 1.020 um en dessous de la surface du tissu. Un zoom numérique 8X a été utilisé pour capturer des détails tels que les processus fines. L'image est de 225 x 225 um de taille, échelle bar = 20 um.

Figure 4. Représentant l'image de reconstruction 3D (225 x 225 x 320 um) de la pile d'images de la figure 3. L'image est de 225 x 225 um de taille, échelle bar = 28 um.
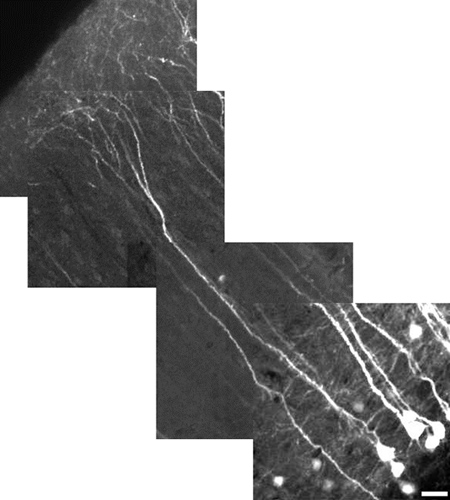
Figure 5. Haute résolution de l'image reconstruite d'un neurone pyramidal couche V du néocortex l'aide d'un zoom numérique 10X. Neuron mesure 485 mm de longueur, échelle = 25 pm. Le champ de vision de chaque mosaïque d'images est de 180 um x 180 um. Chaque tuile est à une profondeur différente (z-niveau). Les dendrites apicales corticales ne sont pas, en général, expresse YFP ainsi que le soma. Pour avoir les deux dans le même champ de vision, comme le montre ici, la puissance a été réduite à minimiser la saturation de soma, ce qui le rend plus sombre processus belle apparence. Nous mettons l'accent ici est de démontrer champ de vue plutôt que les détails fins. À révéler des détails plus fins, utiliser un zoom numérique, se concentrer sur une région sans soma, et d'augmenter la puissance du laser.
Discussion
Bien standards colorants organiques sont compatibles avec une gamme de solvants organiques, et donc ne posent pas de problème particulier pour la compensation des protocoles, des protéines fluorescentes sont souvent moins tolérants des changements dans le solvant. 4 L'objectif de ce travail était de surmonter une limitation sérieuse de précédentes protocoles de compensation optique où la fluorescence de XFP a été perdue ou gravement dégradées. Les images qui sont présentées ici montrent que ...
Déclarations de divulgation
Les expériences sur les animaux ont été effectuées en conformité avec les directives et règlements établis par les soins de l'Université Yale animaux institutionnel et des comités utilisation.
Remerciements
Nous tenons à remercier Jacob Solis pour son aide dans le montage vidéo.
Ce travail a été financé en partie par une bourse de carrière NSF DBI-0953902 à MJ Levene.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Phosphate Buffered Saline | Sigma-Aldrich, Inc | D8537 | 500 ml, pH 7,2 |
| Paraformaldéhyde | Sciences microscopie électronique | 15710 | 10 x 10 ml, le paraformaldéhyde 16% |
| L'alcool éthylique | Américaine bioanalytique | AB00515-00500 | 500 ml, 200 preuve |
| L'alcool éthylique | Produits Pharmco, Inc | 111000190 | 1 gal., 190 preuve |
| Alcool benzylique | Sigma-Aldrich, Inc | 402834 | 500 ml, 99 +% |
| Le benzoate de benzyle | Sigma-Aldrich, Inc | B6630-IL | 500 ml, ≥ 99% |
| 5X/0.5 objectif NA | Nikon | Farine AZ plan 5X | 15 WD |
Références
- Parra, S. G., Chia, T. H., Zinter, J. P., Levene, M. J. Multiphoton microscopy of cleared mouse organs. J. Biomed. Opt. 15, 036017 (2010).
- Vesuna, S., Torres, R., Levene, M. J. Multiphoton fluorescence, second harmonic generation, and fluorescence lifetime imaging of whole cleared mouse organs. J. Biomed. Opt. 16, 106009 (2011).
- Zucker, R. M. Whole insect and mammalian embryo imaging with confocal microscopy: Morphology and apoptosis. Cytometry. A69, 1143-1152 (2006).
- Sakhalkar, H. S. Functional imaging in bulk tissue specimens using optical emission tomography: Fluorescence preservation during optical clearing. Phys. Med. Biol. 52, 2035-2054 (2007).
- Dazai, J., Spring, S., Cahill, L. S., Henkelman, R. M. Multiple-mouse Neuroanatomical Magnetic Resonance Imaging. J. Vis. Exp. (48), e2497 (2011).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed. Eng. Online. 2, (2003).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M., Nerbonne, J. M., Lichtman, J. W., Sanes, J. R. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28, 41-51 (2000).
- Hama, H. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neuro. 14, 1481-1488 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon