A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Multiphoton מיקרוסקופי של מוח העכבר הותר הבעת YFP
In This Article
Summary
מיקרוסקופיה multiphoton של איברים שלמים עכבר ניתן על ידי ניקוי האיברים אופטיים לפני ההדמיה, אך לא כל הפרוטוקולים לשמר את אות הניאון של חלבוני ניאון. באמצעות שיטה אופטית סליקה עם התייבשות אתנול מבוסס ואלכוהול בנזיל: סליקה בנזואט נזיל, אנחנו מראים תמונות multiphoton ברזולוציה גבוהה של כל המוח של עכבר מביע YFP.
Abstract
מיקרוסקופיה multiphoton של הדור הפנימי פלואורסצנטי וההרמוניה השני (SHG) של איברי עכבר שלמים מתאפשרת על ידי ניקוי האיברים אופטיים לפני ההדמיה. 1,2 עם זאת, עבור איברים המכילים חלבוני ניאון כגון GFP וYFP, פרוטוקולי סליקה אופטיות המשתמשים במתנול התייבשות וברורה שימוש באלכוהול בנזיל: נזיל בנזואט (באב) ואילו לא מוגן מאור 3 לא לשמר את אות הניאון. הפרוטוקול המובא כאן הוא דרך חדשה שבה לבצע סליקה אופטית איבר שלמה במוח עכבר תוך שמירה על אות הקרינה של YFP מתבטאת בתאי עצב. שינוי פרוטוקול סליקה האופטי כזה שהאיבר הוא התייבשות באמצעות סדרה מדורגת אתנול כבר נמצא כדי להפחית את הניזק לחלבוני ניאון ולשמר את אות הניאון להדמית multiphoton. 4 שימוש בשיטה אופטימלית של סליקה אופטית עם התייבשות אתנול מבוסס ו סליקה על ידי אבבעוד מוגן מפני אור, אנחנו מראים תמונות multiphoton רזולוציה גבוהה של חלבון ביטוי ניאון צהוב (YFP) בתאי העצב של מוח יותר מ 2 מ"מ עכבר מתחת לפני שטח הרקמות.
Protocol
1. זלוף בעלי החיים 5 וסליקת מוח עכבר שלמה
- כל אורכו של ההליך יכול להשתנות בהתאם לאורכו של זמן בשימוש לצעד התייבשות, אבל בסך הכל כל התהליך יכול להתבצע בשני ימים.
- שוקל עכברי YFP ולאחר מכן עמוק להרדים עם זריקת intraperitoneal של קטמין / xylazine (100 מ"ג / ק"ג: 10 מ"ג / ק"ג).
- לאשר מטוס כירורגית של הרדמה עמוקה לפני שיעבור לניתוח. בדקו את בעלי החיים כל 5 דקות כדי לראות אם הוא מגיב לבוהן איתן או קמצוץ זנב. אם בעל החיים מגיבים, מינון משלימה (1/3 ממינון המקורי) של קטמין / xylazine נדרש.
- ברגע שהרדים עמוק, לרסן את העכבר על ידי עמידה בכל איבר למיטת ניתוחים באמצעות קלטת מעבדה, כדי שהעכבר הוא במצב שכיבה (recumbancy הגבה), חושף את חזו לניתוח. המיטה כירורגית עשויה בדרך כלל ממתכת או רשת פלסטיק ומניחה אותה בכיור או על גבי שפות חשוקות מחבת כך שהדם ומקבעפסולת יכולה בקלות להיות שנאספה.
- כדי להתחיל, לעשות חתך מתחת לתהליך xyphoid. חותך לאורך הבסיס של כלוב הצלעות באמצעות מספריים ופינצטה ולמשוך בחזרה עור כמו החתך הוא עשה. בשני חתכים לאורך כל הצד של עצם החזה (העכבר דרך הצלעות) כדי ליצור דש של רקמה המתקיים הרחק מבית החזה באמצעות מלקחיים לעזוב את הלב חשוף.
- הכנס מחט 23 גרם לחדר השמאלי של הלב ולעשות חתך קטן בקיר השריר של העלייה הימנית כדי לאפשר לדם לברוח. אנא עיין במאמר יופיטר 2497 לוידאו של הליך זה. 5
- מייד לאחר העלייה הימנית היא לחתוך, להתחיל זלוף עם 4 מעלות צלזיוס נאגר מלוח פוספט, PBS, (pH 7.2) עד שדם כבר לא נצפה ניקוז מהעלייה הימנית של הלב (מ 30 - 40 מ"ל בשיעור של כ 5 מ"ל / דקה).
- ברגע שכל הדם התרוקן (נוזל יציאת העלייה הימנית ברור), לעבור למדיום זלוף 4% מצונניםפתרון PFA. תנקב עד שגופו של העכבר הופך ניכר נוקשה וקר למגע (30 כ - 40 מ"ל בשיעור של כ 5 מ"ל / דקה). (מרוכז 16% פתרון PFA מדולל בהתאם להוראות יצרן והוא הוסיף NaOH עד pH 7.2 הוא הגיע. ילבש כפפות וחלוקה מעבדה ולטפל ולערבב כימיקלים בתוך מנדף.)
- לאחר זלוף, הסר את העכבר מהמיטה כירורגית ולהתחיל לערוף הכריתה של המוח.
- שימוש במלקחיים ומספריים איריס, להסיר את הגולגולת בסעיפים קטנים המתחילים מהחלק האחורי של הגולגולת ולנוע קדימה. לבצע חתכים קטנים בכל 2-4 מ"מ עם מספריים על פני הגולגולת תוך כדי שימוש במלקחיים בזהירות למשוך את העצם מהמוח בסעיפים קטנים. האם זה עד המשטח העליון של המוח כולו חשוף.
- הבלו על המוח מהגולגולת באמצעות 5 מ"מ רחב, מרית שטוחה ומקום לתוך בקבוקון זכוכית. לצלול ב4% PFA עבור 6 שעות ב 4 ° C לקיבעון הודעה.
- לאחר הודעהקיבעון, לשטוף את המוח פעמים בטמפרטורת החדר PBS על ידי שפיכת PFA מתוך בקבוקון הזכוכית והחלפתו בערוץ מדע. מערבולת המוח בפתרון PBS לפני נשפך החוצה ולהחליף עם PBS לכביסה שנייה.
- מייבש את המוח בטמפרטורת חדר על ידי סדרה מדורגת של incubations אתנול (פעם אחת ב 50%, 70%, 95%, ופעמים ב100%) בשעת 2 שעות לדגירה, ואז 12 שעות לדגירת 100% אתנול השנייה, כדי לחלץ את המים מרקמות הקבועות. עבור כל דגירה, לשפוך את הפתרון הקודם אתנול מבקבוקון הזכוכית ולהחליפו בפתרון הבא, עד שהמוח הוא שקוע לחלוטין.
- לאחר הדגירה השנייה באתנול 100%, לשפוך את הפתרון ולהחליף בחלקים שווים אתנול ופתרון הסליקה המכיל בנזיל אלכוהול ונזיל בנזואט (1:2 כרך: יחס נפח). לאחר 2 שעות של דגירה, מזוג פתרון זה ולהחליף בפתרון של 100% בנזיל אלכוהול ונזיל בנזואט (1:2 כרך: יחס נפח). Refraראשי ctive מפתרון הסליקה הוא n = 1.54.
- ברגע באב, המוח יהפוך ניכר שקוף, בתוך 4-5 שעות. לקבלת תוצאות הטובות ביותר סליקה, השאר את המוח כדי לנקות במשך 6 ימים בטמפרטורת חדר ואילו מוגן מפני אור בהיר.
2. התקנת מיקרוסקופ
- ברגע שהמוח מנוקה ומוכן להדמיה, להצמיד אותו לתחתית של צלחת פטרי באמצעות cyanoacrylate. אפשר הדבק להתייבש לפני שימשיך.
- לאחר הייבוש, להטביע את המוח באב ומניח צלחת תחת מיקרוסקופ למטרת הדמיה.
- אנו משתמשים במיקרוסקופ multiphoton שמשלב ליזר מאי טאי טיטניום ספיר מתכווננת בין 710 ננומטר ל אורך גל עירור ננומטר 990. גל העירור אנו משתמשים כדי לייצר אותות YFP הוא 886 ננומטר. ליזר הכח משתנה 30-100 mW, תלוי בעומק הדמיה.
- תפוס את אות הניאון משתקף באמצעות אובייקטיבי 5X ניקון (NA, 0.5) המאפשרת לגדוליםתחום של נוף הדמיה (2 2 מ"מ x).
- סנן אות הניאון משתקף באמצעות מסנן bandpass 535/50 ולאסוף אותו באמצעות GaAsP PMT (H7422PA-40, Hamamatsu, Bridgewater, ניו ג'רזי).
- תמונות תהליך באמצעות תוכנת ScanImage 6 ברזולוציה של 2048 x 2048 פיקסלים תוך שימוש בשיעור סריקה של כל השורה 2 ms להפיק רזולוציה גבוהה, תמונות YFP.
- לאחר ההדמיה יושלם, להסיר את המוח מצלחת פטרי באמצעות מלקחיים ולאחסן באב מוגן מפני אור להדמית עתיד. לקבלת דוגמיות מודבקת, להסיר את הרקמה על ידי הפעלת סכין גילוח בין הדבק וצלחת פטרי בזווית שאינה עולה על 30 מעלות. יש לנו לאחסן דגימות באב לתקופה של עד שנת 1 עם שפל לא נראה לעין.
3. נציג תוצאות
את התמונות וסרטוני וידאו המוצגים כאן הנציג להפגין היכולת הגבוהה ברזולוצית multiphoton ההדמיה התאפשרה סליקה אופטית. ההדמיה של מוח כולו מאפשרתלYFP שכותרתו נוירונים בשכבות השונות של קליפת המוח וההיפוקמפוס להיות נראים בבירור עמוק כמו 2 מ"מ מתחת לפני שטח הרקמות. איור 1 מציג תמונת נציג של תצוגת עטרה מקבילה לתכונות אנטומיות של ההיפוקמפוס ב2.92 מ"מ זנב עד 7 גבחת. העומק של הדמיה במדגם היה 1.94 מ"מ. החלק מהבדל זה נובע מהסרה של מוח הקטן בסוף הזנב של המוח ואת היתרה הייתה בשל הצטמקות מתהליך ההתייבשות. תמונה אחרת מתוך הערימה מראה עצב פירמידליים השכבה V / שישי של הניאוקורטקס לבטא 2 מ"מ YFP מתחת לפני שטח הרקמה (איור 2). כל התמונות נרכשו באמצעות אובייקטיבי וגדלת 5X ניקון נעשה שימוש בתכונת הזום הדיגיטלית לרכישת תמונה בתוכנת ScanImage.
על ידי התקרבות על הניאוקורטקס, אקסונים הבודדים וגופי תא של הנוירונים פירמידליים נוירון בשכבת V של הניאוקורטקס ברוריםly להבחין עד 1.02 מ"מ מתחת לפני שטח הרקמה (איור 3). שימוש במחסנית התמונה מהאיור 3, שיקום 3D של אזור נוירון נעשה באמצעות תוכנת ImageJ 8 (איור 4).
יכולת הרזולוציה הגבוהה של MPM גם מאפשרת לנו להציג את התמונות של כל הנוירונים, בודדים. כאן אנו מציגים שחזור של נוירון פירמידלי שכבת V של הניאוקורטקס שבתהליכים דנדריטיים בודדים הם נראים בבירור (איור 5).

איור 1 תמונת נציגת מחסנית תמונה 1.2 מ"מ (0.8-2 מ"מ מתחת לפני שטח הרקמה). של מוח עכבר כולו מראה הניאוקורטקס ואת השכבות השונות של ההיפוקמפוס. תכונות של ההיפוקמפוס גלויות 1.1 מ"מ מתחת לפני שטח הרקמה וסומנו בתווית באמצעות המעקבing קוד:. DG = gyrus המשוננת, GrDG = שכבה פרטנית של DG, Lmol = lacunosum moleculare שכבה, מול = שכבה המולקולרית DG, או שכבת מכשירי אוריין =, PoDG = polymorph שכבת DG, PY = שכבת התא פירמידלי, רד = שכבת radiatum 7 תמונה היא 1.8 x 1.8 מ"מ בגודל, בר קנה מידה = 200 מיקרומטר. הסוף המקורי של המוח הוצמד לצלחת פטרי עם סוף הזנב כלפי מעלה לכיוון המטרה. זה הקל הדמיה במטוס העטרה.
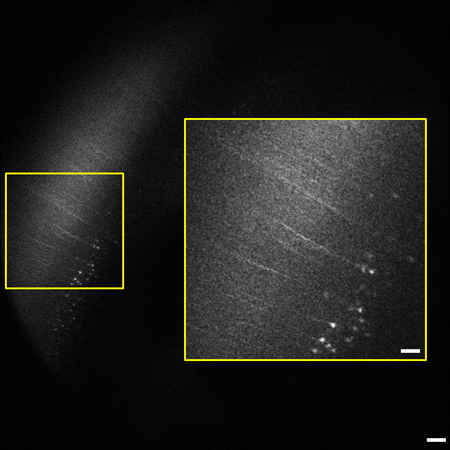
איור 2 מסגרת נציג ממחסנית תמונת המ"מ 1.2 (0.8-2 מ"מ מתחת לפני שטח הרקמה). של מוח עכבר כל הדגשת הניאוקורטקס. תאים ותהליכים המבטאים את פירמידת YFP בשכבת V / שישית של קליפת המוח הם 2 מ"מ גלוי מתחת לפני שטח הרקמות. התואר של תיוג הוא בקנה אחד עם דיווחים קודמים של התיוג הדליל בניאוקורטקס. 9 הבלעה (מימין) מוגדלים מב אזור oxed על שמאל. תמונה היא 1.8 מ"מ x 1.8 בגודל, סרגל קנה מידה = 200 מיקרומטר (50 מיקרומטר הבלעה).
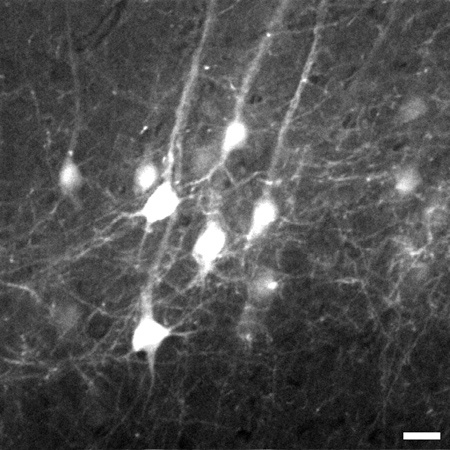
איור 3. מסגרת נציג נלקחה 774 מיקרומטר מתחת לפני שטח הרקמה ממחסנית התמונה של נוירונים פירמידליים V שכבה ב הניאוקורטקס של המוח. סטאק הולך בין 700 מיקרומטר ל1020 מיקרומטר מתחת לפני שטח הרקמות. זום דיגיטלי 8X היה משמש ללכידת פרטים כגון תהליכים עדינים. תמונה היא 225 225 מיקרומטר x בגודל, סרגל קנה מידה = 20 מיקרומטר.

איור 4. תמונה מייצגת של 3D שיקום (225 x 225 x 320 מיקרומטר) של ערימת התמונה באיור 3. תמונה היא 225 225 מיקרומטר x בגודל, סרגל קנה מידה = 28 מיקרומטר.
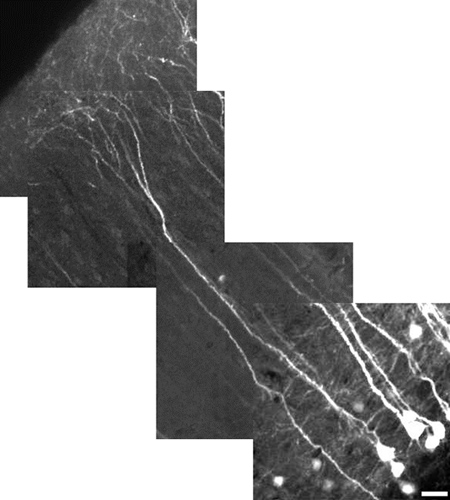
איור 5. תמונה משוחזרת ברזולוציה הגבוהה של נוירון פירמידלי שכבת V של הניאוקורטקס באמצעות זום דיגיטלי 10X. Neuron מודד 485 מיקרומטר באורך, סרגל קנה מידה = 25 מיקרומטר. שדה הראיה לכל אריח תמונה הוא 180 x 180 מיקרומטר מיקרומטר. כל אריח הוא בעומק שונה (z ברמה). הדנדריטים apical קליפת המוח לא, באופן כללי, המפורש YFP כמו גם את הסומא. יש גם באותו שדה הראייה, כפי שמוצג כאן, הכח הונמך כדי למזער את הרוויה של סומה, זה הופך את תהליך דימר המראה העדין. הדגש שלנו כאן היה על הוכיח תחום של נוף ולא פרטים קטנים. כדי לחשוף את הפרטים מעודנים יותר, להשתמש זום דיגיטלי, יתמקד באזור ללא סומה, ולהגביר את כוח הליזר.
Discussion
אמנם צבעים אורגניים תקניים תואמים למגוון רחב של ממסים אורגניים, ולכן לא מהווים אתגר מיוחד לניקוי פרוטוקולים, חלבוני ניאון הם בדרך כלל פחות סובלניים לשינויים בממס. 4 המטרה של העבודה הנוכחית היה להתגבר על מגבלה רצינית של פרוטוקולים קודמים אופטיים סליקה שבו קרינה...
Disclosures
ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי הטיפוח של אוניברסיטת ייל המוסדית בעלי החיים ושימוש בועדה.
Acknowledgements
ברצוננו להודות ליעקב סוליס לעזרתו בעריכת וידאו.
עבודה זו מומנה בחלק פרס NSF קריירת DBI-0953902 לMJ לוין על ידי.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | תגובות |
| נאגר מלוח פוספט | סיגמה אולדריץ, Inc | D8537 | 500 מ"ל, pH 7.2 |
| Paraformaldehyde | מדעי מיקרוסקופ אלקטרונים | 15710 | 10 x 10 מ"ל, 16% paraformaldehyde |
| אתיל אלכוהול | אמריקאי Bioanalytical | AB00515-00500 | 500 מ"ל, 200 הוכחה |
| אתיל אלכוהול | Pharmco מוצרים, Inc | 111000190 | גל 1., 190 הוכחה |
| בנזיל אלכוהול | סיגמה אולדריץ, Inc | 402834 | 500 מ"ל, 99 +% |
| בנזיל בנזואט | סיגמה אולדריץ, Inc | B6630-IL | 500 מ"ל, ≥ 99% |
| 5X/0.5 אובייקטיבי NA | ניקון | קמח תכנית AZ 5X | 15 WD |
References
- Parra, S. G., Chia, T. H., Zinter, J. P., Levene, M. J. Multiphoton microscopy of cleared mouse organs. J. Biomed. Opt. 15, 036017 (2010).
- Vesuna, S., Torres, R., Levene, M. J. Multiphoton fluorescence, second harmonic generation, and fluorescence lifetime imaging of whole cleared mouse organs. J. Biomed. Opt. 16, 106009 (2011).
- Zucker, R. M. Whole insect and mammalian embryo imaging with confocal microscopy: Morphology and apoptosis. Cytometry. A69, 1143-1152 (2006).
- Sakhalkar, H. S. Functional imaging in bulk tissue specimens using optical emission tomography: Fluorescence preservation during optical clearing. Phys. Med. Biol. 52, 2035-2054 (2007).
- Dazai, J., Spring, S., Cahill, L. S., Henkelman, R. M. Multiple-mouse Neuroanatomical Magnetic Resonance Imaging. J. Vis. Exp. (48), e2497 (2011).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed. Eng. Online. 2, (2003).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M., Nerbonne, J. M., Lichtman, J. W., Sanes, J. R. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28, 41-51 (2000).
- Hama, H. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neuro. 14, 1481-1488 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved