É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microscopia multifotônica do cérebro do rato Cleared Expressando YFP
Neste Artigo
Resumo
Microscopia Multiphoton de órgãos inteiros de rato é possível através opticamente limpando o órgão antes de imagem, mas nem todos os protocolos de preservar o sinal de fluorescência de proteínas fluorescentes. Usando um método de compensação óptica com base de etanol a desidratação e álcool benzílico: benzil benzoato de compensação, que mostram imagens de alta resolução multifotônica de cérebro de rato inteiro expressando YFP.
Resumo
Microscopia Multiphoton de geração de fluorescência intrínseca e segunda harmónica (SHG) de órgãos inteiros de rato é possível graças opticamente limpeza do órgão, antes de imagem. 1,2 No entanto, para os órgãos que contêm proteínas fluorescentes, tais como GFP e YFP, protocolos de compensação ópticos que usam metanol desidratação e clara usando álcool benzílico: benzoato de benzila (BABB) enquanto desprotegido de 3 luz não preservam o sinal fluorescente. O protocolo aqui apresentado é uma nova forma em que para realizar compensação órgão inteiro óptico no cérebro do rato, preservando o sinal de fluorescência de YFP expressa em neurónios. A modificação do protocolo de compensação óptica de tal modo que o órgão é desidratado usando uma série graduada de etanol foi encontrada para reduzir os danos para as proteínas fluorescentes e preservar o seu sinal fluorescente para imagiologia multifotônica. 4 Utilizando um método optimizado de compensação óptica com base de etanol e de desidratação desmatamento por BABBenquanto protegida da luz, que mostram imagens de alta resolução multifotônica de proteína fluorescente amarela expressão (YFP), nos neurónios do cérebro de um rato mais de 2 mm abaixo da superfície do tecido.
Protocolo
1. Perfusão Animal 5 e Compensação cérebro inteiro Rato
- O comprimento total do procedimento podem variar, dependendo do período de tempo utilizado por passo de desidratação, no total, mas de todo o processo pode ser conduzido em dois dias.
- Pesar ratos YFP e em seguida profundamente anestesiar com uma injecção intraperitoneal de cetamina / xilazina (100 mg / kg: 10 mg / kg).
- Confirmar um plano cirúrgico de anestesia profunda antes de prosseguir para a cirurgia. Verifique o animal a cada 5 minutos para ver se ele reage a um dedo do pé firme ou pitada cauda. Se o animal reage, uma dose suplementar (1/3 da dose original) de cetamina / xilazina é necessária.
- Uma vez anestesiados profundamente, restringir o mouse aderindo cada membro a um leito cirúrgico com fita laboratório para que o mouse está em uma posição supina (recumbancy dorsal), expondo o peito para a cirurgia. O leito cirúrgico é normalmente feita de uma malha de metal ou de plástico e colocado numa pia ou em cima de uma lipped-pan de modo que o sangue e fixadorresíduos podem ser facilmente coletados.
- Para começar, fazer uma incisão abaixo do processo xifóide. Corte ao longo da base da caixa torácica utilizando tesouras e pinças e puxar a pele como o corte é feito. Fazer dois cortes ao longo de ambos os lados do esterno rato (através das costelas), para criar uma aba de tecido, que é realizada fora da cavidade torácica, usando uma pinça hemostática para deixar o coração exposto.
- Inserir uma agulha de 23 g para o ventrículo esquerdo do coração e fazer uma pequena incisão na parede do músculo do átrio direito para permitir que o sangue escape. Por favor, consulte a Jove artigo 2497 para um vídeo deste procedimento. 5
- Imediatamente após o átrio direito é cortado, iniciar uma perfusão de 4 ° C com solução salina tamponada com fosfato, PBS, (pH 7,2) até que o sangue não é mais observada drenagem a partir do átrio direito do coração (30 - 40 ml a uma taxa de cerca de 5 ml / min).
- Uma vez que todo o sangue foi drenado (líquido que sai do átrio direito é claro), mudar o meio de perfusão a 4% refrigeradosSolução de PFA. Perfundir até que o corpo do rato torna-se visivelmente rígido e frio ao toque (aprox. 30 - 40 ml a uma taxa de cerca de 5 ml / min). (Concentrado de 16% solução de PFA é diluída de acordo com as instruções do fabricante e é adicionado NaOH até pH 7,2 é atingida. Usar luvas e uma bata de laboratório e manipular e misturar produtos químicos dentro de um extractor de fumo.)
- Após a perfusão, remover o mouse do leito cirúrgico e decapitar para começar a excisão do cérebro.
- Utilizando uma pinça e tesouras da íris, remover o crânio em pequenos troços, a partir da parte de trás do crânio e avançar. Faça pequenos cortes a cada 2 - 4 mm com a tesoura em todo o crânio ao usar a pinça para retirar cuidadosamente o osso longe do cérebro em pequenos troços. Faça isso até que toda a superfície superior do cérebro está exposto.
- O cérebro Excise do crânio utilizando um 5 mm de largura, e uma espátula plana lugar para um frasco de vidro. Submerge em PFA a 4% durante 6 horas a 4 ° C para a fixação de pós.
- Depois de pósfixação, lavar o cérebro por duas vezes em PBS em temperatura ambiente por vazamento da PFA para fora do frasco de vidro e substituindo-o com PBS. Roda o cérebro em solução de PBS antes de derramar e substituindo com PBS para uma segunda lavagem.
- Desidratar o cérebro, à temperatura ambiente por uma série graduada de etanol incubações (em vez de 50%, 70%, 95%, e duas vezes em 100%) a 2 horas, por incubação, e depois de 12 horas de incubação para o segundo o etanol a 100%, a extrair a água do tecido fixado. Para cada incubação, derramar a solução de etanol anterior a partir do frasco de vidro e substitui-lo com a solução seguinte até ao cérebro está completamente submergido.
- Após a segunda incubação em etanol a 100%, derramar a solução e substitua por partes iguais de etanol e a solução de limpeza contendo álcool benzílico e benzoato de benzilo (1:2 vol: vol proporção). Após 2 h de solução de incubação, este decantar e substituir com uma solução 100% de álcool benzílico e de benzoato de benzilo (1:2 vol: vol proporção). O refraíndice ctive da solução de limpeza é n = 1,54.
- Uma vez em Babb, o cérebro vai tornar-se visivelmente transparente, dentro de 4 - 5 horas. Para melhores resultados de compensação, deixe o cérebro para limpar durante 6 dias à temperatura ambiente ao mesmo tempo protegidos da luz intensa.
2. Configuração microscópio
- Uma vez que o cérebro é limpa e pronta para a imagiologia, apor-lo para o fundo de uma placa de Petri utilizando cianoacrilato. Permitir que o adesivo seque antes de prosseguir.
- Após a secagem, submergir o cérebro em BABB e colocar a placa de Petri com o objetivo microscópio para imagens.
- Usamos um microscópio multifotônica que incorpora um laser de titânio Mai Tai safira ajustável entre um nm de comprimento de onda 710-990 nm de excitação. O comprimento de onda de excitação que usamos para gerar sinais YFP é 886 nm. Laser de alimentação varia de 30-100 mW, dependendo da profundidade de imagem.
- Capturar o sinal reflectido fluorescente utilizando uma objectiva Nikon 5X (NA, 0.5) que permite a amplafield-of-view de imagem (2 x 2 mm).
- Filtrar o sinal reflectido fluorescente utilizando um filtro 535/50 passa-banda e recolhê-la utilizando um PMT GaAsP (H7422PA-40, Hamamatsu, Bridgewater, New Jersey).
- Processar imagens usando software scanimage 6 em uma resolução de 2048 x 2048 pixels, usando uma taxa de varredura de 2 ms por linha para gerar imagens de alta resolução, YFP.
- Uma vez que imagens estiver concluída, remova o cérebro de uma placa de Petri com pinça e armazenar em BABB protegidos da luz para imagens de futuro. Para amostras coladas, remover o tecido através da execução de uma lâmina de barbear entre a cola e a placa de Petri com um ângulo não superior a 30 graus. Temos armazenado amostras em BABB por até um ano sem degradação visível.
3. Resultados representativos
As imagens representativas e vídeos mostrados aqui demonstram a alta resolução multifotônica capacidade de imagem possível graças compensação óptica. Imagiologia cerebral permite todopara YFP-rotulado neurônios nas diferentes camadas do hipocampo e do córtex que seja claramente visível na profundidade de 2 mm abaixo da superfície do tecido. Figura 1 mostra uma imagem representativa de uma vista coronal correspondente às características anatómicas do hipocampo a 2,92 milímetros caudal ao bregma 7. A profundidade da imagem na amostra foi 1,94 mm. Alguma desta diferença é devido à remoção do cerebelo na extremidade caudal do cérebro e o balanço foi devido ao encolhimento do processo de desidratação. Uma outra imagem da pilha mostra a camada de V / VI neurónios piramidais do neocórtex expressando YFP 2 mm abaixo da superfície do tecido (Figura 2). Todas as imagens foram obtidas usando o objetivo Nikon 5X e ampliação foi feito usando o recurso de zoom digital de aquisição de imagem em software scanimage.
Por zoom sobre o neocórtex, os axônios individuais e neurônios de neurônios piramidais da camada V do neocórtex são clarasly distinguíveis-se a 1,02 mm abaixo da superfície do tecido (Figura 3). Utilizando a pilha de imagens a partir da Figura 3, uma reconstrução 3D da região neurónio foi feito utilizando o software ImageJ 8 (Figura 4).
A capacidade de alta resolução do MPM também nos permite apresentar imagens de todo, os neurônios individuais. Aqui, mostramos uma reconstrução de uma camada de neurónios piramidais do neocórtex V em que os processos individuais dendríticas são claramente visíveis (Figura 5).

Figura 1 Imagem representativa de uma pilha de imagens 1,2 milímetros (0,8 - 2 mm abaixo da superfície do tecido). De cérebro de rato inteiro mostrando neocórtex e as diferentes camadas do hipocampo. Características do hipocampo são visíveis 1,1 milímetros abaixo da superfície do tecido e têm sido identificadas com as seguintesing código:. DG giro = dentada, GrDG = camada granular do DG, Lmol = lacunosum moleculare camada, Mol = camada molecular DG, ou = camada oriens, PoDG = polimorfo camada DG, Py = camada de células piramidais, Rad = estrato radiatum 7 Imagem é de 1,8 x 1,8 mm de tamanho, barra de escala = 200 m. A extremidade rostral do cérebro foi fixado a uma placa de Petri com a extremidade caudal para cima para o objectivo. Isso facilitou imagens no plano coronal.
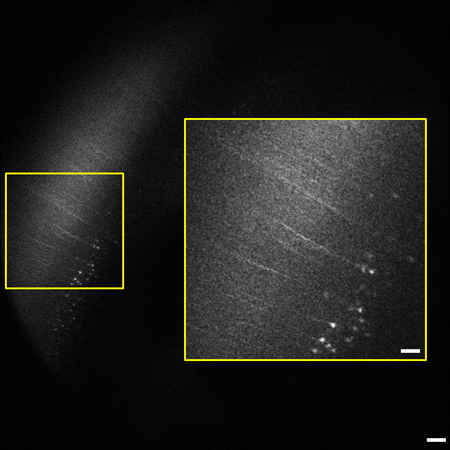
Figura 2 moldura Representante da pilha imagem 1,2 milímetros (0,8 - 2 mm abaixo da superfície do tecido). De cérebro de rato inteiro destacando o neocórtex. Células piramidais e processos expressando YFP em camada V / VI de córtex são visíveis 2 mm abaixo da superfície do tecido. O grau de rotulagem é consistente com relatórios anteriores da rotulagem escassa no neocórtex. 9 Inset (à direita) é ampliada a partir de b oxed área à esquerda. Imagem é de 1,8 x 1,8 mm de tamanho, barra de escala = 200 mM (50 mm de inserção).
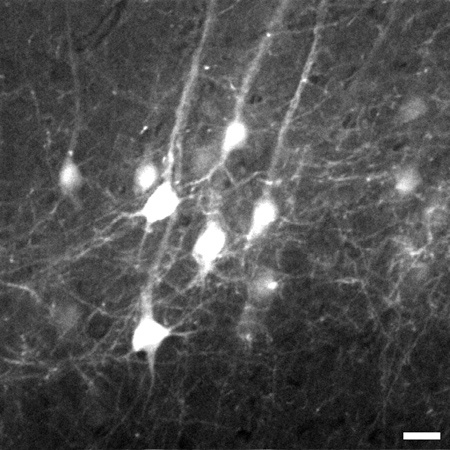
Figura 3. Moldura Representante tomadas 774 uM por baixo da superfície do tecido a partir da pilha de imagens de neurónios da camada V piramidais no neocórtex do cérebro. Stack vai de 700 mm a 1020 uM abaixo da superfície do tecido. Um zoom digital 8X foi usado para capturar detalhes como processos de multa. Imagem é de 225 x 225 M em tamanho, barra de escala = 20 um.

Figura 4. Imagem representativa de reconstrução 3D (225 x 225 x 320 mm) da pilha de imagem da Figura 3. Imagem é de 225 x 225 M em tamanho, barra de escala = 28 uM.
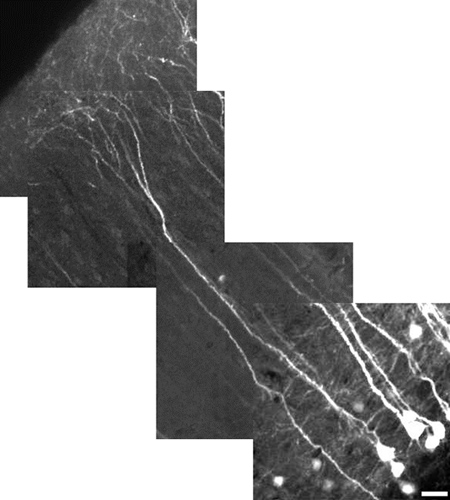
Figura 5. De alta resolução de imagem reconstruído de uma camada de neurónios piramidais do neocórtex V utilizando um zoom digital de 10x. Neurônio mede 485 mM de comprimento, barra de escala = 25 um. O campo de visão de cada telha imagem é 180 um x 180 jam. Cada telha é, a uma profundidade diferente (z-nível). As dendrites apicais corticais não, de um modo geral, YFP express, bem como a soma. Para ter os dois no mesmo campo de visão, como mostrado aqui, o poder foi reduzido para minimizar a saturação da soma, o que torna o dimmer olhar fino processo. Nossa ênfase aqui foi em demonstrar campo de visão, ao invés de detalhes. Para revelar detalhes mais finos, usar um zoom digital, foco em uma região sem soma, e aumentar a potência do laser.
Discussão
Enquanto padrão corantes orgânicos são compatíveis com uma variedade de solventes orgânicos, e, portanto, não representam um desafio especial para limpar os protocolos, as proteínas fluorescentes são menos tolerantes a mudanças em solvente. 4 O objetivo do presente trabalho foi o de superar uma séria limitação ópticos anteriores protocolos de compensação onde fluorescência de XFPs foi perdida ou seriamente prejudicado. As imagens que são aqui apresentados demonstram que a fluorescência de YF...
Divulgações
Experimentos em animais foram realizados de acordo com as diretrizes e regulamentos estabelecidos pela Care da Universidade de Yale animal Institucional e Comitê de uso.
Agradecimentos
Gostaríamos de agradecer a Jacob Solis por sua assistência em edição de vídeo.
Este trabalho foi financiado em parte por uma Prêmio CARREIRA NSF DBI-0953902 a MJ Levene.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Solução salina tamponada com fosfato | Sigma-Aldrich, Inc. | D8537 | 500 ml, pH 7,2 |
| Paraformaldeído | Electron Microscopy Sciences | 15710 | 10 x 10 ml de paraformaldeído, 16% |
| Álcool etílico | Americana Bioanalytical | AB00515-00500 | 500 ml, 200 proof |
| Álcool etílico | Pharmco Products, Inc. | 111000190 | 1 gal., 190 provas |
| O álcool benzílico | Sigma-Aldrich, Inc. | 402834 | 500 ml, 99% + |
| Benzoato de benzilo | Sigma-Aldrich, Inc. | B6630-IL | 500 ml, 99% ≥ |
| 5X/0.5 objetivo NA | Nikon | AZ Farinha Plano de 5X | 15 WD |
Referências
- Parra, S. G., Chia, T. H., Zinter, J. P., Levene, M. J. Multiphoton microscopy of cleared mouse organs. J. Biomed. Opt. 15, 036017 (2010).
- Vesuna, S., Torres, R., Levene, M. J. Multiphoton fluorescence, second harmonic generation, and fluorescence lifetime imaging of whole cleared mouse organs. J. Biomed. Opt. 16, 106009 (2011).
- Zucker, R. M. Whole insect and mammalian embryo imaging with confocal microscopy: Morphology and apoptosis. Cytometry. A69, 1143-1152 (2006).
- Sakhalkar, H. S. Functional imaging in bulk tissue specimens using optical emission tomography: Fluorescence preservation during optical clearing. Phys. Med. Biol. 52, 2035-2054 (2007).
- Dazai, J., Spring, S., Cahill, L. S., Henkelman, R. M. Multiple-mouse Neuroanatomical Magnetic Resonance Imaging. J. Vis. Exp. (48), e2497 (2011).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed. Eng. Online. 2, (2003).
- Paxinos, G., Franklin, K. B. J. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M., Nerbonne, J. M., Lichtman, J. W., Sanes, J. R. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28, 41-51 (2000).
- Hama, H. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neuro. 14, 1481-1488 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados