Method Article
De bajo peso molecular de proteínas en el enriquecimiento de las películas delgadas de silicio mesoporosos para el descubrimiento de biomarcadores
En este artículo
Resumen
Hemos desarrollado una tecnología basada en película delgada de sílice mesoporoso para la recuperación selectiva de proteínas de bajo peso molecular y péptidos de suero humano. Las propiedades físico-químicas de nuestros chips mesoporosos fueron finamente sintonizada para proporcionar un control importante en el enriquecimiento de péptido y por lo tanto el perfil de la proteoma de suero para el diagnóstico.
Resumen
La identificación de marcadores biológicos circulantes tiene un gran potencial para los no invasivos en el diagnóstico precoz y pronóstico, así como para el seguimiento de la eficacia terapéutica. 3.1 La circulación de proteoma de bajo peso molecular (PBPM), integrado por pequeñas proteínas desprenden de los tejidos y células, o fragmentos peptídicos derivados de la degradación proteolítica de proteínas más grandes, se ha asociado con el estado patológico en pacientes y probablemente refleja el estado de enfermedad. 4,5 A pesar de estas aplicaciones clínicas potenciales, el uso de espectrometría de masas (MS) para perfilar la PBPM desde fluidos biológicos ha demostrado ser muy difícil debido a la gran rango dinámico de las concentraciones de proteínas y péptidos en el suero. 6 Sin muestra pre-tratamiento, algunas de las proteínas más abundantes altamente oscurecer la detección de baja abundancia de especies en suero / plasma. Actuales enfoques basados en la proteómica, como de dos dimensiones en gel de poliacrilamida-elmétodos ectrophoresis (2D-PAGE) y la proteómica son de escopeta en mano de obra intensiva, bajo rendimiento y la idoneidad de una oferta limitada para aplicaciones clínicas. 9.7 Por lo tanto, una estrategia más eficaz se requiere para aislar PBPM de la sangre y permitir que el cribado de alto rendimiento de las muestras clínicas .
A continuación, presentamos una forma rápida, eficiente y confiable de varios fraccionamiento sistema basado en los chips de sílice mesoporosos para apuntar específicamente y enriquecer PBPM. 10,11 mesoporosos de sílice (MPS) películas delgadas con características ajustables a escala nanométrica se fabricaron utilizando la vía de copolímero de tres bloques de plantilla . El uso de plantillas diferentes polímeros y las concentraciones de polímero en la solución de precursor, varias distribuciones de tamaño de poro, estructuras de poros, conectividad y propiedades superficiales se determinaron y se aplica para la recuperación selectiva de proteínas de baja masa. El análisis selectivo de los péptidos enriquecidos en las diferentes subclases de acuerdo a sus propiedades físico-químicas se en-Hance la eficiencia de la recuperación y la detección de especies de baja abundancia. En combinación con la espectrometría de masas y el análisis estadístico, se demostró la correlación entre las características nanofase de las películas delgadas de sílice mesoporosos y la especificidad y la eficacia de la cosecha baja proteoma de masas. Los resultados presentados en este documento revelan el potencial de la tecnología basada en la nanotecnología para proporcionar una poderosa alternativa a los métodos convencionales de recolección PBPM de fluidos biológicos complejos. Debido a la capacidad de sintonizar las propiedades de los materiales, la capacidad de producción de bajo costo, la sencillez y la rapidez de la toma de muestras, y los requerimientos de la muestra muy reducidos para el análisis, esta novela de la nanotecnología tendrá un impacto sustancialmente el campo de la investigación de biomarcadores proteómicos y proteómica clínica evaluación.
Protocolo
1. Fabricación de chips
- Crear la solución de revestimiento para el chip, empezando con la solución de precursor de silicato hidrolizado. Mezclar 14 ml de tetraetilortosilicato (TEOS) con 17 ml de etanol, 6,5 ml de agua desionizada y 0,5 ml de HCl 6M bajo fuerte agitación (1200 rpm) usando un revolver placa caliente. Calentar esta solución a 80 ° C durante 2 horas, manteniendo la agitación constante.
- Se preparan soluciones de polímero mediante la adición de la deseada tri-bloque coploymer (Pluronic F127, L121 y P123) a 10 ml de etanol a temperatura ambiente con fuerte agitación. Completa la mezcla por adición de 7,5 ml de la solución de silicato (del paso 1,1) en la solución del copolímero tri-bloque seguido de 2 horas de fuerte agitación a temperatura ambiente. Esto representa la solución de revestimiento final.
- Aplicar 1 ml de solución de revestimiento a una oblea de silicio de 4 pulgadas por recubrimiento por rotación a una velocidad de 1500 rpm durante 20 segundos. Entonces el calor a 80 ° C durante 12 horas.
- Calentar las películas para quitar Su orgánicarfactant elevando la temperatura de 1 ° C por minuto hasta 425 ° C y hornear durante 5 horas.
- Trate previamente la sílice mesoporoso (MPS) con la superficie del chip incineración con plasma de oxígeno (Plasma Asher - marzo de plasma del sistema). (O 2 Caudal: 80 cm ³, potencia: 300 W, tiempo: 10 minutos).
- Opcional superficie modificación química: virutas silanate en 3% en un organosilano metanol: agua DI (19:1) solución durante 72 horas a temperatura ambiente en un N 2 guantera. Enjuagar secuencialmente con metanol y agua desionizada. Cure fichas a 110 ° C durante 15 minutos en un horno con ventilador accionado.
2. Ejemplo de Pre-tratamiento
- Añadir TFA y ACN para cada muestra de suero de tal manera que las concentraciones finales son 0,01% de TFA y 5% de ACN. Vortex para mezclar.
- Agitar estas muestras en una mesa de vórtice agitador a temperatura ambiente durante 30 minutos.
3. El fraccionamiento de suero
- Pre-hornear virutas durante la noche en un horno a 160 ° C. Por otra parte, almacenamientoe las fichas en un desecador hasta su utilización para evitar la hidratación de la superficie por el agua en el aire ambiente.
- El uso de aire comprimido a desempolvar cualquier partícula que pueda haber en la superficie del chip.
- Cortar prefabricado, comprado CultureWell cámaras cubreobjetos para incluir el número deseado de pozos. Cubreobjetos limpia con etanol al 100% y luego colóquela sobre una superficie de chips de MPS. Presione hacia abajo cubreobjetos con unas pinzas para asegurar un sellado completo con chip.
- Pipetear 10 L de muestra de suero en cada uno de 3 mm bien. Incubar durante 30 minutos en una cámara humidificada, a temperatura ambiente.
- Pipeta hasta el suero de los pozos y deseche. Pipetear 10 L de agua desionizada a cada pozo para lavar proteínas más grandes. Repite 4 veces.
- Verter de 5 l de tampón de elución (0,1% TFA + 50% ACN) a cada pocillo de la muestra. Pipetear arriba y hacia abajo 30 veces mientras se mueve alrededor de la punta de la pipeta en el pozo para mezclar el tampón de elución. (Solamente se aplican tampón de elución a 1-2 muestras en un tiempo para evitar tampón de eluciónse evapore tan rápidamente).
- Después de mezclar, pipetear todo el tampón de elución y colocar en un tubo de microcentrífuga hasta que esté listo para realizar análisis MALDI-TOF.
- Con el fin de emular la complejidad de una muestra biológica y para evaluar el efecto de enriquecimiento en la cosecha de las especies de bajo peso molecular con nuestro sistema de fraccionamiento en el chip, se seleccionaron y se reunió una mezcla estándar de proteínas y péptidos de conteo veintiséis especies diferentes con una amplia distribución de pesos moleculares (900-66 500 Da) y PI (4,0 a 10,2) y concentraciones (0.5-8 pmol / l) (véase la lista de proteína en la Tabla 1).
4. MALDI-TOF análisis de los péptidos
- Punto 0.5 l de la muestra a la placa de MALDI objetivo y dejar secar.
- Punto 0,5 matriz l (α-ciano-4-hidroxicinámico (CHCA), 5 g / l) o una solución saturada de ácido trans-3 ,5-dimetoxi-4-hidroxicinámico (SA) en 50% de acetonitrilo que contenía 0,1% de TFA y permitir a co-cristalización.
- Punto 0.5 l de solución de calibración para cada punto de calibración y deje que se seque.
- Inserte la placa de destino en el espectrómetro de masas MALDI-TOF. La máquina debe estar configurado en modo positivo con un reflector de la intensidad del láser de 4200 y 3000 disparos por ejemplo. El rango de masas seleccionado debe ser 800 a 5000 Da con una masa objetivo de 2000 Da.
- Realice mismo análisis MALDI-TOF en el modo lineal, sino cambiar el rango de masas de 900 a 10.000 Da o Da 3000 a 70.000 y una masa objetivo de 5000 Da.
5. Análisis de Datos
- Los espectros de crudo fueron procesados con el software ConvertPeakList y los datos se exportan a SpecAlign software para procesamiento previo. Todos los espectros fueron alineados utilizando el método de correlación PAFFT y las intensidades se normalizaron a la corriente total de iones (TIC) en cada espectro correspondiente. Todos los espectros se alisa y se de-divulgó con el factor de 4 y 0,5, respectivamente. Los picos se detectaron con una línea de base de 0,5 ventana de masa, de 21 y la alturaratio de 1,5, los valores negativos fueron retirados antes del análisis.
- La agrupación jerárquica se ha realizado mediante Cluster 3.0 y visualizados con el software de Mapletree. MALDI MS de datos (m / z pico de intensidad) es log-transformados, normalizada, y centrado en la mediana. De correlación de Pearson se utilizó para calcular la distancia entre las muestras, y la agrupación de ligamiento completo se realizó.
- Un estudiante independiente t-test fue utilizado para la comparación entre los grupos (n = 2 grupos) para cada pico detectado MS antes del análisis de agrupamiento jerárquico no supervisado. Un valor de p de 0,02 o menos fue considerado significativo para seleccionar los péptidos y las proteínas diferencialmente cosechados entre los distintos chips de mesoporosos proteómicos (poros grandes frente a pequeños poros).
6. Los resultados representativos
Como se muestra en la Figura 1, en este estudio se han fabricado una serie de películas delgadas de sílice mesoporosos con una variedad de nanotextures y explorado exhaustivamente elIR en uso selectivo Figura 2a capturar y enriquecer péptidos y proteínas LMW partir de suero humano. yb muestran los espectros de MS de la muestra de suero sin procesar para péptidos en el intervalo de 900 a 10.000 Da y para las proteínas en el intervalo de 3.000 ~ 70.000 Da, respectivamente . Estos espectros ilustran la supresión de la señal en la región LMW debido a la presencia de bien ionizado, muy abundante, de alto peso molecular (HMW) de proteínas tales como albúmina. Figura 2c y d muestran los espectros de MS de la muestra de suero después de fraccionamiento por el L121 MPS (tamaño de poro, 6 nm). La mayoría de las moléculas grandes se han agotado, resultando en un enriquecimiento significativo de los componentes LMW. Como control, la misma muestra de suero se aplicó sobre una superficie no porosa de sílice puro para evaluar la especificidad de las películas delgadas de MPS para la recuperación PBPM. Como puede verse en la Figura 2e y f, no hubo cosecha significativa de peplas mareas o las proteínas de la sílice porosa. Así se puede concluir que era la arquitectura mesoporoso y no la afinidad superficie de la sílice que constituye el factor predominante en el enriquecimiento de PBPM.
Precisamente controladas variaciones en el tamaño de poro se puede lograr mediante el uso de copolímeros con diferentes longitudes de bloques hidrófobos. Mediante el uso de las proteínas y la mezcla de péptidos diseñados, el efecto del tamaño de poro en el péptido LMW y la eficacia de recuperación de proteína se investigó utilizando MPS películas delgadas preparadas a partir de cuatro tensioactivos Pluronic (F127, P123, L121, L121 y más agente de hinchamiento) con diferentes relaciones de volumen de los componentes hidrófilos e hidrófobos para formar tamaños de poro de 3,7 nm, 5.2, 7.4 nm y 9,0 nm, respectivamente. Esta gama de tamaños de poro condujo a la recuperación de un repertorio diferente de péptidos y proteínas a partir de la misma muestra de suero a través de tamaño y forma de exclusión (Figura 3). Los espectros de proteínas de alto peso molecular en demonstrate el corte molecular de cada tipo de chip. Además de la reducción dependiente del tamaño de las proteínas de alto peso molecular, el fraccionamiento en el chip de la solución de estándares muestra un diferencial y el enriquecimiento selectivo de especies LMW asociados con los tamaños de poro. El agrupamiento de dos vías jerárquico presenta en la Figura 3b muestra el patrón LMW normas enriquecimiento obtenido con el MSC diferente. Incluso si todos los péptidos están por debajo del corte molecular de los chips, existe una correlación positiva entre los tamaños de poro y el peso molecular de las especies atrapadas. El MSC con poros grandes, de hasta 9 nm, preferentemente cosechar grandes péptidos, péptidos más pequeños mientras se recuperan más eficazmente por los chips con poros más pequeños. La transformación estructural de la disposición mesoporoso se llevó a cabo mediante la regulación de la concentración del polímero plantilla. El aumento de la concentración del polímero plantilla resultó en una curvatura reducida interfacial entre las fasesdel agua, el copolímero, y el silicato, por consiguiente, iniciando la progresión interrelacionada de un esférico a una estructura cilíndrica. Pluronic F127, con su alto peso molecular, posee este alto grado de periodicidad estructural. Al aumentar la concentración de F127 en el inicio de solución, diferentes nanoestructuras MPS película delgada periódicos se puede obtener de nanoestructura 3D para nanoestructura 2D. Las nanoestructuras 3D cúbicos y hexagonales de nido de abeja, que posee la interconexión nanopore más deseable y la morfología de nanopore más accesible, exhiben un rendimiento superior en forma selectiva enriquecer péptidos de BPM que la estructura hexagonal 2D, a pesar de que comparten las mismas distribuciones de tamaño de poro y la misma moleculares de corte para el suero fraccionamiento (Figura 4). También simplificado la conjugación de organo-silano en los chips de MPS mediante la introducción de plasma de oxígeno calcinación para pretratar la superficie del chip. Con el fin de estudiar cualitativamente el efecto electrostático en selectoive en el chip de enriquecimiento, se utilizan las proteínas y la mezcla de péptidos. MS análisis de la solución de estándares proteómicos fraccionó en los chips de MPS preparados con L121 y conjugados con los grupos funcionales químicos se presentan en la Figura 5. La carga positiva y negativamente cargado los péptidos y proteínas LMW son capturados en el aniónico y los chips catiónicos respectivamente. La comparación cuantitativa de los chips de MPS múltiples en la recuperación de los péptidos con carga neta positiva se muestra en la Figura 5a. Los chips con carga negativa y las fichas sin ningún tipo de modificación (con un cargo negativo menor originalmente) muestran el enriquecimiento significativamente mayor para los péptidos que los chips modificados con APTES (-NH 2). A la inversa, los chips cargados positivamente MPS poseen capacidad excepcional para recuperar esos péptidos con carga neta negativa, como se demuestra en la Figura 5b. Mientras α-endorfina no muestra un cambio significativo due a su PI alrededor de 6.

Figura 1. Principio de MPS fraccionamiento fichas y el enriquecimiento de BPM. Después muestra manchas en la superficie, las proteínas y péptidos LMW están atrapados en los poros, mientras que las especies más grandes se mantuvo fuera de los poros y se elimina durante las etapas de lavado. Las fracciones enriquecidas se eluyen a continuación y se analizaron por MALDI.
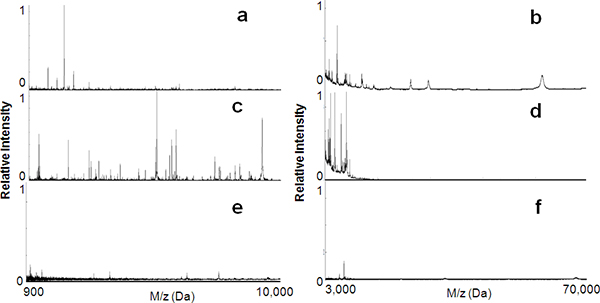
Figura 2. Enriquecimiento péptido utilizando los chips de sílice mesoporosos de película delgada. MALDI MS perfiles, tanto en el rango de masa baja (900 a 10 000 Da) y el rango de masas de alta (3000 a 70 000 Da) antes de (a, b) y después (c, d) el tratamiento de suero en las películas delgadas de sílice mesoporosos ( L121, de 6 nm). La recuperación molecular se reduce significativamente cuando se utiliza en blanco superficies no porosas de sílice (e, f).

Figura 3. Enriquecimiento molecular de corte y el tamaño depende de los chips de MPS. (A) vista ampliada de los espectros de MALDI demostrando la característica molecular de corte de cada uno de los chips MPS correlacionan con el tamaño de poro. (B) la agrupación de dos vías jerárquicas de las características de una mezcla de péptidos entre los diferentes chips. La intensidad del color rojo o amarillo indica la concentración de péptido relativa. Poros más grandes mejorado la recolección de grandes péptidos (3600 a 8500 Da), mientras que los péptidos pequeños (900 a 3500 Da) se recuperaron preferentemente desde los chips con poros más pequeños.
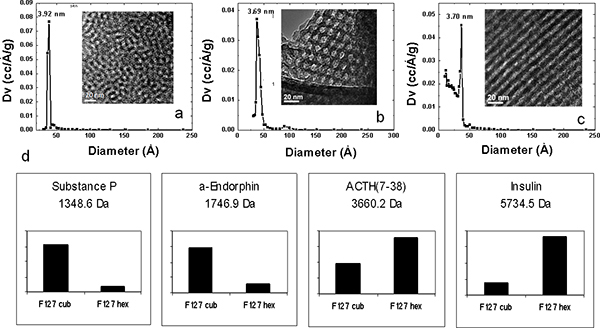
Figura 4. Caracterizaciones físicas de películas delgadas de MPS y la recuperación selectiva con diferentes nanoestructuras. XRD patrones (a, b, c), TEM (recuadro a, b, c), Pluronic F127 a diferentes concentraciones en la solución de precursor: 4,0 x10 -3 M (una), 6,0 x 10 -3 M (b), y 8,0 x 10 -2 M (c). (D) del gráfico de barras de la intensidad de detección que ilustra la recuperación selectiva péptidos en 3D cúbicos y 3D hexagonales F127 virutas proteómicos (Cub y hexagonal, respectivamente). Las modificaciones estructurales diferentes presentar un enriquecimiento selectivo.
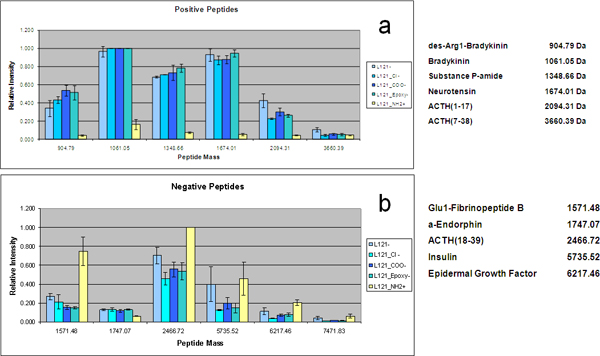
Figura 5. Carga específica de recuperación para los chips con funciones de superficie. Barra gráfica de la intensidad de MS de detección de péptidos selectivamente capturadas en los chips funcionalizados. De acuerdo con su punto isoeléctrico, los péptidos son carga positiva o negativa a pH 7,0. (A) péptidos positivos ((1) des-Arg1-bradiquinina, (2) La bradiquinina, (3) la sustancia P-amida, (4) neurotensina, (5) de ACTH (1-17), (6) de ACTH (7 - 38)) están específicamente enriquecido en la carga negativa-surcaras. (B) péptidos negativos ((7) Glu1-fibrinopéptido B, (8) α-endorfina, (9) de insulina de ACTH (18-39), (10), (11) de EGF, (12) similar a la insulina GFII) son específicamente enriquecido en las superficies de carga positiva.
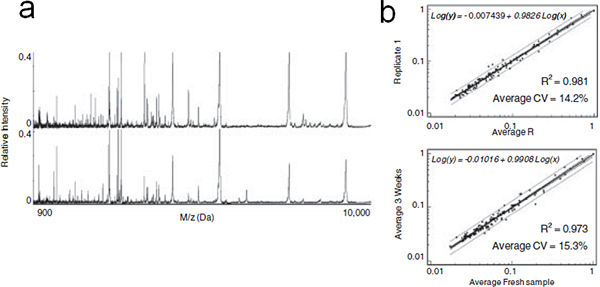
Figura 6. On-chip de estabilización de suero fraccionado. (A) Representante perfiles MALDI de péptidos y proteínas LMW eluye inmediatamente después de fraccionamiento de suero (la parte superior) o después de 3 semanas de on-chip de almacenamiento a temperatura ambiente (inferior). (B) De arriba a abajo: el análisis de regresión lineal de las intensidades medias de los picos detectados de EM en cada repetición en comparación con el replicar de un recién fraccionado de suero y se fraccionó suero después de MPS 3wk de almacenamiento de los chips a temperatura ambiente. La ecuación, CV y el coeficiente de determinación (R 2) se indican.
Discusión
Se están acumulando pruebas de que el bajo peso molecular región del proteoma circulatorio es una rica fuente de biomarcadores de diagnóstico para la detección precoz de la enfermedad. En esta tecnología, hemos presentado una serie de chips de silicio mesoporosos, con tamaños de poro diferentes, las estructuras de los poros y modificaciones para enriquecer de manera selectiva péptidos y proteínas de bajo peso molecular. Para evaluar la estabilidad de proteínas, los chips de MPS se incubaron con suero humano, se secó después del lavado, y se almacena para 3wk a temperatura ambiente. Los patrones de proteínas / péptidos obtenidos fueron comparables con las de suero recién fraccionada (Figura 6a), confirmado por los resultados del análisis estadístico mostró en la Figura 6b. La variabilidad de las señales de pico medidos por el CV medio se estimó en 12,7% para el suero crudo y en el 14,2% de las muestras fraccionadas. Las variaciones marginales podría ser debido a la variabilidad interna del instrumento MALDI y sugirió que la juntan-chip de pretratamiento y almacenamiento no indujo ninguna alteración significativa de los perfiles de proteínas MS. El mismo experimento se ha realizado en el silicio poroso no. El suero seco recuperado después del almacenamiento en la superficie de silicio se fraccionó en los chips MPS antes del análisis MALDI. El perfil de pobre MS obtenidos demostraron la ventaja de estabilización de la superficie mesoporoso. En analogía con los mecanismos previamente postulado, que postula que las especies LMW atrapados dentro de los nanoporos se han conservado de la degradación a través de la exclusión por tamaño de las proteasas, o por la inhibición estérica de su actividad proteolítica en el espacio confinado de los nanoporos. El método basado en chip de MPS podría ser una herramienta poderosa en el péptido y el perfil de proteínas LMW de estudio complejo de los fluidos biológicos. Los chips de MPS son baratas de fabricar y permitir la producción a escala hasta alcanzar el procesamiento simultáneo de un gran número de muestras, proporcionando características ventajosas para exploratorio cribado y biomarcador de descubrimiento.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue financiado por la Alianza de NanoHealth pre-centro de premio (W81XWH-11-2-0168) y Texas Centro de Nanomedicina Cáncer (1U54CA151668-01).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Tetraetoxisilano | Sigma-Aldrich | 131903 | 98% |
| Giro revestidor | Brewer Ciencia | Cee 200X | |
| Plasma Asher | Nordson de marzo | AP-600 | |
| Elipsómetro espectroscópica | JA Woollam Co. | M-2000DI | |
| MALDI-TOF | Applied Biosystems | Voyager-DE-STR | |
| α-ciano-4-hidroxicinámico | Sigma-Aldrich Co. | C8982 | Matriz para MALDI-TOF |
| trans-3 ,5-dimetoxi-4-hidroxiácido cinámico | Sigma-Aldrich Co. | 85429 | Matriz para MALDI-TOF |
| Revuelva la placa caliente | Thermo Scientific | 11-475-30Q | |
| CultureWell cámaras cubreobjetos | Sigma-Aldrich | GBL103350 | 3 mm de diámetro. X 1 mm de profundidad, 3.10 l, estéril |
| Pluronic F 127 | BASF | PEO 106-70-PPO PEO 106 | |
| Pluronic L121 | BASF | PEO 5-PPO 70-PEO 5 | |
| Pluronic P123 | BASF | PEO 20-70-PPO PEO 20 |
Tabla 1. Propiedades físico-químicas y concentraciones diseñados (peso molecular y IsoPunto-eléctrico) del péptido seleccionado y los estándares de proteína.
Referencias
- Wulfkuhle, J. D., Liotta, L. A., Petricoin, E. F. Proteomic applications for the early detection of cancer. Nat. Rev. Cancer. 3, 267-275 (2003).
- Etzioni, R. The case for early detection. Nat. Rev. Cancer. 3, 243-252 (2003).
- Hanash, S. M., Pitteri, S. J., Faca, V. M. Mining the plasma proteome for cancer biomarkers. Nature. 452, 571-579 (2008).
- Liotta, L. A., Ferrari, M., Petricoin, E. Clinical proteomics: written in blood. Nature. 425, 905-905 (2003).
- Petricoin, E. F., Belluco, C., Araujo, R. P., Liotta, L. A. The blood peptidome: a higher dimension of information content for cancer biomarker discovery. Nat. Rev. Cancer. 6, 961-967 (2006).
- Anderson, N. L., Anderson, N. G. The human plasma proteome: history, character, and diagnostic prospects. Mol. Cell Proteomics. 1, 845-867 (2002).
- Gorg, A., Weiss, W., Dunn, M. J. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 4, 3665-3685 (2004).
- Liu, H., Sadygov, R. G., Yates, J. R., 3rd, . A model for random sampling and estimation of relative protein abundance in shotgun proteomics. Anal. Chem. 76, 4193-4201 (2004).
- Rabilloud, T. Two-dimensional gel electrophoresis in proteomics: old, old fashioned, but it still climbs up the mountains. Proteomics. 2, 3-10 (2002).
- Hu, Y. Tailoring of the nanotexture of mesoporous silica films and their functionalized derivatives for selectively harvesting low molecular weight protein. ACS Nano. 4, 439-451 (2010).
- Bouamrani, A. Mesoporous silica chips for selective enrichment and stabilization of low molecular weight proteome. Proteomics. 10, 496-505 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados