Method Article
Niedermolekulare Protein Enrichment auf mesoporösem Siliciumdioxid Dünnschichten für Biomarker Discovery
In diesem Artikel
Zusammenfassung
Wir haben eine Technologie auf mesoporösen Siliciumdioxid-Dünnschicht zur selektiven Rückgewinnung von niedermolekularen Proteinen und Peptiden aus Humanserum. Die physikalisch-chemischen Eigenschaften unserer mesoporösen Chips wurden fein abgestimmt, um wesentliche Bereicherung in der Peptid-Kontrolle stellen und damit das Profil Serumproteom für diagnostische Zwecke.
Zusammenfassung
Die Identifizierung von zirkulierenden Biomarkern ein großes Potenzial für die nicht invasive Ansätze bei der frühen Diagnose und Prognose sowie zur Überwachung der therapeutischen Wirksamkeit. 1-3 Das zirkulierende niedrigem Molekulargewicht Proteoms (LMWP) von kleinen Proteinen, die aus Geweben und Zellen abgestoßen oder zusammengesetzt Peptidfragmente aus dem proteolytischen Abbau von größeren Proteinen abgeleitet sind, mit den pathologischen Zustand bei Patienten in Verbindung gebracht worden und wahrscheinlich auf den Zustand der Krankheit. 4,5 Trotz dieser mögliche klinische Anwendungen, die Verwendung von Massenspektrometrie (MS) ein Profil des LMWP aus biologischen Flüssigkeiten hat sich als sehr schwierig aufgrund der großen dynamischen Bereich von Protein-und Peptid-Konzentrationen im Serum. 6 Ohne Probe vor der Behandlung, zu verschleiern einige der höchst vorkommenden Proteine die Erkennung von Low-Fülle Spezies im Serum / Plasma. Übliche Proteom-Ansätze, wie zweidimensionale Polyacrylamid-Gel-electrophoresis (2D-PAGE) und Schrotflinte Proteomik Methoden sind arbeitsintensiv, geringer Durchsatz und bieten nur bedingt geeignet für klinische Anwendungen. 9.7 Daher ist eine wirksamere Strategie erforderlich, um LMWP aus Blut zu isolieren und ermöglichen die Hochdurchsatz-Screening von klinischen Proben .
Hier präsentieren wir eine schnelle, effiziente und zuverlässige Multi-System-Fraktionierung auf mesoporösen Siliciumdioxid-Chips basieren, um gezielt und bereichern LMWP. 10,11 mesoporösen Silica (MPS) dünne Filme mit einstellbaren Eigenschaften im Nanobereich hergestellt wurden unter Verwendung des Triblockcopolymer Vorlage Weg . Mit Hilfe verschiedener Vorlagen Polymer-und Polymer-Konzentrationen in der Vorläufer-Lösung wurden verschiedene Porengrößenverteilungen, Porenstrukturen, Konnektivität und Oberflächeneigenschaften bestimmt und bewarb sich um selektive Gewinnung von Proteinen mit geringer Masse. Die selektive Analyse der angereicherten Peptide in verschiedenen Unterklassen nach ihrer physikalisch-chemischen Eigenschaften wird deverknüpft, wird die Wirksamkeit der Gewinnung und Nachweis von geringer Menge Arten. In Kombination mit der Massenspektrometrie und statistische Analyse haben wir gezeigt, die Korrelation zwischen den Nanophasen Eigenschaften der mesoporösen Siliciumdioxid-Dünnschichten und der Spezifität und Wirksamkeit von geringer Masse Proteom Ernte. Die hier vorgelegten Ergebnisse zeigen das Potenzial der Nanotechnologie-basierten Technologie, um eine leistungsstarke Alternative zu herkömmlichen Verfahren zur Ernte von LMWP komplexen biologischen Flüssigkeiten bieten. Aufgrund der Fähigkeit, um die Materialeigenschaften zu stimmen, die Fähigkeit zur Low-Cost-Produktion, die Einfachheit und Schnelligkeit der Probenentnahme sowie den stark reduzierten Anforderungen an die Stichprobe für die Analyse, wird dieses neuartige Nanotechnologie wesentlich Einfluss auf das Gebiet der Proteom-Forschung und klinische Biomarker proteomische Beurteilung.
Protokoll
1. Chipfertigungstechnologie
- Erstellen der Beschichtungslösung für den Chip, indem man mit dem hydrolysierten Silikat Vorläuferlösung. Mischen 14 ml Tetraethylorthosilicat (TEOS) mit 17 ml Ethanol, 6,5 ml deionisiertes Wasser und 0,5 ml 6 M HCl unter starkem Rühren (1200 Umdrehungen pro Minute) unter Verwendung einer Heizplatte gerührt. Erhitzen dieser Lösung bei 80 ° C für 2 Stunden, Halten der Rühren konstant.
- Planen Polymerlösungen mit indem die gewünschte Triblock-coploymer (Pluronic F127, L121 und P123) zu 10 ml Ethanol bei Raumtemperatur unter starkem Rühren. Führen der Mischung durch Zugabe von 7,5 ml der Silikatlösung (aus Schritt 1.1) in den Tri-Block-Copolymer-Lösung für 2 Stunden starkem Rühren bei Raumtemperatur. Dies ist der letzte Beschichtungslösung.
- Es wird 1 ml der Beschichtungslösung auf ein 4 Zoll-Siliciumwafer durch Schleuderbeschichten bei einer Geschwindigkeit von 1500 UpM für 20 Sekunden. Dann wird Wärme bei 80 ° C für 12 Stunden.
- Erhitzen Sie die Filme auf organische su entfernenrfactant durch Erhöhen der Temperatur 1 ° C pro Minute auf 425 ° C und dann 5 Stunden gebacken.
- Vorbehandeln die mesoporösen Siliciumdioxid (MPS) Chip-Oberfläche mit Sauerstoff-Plasma-Veraschung (Plasma Asher - March Plasma Systems). (O 2 Durchfluss: 80 sccm, Leistung: 300 W, Zeit: 10 Minuten).
- Optional Oberfläche chemische Modifikation: silanisiert Chips in 3% Organosilan in einer Methanol: DI-Wasser (19:1)-Lösung für 72 Stunden bei Raumtemperatur unter N 2-Handschuhfach. Spülen Sie nacheinander mit Methanol und DI-Wasser. Cure-Chips bei 110 ° C für 15 Minuten in einem Gebläse-betriebenen Ofen.
2. Probenvorbehandlung
- In TFA und ACN zu den Serumproben, so dass die Endkonzentration 0,01% TFA und 5% ACN sind. Vortex mischen.
- Schütteln diese Proben auf einem Tisch Vortex-Schüttler bei Raumtemperatur für 30 Minuten.
3. Serum-Fraktionierung
- Pre-Bake-Chips über Nacht in einem Ofen bei 160 ° C Alternativ store die Chips in einem Exsikkator bis zur Verwendung um die Befeuchtung der Oberfläche durch das umgebende Wasser in der Luft zu verhindern.
- Verwenden Sie Druckluft zu entstauben, dass Partikel, die auf der Oberfläche des Chips sein kann.
- Schneiden Sie vorgefertigte, gekauft CultureWell chambered Deckglas, um die gewünschte Anzahl von Brunnen gehören. Sauberes Deckglas mit 100% Ethanol und dann am MPS Chipoberfläche. Drücken Sie nach unten Deckglas mit einer Pinzette, um eine vollständige Abdichtung mit Chip zu gewährleisten.
- Je 10 ul Serum Probe in jedem gut 3 mm. Inkubieren für 30 Minuten in einer befeuchteten Kammer bei Raumtemperatur.
- Pipette bis Serum aus Brunnen und entsorgen. Je 10 ul entionisiertem Wasser in jede Vertiefung weg zu waschen größeren Proteinen. 4 Mal wiederholen.
- Je 5 ul Elutionspuffer (0,1% TFA + 50% ACN) zu jeder Probe gut. Und Abpipettieren 30-mal, während Sie die Pipettenspitze herum in den Brunnen, um den Elutionspuffer zu mischen. (Nur Anwendung Elutionspuffer auf 1-2 Proben zu einem Zeitpunkt zu verhindern Elutionspufferverdunstet so schnell).
- Nach dem Mischen pipettieren alle Elutionspuffer und Ort in einem Mikrozentrifugenröhrchen erst unmittelbar vor der MALDI-TOF-Analyse durchzuführen.
- Um die Komplexität einer biologischen Probe zu emulieren und um die Bereicherung Effekt bei der Ernte niedermolekulare Spezies mit unserem On-Chip-Fraktionierung System evaluieren, haben wir uns zusammengesetzt und eine Standard-Mischung von Proteinen und Peptiden zählen 26 verschiedene Arten mit einem breiten Bereich der Molekulargewichte (900 bis 66 500 Da) und PiS (4,0-10,2) und Konzentrationen (0,5-8 pmol / ul) (siehe Liste Protein in Tabelle 1).
4. MALDI-TOF Analyse von Peptiden
- Spot 0,5 ul Probe auf MALDI-Target Platte und trocknen lassen.
- Landschaftliches 0,5 ul Matrix (α-Cyano-4-hydroxyzimtsäure (CHCA), 5 g / L) oder gesättigten Lösung von trans-3 ,5-dimethoxy-4-hydroxyzimtsäure (SA) in 50% Acetonitril, enthaltend 0,1% TFA und erlauben, Co-Kristallisation.
- Spot 0,5 ul Kalibrierlösung jeder Kalibrierung vor Ort und trocknen lassen.
- Legen Sie die Zielscheibe in MALDI-TOF-Massenspektrometer. Die Maschine sollte zu positiven Reflektor-Modus mit einer Laserintensität von 4200 und 3000 Aufnahmen pro Probe eingestellt werden. Die ausgewählten Massenbereich sollte 800 bis 5000 Da mit einer Ziel-Masse von 2000 Da sein.
- Führen Sie dieselben MALDI-TOF-Analyse im linearen Modus ändern, aber die Masse Bereich auf 900 bis 10.000 Da oder 3000 auf 70.000 Da und einem Ziel-Masse von 5000 Da.
5. Datenanalyse
- Die Roh-Spektren wurden mit dem ConvertPeakList Software verarbeitet und die Daten exportiert wurde, um Software für die Vorverarbeitung SpecAlign. Alle Spektren wurden ausgerichtet mit dem PAFFT Korrelation Verfahren und Intensitäten wurden auf insgesamt Ionenstrom (TIC) in jedem entsprechenden Spektrum normalisiert. Alle Spektren wurden geglättet und mit Faktor 4 und 0,5 entrauschte bzw. Die Peaks wurden mit einem Ausgangswert von 0,5, Massen-Fenster von 21 und Höhe erfasstVerhältnis 1,5, wurden negative Werte vor der Analyse entfernt.
- Hierarchical Clustering wurde unter Verwendung von Cluster 3.0 und visualisiert mit Mapletree Software. MALDI-MS-Daten (m / z Peakintensitäten) war log-transformiert, normalisiert, und die mediane zentriert. Pearson-Korrelation wurde verwendet, um den Abstand zwischen den Proben zu berechnen, und vollständige Bindung Clustering durchgeführt.
- Eine unabhängige Student t-Test wurde zum Vergleich zwischen den Gruppen (n = 2-Gruppen) für jeden erkannten MS-Peak vor unüberwachten hierarchischen Cluster-Analyse verwendet. Ein P-Wert von 0,02 oder niedriger wurde als signifikant differentiell geerntet Peptiden und Proteinen unter den verschiedenen mesoporösen Proteom-Chips (Große Poren verglichen mit kleinen Poren) zu wählen.
6. Repräsentative Ergebnisse
Wie in 1 gezeigt, in dieser Studie haben wir eine Reihe von mesoporösen Siliciumdioxid-Dünnschichten mit einer Vielzahl von nanotextures hergestellt und umfassend untersucht dieir Verwendung bei der selektiven Aufnahme und Anreicherung LMW Peptide und Proteine aus menschlichem Serum. 2a und b zeigen die MS-Spektren des unbearbeiteten Serumprobe für Peptide im Bereich von 900 bis 10.000 Da und für Proteine im Bereich von 3.000 ~ 70.000 Da jeweils . Diese Spektren veranschaulichen die Signalunterdrückung in der LMW Bereich aufgrund der Gegenwart von gut ionisiert, zahlreicheren mit hohem Molekulargewicht (HMW) Proteine, wie Albumin. 2c und d zeigen die MS-Spektren der Serumprobe nach Fraktionierung durch das MPS-L121 (Porengröße, 6 nm). Die meisten der großen Moleküle aufgebraucht wurde, was zu einer signifikanten Anreicherung der LMW-Komponenten. Als Kontrolle wurde die gleiche Serumprobe auf einem unporösen reinem Siliciumdioxid aufgetragen um die Spezifität der MPS Dünnschichten für LMWP Verwertung zu bewerten. Wie in 2e und f ersichtlich ist, gab es keinen signifikanten Gewinnung von PeptidenGezeiten oder Proteinen aus der nicht porösen Siliziumdioxid. So kann der Schluss gezogen, dass es die mesoporösen Architektur und nicht die Silica-Oberfläche, die die Affinität überwiegen Faktor stellt in der Anreicherung von LMWP war.
Genau kontrollierte Variationen in der Porengröße kann durch die Verwendung von Copolymeren mit unterschiedlichen hydrophoben Block gewährleistet werden konnte. Durch die Verwendung der Proteine und Peptide ausgebildet Mischung wurde die Wirkung der Porengröße auf der LMW-Peptid und Proteingewinnung Wirksamkeit untersucht unter Verwendung MPS dünnen Filmen aus vier Pluronic-Tenside (F127, P123, L121, L121 und zzgl. Quellmittel) mit unterschiedlichen Volumenverhältnissen hergestellt der hydrophilen und hydrophoben Komponenten Porengrößen von 3,7 nm, 5,2 nm, 7,4 nm und 9,0 nm bzw. bilden. Dieser Bereich von Porengrößen führte zur Gewinnung von einer anderen Repertoire von Peptiden und Proteinen aus der gleichen Serumprobe über Größe und Form Ausschluss (Abbildung 3). Das Protein-Spektren bei hohem Molekulargewicht demonstrate die molekularen Cut-off von jeder Art von Chip. Zusätzlich zu den größenabhängigen Erschöpfung der HMW-Proteine, zeigt der On-Chip-Fraktionierung des Standards Lösung eine Differenzial und selektiven Anreicherung von LMW Spezies mit den Porengrößen zugeordnet. Die Zwei-Wege-hierarchisches Clustering in Abbildung 3b, zeigt die LMW-Standards Bereicherung Muster mit den verschiedenen MSC erhalten. Selbst wenn alle Peptide unterhalb der molekularen Cut-off der Chips sind, gibt es eine positive Korrelation zwischen der Porengrößen und das Molekulargewicht der eingefangenen Spezies. Die MSC mit großen Poren, bis zu 9 nm, vorzugsweise ernten größere Peptide, während kleinere Peptide effizienter von den Chips mit kleineren Poren gewonnen werden. Die strukturelle Umwandlung des mesoporösen Anordnung wurde durch das Einstellen der Konzentration des Matrix-Polymer durchgeführt. Eine Erhöhung der Konzentration des Matrix-Polymer zu einer verringerten Grenzflächenkrümmung zwischen den Phasendes Wassers, des Copolymers und des Silicats, damit die Einleitung des miteinander Übergang von einer sphärischen, um eine zylindrische Struktur. Pluronic F127, mit hohem Molekulargewicht, besitzt diese hohe strukturelle Periodizität. Durch Erhöhung der Konzentration von F127 in Ausgangslösung, können verschiedene MPS Dünnfilm periodischen Nanostrukturen aus 3D Nanostruktur 2D Nanostruktur erhalten werden. Die 3D-kubischen und hexagonalen Waben-Nanostrukturen, die über mehr wünschenswert Nanopore Interkonnektivität und leichter zugänglich Nanopore Morphologie, weisen eine überlegene Leistung in selektiven Anreicherung von LMW-Peptide als die 2D-hexagonalen Struktur, auch wenn sie ähnlich Porengrößenverteilungen und den gleichen molekularen Cut-off für Serum teilen Fraktionierung (Abbildung 4). Wir hat außerdem die Konjugation von Organo-Silan auf MPS-Chips durch Einleiten von Sauerstoff Plasmaveraschen, um den Chip Oberfläche vorzubehandeln. Um qualitativ studieren die elektrostatische Wirkung auf ausgewähltenIVE-on-Chip-Anreicherung, nutzen wir die Mischung von Proteinen und Peptiden. MS-Analyse des Proteom-Standards Lösung fraktioniert MPS-Chips mit L121 hergestellt und konjugiert mit der chemischen funktionellen Gruppen ist in 5 dargestellt. Die positiv geladenen und negativ geladenen die Peptide und LMW Proteine wurden auf der anionischen und kationischen Chips erfasst sind. Der quantitative Vergleich von mehreren MPS-Chips bei der Wiederherstellung der Peptide mit positiver Nettoladung ist in Abbildung 5a dargestellt. Die Chips mit negativer Ladung und die Chips ohne Modifikation (mit einer leichten negativen Ladung ursprünglich) eine deutlich höhere Anreicherung für diese Peptide als die Chips mit APTES (-NH 2) modifiziert. Umgekehrt besitzen die positiv geladenen MPS-Chips außergewöhnliche Fähigkeit, diese Peptide mit negativer Nettoladung zu erholen, wie in 5b gezeigt. Während α-Endorphin zeigt keine signifikante Änderung due ihre PI etwa 6.

Abbildung 1. Prinzip der MPS-Chips Fraktionierung und LMW Bereicherung. Nach Probenauftragsspitze auf der Oberfläche, sind LMW Proteinen und Peptiden in die Poren eingeschlossen, während die größeren Arten blieben außerhalb der Poren und werden während der Waschschritte entfernt. Die angereicherten Fraktionen werden dann eluiert und durch MALDI.
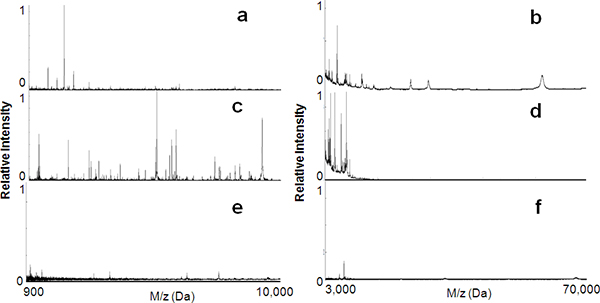
Abbildung 2. Peptid-Anreicherung mit Hilfe der mesoporösen Siliciumdioxid-Dünnfilm-Chips. MALDI-MS-Profile sowohl die geringe Masse (900 bis 10 000 Da) und der hohen Masse Bereich (3000 bis 70 000 Da) vor (a, b) und nach (c, d) Serum-Verarbeitung auf der mesoporösen Siliciumdioxid-Schichten ( L121, 6 nm). Die molekulare Erholung wird deutlich reduziert, wenn Sie leere porösen Silica-Oberflächen (e, f).

Abbildung 3. Molekulare Cut-off-und größenabhängige Bereicherung des MPS-Chips. (A) Vergrößerte Ansicht des MALDI-Spektren zeigen die charakteristischen molekularen Cut-off von je MPS-Chips in Korrelation zu der Porengröße. (B) Zwei-Wege-hierarchisches Clustern der Peptidgemisch Funktionen zwischen den verschiedenen Chips. Die Intensität der roten oder gelben Farbe zeigt die relative Peptidkonzentration. Größere Poren erhöht die Ernte von größeren Peptiden (3600 bis 8500 Da), während die kleinen Peptiden (900 bis 3500 Da) wurden vorzugsweise von den Chips mit kleineren Poren gewonnen.
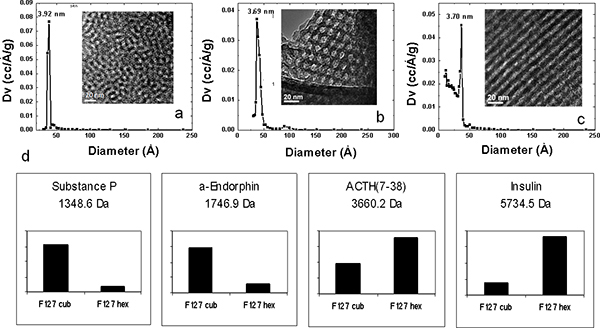
Abbildung 4. Physikalische Charakterisierung von dünnen Filmen und MPS selektive Gewinnung mit verschiedenen Nanostrukturen. XRD-Muster (a, b, c), TEM (Einschub a, b, c), Pluronic F127 bei verschiedenen Konzentrationen in der Vorläuferlösung: 4,0 ×10 -3 M (a), 6,0 × 10 -3 M (b) und 8,0 × 10 -2 M (c). (D) Balkenanzeige für die Intensität der Erkennung, welche die selektive Peptide Erholung auf 3D kubischen und hexagonalen 3D-F127 Proteom-Chips (Cub und Hex, jeweils). Die unterschiedlichen strukturellen Modifikationen stellen eine selektive Anreicherung.
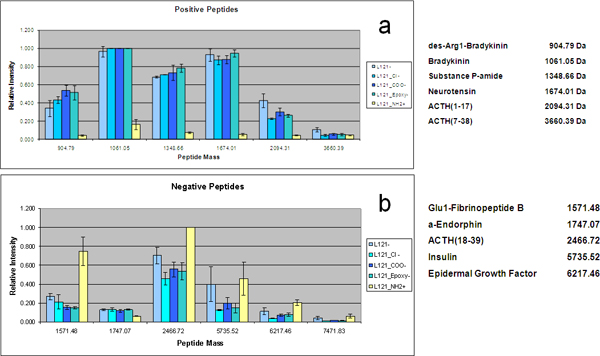
Abbildung 5. Charge-spezifische Erholung für die Chips mit unterschiedlichen Oberflächen-Funktionen. Balkendiagramm der MS Intensität Nachweis von selektiv erfasst Peptide auf den funktionalisierten Chips. Nach ihren isoelektrischen Punkt sind die Peptide positiv oder negativ bei pH 7,0 berechnet. (A) Positive Peptide ((1) des-Arg1-Bradykinin, (2) Bradykinin, (3) Substanz P-amid, (4) Neurotensin, (5) ACTH (1-17), (6) ACTH (7 - 38)) sind speziell auf dem negativ geladenen sur angereichertGesichter. (B) Negativ Peptide ((7) Glu1-Fibrinopeptid B, (8) α-Endorphin, (9) ACTH (18-39), (10) Insulin, (11) EGF (12) Insulin-like FGII) sind speziell auf den positiv geladenen Oberflächen angereichert.
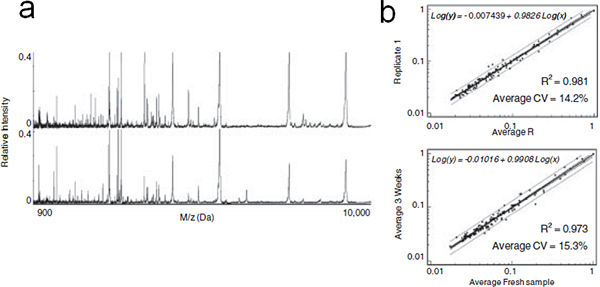
Abbildung 6. On-Chip Stabilisierung der fraktionierten Serum. (A) Repräsentative MALDI Profile von LMW-Peptide und Proteine eluiert unmittelbar nach der Serum-Fraktionierung (oben) oder nach 3 wk von On-Chip-Lagerung bei Raumtemperatur (unten). (B) Von oben nach unten: lineare Regressionsanalyse der mittleren Intensitäten der detektierten MS-Peaks in jeder Wiederholung im Vergleich zu 1 für frisch fraktionierten Serum und fraktionierte Serum nach 3WK MPS-Chips Lagerung bei Raumtemperatur zu replizieren. Die Gleichung, Lebenslauf und Bestimmtheitsmaß (R 2) sind angegeben.
Diskussion
Die Beweise mehren sich, dass die niedermolekularen Bereich des Kreislaufsystems Proteom eine reiche Quelle von diagnostischen Biomarkern für die Früherkennung von Krankheiten ist. Bei dieser Technologie stellten wir eine Reihe von mesoporösen Siliciumdioxid-Chips mit unterschiedlichen Porengrößen, Porenstrukturen und Modifikationen an Peptiden und selektiv zu bereichern Proteine mit niedrigem Molekulargewicht. Um die Stabilität von Proteinen zu untersuchen, wurden die MPS-Chips mit humanem Serum, nach dem Waschen getrocknet inkubiert und gelagert 3WK bei Raumtemperatur. Die Protein / Peptid-Muster erhalten wurden, waren vergleichbar mit denen von frisch fraktioniert Serum (6a), wie durch die Ergebnisse der statistischen Analyse zeigte in 6b bestätigt. Die Variabilität der Peak-Signale durch die durchschnittliche CV gemessen wurde bei 12,7% für Rohserum und bei 14,2% für den fraktionierten Proben geschätzt. Die Rn Variationen könnten darauf zurückzuführen sein, interne Variabilität des MALDI Instrument und schlug vor, dass die on-Chip-Vorbehandlung und Lagerung induziert keine signifikante Veränderung der MS Proteinprofile. Das gleiche Experiment wurde auf nicht porösem Silizium durchgeführt. Das getrocknete Serum nach der Lagerung auf Silizium-Oberfläche wiederhergestellt wurde fraktioniert auf den MPS-Chips vor MALDI-Analyse. Der arme MS Profils erhalten die Stabilisierung Vorteil der mesoporösen Oberfläche demonstriert. In Analogie mit zuvor postulierten Mechanismen, stellen wir die Hypothese, dass die LMW-Spezies in den Nanoporen gefangen vor dem Abbau wurden durch den Ausschluss von Proteasen Größe erhalten, oder durch sterische Hemmung ihrer proteolytischen Aktivität in dem engen Raum der Nanoporen. Die MPS-Chip basierende Methode könnte ein mächtiges Werkzeug in der Peptid-und LMW-Protein-Profiling von komplexen biologischen Flüssigkeiten Studie sein. Die MPS-Chips sind kostengünstig herzustellen und skaliert die Produktion ermöglichen die gleichzeitige Verarbeitung einer großen Anzahl von Proben zu erreichen, bietet vorteilhafte Merkmale für die Versuchsfischerei Screening und BioMarker Entdeckung.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der Allianz NanoHealth Pre-Center Award (W81XWH-11-2-0168) und Texas Center for Cancer Nanomedizin (1U54CA151668-01) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Tetraethoxysilan | Sigma-Aldrich | 131903 | 98% |
| Spin Coater | Brewer Science | Cee 200X | |
| Plasma Asher | Nordson März | AP-600 | |
| Spektralellipsometer | JA Woollam Co. | M-2000DI | |
| MALDI-TOF | Applied Biosystems | Voyager-DE-STR | |
| α-Cyano-4-Hydroxyzimtsäure | Sigma-Aldrich Co. | C8982 | Matrix für die MALDI-TOF |
| trans-3 ,5-dimethoxy-4-hydroxyZimtsäure | Sigma-Aldrich Co. | 85429 | Matrix für die MALDI-TOF |
| Rühren Sie heißen Platte | Thermo Scientific | 11 bis 475-30Q | |
| CultureWell chambered Deckglas | Sigma-Aldrich | GBL103350 | 3 mm Durchmesser. × 1 mm Tiefe, 3-10 ul, steril |
| Pluronic F 127 | BASF | PEO-PPO-106-70-PEO 106 | |
| Pluronic L121 | BASF | PEO 5-PPO-PEO-70 5 | |
| Pluronic P123 | BASF | PEO 20 PPO 20 PEO 70 |
Tabelle 1. Physikalisch-chemische Eigenschaften und konzipiert Konzentrationen (Molekulargewicht und Iso-Elektrischen Punkt) der ausgewählten Peptid und Protein-Standards.
Referenzen
- Wulfkuhle, J. D., Liotta, L. A., Petricoin, E. F. Proteomic applications for the early detection of cancer. Nat. Rev. Cancer. 3, 267-275 (2003).
- Etzioni, R. The case for early detection. Nat. Rev. Cancer. 3, 243-252 (2003).
- Hanash, S. M., Pitteri, S. J., Faca, V. M. Mining the plasma proteome for cancer biomarkers. Nature. 452, 571-579 (2008).
- Liotta, L. A., Ferrari, M., Petricoin, E. Clinical proteomics: written in blood. Nature. 425, 905-905 (2003).
- Petricoin, E. F., Belluco, C., Araujo, R. P., Liotta, L. A. The blood peptidome: a higher dimension of information content for cancer biomarker discovery. Nat. Rev. Cancer. 6, 961-967 (2006).
- Anderson, N. L., Anderson, N. G. The human plasma proteome: history, character, and diagnostic prospects. Mol. Cell Proteomics. 1, 845-867 (2002).
- Gorg, A., Weiss, W., Dunn, M. J. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 4, 3665-3685 (2004).
- Liu, H., Sadygov, R. G., Yates, J. R., 3rd, . A model for random sampling and estimation of relative protein abundance in shotgun proteomics. Anal. Chem. 76, 4193-4201 (2004).
- Rabilloud, T. Two-dimensional gel electrophoresis in proteomics: old, old fashioned, but it still climbs up the mountains. Proteomics. 2, 3-10 (2002).
- Hu, Y. Tailoring of the nanotexture of mesoporous silica films and their functionalized derivatives for selectively harvesting low molecular weight protein. ACS Nano. 4, 439-451 (2010).
- Bouamrani, A. Mesoporous silica chips for selective enrichment and stabilization of low molecular weight proteome. Proteomics. 10, 496-505 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten