Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Solubilización y Bio-Corrector ortográfico y de los puntos cuánticos y Ensayos de toxicidad bacteriana por curva de crecimiento y Recuento
En este artículo
Resumen
Las nanopartículas tales como puntos cuánticos semiconductores (puntos cuánticos) se puede utilizar para crear agentes fotoactivables para aplicaciones anti-microbianos o anti-cáncer. Esta técnica muestra cómo el agua solubilizar teluro de cadmio (CdTe) QDs, conjugado a un antibiótico, y le realizará un ensayo de inhibición bacteriana basada en las curvas de crecimiento y recuento en placa.
Resumen
Los puntos cuánticos (puntos cuánticos) son semiconductores de nanopartículas fluorescentes con tamaño que dependen de los espectros de emisión que pueden ser excitados por una amplia selección de longitudes de onda. Puntos cuánticos han atraído un gran interés para la imagen, el diagnóstico y la terapia debido a su fluorescencia brillante, estable 1,2 3,4,5. Cuánticos pueden conjugarse con una variedad de moléculas bio-activas para la unión a las bacterias y células de mamíferos 6.
Puntos cuánticos también están siendo ampliamente investigados como agentes citotóxicos para el asesinato selectivo de las bacterias. La aparición de multiplicar cepas de bacterias resistentes está convirtiendo rápidamente en una crisis de salud pública, especialmente en el caso de los agentes patógenos Gram negativos 7. Debido al efecto antimicrobiano conocido algunos de los nanomateriales, especialmente Ag, hay cientos de estudios que examinan la toxicidad de las nanopartículas a las bacterias 8. Estudios bacterianas se han realizado con otros tipos de nanopartículas semiconductoras, así, especially TiO2 9,10-11, pero también ZnO 12 y otros, incluyendo CuO 13. Algunas comparaciones de las cepas bacterianas se han realizado en estos estudios, por lo general la comparación de una cepa Gram negativas con un Gram positivos. Con todas estas partículas, mecanismos de toxicidad se atribuyen a la oxidación: o bien la fotogeneración de especies de oxígeno reactivas (ROS) por las partículas o la liberación directa de los iones metálicos que pueden causar toxicidad oxidativa. Incluso con estos materiales, los resultados de diferentes estudios varían mucho. En algunos estudios, la cepa de prueba Gram positivas se informa, más sensible que el negativo de 10 gramos, en otros es todo lo contrario 14. Estos estudios han sido bien revisado 15.
En todos los estudios de nanopartículas, la composición de las partículas, el tamaño, la química de superficie, muestra el envejecimiento / degradación, y longitud de onda, potencia y duración de la exposición a la luz todos pueden afectar dramáticamente los resultados. Además, Synthesisubproductos s y disolventes deben ser considerados 16 17. Técnicas de alto rendimiento de detección son necesarios para poder desarrollar nuevos agentes eficaces de la nanomedicina.
Puntos cuánticos de CdTe tiene efectos antimicrobianos sólo 18 o en combinación con antibióticos. En un estudio anterior, hemos demostrado que el acoplamiento de los antibióticos para CdTe puede aumentar la toxicidad de las bacterias, pero disminuir la toxicidad en células de mamíferos, debido a la disminución en la producción de especies reactivas del oxígeno de los conjugados 19. Aunque no es probable que contengan cadmio-compuestos serán aprobados para uso en seres humanos, tales preparaciones podrían ser utilizados para la desinfección de superficies o la esterilización de agua.
En este protocolo, le damos un enfoque directo a la solubilización de los puntos cuánticos de CdTe con ácido mercaptopropiónico (MPA). Los puntos cuánticos están listos para usar en una hora. A continuación demuestran el acoplamiento a un agente antimicrobiano.
La segunda parte del protocolodemuestra un ensayo de inhibición de 96-así bacteriana usando los puntos cuánticos conjugados y no conjugados. La densidad óptica se leyó durante muchas horas, permitiendo que los efectos de la adición QD y exposición a la luz para ser evaluada de inmediato así como después de un periodo de recuperación. Se ilustra un recuento de colonias para la cuantificación de la supervivencia bacteriana.
Protocolo
1. QD Solubilización
Este es un método apropiado para CdTe. Métodos similares se pueden utilizar con otros tipos de puntos cuánticos tales como InP / ZnS 20 y CdSe o ZnS 21.
- Preparar una solución de puntos cuánticos de CdTe en tolueno a 15 micras (densidad óptica = 2,5 en el pico del excitón primero).
- Transfiera 200 l de esta población en un vial de vidrio. No use plástico!
- Añadir 800 l de tolueno, 1 ml de tampón borato 200 mM (pH 9) y 2 l de 11,5 M de ácido mercaptopropiónico (AMP).
- Tapar el frasco y agitar enérgicamente durante 30-60 segundos.
- Las fases acuosa y orgánica disolvente se separa espontáneamente. La fase acuosa se convertirá en el color de los puntos cuánticos. Para evitar que la capa de tolueno, retírelo y deséchelo. Luego transferir la fase acuosa en un vial limpio.
- Purificar los puntos cuánticos solubilizados mediante el lavado / filtrado de cuatro veces utilizando una l 500, 10000 de corte de peso molecular del filtro centrífugo. Los filtros deben sercentrifugó a 3000 xg durante 13 minutos. Por lo menos los últimos dos lavados, se lava con el tampón final deseado.
- Después del lavado final, suspender los puntos cuánticos lavados en tampón de borato 50 mM a pH deseado y almacenar a 4 ° C. Ellos serán estables durante 1-2 semanas.
- Mida espectros de absorción y de emisión para estimar la concentración basada en fórmulas publicadas 22.
Los resultados representativos: Figura 1 muestra una imagen de puntos cuánticos de CdTe bajo iluminación de la lámpara UV, y espectros de emisión antes y después de la solubilización de agua, que muestra el cambio insignificante desde el intercambio tapa. Los valores de tamaño son el diámetro del núcleo medida por microscopía electrónica.
2. Conjugación QD a los antibióticos
Esta parte del protocolo es aplicable a cualquier carga negativa en agua solubilizada nanopartículas, incluyendo puntos cuánticos más comerciales, las partículas metálicas, y 19 más.
- Cualquier molécula que funciona eithER autoensambla a los puntos cuánticos cargados negativamente solubilizados, o que tiene un grupo reactivo que puede ser conjugado, tal como una amina primaria. En este ejemplo, se está utilizando polimixina B (PMB), que está cargado positivamente y auto-ensambla sin necesidad de reactivos conjugación. Disolver el PMB en H 2 O a 60 micras. (Si el antibiótico elegido no es soluble en H 2 O, se disuelven en DMSO o etanol a una concentración de 0,1-1 mM). Esto será una solución 10x (en H 2 O) o una solución 100x (en disolvente).
- Calcular la cantidad de solución de QD será necesario para los experimentos de toxicidad de la bacteria. Para una placa de 96 pocillos con 0,3 ml por pocillo en quadruplicates, 0,5 ml de conjugado nM 200 que se necesita. Preparar dos tubos que contienen 100 L de 1 uM puntos cuánticos en tampón de borato 50 mM.
- Si el acoplamiento a una amina primaria, preparar una mg 19 / ml (100 mM) solución de 1-etil-3-[3-dimetilaminopropil] carbodiimida (EDC) en H 2 O. EDC en la solución no es estable; El uso inmediatamente y desechar el resto.
- Añadir 50 l de la solución 10x antibiótico (en H 2 O) o 5 l de la solución 100x (en disolvente) al tubo de conjugado. Para PMB: conjugación de CdTe en una proporción molar de 30:1, se añaden 50 l de PMB mM 60. Añadir H 2 O o disolvente para el tubo de control sólo QD.
- Si es necesario, añadir 1 l de la solución madre de EDC para el tubo de conjugado.
- Llevar el volumen conjugado a 0,5 ml con el tampón adecuado (tampón borato o PBS; no tampones que contienen amina, tales como Tris, ya que inhiben la EDC).
- Tubos de protegerlo de la luz con papel de aluminio, y el lugar en un nutator o una mecedora durante 1 hora. Si la agregación se produce, repita la conjugación con bajas concentraciones de antibióticos. Valorar hacia arriba de concentración hasta que las partículas no se agregan.
- Lavar los conjugados pasando a través de un filtro apropiado. 10000 corte de peso molecular que funciona para la mayoría de los antibióticos, pero no para las proteínas o anticuerpos.
- Dependiendo de la molécula, los diferentes métodos se puede utilizar para estimar el número de moléculas de antibióticos por QD: espectroscopía de fluorescencia o absorbancia, electroforesis en gel, o la transformada de Fourier de infrarrojos (FTIR).
Los resultados representativos. En este ejemplo, la conjugación de PMB se caracteriza por los cambios en el espectro de emisión QD. Figura 2 muestra el espectro de puntos cuánticos de CdTe con la adición de PMB.
3. Preparación de las bacterias para la pantalla de 96 pocillos, Determinación de antibióticos IC 50
Esto es aplicable a casi cualquier cepa bacteriana crecido en el medio apropiado 18. La longitud exacta de tiempo las grabaciones deben seguir depende de la tasa de crecimiento bacteriano. En nuestro ejemplo, podemos utilizar Escherichia coli cultivadas en caldo de lisogenia (LB).
- Con el fin de elegir las concentraciones apropiadas QD conjugadas, es importante conocer laIC 50 del antibiótico para ser conjugado y si los puntos cuánticos solos son tóxicos. Esto debe ser comenzado 2 días antes del experimento de conjugación. Por la noche, las semillas de 10 ml de medio de crecimiento bacteriano a partir de una colonia fresca, usando la técnica correcta estéril y seguridad de la biotecnología.
- Al día siguiente, 1-2 horas antes del experimento, llenar cada uno de los pocillos de una clara de fondo 96-pocillos con una cantidad casi-máxima de medio de crecimiento. Con una pipeta multicanal de semillas, cada uno con 1-50 l de cultivo bacteriano (la concentración dependerá de la rapidez con la cepa en particular crece y se necesita ser calibrado por el laboratorio).
- Colocar la placa en el lector de placas y la puso a leer cada 10 minutos durante 2 horas a una determinada longitud de onda (600 nm por lo general). Vigilar la placa de modo que las bacterias no crecen demasiado densos con demasiada rapidez.
- Cuando las células de todo llegar a OD = 0.1-0.15, retire la placa del lector de la placa y detener la grabación.
- Añadir fármacos solos y solas en puntos cuánticosconcentraciones diferentes en al menos triplicado. Utilizar un lado de la placa como un "oscuro" control y un medio para ser iluminada. Una disposición sugerida se da en la Figura 3. Las concentraciones debería abarcar una gama lo suficientemente amplia como para incluir una concentración que inhibe las bacterias muy poco, y uno que mata a todos.
- Proteger el lado "oscuro" de la placa con papel de aluminio. Expone el otro lado a una lámpara en la longitud de onda deseada. Usamos una medida de 96 pozos, 440-nm lámpara hecha de 2,4 mW LED (Figura 4) e irradiar por 30-60 minutos. Las placas negras con fondos claros ayudan a proteger a las bacterias no expuestas a la luz parásita. Una columna de vacío también puede ser utilizado entre los lados expuestos y de las Naciones Unidas expuestos.
- Después de exposición a la luz, poner la placa en el lector de placas y registro de OD 600 cada 10 minutos durante 5-12 horas, dependiendo de la tasa de crecimiento. Mantenga la temperatura <32 ° C si es posible, para evitar la desecación de los cultivos.
- Trazar las curvas de crecimientoen un punto de tiempo seleccionado frente a log [de concentración] y determinar la IC 50 del antibiótico utilizando la ecuación de Hill:

donde H es el coeficiente de Hill, y el máximo es el punto más alto de crecimiento (idealmente en una meseta), y minutos y es el punto cero, también es ideal en una meseta. Es poco probable que los puntos cuánticos solamente se muestran toxicidad mucho a las células a las concentraciones utilizadas, por lo que un valor no será determinada.
Los resultados representativos. Al final del período de registro, pozos claras indicará la muerte celular completa, y un gradiente de densidad celular debe aparecer a lo largo de concentraciones crecientes del fármaco. Las bacterias se muestran en forma de S curvas de crecimiento (Figura 5 A), la ubicación de la meseta máxima variará en gran medida a partir de una cepa a otra y también depende de la temperatura. Un punto de tiempo dado puede serelegido como representante y representado los valores frente a log [antibióticos] para dar el CI 50 (Figura 5 B). Para evaluar la toxicidad QD, la supervivencia frente a log [QD] también se puede dibujar, pero el logro de muerte bacteriana significativa con puntos cuánticos es el único raro (Figura 5 C).
4. Preparación de las bacterias para la pantalla de 96 pocillos con antibióticos o puntos cuánticos
- El día antes del experimento, las semillas de 10 ml de la cultura de una colonia fresca en el medio rico en su caso, usando la técnica correcta estéril y seguridad de la biotecnología. El conjugado QD-antibiótico debe estar preparado en este día, a menos que sea muy inestable.
- 1-2 horas antes del experimento, llenar cada uno de los pocillos de una clara de fondo 96-pocillos con una cantidad casi-máxima de medio de crecimiento. Utilizando una pipeta multicanal de semillas, cada pocillo con 1-50 l de cultivo bacteriano.
- Colocar la placa en el lector de placas y la puso a leer cada 10 minutos durante 2 horas en la misma longitud de onda en la parte 3.
- Cuando las células de todo llegar a OD = 0.1-0.15, retire la placa del lector de la placa y detener la grabación.
- Añadir conjugados QD a diferentes concentraciones en al menos cuadruplicado. Utilizar un lado de la placa como un "oscuro" control y un medio para ser iluminada. Una disposición sugerida se da en la Figura 6. Una tira de control de las bacterias solo se debe incluir siempre en caso de problemas con la cultura, la temperatura, etc afectar a las condiciones de crecimiento. Una sola tira de la única droga y QD sólo debería incluirse también para asegurarse de que coincida con la placa de control realizado con anterioridad. El resto de los pocillos están dedicados a conjugados con el fin de permitir una buena estadística.
- Proteger el lado "oscuro" de la placa con papel de aluminio. Expone el otro lado a una lámpara en la longitud de onda deseada.
- Después de exposición a la luz, poner la placa en el lector de placas y registro de OD 600 cada 10 minutos durante 5-12 horas. Mantenga la temperatura <32 ° C si es posible, para evitar que el Dr.ying de las culturas.
Los resultados representativos. La combinación de puntos cuánticos y los antibióticos pueden ser menos tóxicos que los antibióticos solo, igualmente tóxicos, tóxicos o más. Esto puede ser cuantificado mediante las curvas de crecimiento y CI 50 mediciones. La figura 7 muestra un ejemplo de conjugados que igualmente tóxicos como antibióticos solos, y un ejemplo de conjugados que son más tóxicos.
5. Placa de Conde
- Elija uno o más pozos de los tratados con placas de 96 pocillos que se utilizarán para diluciones seriadas y conteo de colonias.
- Hacer una serie de dilución de cada una de las muestras seleccionadas de bacterias con solución de PBS o solución salina (0,9% de NaCl). Transferir 20 l de la solución bacteriana y se diluye con 180 ml de solución salina, cambiar la punta de la pipeta, mezclar y transferir 20 l de solución diluida bacteriana a 180 ml de solución salina. Repetir 6 veces.
- Tomar 10 l de cada dilución y la placa en un apropiado los medios de comunicación placa sólida. Todas las concentraciones de 8 una muestra puede ser chapada en un plato redondo de 10 cm de Petri, aunque platos rectangulares son los preferidos ya que es más fácil para alinear las cosas.
- Deje que se seque en el banquillo durante 15 minutos. a continuación, se incuba a la temperatura apropiada para sus bacterias durante 16 horas.
- Contar las colonias y calcular unidades formadoras de colonias (ufc) de acuerdo con (n º de colonias x factor de dilución) / volumen plateado = UFC / mL.
La figura 8 muestra una placa de UFC ejemplo.
6. Los resultados representativos
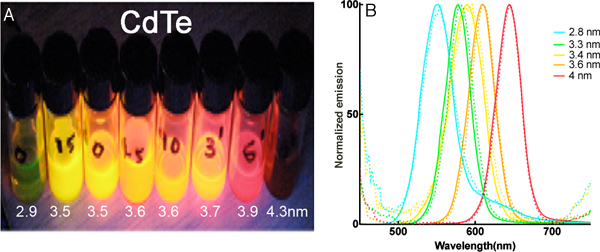
Figura 1. Puntos cuánticos de CdTe. (A) Ocho puntos cuánticos de CdTe los preparativos de iluminación con una varita UV (365 nm). (B) Absorbancia y espectros de emisión de los cinco tamaños seleccionados antes y después de la solubilización de agua. Las líneas discontinuas son espectros en tolueno, las líneas continuas son en agua.
files/ftp_upload/3969/3969fig2.jpg "/>
Figura 2. El análisis espectral y el gel de QD-PMB conjugados. Naranja emisores de puntos cuánticos de CdTe se utilizaron para este ejemplo, los efectos sobre otros tipos de puntos cuánticos tendrá que ser evaluado para cada experimento. (A) absorbancia Típica (línea gris) y espectros de emisión (en negro) de los puntos cuánticos antes de la conjugación de la PMB y la emisión (línea discontinua) después de la adición de 160 equivalentes molares de PMB. (B) Relación entre la proporción de PMB y la intensidad de emisión QD (cuadrados) y el pico de ubicación de longitud de onda (triángulos).
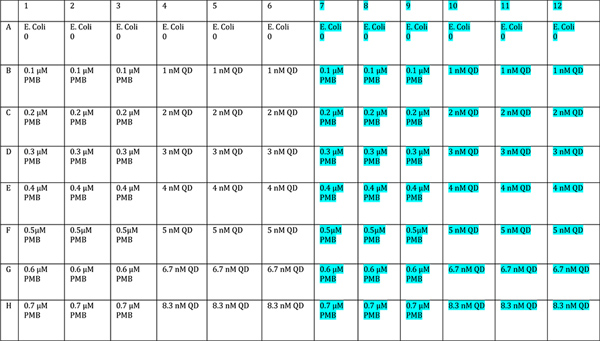
Figura 3. Sugerido disposición de la placa de la placa de control de crecimiento. Una amplia gama de concentraciones de PMB y QD está representado. La mitad de la placa se irradia (resaltado en azul), y una media idéntica está protegido de la luz. Haga clic aquípara ampliar la figura.

Figura 4. Custom 96-Lámpara LED para la irradiación de la placa de uniforme, que muestra el aspecto apagado y encendido. Un típico de mano lámpara UV también se puede usar, pero no cubre toda la placa de manera uniforme.
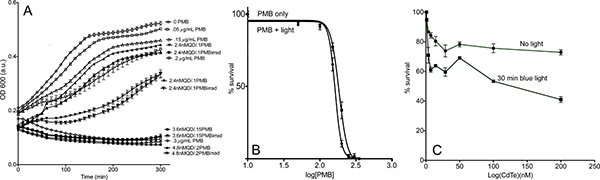
Figura 5. Ejemplo de resultados de la placa de control de crecimiento. (A) representativos curvas de crecimiento de bacterias con diferentes concentraciones del fármaco, de 0 a completar la muerte celular. Los símbolos abiertos son PMB sólo con concentraciones dado; los símbolos son sólidos CdTe-PMB sin irradiación, y los símbolos medio llenas son CdTe-PMB con irradiación. La irradiación no tuvo ningún efecto sobre las muestras de PMB-solamente, por lo que estas curvas se omite para mayor claridad. Todos los conjugados de PMB-CdTe son 30:1 PMB: proporciones QD. (B) Las representaciones de los valores de la curva de crecimiento en 200 minutos frente a log [PMB] y se ajusta a la ecuación. (1). Para contROL para los efectos de la luz, una curva que se hace con antibióticos sólo con 30 minutos de exposición a la luz. (C) la supervivencia bacteriana en 200 minutos frente a la concentración QD, utilizando puntos cuánticos de CdTe. Algo de la toxicidad se ve con exposición a la luz, pero demasiado poco para determinar un valor de IC 50. Haga clic aquí para ver más grande la figura .
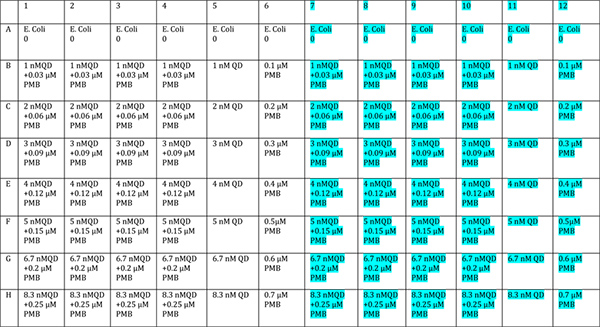
Figura 6. Sugerido para el diseño de la placa de prueba conjugado. La mitad azul-puso de relieve de la placa debe ser expuesto a la luz, y la mitad sin resaltar está protegida. Haga clic aquí para ver más grande la figura .
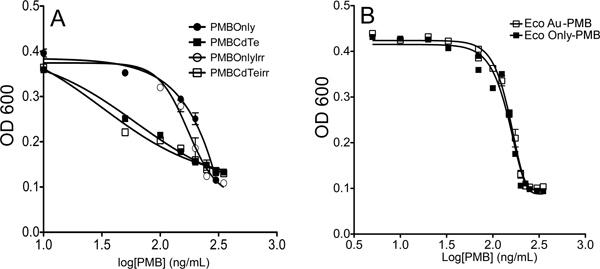
Figura 7. Ejemplo de los resultados de la placa de prueba conjugado. Los valores de crecimiento de la curva en 200 min fueron plotted y un ajuste a la ecuación. (1). (A) CdTe-PMB conjugados muestran un aumento de la toxicidad sobre PMB solo. (B) el oro de nanopartículas de Au-PMB conjugados no muestran ningún aumento de la toxicidad sobre PMB solo.
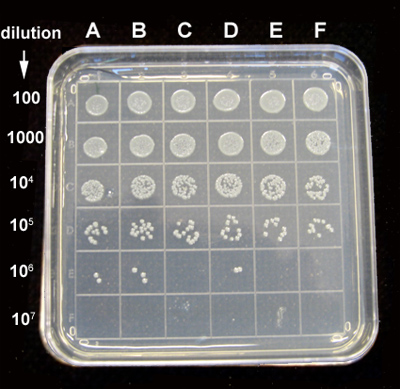
Figura 8. Ejemplo de una placa de UFC. E. E. sembradas en una placa de 96 pocillos se trató con QD-PMB con o sin irradiación durante 30 min. a continuación, se incubó a 32 ° C durante 4 horas. Diluciones seriadas de cada muestra bacteriana se hizo con solución salina, y 10 l de 100 X 10 X 7 diluciones se cultivaron sobre placas de agar. Las placas se incuban a 37 ° C y se contaron las colonias después de 16 horas. La placa muestra las diluciones a lo largo de las filas como se indica, las columnas son: (A) 0,06 mM de PMB + 2 nM CdTe, (B) 0,12 mM de PMB + 4 nM CdTe (C) 0,2 mM + 6,7 nM PMB CdTe, (D) 0,06 uM PMB + 2 nM CdTe irradiado, (E) 0,12 mM de PMB + 4 nM CdTe irradiado, (F) 0,2 mM + 6,7 nM PMB CdTe IRRAmediado.
Access restricted. Please log in or start a trial to view this content.
Discusión
Las nanopartículas representan un enfoque prometedor para la creación de nuevos agentes antimicrobianos. Análisis de la curva de crecimiento es una forma de monitorear la densidad de células bacterianas que distingue a las células activamente de cultivo de células de crecimiento inhibido. Cuando se combina con el conteo de placas, permite un análisis exhaustivo del potencial de los antibióticos de un conjugado. El formato de 96 pocillos permite variaciones relativamente de alto rendimiento de la concentración y...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por el programa Discovery NSERC individual, el NSERC / CIHR Programa Colaborativo de Investigación en Salud (CHRP), y el NSERC CREATE Canadiense Programa de Entrenamiento de Astrobiología (CATP).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre | Empresa | Número de catálogo | Comentarios (opcional) |
| Borato componente tampón # 1 | Pescador | El ácido bórico A-74-1 | |
| Borato componente tampón # 2 | Sigma-Aldrich | Tetraborato de sodio B9876 | |
| MPA | Sigma-Aldrich | M5801 | |
| Vivaspin 500 | GE Healthcare | 28-9322 | Varios MWCO disponibles |
| Viales de vidrio | Pescador | 03-338C | |
| EDC | Sigma-Aldrich | E6383 | |
| Polimixina B | Sigma-Aldrich | P1004 | |
| Gr bacterianaowth medio (LB) Componente # 1 | Pescador | NaCl S271 | |
| Medio de crecimiento bacteriano (LB) Componente # 2 | BD | Triptona 211705 | |
| Medio de crecimiento bacteriano (LB) Componente # 3 | BD | Extracto de Levadura 211929 | |
| Lámpara de exposición a la luz | Costumbre | ||
| Borrar de fondo placas de 96 pocillos | Pescador | 07-200-567 o 07-200-730 | |
| Espectrómetro de fluorescencia | Molecular Devices | ||
| Absorbancia lector de placas | Molecular Devices | ||
| Bactoagar para medios sólidos | Bioshop | AGR001.1 | |
| Placas de Petri redondear | Pescador | 08-75-12 | |
| Petri platos rectangulares | Pescador | 08 a 757-11A |
Referencias
- Michalet, X. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307, 538-544 (2005).
- Jamieson, T. Biological applications of quantum dots. Biomaterials. 28, 4717-4732 (2007).
- Asokan, S. The use of heat transfer fluids in the synthesis of high-quality CdSe quantum dots, core/shell quantum dots, and quantum rods. Nanotechnology. 16, 2000-2011 (2005).
- Chan, W. C. W. Luminescent quantum dots for multiplexed biological detection and imaging. Curr. Opin. Biotechnol. 13, 40-46 (2002).
- Chan, W. C. W., Nie, S. M. Quantum dot bioconjugates for ultrasensitive nonisotopic detection. Science. 281, 2016-2018 (1998).
- Biju, V., Itoh, T., Ishikawa, M. Delivering quantum dots to cells: bioconjugated quantum dots for targeted and nonspecific extracellular and intracellular imaging. Chem. Soc. Rev. 39, 3031-3056 (2010).
- Boucher, H. W. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clin. Infect. Dis. 48, 1-12 (2009).
- Morones, J. R. The bactericidal effect of silver nanoparticles. Nanotechnology. 16, 2346-2353 (2005).
- Mitoraj, D. Visible light inactivation of bacteria and fungi by modified titanium dioxide. Photochemical & Photobiological Sciences. 6, 642-648 (2007).
- Fu, G., Vary, P. S., Lin, C. T. Anatase TiO2 nanocomposites for antimicrobial coatings. J. Phys. Chem. B. 109, 8889-8898 (2005).
- Chung, C. J., Lin, H. I., Tsou, H. K., Shi, Z. Y., He, J. L. An antimicrobial TiO2 coating for reducing hospital-acquired infection. J. Biomed. Mater. Res. B. Appl. Biomater. 85, 220-224 (2008).
- Nair, S. Role of size scale of ZnO nanoparticles and microparticles on toxicity toward bacteria and osteoblast cancer cells. J. Mater. Sci. Mater. Med. 20, Suppl . 1. S235-S241 (2009).
- Heinlaan, M., Ivask, A., Blinova, I., Dubourguier, H. C., Kahru, A. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus. Chemosphere. 71, 1308-1316 (2008).
- Rincon, A. G., Pulgarin, C. Use of coaxial photocatalytic reactor (CAPHORE) in the TiO2 photo-assisted treatment of mixed Escherichia coli and Bacillus subtilis and the bacterial community present in wastewater. Catal. Today. 101, 331-344 (2005).
- Neal, A. L. What can be inferred from bacterium-nanoparticle interactions about the potential consequences of environmental exposure to nanoparticles. Ecotoxicology. 17, 362-371 (2008).
- Kovochich, M. Comparative toxicity of C60 aggregates toward mammalian cells: role of tetrahydrofuran (THF) decomposition. Environ. Sci. Technol. 43, 6378-6384 (2009).
- Hoshino, A. Physicochemical properties and cellular toxicity of nanocrystal quantum dots depend on their surface modification. Nano Letters. 4, 2163-2169 (2004).
- Dumas, E. M., Ozenne, V., Mielke, R. E., Nadeau, J. L. Toxicity of CdTe Quantum Dots in Bacterial Strains. IEEE Trans. NanoBiosci. 8, 58-64 (2009).
- Park, S., Chibli, H., Wong, J., Nadeau, J. L. Antimicrobial activity and cellular toxicity of nanoparticle-polymyxin B conjugates. Nanotechnology. 22, 185101(2011).
- Cooper, D. R., Dimitrijevic, N. M., Nadeau, J. L. Photosensitization of CdSe/ZnS QDs and reliability of assays for reactive oxygen species production. Nanoscale. 2, 114-121 (2010).
- Pong, B. K., Trout, B. L., Lee, J. Y. Modified ligand-exchange for efficient solubilization of CdSe/ZnS quantum dots in water: A procedure guided by computational studies. Langmuir. 24, 5270-5276 (2008).
- Narayanaswamy, A., Feiner, L. F., Meijerink, A., Zaag, P. J. vander The effect of temperature and dot size on the spectral properties of colloidal InP/ZnS core-shell quantum dots. Acs Nano. 3, 2539-2546 (2009).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados