Method Article
Optimizado manchas y Proliferación métodos de modelización para la vigilancia del uso de tintes División Celular Celulares de seguimiento
En este artículo
Resumen
El uso exitoso de los tintes de seguimiento para controlar la función celular inmune celular y la proliferación implica varios pasos críticos. Se describen métodos para: 1) la obtención brillante, uniforme, reproducible etiqueta-ción con colorantes de membrana, 2) selección de fluorocromos y condiciones de adquisición de datos, y 3) la elección de un modelo para cuantificar la proliferación celular basada en la dilución de colorante.
Resumen
Tintes fluorescentes seguimiento celulares, en combinación con el flujo y la citometría de imagen, son herramientas poderosas para estudiar las interacciones y destinos de los diferentes tipos de células in vitro e in vivo. 1-5 Aunque existen literalmente miles de publicaciones que utilizan estos colorantes, algunos de los las aplicaciones móviles más comunes de seguimiento incluyen la supervisión de:
- tallo y la quiescencia de células progenitoras, la proliferación y / o diferenciación 6-8
- antígeno impulsado por la membrana de transferencia 9 y / o la proliferación de células precursoras y 3,4,10-18
- inmune de células reguladoras y efectoras función 1,18-21.
Tintes de células disponibles comercialmente de seguimiento varían ampliamente en sus composiciones químicas y propiedades de fluorescencia pero la gran mayoría de caída en una de dos clases basadas en su mecanismo de marcaje de las células. "Tintes de membrana", tipificado por PKH26, son tintes altamente lipofílicas tsombrero de forma estable, pero de manera no covalente en las membranas celulares 1,2,11 partición. "Tintes proteína", tipificado por CFSE, amino son los colorantes reactivos que forman enlaces covalentes estables con proteínas celulares 4,16,18. Cada clase tiene sus propias ventajas y limitaciones. La clave de su uso exitoso, especialmente en los estudios multicolor donde múltiples colorantes se utilizan para rastrear diferentes tipos de células, por lo tanto para entender los temas críticos que permitan el uso óptimo de cada clase 2-4,16,18,24.
Los protocolos incluyen aquí destacar tres causas comunes de malos resultados o variable cuando se utiliza el seguimiento de células tintes. Estos son:
- Si no se consigue brillante, etiquetado uniforme y reproducible. Este es un punto de partida necesario para cualquier estudio de seguimiento de celda, pero requiere atención a las diferentes variables cuando se utilizan colorantes de membrana que cuando se utilizan colorantes de proteínas o reactivos de unión en equilibrio, tales como los anticuerpos.
- Subóptimas combinaciones de fluorocromos unnd / o la no inclusión de controles críticos de compensación. El seguimiento de fluorescencia del colorante es típicamente 2 10-03 10 veces más brillante que la fluorescencia de anticuerpos. Por tanto, es esencial verificar que la presencia de un colorante de seguimiento no comprometer la capacidad de detectar otras sondas que se utilizan.
- Si no se obtiene un buen ajuste con el software de modelado pico. Este tipo de software permite la comparación cuantitativa de los efectos proliferativos entre las diferentes poblaciones o estímulos basados en la frecuencia o precursor otras métricas. La obtención de un buen ajuste, sin embargo, requiere la exclusión de muerto / muerte de las células que pueden distorsionar los perfiles de dilución de tinturas y congruencia de los supuestos que subyacen en el modelo con las características del perfil de tinte dilución observada.
Ejemplos dados aquí ilustrar cómo estas variables pueden afectar a los resultados cuando se utiliza la membrana y / o tintes de proteínas para controlar la proliferación celular.
Protocolo
1. Etiquetado general de membrana con PKH26 Tracking Dye Celular (Ref. 25, Figura 1)
- Utilice una técnica estéril para los pasos 1,1 hasta 1,9. Preparar ~ 10 7 células humanas mononucleares de sangre periférica o los linfocitos (hPBMC, HPBL) utilizando el método estándar del laboratorio con la adición de un centrifugado final 300 xg para minimizar la contaminación por plaquetas. Resuspender las células en 10 7 / ml en HBSS BSA 1% y colocar en hielo, reservando una parte alícuota de 500 l (5x10 6 células) para uso en la Etapa 2.
- Coloque 5x10 6 células (500 l) en un tubo de 12 x 75 mm de polipropileno cónico. Lavar una vez con 3,5 ml de HBSS. Aspirar con cuidado el sobrenadante, dejando no más de 15-25 l de fluido residual, pero teniendo cuidado de no eliminar las células. Utilice este tubo para preparar una suspensión de células 2x en el paso 1,4.
- Durante el lavado de células en el paso 1,2, añadir 0,5 ml de diluyente de vehículo etiquetado C (del kit de PKH26GL) a un tubo de 12 x 75 mm de polipropileno cónico. Utilice este tubo para prepararson un 2x PKH26 solución en el paso 1,5.
- Añadir 0,5 ml de diluyente de vehículo etiquetado C a la célula sedimento lavado de la Etapa 1,2 y aspirar y dispensar 3-4 veces para obtener una suspensión de células individuales (células 2x). Evitar la formación de burbujas y el exceso de mezcla, que pueden reducir la viabilidad celular y la recuperación.
- Inmediatamente después de la preparación de la suspensión de células 2x en el paso 1,4, preparar un 2x (4 mM) solución de colorante añadiendo 2,0 l de 1,0 mM PKH26 stock de tinte en etanol (del kit de PKH26GL) al tubo C Diluyente preparado en el Paso 1,3 y vórtice a dispersar uniformemente.
- Inmediatamente después de la preparación de la solución de colorante en el paso 2 x 1,5, rápidamente pipetear la suspensión de células a partir del paso 2 x 1,4 a 2 veces la solución de colorante y al mismo tiempo aspirar y dispensar 3-4 veces para dispersar completamente las células en tintes No:. Añadir 1,0 mM tinte directamente a células, verter las células 2x 2x en el tinte, o añadir celdas 2x 2x colorante mientras se agitaba. Debido a que la tinción es casi instantánea, tales métodos producen menosintensidades uniformes que el método recomendado (Figura 2).
- Después de 1 min, añadir 1,0 ml de suero inactivado por calor o BSA HBSS +5% para detener la absorción de colorante en las membranas celulares. Si no se utiliza suficiente proteína corre el riesgo de la formación de agregados de colorantes, que pueden pellet con las células durante los pasos de lavado y causar etiquetado no deseada de otras células presentes en un experimento. Si el medio de calor con 10% de suero inactivado (CM) o HBSS 1% de BSA se va a usar como el reactivo de parada, llevar a cabo la tinción en un tubo de polipropileno cónico de 15 ml y añadir al menos 5,0 ml de reactivo de parada para asegurar la adsorción de todos colorante no incorporado.
- Centrifugar las células marcadas por 5 min @ ~ 400 x g. Aspirar con cuidado el sobrenadante sin necesidad de retirar las células. Lavar el sedimento dos veces con 4 ml de HBSS CM o BSA 1%, la dispersión de la pastilla antes de recentrifugación. Para minimizar el arrastre de tinte adsorbido sobre las paredes del tubo y maximizar la eficiencia del lavado, transferir las células a un tubo de polipropileno de fresco después de la first resuspensión. Nota: adecuadamente células teñidas se muestran un matiz distinto color rosa en el pellet.
- Resuspender el sedimento celular lavado en 1,0 ml de BSA% HBSS +1. Contar las células, determinar la recuperación celular, y ajustar el volumen para dar una concentración final de 10 7 / ml. Con la aspiración cuidadosa, recuperación celular debe ser ≥ 85%. Si la recuperación celular es <70%, determine la causa antes de continuar. Extraer una alícuota de 150 l (1.5x10 6 células) y colocar en hielo para su uso en el Paso 2.
2. Preparación de los controles de configuración del instrumento y ensayo (Tabla 1)
- Alícuota de 50 l (5x10 5) de células no teñidas de la suspensión celular guardado en el paso 1,1 en cada uno de cinco tubos Eppendorf de 1,8 ml: 1, 3, 4, 5, y 7. Alícuota de 50 l (5x10 5) de células PKH26 OP de Paso 1,9 en cada uno de tres tubos: 2, 6 y 8.
- Añadir 10 l bloque de IgG (100 ug / tubo de IgG; ver tabla de Reactivos) a los Tubos 1-8e incubar durante 10 min a temperatura ambiente (20-25 ° C).
- Añadir una cantidad de saturación de la anticuerpo (s) indicado en la Tabla 1 para los tubos 4, 5, 7, y 8 e incubar todas las muestras (tubos 1-8) para 30 min a temperatura ambiente y protegido de la luz.
- Añadir 1,5 ml de HBSS BSA 1% a todas las muestras, sedimentar las células por centrifugación (5 min @ 400 xg) y se lava una vez con 1,5 ml de HBSS 1% de BSA, con aspiración cuidadosa para evitar la pérdida de células.
- Resuspender cada muestra en 500 l de HBSS BSA 1%. Si se requiere de muestras a ser analizadas en el citómetro, transferir a un tubo de 12 x 75 mm de fondo redondo. Añadir 10 l de 100 ug / ml 7-AAD diario de las acciones de trabajo (véase la tabla de Reactivos) a los tubos 3, 6, 7 y 8, como se indica en la Tabla 1. Incubar en hielo durante 30 min antes de su uso en la configuración del citómetro de flujo y tinción de verificación (Paso 3).
3. Flujo de configuración del citómetro y Verificación de tinción
- Verifique que el flujo CytOMeter está funcionando correctamente, utilizando los procedimientos establecidos del laboratorio para el control de calidad diario. Verificar que las señales pueden ser fácilmente detectados en cada ventana de espectro para ser utilizado, y que las respuestas del detector son linealmente proporcionales a la intensidad de la señal en la ventana que se utilizará para la supervisión proliferación 14.
- Adquirir FSC frente a SSC de datos para el tubo 1, utilizando escalas lineales de pantalla. Ajustar la amplificación de cada detector de tal manera que la población de linfocitos cae en el cuadrante inferior izquierdo de la gráfica de puntos, no está fuera de escala en cualquiera de los parámetros, y no se interrumpe debido a la umbralización. Recopilar datos sin sincronización FSC frente a SSC para todas las muestras en Plaza de 3,3 a 3,7.
- Adquirir datos para el tubo 1, sin usar la compensación de color y escalas logarítmicas de visualización de los 4 detectores de fluorescencia. Ajuste de alta tensión de cada detector (HV) para colocar la autofluorescencia de los linfocitos no marcados en la escala con pocos / sin células se acumula en el primer canal. Establecer un límite de análisis para cada histogramacorrespondiente a la más brillante 2% de las células no teñidas.
- El uso sin compensación de color y los ajustes de alto voltaje establecido en los pasos 3.2 y 3.3, la adquisición de datos para el tubo 2, recogiendo FSC, SSC y señales en los 4 detectores de fluorescencia. Para el detector usado para monitorear PKH26 fluorescencia, verificar que todas las células PKH26 pos aparecer en escala como un solo pico simétrico en la década 3 ª -4 ª, con pocas células / no en el último canal. Si hay varios picos o forma de los picos se sesga, repita el paso 1, con especial atención a la sal minimización y técnica de mezcla (Figura 2). Si es necesario, ajustar la concentración de colorante.
- Uso de los parámetros establecidos en el paso 3.3, la adquisición de datos para el tubo 3, recogiendo FSC, SSC y señales en los 4 detectores de fluorescencia. Para el detector usado para monitorear 7-AAD fluorescencia, verificar que la 7-AAD células pos caer encima del límite de 2% establecida en el paso 3,3 (es decir, que las células no viables están bien resueltosviables a partir de 7-AAD células neg).
- Uso de los parámetros establecidos en el paso 3.3, la adquisición de datos para el tubo 4, recogiendo FSC, SSC y señales en los 4 detectores de fluorescencia. Verifique que las células CD8 pos están bien resueltos a partir de células teñidas (es decir, la caída por encima del límite del 2% establecido en el paso 3.3 para el detector FITC). Repita con el tubo 5 y verificar que las células CD8 pos están bien resueltos a partir de células teñidas (es decir, la caída por encima del límite del 2% establecido en el paso 3.3 para el detector de APC).
- Uso de la configuración establecida en el paso 3.3, adquirir datos para tubos 6, 7 y 8, recogiendo FSC, SSC y señales en los 4 detectores de fluorescencia.
- Use los archivos en modo de lista recogidos para tubos 1-5 y el software de compensación de color para establecer un color se superponen matriz para cada fluorocromo en los detectores que se utilizan para controlar los tres fluorocromos otros. Aplicar esta matriz para el modo de lista de archivos para la muestra 6 y verificar que la presencia de PKH26 laboratorioeling no altera la capacidad de detectar 7-AAD células pos.
- Aplica el color se superponen matriz de paso de 3,8 a modo de lista del archivo de muestra 7 y verifique que: a) 3 subpoblaciones bien resueltas (CD3 CD4 neg neg, CD3 CD4 neg pos CD3 y CD4 pos pos) se pueden identificar en un FITC frente a APC diagrama de puntos, y b) la presencia de anti-CD3-FITC y anti-CD4-APC no altera la capacidad de detectar 7-AAD células pos. Si la presencia de anti-CD3-FITC altera el límite superior 2% para los datos recogidos en el detector de PKH26, reajustar el límite según se requiera.
- Aplicar la matriz de color se superponen desde el paso 3.8 para el modo de lista de archivos para la muestra 8. Si la presencia de PKH26 etiquetado altera el límite del 2% para el FITC, 7-AAD o detectores de APC de los establecidos mediante el control autofluorescencia en el paso 3.3, vuelva a ajustar el límite (s) según sea necesario utilizando Tube 7 de la Tabla 1 y verificar que Todavía es posible distinguish CD3 CD4 pos pos, pos CD3 CD4 neg, CD3 y CD4 neg neg células usando el límite ajustado (es).
4. Proliferación Selección del modelo para la Vigilancia división celular por dilución de colorante
- Determinar el espaciado entre generaciones, que es dependiente del número de canales y décadas logarítmica en el citómetro. Para los instrumentos digitales, este valor, típicamente 4 o 5 décadas, se determina por el número de contenedores en el procesador de señal digital. En los instrumentos analógicos, donde el número de décadas no suele ser un número entero, modelado preciso es el número exacto de décadas en ser determinado experimentalmente. Para hacer esto, los datos de una mezcla de perlas fluorescentes calibrados con el fabricante asignadas intensidades relativas se adquiere a la configuración del detector mismas de alta tensión utilizados en el experimento. La posición de los picos de talón permite la calibración de la escala logarítmica en términos de intensity rango por década registro. Específicamente, esto se hace mediante el trazado del número de canal para cada tipo de perla contra el tronco del fabricante asigna valor. La pendiente de una línea recta de mejor ajuste para los valores de datos de cuentas indica el número de unidades de intensidad relativa por canal. Multiplicado por el número de canales, entonces este valor será el número de décadas de registro para la escala completa, de la cual puede ser el número de canales que corresponden a una disminución de dos veces en la intensidad (es decir, el espaciamiento hija generación) calculado 14.
- Decida si va a utilizar un espacio fijo entre generaciones o para permitir la separación de flotar. Un estándar (fijo) le permite utilizar el valor de separación generacional determinado en el paso 4.5 para asignar la ubicación de cada generación, y se suele utilizar cuando el histograma carece de picos distintos. Un valor flotante permite que cada posición de pico generacional a ser determinada por la forma de histograma y se usa típicamente cuando distinguishablpicos e intergeneracionales son evidentes.
- Decida si va a utilizar un ancho pico fijo para todas las generaciones, o un ancho variable. Un ancho fijo utiliza el SD calculado para la muestra de control no estimulado para modelar todas las generaciones y se elige típicamente cuando la muestra carece de picos distinguibles generacionales. Una anchura variable permite que el programa para variar independientemente la SD para cada generación y se utiliza mejor con picos distinguibles generacionales.
- Ejecute un programa que contiene un módulo de análisis de la proliferación (aquí ModFit LT Versión 3.3). Cargar el archivo estimulado PKH26 pos del conjunto de datos a analizar (por ejemplo, un cultivo estimulado 96 hr de células PKH26 pos contratiñeron como para el tubo 8 en la Tabla 1).
- Seleccione los parámetros para el análisis, en este caso PKH26 (585/42) sobre cerrado viable (7-AAD neg) linfocitos CD3 POS y FSC frente a SSC para excluir los desechos pequeños y grandes agregados (Figura 3). En la definición deestas regiones tener cuidado de incluir la zona alta dispersión frontal donde se encuentran típicamente explosiones y CD3 en cuenta que la expresión puede ser modulada abajo en cultivos estimulados.
- Crear un modelo de proliferación nuevo con el Asistente para la Proliferación. Uso del archivo de datos abiertos (ficha Inicio), cargue el archivo de control no estimulado PKH26 pos y definir la ubicación del canal de pico en la distribución parental correspondiente a las células indivisas.
- Analizar el archivo de la no estimulada PKH26 pos de control, teniendo en cuenta los valores de la posición del pico parental y anchura (desviación estándar). Si una anchura de pico fijo (SD) se desea, comprobación de enganche SD.
- Cargar el PKH26 neg control (por ejemplo, un cultivo de 96 h las células PKH26 neg contratiñeron como para el tubo 7 en la Tabla 1). Ajuste el número de generaciones por ajustar el canal de pico para la generación más oscuro encima del control PKH26 neg. Esto determina la numbre de las generaciones hijas el modelo puede encajar con precisión y es típicamente 6-9 generaciones.
- Abrir el archivo de datos para la muestra estimulada (por ejemplo, un cultivo estimulado 96 hr de células PKH26 pos contratiñeron como para el tubo 8 en la Tabla 1) y confirmar que las regiones de la posición del pico parental y la SD tal como se define en el Paso 4,7 permanecen sin cambios. Si la distancia generacional fijo se desea, seleccione la opción Modelo estándar, de lo contrario seleccione la opción Flotante.
- Analizar cada archivo experimental en el conjunto de datos, utilizando el mismo modelo definido en el Paso 4.9. Ajustes menores en la posición del pico parental puede ser necesario para el mejor ajuste tal como se define visualmente y por la reducción de chi cuadrado (RCS) de valor.
- Registre los indicadores de proliferación deseados que resultan de la de mejor ajuste para cada archivo experimental en el conjunto de datos. Para una descripción completa de los posibles métricas ver Ref. 22.
Resultados
Colorantes de membrana como PKH26 mancha por casi instantánea compartimentación en las membranas celulares en lugar de por reacción química (por CFSE) o la unión de equilibrio (de anticuerpos). Falta de atención a los problemas críticos descritos en la Figura 1 puede dar lugar a la tinción débil o heterogénea del tipo mostrado en la Figura 2. En contraste, el uso de condiciones de etiquetado optimizado (Figura 1, Tabla 2) en los resultados brillantes distribuciones homogéneas adecuadas para una variedad de aplicaciones de seguimiento de células incluyendo la supervisión de la división celular basado en dilución de colorante (Figura 3). Las células muertas / que mueren pierden cantidades variables de tinte de seguimiento, los cuales pueden ampliar y / o intensidad de sesgar generación hija y complicar la proliferación de modelado basado en la dilución tinte 3,4,16,18. El uso de un colorante de viabilidad tanto, se recomienda la recogida de datos de dilución de tinturas en condiciones en que un número significativo de células muertas pueden ser Preenvió, tales como cultivos estimulados (Figura 3) o más muestras (Figura 4).
Debido a que el seguimiento de tinte de etiquetado normalmente da intensidades de fluorescencia en varios órdenes de magnitud mayor que la inmunofenotipificación, es importante incluir controles adecuados de compensación (Tabla 1) y para verificar que la presencia de seguimiento de tinte no perjudicar la capacidad de las células para resolver anticuerpos positivos y negativos (figura 4). Para evitar la necesidad de una compensación excesiva de color, es preferible colocar una brillante fluorocromo, o no se encuentra en las células de interés, tales como un colorante excluidos por las células vivas, en el canal espectral (s) adyacente al colorante de seguimiento (Figura 4A y B vs. 4C y D). Al utilizar el software de modelado de pico para cuantificar magnitud de la proliferación, la obtención de un buen ajuste requiere suposiciones que coincidan dentro del modelo a las características de la prof dilución de coloranteiles siendo analizado (Figura 5 y Tabla 3). Con la selección apropiada de los colorantes de rastreo y reactivos de viabilidad, también es posible caracterizar las respuestas proliferativas en múltiples subpoblaciones de linfocitos simultáneamente. Por ejemplo, como se ilustra en la Figura 6, la adición de un colorante de seguimiento segundo simplifica la discriminación entre las células T reguladoras (etiquetados con Claret CellVue) y altamente proliferado células T efectoras (marcado con CFSE) y proporciona muchos más detalles acerca de sus interacciones que podrían obtenerse utilizando 3 H-timidina etiquetado 18,27.
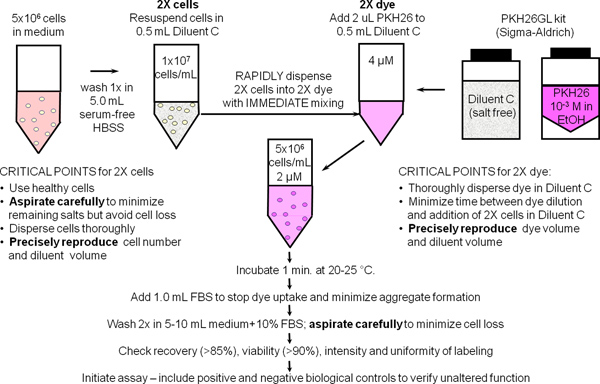
Figura 1. Protocolo general para el etiquetado de membrana PKH26, PKH67 y tintes CellVue. Particionamiento de estos tintes altamente lipofílicas al membra celularnes se produce esencialmente al instante tras la mezcla con las células de tinción cuando se lleva a cabo en el vehículo diluyente de sal libre de C, siempre para maximizar la solubilidad del colorante y la eficiencia de tinción. Como se resume en este esquema para el etiquetado general de membrana con PKH26, tinción brillante, uniforme y reproducible es por lo tanto más fáciles de obtener a través de: 1) reducir al mínimo las cantidades de proteínas y / o sales presentes en la etapa de tinción y 2) utilizando una técnica de mezcla que asegura rápida dispersión homogénea de las células en colorante (es decir, simultáneamente expone todas las células a la misma concentración de colorante).
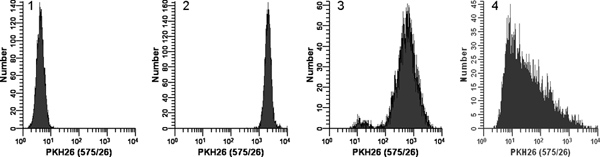
Figura 2. Efecto de las condiciones de tinción en PKH26 distribuciones de fluorescencia (reimpreso de la referencia. 18). Muestras idénticas de crecimiento logarítmico, U culto937 células fueron teñidas con PKH26 (concentraciones finales: 1 x 10 7 células / ml, 12 - 15 micras, PKH26) durante 3 min a temperatura ambiente, con o sin mezcla inmediata tras la adición de las células 2x 2x colorante. Después del lavado, las células teñidas se analizaron en un citómetro de flujo Coulter Beckman cian mediante la configuración constante del instrumento Histograma 1:. De control sin tinción con detector de tensión PKH26 ajusta para colocar todas las celdas de escala en la primera década con pocas células / no se acumula en el primer canal. Histograma 2: tinción con colorante en 15 mM utilizando la adición de las células 2x 2x con colorante inmediata de mezcla dio lugar a una manchado brillante, homogénea, simétrica población de células colocadas en la cuarta década, con pocos / sin células que se acumulan en el último canal (gMFI = . 2548, GCV = 26,2%) Histograma 3: tinción a 15 mM tinte usando la suma de las células 2x 2x tinte pero sin mezclar inmediato dio lugar a una intensidad reducida y un amplio CV (gMFI = 505 , GCV = 116%), así como una subpoblación débilmente manchado, posiblemente debido a una gota de células dispensados en la pared del tubo en lugar de en la solución de tinte 2x Histograma 4:. Un error tinción llevó a 3 l de colorante etanólico concentrado stock que se añade directamente a las células 2 veces en Diluyente C sin mezclar adicionalmente en lugar de ser utilizado para preparar una solución de colorante 2x en Diluyente C. Esto resultó en una concentración de colorante final de 12 mM pero dio tinción extremadamente débil y heterogénea (gMFI = 32,9, GCV = 1020%). La observó derecho sesgar probablemente refleja los efectos combinados de: i) mezclado deficiente debido a célula muy dispares y volúmenes de colorante, y ii) el hecho de que las células más cercanas al punto de dispensación colorante estaría expuesto a una mayor concentración de colorante de los de más de distancia. Haga clic aquí para ampliar la cifra .
re 3 "src =" / files/ftp_upload/4287/4287fig3.jpg "fo: content-width =" 4.5in "fo: src =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
Figura 3. El uso de una sonda de viabilidad simplifica gating de los perfiles de proliferación de células T se marcaron con hPBMC PKH26 (concentración final de células: 3x10 7 / ml, concentración de colorante final: 10 mM).. Después de cultivo durante 96 h en presencia (estimulado) o ausencia (no estimulado) de anti-CD3 y IL-2, las células se tiñeron con anti-CD3-FITC, anti-CD19 APC-y 7-AAD, y se analizaron en un FACSCalibur citómetro de flujo (véase la referencia 13 para más detalles). Compensación de color se realizó en el momento de adquisición de datos usando circuitos de compensación cableada. El alcance de la proliferación se modela como se describió en el Paso 4 utilizando el Asistente proliferación en ModFit LT3.3. Los datos de control de la PKH26 neg (Tabla 1, Tube 7) se superponen para referencia (histogramas grises llenos en la columna 3). Viabilidades para no estimulado y las ITSculturas formuladas fueron del 76% y el 62% (datos sin sincronización de los grupos A y B, respectivamente). Panel A. PKH26 células teñidas cultivadas durante 96 horas en un medio fueron cerrada para incluir viables (7-AAD neg) células CD3 TPV (R1). Además de la inclusión de anticuerpos y 7-AAD puerta células muertas de exclusión, una dispersión frontal (FSC) frente a dispersión lateral (SSC) puerta (R2) se utilizó para excluir los desechos y los agregados. Nótese la ausencia de células muertas en la última parcela en este panel. El modelo de mejor ajuste para el perfil de la proliferación PKH26 (columna 3) dio un solo pico con RCS = 2,1 (Donante 6, Tabla 3), lo que indica una buena simetría, y se utilizó para definir la posición de partida parental y anchura de pico para el análisis de la estimulada muestra de este conjunto de datos (Panel B). Panel B. Una parte alícuota de repetición de PKH26 células teñidas se cultivaron con anti-CD3 y IL 2-por 96 hr y cerrada de la misma manera como en el Panel A. Un modelo con la posición del pico flotante y el ancho pico flotante dio el mejor ajuste para estos datos con RCS = 1,3 (Donante 6, Tabla 3). Panel C. El mismo archivo de datos como en el Panel A se analizó sin el uso de 7-AAD datos. Cuando un primario de FSC frente a SSC se utilizó para excluir parcialmente las células muertas y los agregados (R2) y una puerta secundaria para seleccionar CD3 eventos positivos (R3), una pequeña población residual de células muertas se mantuvo (0,2% de eventos gated). El modelo de mejor ajuste dio un solo pico con RCS = 2,2. Panel D. El mismo archivo de datos como en el Panel B fue cerrada como en el panel C. Nótese la mayor población residual de células muertas en la muestra estimulada (1,29% de eventos gated) para esta estrategia de activación periódica. El modelo de mejor ajuste fue uno con posición de pico y pico de ancho variable (RCS = 1,3). Haga clic aquí para ampliar la cifra .
ig4.jpg "fo: content-width =" 5in "fo: src =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
Figura 4. Efecto de la elección fluorocromo y concentración de colorante en la capacidad de los linfocitos inmunofenotipo marcadas con PKH26. HPBMC se aislaron a partir de 24-hr sangre vieja y se marcaron con PKH26 como se describe en el Paso 1, con la excepción de que la tinción se llevó a cabo en 12 x 75 mm fondo redondo tubos de poliestireno en lugar de 12 x 75 mm tubos de polipropileno cónicos. Inmediatamente después de marcar con PKH26, las células se tiñeron con los reactivos indicados inmunofenotípicos y viabilidad, y se analizaron en un citómetro de flujo LSRFortessa utilizando la estrategia de puerta de la figura 3A y la siguiente configuración óptica: 488 nm láser: FSC-A (488 nm); SSC -A (488/10 BP), FITC-A (530/30 pb); PKH26-A (575/26 pb), 7-AAD-A o PerCP A-(695/40 AP). 640 nm láser: APC-A o TOPRO-3-A (670/14 BP). Compensación de color se realizó en el momento de adquisición de datos usando el software BD DiVa. "Auto"indica autofluorescencia de la de control sin anticuerpo en la ventana espectral relevante (APC para los paneles A y B, PerCP para paneles C y D). Los datos de control de la PKH26 neg (Tabla 1, Tube 7) se superponen para referencia (histogramas grises llenos, columna 5). Tinción post-viabilidades eran similares para todas las muestras (88-92%). Panel A. Las células marcadas con PKH26 a una concentración final de 2 mM se contratiñeron con anti-CD3-FITC, anti-CD4-APC, y 7-AAD ( tubo 8 de la Tabla 3). Después de gating en viable (7-AAD neg) linfocitos CD3 POS (columna 1) y la exclusión de los desechos y agregados basados en FSC y SSC (ver Figura 3A), PKH26 intensidad fue evaluada en combinación con CD4 APC (columnas 2 y 3). Si no compensada (columna 2) o compensada (columna 3), este fluorocromo combinación resultó en buena resolución entre CD4 pos las células T y las células CD4 neg T), como se comprueba por tanto un no-antibody, control autofluorescente (Tubo 6 de la Tabla 1, columna 4) y la trama de dos colores de CD3 vs. CD4 (columna 6). Panel B. Utilizando la combinación de fluorocromo mismo que en el Panel A, pero el aumento de la concentración final de PKH26 a 4 micras, no afectan negativamente a la capacidad de resolver CD4 pos células T CD4 de células T neg. Panel C. Un alícuota de células replican independientemente marcadas con PKH26 a una concentración final de 2 mM se counterstained utilizando anti-CD3-FITC, anti-CD4-PerCP, y TOPRO-3. Después de gating en TOPRO viables (neg-3) linfocitos CD3 POS (columna 1) y la exclusión de los desechos y agregados basados en FSC y SSC (ver Figura 3A), PKH26 intensidad fue evaluada en combinación con anti-CD4-PerCP (columnas 2 y 3). Sustanciales solapamiento espectral de PKH26 en el canal PerCP es evidente en los datos no compensadas (Columna 2), y la resolución entre PKH26 CD4 pos pos y PKH26 CD4 pos neg eventos es marginal después de la compensación se aplica (comparar con la columna 3 no-anticuerpo, control autofluorescente se muestra en la Columna 4). Panel D. Cuando PKH26 se aumenta la concentración de 4 mM, ya no es posible utilizar la combinación de fluorocromo panel superposición C. Espectro de PKH26 en el canal PerCP supera la intensidad de la señal de CD4 (Columna 2) y CD4 pos PKH26 eventos POS ya no puede ser resuelto de CD4 neg PKH26 pos células T (columna 3 vs. Columna 4). Haga clic aquí para ampliar la cifra .
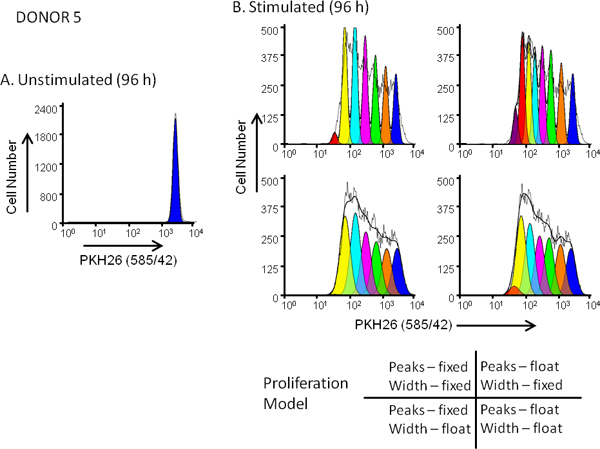
Figura 5. Efecto de la selección de modelo en la proliferación. bondad del ajuste para los perfiles de dilución de colorante hPBMC fueron marcadas con PKH26 (concentración final de células: 3x10 7 / ml, concentración de colorante final: 10 mM). Después de cultivo durante 96 h en presencia (estimulado) o ausencia (no estimulado) de anti-CD3 y IL-2, las células se recogieron de contraste con anti-CD3-FITC, anti-CD19-APC y 7-AAD y se analizaron en un FACSCalibur citómetro de flujo (véase la referencia 13 para los métodos detallados). Compensación de color se realizó en el momento de adquisición de datos usando circuitos de compensación cableada. Panel A. El perfil de intensidad PKH26 partir de un cultivo no estimulado hr 96 para Donante 5, una moderada respuesta, fue cerrada como se muestra en la Figura 3A y utilizado para proporcionar la proliferación ModFit Asistente con una primera estimación de la posición y la anchura del pico que representa indivisas células parentales. Panel B. El perfil de intensidad PKH26 desde una línea paralela estimuladas 96 h cultivo se analizó utilizando las estimaciones a partir dePanel A y 4 combinaciones diferentes de 'proliferación mago ajustes, correspondientes a las intensidades máximas fijas o flotantes, y anchuras máximas fijas o flotantes para las generaciones sucesivas hija como se muestra. Como se resume en la Tabla 3, el modelo que dio el mejor ajuste a los datos observados (mínima menor de chi-cuadrado; RCS) era la "variable / variable" combinación en la que no sólo posiciones de los picos, sino también las desviaciones estándar de los picos de generación hija se les permitió para variar (RCS = 1,5). El mismo modelo dio el mejor ajuste para los donantes 6, una alta respuesta (Figura 3B y Tabla 3).
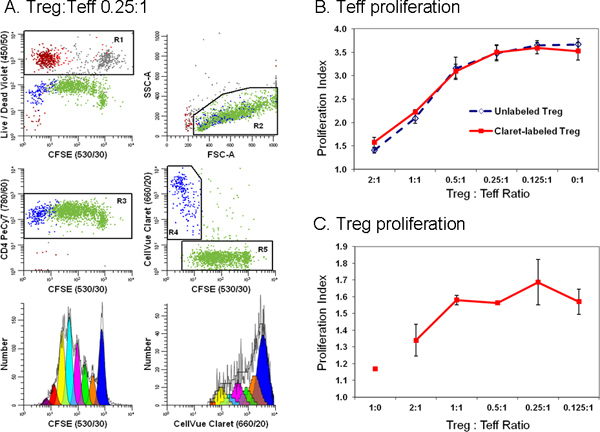
Figura 6. La adición de un colorante de seguimiento de celda de segundo simplifica la discriminación entre las células T efectoras y reguladoras en un ensayo de citometría de flujo de supresión(Adaptado de la Ref. 18.) Linfocitos de monocitos empobrecido preparados a partir de filtros de leucoféresis TRIMA se tiñeron con anti-CD127-PE, anti-CD4-PE-Cy7, y anti-CD25-APC y el flujo ordenados en poblaciones de efector (teff.; CD4 pos CD127 CD25 brillante dim), regulador (Treg; CD4 pos CD127 CD25 dim pos) y accesorios (CD4 neg) las células. Ordenado células Treg marcados con Claret CellVue (concentración final de células: 1x10 6 / ml, concentración de colorante final: 1 M) y Teff ordenados etiquetados con CFSE (concentración celular final: 5 × 10 7 / ml, concentración de colorante final, 5 mM) fueron co-cultivadas en diferentes proporciones en la presencia de células accesorias anti-CD3, anti-CD28 e irradiado. Después de 96 h, se recogieron los cultivos, contratinción con anti-CD4-PE-Cy7 y LIVE / DEAD Violet corregible, y se analizaron en un citómetro de flujo LSRII y compensación de color se realizó en el momento de los datos ADQUISICIOn utilizando BD DiVa software (véase la referencia 18 para más detalles, incluidos los controles de compensación). Los índices de proliferación de teff y Treg se modelaron como se describe en el paso 4, utilizando el Asistente para la proliferación en ModFit LT3.3. Los puntos de datos en los paneles B y C representan la media ± 1 desviación estándar de muestras triplicadas Panel A. Los datos representativos se muestran para una de las tres muestras por triplicado en un Treg:. Teff relación de 0,25:1. Reactivo corregible Violet LIVE / DEAD se utilizó para excluir las células muertas (gráfico R1, superior izquierda, células accesorias = rojo-marrón, gris = no viable Teff y no viables Treg rojo =) de todas las parcelas de datos. Tinción Claret CellVue se utilizó para distinguir Treg viable (R4, parcela centro derecha, azul) desde viable pero muy proliferado Teff (R5, parcela jardín derecho y central, verde). Un CFSE único parámetro de perfil proliferación de teff (diagrama de la izquierda inferior) se generó por gating sobre células que eran CFSE pos (R5), CD4 pos (R3), viable (no R1), y tenía linfocitos scAtter propiedades (R2). Un CellVue único parámetro Claret perfil proliferación de Treg fue generada por gating en células que eran CellVue Claret pos (R4), CD4 pos (R3), viable (no R1), y tenía las propiedades de dispersión de linfocitos (R2). Tenga en cuenta la región de linfocitos generoso (R2) se define para incluir ráfagas de linfocitos. Tenga en cuenta también que el número total de células que han de recogerse depende de la población más bajo de frecuencia de interés. En un experimento de proliferación celular, donde puede ser la población de interés distribuido sobre una amplia gama de intensidades que representan hasta siete u ocho generaciones un gran número de células deben ser recogidos con el fin de modelar con precisión y calcular el número de células en cada generación. Cuando el estudio de células raras, puede ser necesario ejecutar simplemente el tubo de muestra casi seco con el fin de recoger el máximo número posible de eventos. Para el ejemplo que se muestra aquí, haciendo esto dio lugar a un total de ~ 25.000 eventos, de los cuales 11.923 eran de teff (I proliferaciónndex 3,85) y 1.380 eran Treg (índice de proliferación 1,83). Panel B. Como era de esperar, el aumento de la proporción de células T reguladoras presentes en co-cultivos condujo a una mayor supresión de la proliferación de células de teff. Se obtuvieron resultados similares con ambos CellVue Claret-manchado (línea continua) o Treg sin teñir (línea de trazos), lo que indica que la tinción con el colorante Claret CellVue seguimiento no afectó Treg potencia. Panel C. Treg son relativamente anérgicos y, como se esperaba, hizo no proliferan cuando se incubaron con anti-CD3, anti-CD28, y células accesorias en la ausencia de células de teff (Treg: relación de teff de 1:0). Sin embargo, como la proporción de teff presente en co-cultivos aumentó (es decir, como el Treg: relación de teff disminuido), la medida de Treg proliferación también aumentó. Las barras de error generalmente más grandes para estos datos por lo menos en parte refleja la extensión limitada de proliferación, lo que lleva a un menor número de eventos recogidos relativos a teff y mayor inciertodad en la modelización del número de células en cada generación. Haga clic aquí para ampliar la cifra .
| Tubo No. (Propósito) | PKH26 | Anticuerpo (s) | 7-AAD |
| 1 (Setup, compensación) | - | - | - |
| 2 (programa de instalación, compensación) | + | - | - |
| 3 (configuración, la indemnización) | - | - | + |
| 4 (compensación) | - | CD8-FITC b | - |
| 5 (compensación) | - | CD8-APC b | - |
| 6 (ningún control Ab) | + | - | + |
| 7 (no hay seguimiento con tintetrol) | - | CD3-CD4-FITC APC o c CD19-APC | + |
| 8 (T0 control) | + | CD3-CD4-FITC APC o c CD19-APC | + |
. Configuración de la Tabla 1 un instrumento controla una controles enumerados son apropiados para un 4-color ensayo de células T CD4 monitoreo de proliferación usando:. PKH26 (proliferación colorante), CD3-FITC (pan-T marcador de células), CD4-APC (T-helper marcador de células), 7-aminoactinomycin D (7-AAD; muerto exclusión celular) b Brighter sustitutos para CD3-FITC y CD4 APC-(mejor capacidad de detección de errores de compensación) c Figura 3:.. CD3-FITC y CD19-APC. d Figura 4: CD3-FITC y CD4-APC.
| Tipo de célula | Concentración final de células | Concentración de colorante final </ Strong> | Referencia |
| b hPBMC | 1 x 10 7 / ml | 2 mM PKH67 | 10,17 |
| 5 x 10 6 / ml | 2 mM PKH26 | 12 | |
| 3 x 10 7 / ml | 10 mM PKH26 | 13 | |
| 5 x 10 7 / ml | 30 mM PKH26 | 18 | |
| 1 x 10 6 / ml | 1 mM Claret CellVue c | 18 | |
| 3 x 10 7 / ml | 4 Claret CellVue mM | 13 | |
| 5 x 10 7 / ml | 5 Claret CellVue mM | 18 | |
| Las células en cultivo | 5 x 10 5 / ml | 0,1 mM PKH26 (1 ° células mamarias) | 8 |
| 1 x 10 7 / ml | 15 mM PKH26 (U937) | 18 | |
| 1 x 10 7 / ml | 12,5 -15 mu M PKH26 (U937) | 15 | |
| 1 x 10 7 / ml | 1 mM PKH67 (K562) | 18 | |
| 1 x 10 7 / ml | 1 mM PKH67 (líneas de células T) | 9 | |
| 1 x 10 7 / ml | 10 mM Claret CellVue (YAC-1) | 23 |
Tabla 2. No cause Dye membrana Condiciones de tinción a. A. Adaptado y actualizado de la referencia 18. B Un lavado de baja velocidad (300 xg) se utilizó para minimizar la contaminación plaquetaria. C (células Treg CD4 de flujo según CD25 pos pos neg linfocitos CD127).
| Configuración de Modelo | Resultados del Modelo | ||||||||
| Donante | Tratamiento | Peak Position | SD | Posición Parental | Padres SD | N º de Picos Equipada | RCS | PI | PF |
| 5 | Unstimulated | Flotar | Flotar | 209 | 4,5 | 1 | 5,1 | 1,0 | 0 |
| 5 | Estimulado | Fijo | Fijo | 209 | 4,5 | 7 | 35 | 3,9 | 31 |
| 5 | Estimulado | Flotar | Fijo | 209 | 4,5 | 8 | 19 | 4,3 | 30 |
| 5 | Estimulado | Fijo | Flotar | 209 | 9,2 | 6 | 1,9 | 3,8 | 30 |
| 5 | Estimulado | Flotar | Flotar | 209 | 9.0 | 7 | 1,5 | 3,7 | 29 |
| 6 | Unstimulated | Flotar | Flotar | 205 | 4.0 | 1 | 2,1 | 1,0 | 0 |
| 6 | Estimulado | Fijo | Fijo | 205 | 4.0 | 6 | 42 | 6,6 | 60 |
| 6 | Estimulado | Flotar | Fijo | 205 | 4.0 | 7 | 12 | 7,4 | 60 |
| 6 | Estimulado | Fijo | Flotar | 205 | 8,6 | 6 | 6,9 | 6,8 | 62 |
| 6 | Estimulado | Flotar | Flotar | 205 | 6,5 | 6 | 1,3 | 6,5 | 59 |
Tabla 3. Impacto del Modelo proliferación de bondad de ajuste (RCS) y mediciones de proliferación a. Una tinción de muestras, recolección de datos y conmutación como se describe en la Figura 3A y B.
Discusión
Los métodos descritos aquí son las que se encuentran en nuestros laboratorios combinados para dar más fiabilidad óptimos resultados para el etiquetado hPBMC el uso de tintes membrana 13,16,18 y fenotipificación subconjunto de linfocitos y la proliferación de seguimiento utilizando tintes membrana o proteínas 2,11,13,16, 18. Como se ilustra en las Figuras 1 y 2, el etiquetado uniforme brillante es más fácilmente consigue limitando la presencia de sales fisiológicas y utilizando una técnica de mezcla que resulta en la exposición rápida y homogénea de todas las células a la misma concentración de colorante. Debido a que la tinción con colorantes de membrana se produce por el reparto en la bicapa lipídica, otras variables que alteran la concentración de colorante libre también puede afectar la eficiencia de etiquetado. Por ejemplo, el etiquetado en tubos de poliestireno de fondo redondo de resultados en menos eficiente lavado de las sales antes de la resuspensión en Diluyente C y también en menor concentración libre de tintes debido a la adsorción de colorante en las paredes del tubo, en particulara bajas concentraciones de colorante. Ambos factores tienden a dar más amplias distribuciones de tinción que cuando etiquetado se realiza utilizando tubos cónicos de polipropileno de fondo (Figuras 3, 4 y resultados sin publicar). Edad y tipo de muestra también pueden afectar la anchura del pico incluso cuando los procedimientos de tinción se utilizan optimizado. Por ejemplo, CV para PKH26 pos linfocitos aislados de sangre recién extraída rango de 14 a 20% (Figura 3, Ref. 13 y resultados no publicados), mientras que CV de los linfocitos aislados de 24 muestras de sangre hr viejos o rango TRIMA féresis filtros 25 a 30 % (Figura 4 y Ref. 18).
La tinción uniformidad y la medida en que las células no viables pueden ser excluidos de análisis tanto afectar si los picos distinguibles hija son evidentes en el perfil de dilución de colorante, que a su vez influye en la elección de un modelo de proliferación para ajustar los datos observados (Figuras 5 y 6 ). Aunque ModFit (Verity Software House, Topsham, ME) se usa aquí como un ejemplo de software usado para generar métricas como el índice de proliferación y frecuencia del precursor (Figuras 3, 5 y 6, Tabla 3), otros paquetes de software también contienen módulos para analizar datos de proliferación. Estos incluyen FCSExpress (De Novo Software, Los Angeles, CA) y FlowJo (Árbol Star, Inc., Ashland, Oregón). Todos estos programas utilizan una no lineal de análisis de mínimos cuadrados para encontrar iterativamente el mejor ajuste a los datos en bruto, cambiando la posición, la altura y la SD (o anchura) de los picos Gaussianos que representan generaciones sucesivas hija. Índice de proliferación (IP) y la frecuencia de los precursores (PF) son las medidas más utilizadas de medida de la proliferación. PI, tal como se define por ModFit, es una medida del aumento de número de células durante el curso del ensayo, análogo a la "índice de estimulación 'de un ensayo de absorción de timidina. PF devuelve la fracción de células en la populat inicialion que responden al estímulo de la proliferación. Se recomienda precaución, sin embargo, al leer la literatura desde la terminología varía un poco entre paquetes de software (por ejemplo, FlowJo y ModFit utilizan diferentes definiciones y cálculos de lo que se entiende por "proliferación Index") 22.
Los temas críticos discutidos aquí para el etiquetado y el análisis de proliferación con tintes de membrana también se encuentran cuando se utilizan colorantes proteicos. Por ejemplo, una cuidadosa atención a la técnica de mezcla también deben ser observadas, junto con la exclusión de células muertas / morir, con el fin de obtener distribuciones uniformes y picos distinguibles hija cuando se utiliza CFSE (Figura 6) 2-4,13,18,24. La elección apropiada de fluorocromos para fenotipado y evaluación de viabilidad es también importante para evitar excesivas solapamiento espectral y la incapacidad de reconocer las células positivas de anticuerpos, particularmente con tintes visibles emisores de proteína tales como CFSE 2-4,11,13,16,18 . La reducción de la concentración de colorante de seguimiento disminuye los problemas de compensación en canales espectrales adyacentes pero también limita el número de divisiones celulares que pueden ser monitoreados antes de intensidades hija celulares comienzan a solaparse con la autofluorescencia. Alternativamente, el uso de tintes de células nuevas de rastreo tales como el emisor de Claret CellVue rojo lejano (Sigma-Aldrich, St. Louis, MO) o violeta emisor de CellTrace Violet (Life Technologies, Grand Island, NY) puede reducir los problemas de compensación (Figura 6). Finalmente, aunque los colorantes de membrana en general tienden a exhibir una menor toxicidad 11,26, es posible sobre células de etiqueta ni con la clase de colorante. Por tanto, es siempre necesario verificar que la concentración de colorante de seguimiento utilizado no ha alterado la funcionalidad de las células para ser rastreados (Figura 6) 3,13,16,18.
Divulgaciones
K. Humphrey, JD Tario Jr., y Wallace PK han recibido pre-comerciales reactivos celulares de seguimiento para la evaluación de Life Technologies, Inc. y BD Biosciences. AD Bantly y JS Moore han recibido pre-comercial célula de seguimiento de los reactivos para la evaluación de Life Technologies, Inc. y la financiación de PTI Research, Inc. para la pre-comercial caracterización de células CellVue diversos seguimiento de los tintes. K. Muirhead es empleado por SciGro, Inc., que ofrece servicios de consultoría a las Tecnologías de Phanos, Inc. (propietaria de la PKH y tintes CellVue) y proporciona soporte de copia de seguridad técnica para Sigma-Aldrich y tecnologías de orientación molecular, Inc. (distribuidores de estos colorantes).
La producción y el libre acceso a este artículo es patrocinado por Sigma-Aldrich.
Agradecimientos
Los autores gustaría dar las gracias a las siguientes personas por sus contribuciones técnicas e intelectuales para el desarrollo de estos métodos a través de los años: Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis celular Ciencia e Investigación PTI) , Brian Gray (PTI Research), Jan Fisher (Dartmouth Medical School), Alice Givan (Dartmouth Medical School), Betsy Ohlsson-Wilhelm (SciGro, Inc.), y Mary Waugh (Dartmouth Medical School). También me gustaría dar las gracias a la clase de Bowdoin 2006 de los Cursos Anuales de Métodos de Investigación y Aplicaciones de la citometría de flujo, lo que generó los datos mostrados en la Figura 2.
Citometría de flujo se realizó en el Laboratorio de Roswell Park Cancer Institute Citometría de flujo, que se estableció en parte por donaciones de equipo del Programa de Instrumentos NIH compartido, y recibe el apoyo de la Beca Core (5 P30 CA016056-29) de la NationalInstituto del Cáncer Roswell Park para el Cáncer del Instituto, y en la Citometría de Flujo Abramson Cancer Center y clasificación de células Laboratorio de Recursos de la Universidad de Pennsylvania, que fue establecida en parte por donaciones de equipo del Programa de Instrumentos NIH compartido, y recibe el apoyo de NIH # 2P30 CA016520 del Instituto Nacional del Cáncer. La obra se muestra en las figuras 3 y 5 también fue apoyado en parte por subvención SBIR EB00228 del Instituto Nacional de Imágenes Biomédicas y Bioingeniería (NIBIB) otorgó a PTI Research, Inc.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo o equipo | Empresa | Número de catálogo | Comentarios |
| Comercialmente adquirida | |||
| 7-D Aminoactinomycin | Sigma-Aldrich | A9400 | |
| Albúmina de suero bovino (BSA) | Sigma-Aldrich | A4503 | |
| Suero fetal bovino (FBS) | Atlanta Biológicos | S11150 | |
| Solución salina equilibrada de Hanks (HBSS) | Life Technologies | 14175-079 | El calcio y el magnesio libre, sin rojo de fenol |
| IgG humana fracción Cohn II y III globulinas | Sigma-Aldrich | G-4386 | |
| Ratón anti-CD3 humano-FITC | BD Biosciences | 349201 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Anti-ratón humanos CD4-APC | BD Biosciences | 340672 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-CD4 humano PECy7 | BD Biosciences | 348799 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-humano CD8-FITC | BD Biosciences | 347313 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-humano CD8-APC | Caltag (Life Technologies) | MHCD0805 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-CD19 humano-APC | Caltag (Life Technologies) | MHCD1905 | Saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-humano CD25-APC | BD Biosciences | 340938 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-humano CD127-PE | BD Biosciences | 557938 | La saturación de concentración tal como se determina mediante valoración de laboratorio |
| Ratón anti-CD3 humano | eBiosciences | 16-0037-85 | 1,0 mg / ml; azida libre |
| Ratón anti-CD28 humano | eBiosciences | 16-0289-85 | 1,0 mg / ml; azida libre |
| PBS | Gibco | 21300-058 | |
| PKH26 rojo fluorescente de células kit de unión que contiene 10-3M PKH26 en EtOH y C Diluyente | Sigma-Aldrich | PKH26GL-1KT o MINI26-1KT | Procedimientos en el paso 1 se aplican tambiéna los kits que contienen PKH67 u otros colorantes CellVue |
| Claret CellVue mucho rojo fluorescente celular kit de unión que contiene 10-3M Claret CellVue en EtOH y C Diluyente | Sigma-Aldrich | MINCLARET-1KT o MIDCLARET 1KT- | |
| 5 - (y-6)-diacetato de carboxifluoresceína, succinimidil éster (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | No fluorescente; escindidos por esterasas de membrana para formar amino-reactivo fluorescente carboxifluoresceína succinimidil éster (CFSE) |
| LIVE / DEAD Violet corregible | Invitrogen (Life Technologies) | L34955 | |
| Estéril 12 x 75 mm cónico tubos de polipropileno y gorras | VWR | 60818-102 | Da tinte mejor eficiencia de tinción de membrana (reducido adsorción de colorante, menos pérdida de células durante la aspiración sobrenadante) |
| 12 x 75 mm round fondo tubos de poliestireno | Becton Dickinson | 21008-936 | |
| Citómetro de flujo | BD Bioscience | FACSCalibur LSRFortessa | Cualquier citómetro capaz de detectar FITC, PKH26, y 7 AAD-(ex. 488 nm;. Em 520 nm, 567 nm, y 655 nm, respectivamente) y ex APC. 633-640 nm, em. 660 nm) |
| Citómetro de flujo | Beckman Coulter | LSRII cian | Cualquier citómetro capaz de detectar FITC, PKH26, y 7 AAD-(ex. 488 nm;. Em 520 nm, 567 nm, y 655 nm, respectivamente) y ex APC. 633-640 nm, em. 660 nm) |
| Laboratorio Preparado | |||
| 7 Aminoactinomycin D, caldo concentrado | NA | NA | 1 mg / ml en PBS. Congelar y almacenar en alícuotas a -20 ° C. |
| 7 Aminoactinomycin D, worrey de stock | NA | NA | 100 g / ml en PBS; preparar diariamente de 1 mg / ml stock congelado. |
| IgG bloque | NA | NA | HBSS + 10 mg / ml de IgG humana fracción Cohn II y III globulinas + 10 mg / ml de BSA. |
Referencias
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados