Method Article
Оптимизирован Окрашивание и распространения методов моделирования для деления клеток Мониторинг использования красителей сотовых слежения
В этой статье
Резюме
Успешное использование красителей клетки слежения для мониторинга иммунной функции и пролиферации клеток включает в себя несколько важных этапов. Мы опишем методы: 1) получение яркого, равномерного, воспроизводимые этикетки-ния с мембранными красители, 2) выбрать флуорохромы и условий сбора данных и 3) выбор модели для количественной пролиферации клеток на основе красителя разбавлением.
Аннотация
Fluorescent cell tracking dyes, in combination with flow and image cytometry, are powerful tools with which to study the interactions and fates of different cell types in vitro and in vivo.1-5 Although there are literally thousands of publications using such dyes, some of the most commonly encountered cell tracking applications include monitoring of:
- stem and progenitor cell quiescence, proliferation and/or differentiation6-8
- antigen-driven membrane transfer9 and/or precursor cell proliferation3,4,10-18 and
- immune regulatory and effector cell function1,18-21.
Commercially available cell tracking dyes vary widely in their chemistries and fluorescence properties but the great majority fall into one of two classes based on their mechanism of cell labeling. "Membrane dyes", typified by PKH26, are highly lipophilic dyes that partition stably but non-covalently into cell membranes1,2,11. "Protein dyes", typified by CFSE, are amino-reactive dyes that form stable covalent bonds with cell proteins4,16,18. Each class has its own advantages and limitations. The key to their successful use, particularly in multicolor studies where multiple dyes are used to track different cell types, is therefore to understand the critical issues enabling optimal use of each class2-4,16,18,24.
The protocols included here highlight three common causes of poor or variable results when using cell-tracking dyes. These are:
- Failure to achieve bright, uniform, reproducible labeling. This is a necessary starting point for any cell tracking study but requires attention to different variables when using membrane dyes than when using protein dyes or equilibrium binding reagents such as antibodies.
- Suboptimal fluorochrome combinations and/or failure to include critical compensation controls. Tracking dye fluorescence is typically 102 - 103 times brighter than antibody fluorescence. It is therefore essential to verify that the presence of tracking dye does not compromise the ability to detect other probes being used.
- Failure to obtain a good fit with peak modeling software. Such software allows quantitative comparison of proliferative responses across different populations or stimuli based on precursor frequency or other metrics. Obtaining a good fit, however, requires exclusion of dead/dying cells that can distort dye dilution profiles and matching of the assumptions underlying the model with characteristics of the observed dye dilution profile.
Examples given here illustrate how these variables can affect results when using membrane and/or protein dyes to monitor cell proliferation.
протокол
1. Генеральный маркировки мембраны с PKH26 краска отслеживания сотовых (Ref. 25; рис. 1)
- Используйте стерильную технику для шага 1,1 - 1,9. Подготовка ~ 10 7 человек мононуклеарных клеток периферической крови или лимфоцитами (hPBMC, hPBL) с использованием стандартных методов лаборатории с добавлением 300 мкг окончательного спина чтобы свести к минимуму загрязнение тромбоцитов. Ресуспендируют клеток на 10 7 / мл в HBSS +1% BSA и место на льду, оставляя на 500 мкл (5х10 6 клеток) для использования в шаге 2.
- Место 5x10 6 клеток (500 мкл) в 12 х 75 мм конической трубе полипропилена. Мыть раз с 3,5 мл HBSS. Осторожно аспирации супернатант, оставляя не более 15-25 мкл остаточной жидкости, но осторожно, чтобы не удалить клетки. Используйте эту трубу, чтобы подготовить 2x суспензии клеток в шаге 1.4.
- Во время стирки в ячейке Шаг 1,2, добавляют 0,5 мл разбавителя автомобиля маркировки C (от PKH26GL комплект) к 12 х 75 мм конической трубе полипропилена. Используйте эту трубку, чтобы приготовительныеявляются 2x PKH26 решение в шаге 1.5.
- Добавить 0,5 мл раствора транспортного средства маркировки C до промытый осадок клеток, начиная с шага 1.2 и аспирации и выдачи 3-4 раз для получения суспензии отдельных клеток (2x клеток). Избегайте образования пузырей и чрезмерного смешивания, что может уменьшить жизнеспособность клеток и восстановление.
- Сразу же после получения 2x суспензии клеток в шаге 1.4, подготовить 2x (4 мкм) раствор красителя путем добавления 2,0 мкл 1,0 мм PKH26 красителя складе в этаноле (от PKH26GL комплект) для разведения трубки C, полученного на стадии 1.3 и вихрь дисперсных равномерно.
- Сразу же после получения 2x раствор красителя в шаге 1.5, быстро пипетировать 2x клеточной суспензии из 1,4 Шаг в 2х раствор красителя и одновременно аспирации и выдачи 3-4 раз, чтобы полностью рассеять клеток в красителях Запрещается:. Добавить 1,0 мМ красителя непосредственно в клеток, залить 2x 2x клеток в красителях, или добавить 2x клеток в 2 раза красителя в то время как встряхиванием. Потому что окрашивание почти мгновенно, такие методы дают меньшеравномерной интенсивностью, чем рекомендуемый метод (рис. 2).
- Через 1 мин, добавить 1,0 мл инактивированной нагреванием сыворотки или HBSS +5% BSA, чтобы остановить красителя в клеточные мембраны. Отказ от использования достаточно белка риск образования агрегатов красителя, который может гранул с клетками во время стирки шагов и привести к непредвиденным маркировки других клеток, присутствующих в эксперименте. Если среда с 10% инактивированной нагреванием сыворотки (CM) или HBSS +1% BSA должны быть использованы в качестве стоп-реагент, проводить окрашивание в 15 мл коническую трубку полипропилена и добавить по меньшей мере 5,0 мл стоп-реагента для обеспечения адсорбции всех неинкорпорированных красителя.
- Центрифуга меченых клеток в течение 5 мин при ~ 400 х гр. Осторожно аспирации супернатант, не снимая клетки. Вымойте гранул в два раза с 4 мл CM или HBSS +1% BSA, диспергирования гранул задолго до recentrifugation. Чтобы свести к минимуму переноса красителя адсорбированных на стенках труб и увеличить эффективность стирки, передает клетки в новую пробирку полипропилена после FiПервое ресуспендирования. Примечание: адекватно окрашенные клетки будут обладать различными розовым оттенком в гранулах.
- Ресуспендируют промытый осадок клеток в 1,0 мл HBSS BSA% +1. Подсчет клеток, определения восстановления клеток и регулировать громкость, чтобы дать конечной концентрации 10 7 / мл. При тщательном стремление, восстановления клеток должна быть ≥ 85%. Если восстановление клеток <70%, определить причину прежде чем двигаться дальше. Вывод на 150 мкл (1.5x10 6 ячеек) и место на льду для использования в шаге 2.
2. Подготовка органов управления инструмента и анализа Setup (Таблица 1)
- Алиготе 50 мкл (5х10 5) неокрашенных клеток из клеточной суспензии сохраняется в шаге 1.1 в каждом из пяти 1,8 мл Eppendorf трубы: 1, 3, 4, 5 и 7. Алиготе 50 мкл (5х10 5), PKH26 клетки поз, начиная с шага 1,9 в каждом из трех трубок: 2, 6 и 8.
- Добавить 10 мкл IgG блок (100 мкг / трубка IgG; см. таблицу реагентов) для труб 1-8и инкубировать в течение 10 мин при комнатной температуре (20-25 ° C).
- Добавить насыщения количество антител (ы), указанные в таблице 1 до 4 Трубы, 5, 7, и 8, и инкубировать всех образцов (трубы 1-8) в течение 30 мин при комнатной температуре в защищенном от света.
- Добавить 1,5 мл HBSS +1% BSA для всех образцов, осадок клеток путем центрифугирования (5 мин при 400 мкг) и мыть один раз с 1,5 мл HBSS +1% BSA, с тщательным стремление избежать потерю клеток.
- Ресуспендируют каждого образца в 500 мкл HBSS +1% BSA. Если это необходимо для анализируемых образцов на цитометра передать 12 х 75 мм круглой трубе вниз. Добавить 10 мкл 100 мкг / мл 7-AAD ежедневные рабочие склад (см. таблицу реагентов) до 3 Трубы, 6, 7 и 8, как указано в таблице 1. Инкубировать на льду в течение 30 мин до использования в потоке установки цитометра и окрашивания проверки (шаг 3).
3. Поток установки Цитометр и окрашивания проверки
- Убедитесь, что поток cytomeтер работает нормально, с использованием установленных процедур лаборатории для ежедневного контроля качества. Убедитесь, что сигналы могут быть легко обнаружены в каждом спектрального окна, которые будут использоваться, и что детектор ответы линейно пропорциональна интенсивности сигнала в окне будут использоваться для распространения мониторинг 14.
- Приобретать FSC против SSC данных для труб 1, используя линейные шкалы дисплея. Регулировка усиления каждого из детекторов, что популяции лимфоцитов падает в левом нижнем квадранте точкой сюжета, не зашкаливать в любой параметр и не прерывался в связи с порога. Сбор ungated данным ФСБ против SSC для всех образцов в шагах 3,3 - 3,7.
- Получение данных для труб 1, используя никакой компенсации цвета и логарифмические шкалы дисплея для всех 4 флуоресценции детекторами. Регулировка высокого напряжения каждого детектора (HV), чтобы поместить аутофлюоресценции неокрашенных лимфоцитов на шкале с несколькими / нет клетках накапливается в первом канале. Установить границы анализа для каждой гистограммысоответствующие самым ярким 2% неокрашенных клеток.
- Использование никакой компенсации цвета и HV параметры установлены в шагах 3.2 и 3.3, сбор данных для Tube 2, сбор FSC, SSC и сигналами во всех 4 флуоресценции детекторами. Для детектора используется для мониторинга PKH26 флуоресценции, убедитесь, что все PKH26 поз клетки появляются на масштабе как один симметричный пик в 3 -4 десятилетие й, с немногими / нет клеток в последний канал. Если есть несколько пиков или пиков формы перекос, повторите шаг 1 с тщательным вниманием к соленой минимизации и смешивания техники (рис. 2). Если необходимо, отрегулируйте концентрации красителя.
- С помощью параметров создан в шаге 3.3, сбор данных для трубки 3, сбор FSC, SSC и сигналами во всех 4 флуоресценции детекторами. Для детектора используется для мониторинга 7-AAD флуоресценции, убедитесь, что 7-AAD поз клетки попадают выше 2% границы, установленной в пункте 3.3 (т. е. нежизнеспособные клетки хорошо решенаот жизнеспособных 7-AAD нег клеток).
- С помощью параметров создан в шаге 3.3, сбор данных для трубки 4, собирая FSC, SSC и сигналами во всех 4 флуоресценции детекторами. Убедитесь, что CD8 поз клетки хорошо решена с неокрашенных клеток (например, падение выше 2% границы, установленной в пункте 3.3 для FITC детектор). Повторите с трубкой 5 и убедиться, что CD8 поз клетки хорошо решена с неокрашенных клеток (т.е. падение выше 2% границы, установленной в пункте 3.3 для детектора APC).
- С помощью параметров создан в шаге 3.3, сбор данных в течение 6 Трубы, 7 и 8, сбор FSC, SSC и сигналами во всех 4 флуоресценции детекторами.
- Используйте режим списка файлов, собранных для труб 1-5 и цвет компенсации программного обеспечения для создания цвета перекрывают матрицы для каждого флуорохромом в детекторах используется для мониторинга трех других флуорохромы. Примените эту матрицу к списку файлов режим для примера 6 и убедиться, что присутствие PKH26 лабораторииЭлинг не влияет на способность обнаруживать 7-AAD поз клеток.
- Применить цвета перекрывают матрицы, начиная с шага 3,8 до списка файлов режим для примера 7 и убедитесь, что: а) 3 хорошо разрешенных субпопуляций (CD3 CD4 нег нег, CD3 CD4 POS-нег и CD3 CD4 POS POS) могут быть определены на FITC против APC точкой сюжета, и б) наличие анти-CD3-FITC и анти-CD4-APC не изменяет способность обнаруживать 7-AAD поз клеток. Если присутствие анти-CD3-FITC изменяет верхнюю границу 2% на данных, собранных на PKH26 детектор, скорректировать границы по мере необходимости.
- Примените цветовой матрицы перекрытия от 3,8 до шага списка файлов режим для примера 8. Если присутствие PKH26 маркировки изменяется на 2% границы для FITC, 7-AAD или APC детекторов от тех, которые устанавливаются с помощью автофлуоресценции контроля в пункте 3.3, скорректировать границы (страны) по мере необходимости использования труб 7 таблицы 1 и убедитесь, что она еще можно Distinguish CD3 CD4 POS POS-терминалы, POS-CD3 CD4 нег, и CD3 CD4 нег нег клеток с использованием скорректированного границей (страны).
4. Распространение Выбор модели для сотовых отдела мониторинга путем разбавления краски
- Определить расстояние между поколениями, которая зависит от числа каналов и логарифмические десятилетия на цитометре. Для цифровых инструментов, эта величина, как правило, 4 или 5 лет, определяется по числу контейнеров в цифровой сигнальный процессор. На аналоговых инструментов, где несколько десятилетий редко является целым числом, точное моделирование требует точного числа десятилетия быть определены экспериментально. Чтобы сделать это, данные из смеси калиброванный флуоресцентных бусин с производителем назначенный относительной интенсивности приобретается в то же детектор высоких настройках напряжения, используемых в эксперименте. Положение борта пиков позволяет для калибровки логарифмической шкале с точки зрения Intensity диапазона в журнале десятилетие. В частности, это делается путем построения канала для каждого типа борта против журнала производителя присвоенное значение. Наклон наилучшее прямой линии борта значения данных дает число относительных единицах интенсивности каждого канала. Умноженной на количество каналов, это значение будет тогда количество журналов десятилетий для полной шкалы, из которых количество каналов, соответствующих двукратное снижение интенсивности (т. е. расстояние дочернего поколения) могут быть вычислены 14.
- Решите, нужно ли использовать фиксированный интервал между поколениями или позволить расстояние плавать. Стандартный (фиксированная) установка будет использоваться поколениями значение расстояния определяются в шаге от 4,5 до присвоить местоположение каждого поколения, и обычно используется, когда гистограмма не хватает ярко выраженных пиков. Float настройка позволяет каждому поколений положение пика определяется гистограммы форму и обычно используется, когда distinguishablэлектронной поколений пики очевидны.
- Решите, следует ли использовать фиксированную ширину пика для всех поколений или плавающей ширины. Фиксированной ширины используются SD рассчитаны для нестимулированных контрольный образец для моделирования всех поколений и, как правило, выбранные, когда образец не хватает различимы поколений пиков. Плавающей ширины позволяет программе самостоятельно варьировать SD для каждого поколения и лучше всего использовать с различимы поколений пиков.
- Запустите программу, содержащую модуль анализа распространения (здесь ModFit LT версия 3,3). Загрузите стимулировали PKH26 поз файл из набора данных для анализа (например, стимулировали 96 час культуре клеток PKH26 поз контрастно, как и для труб 8 в таблице 1).
- Выберите параметры для анализа, в этом случае PKH26 (585/42) закрытого на жизнеспособные (7-AAD нег) CD3 POS-лимфоцитов и ФСБ против SSC, чтобы исключить мелкого мусора и больших агрегатов (рис. 3). При определенииэти области быть осторожными, чтобы включать высокие вперед площадь рассеяния, где взрывы, как правило, найти и отметить, что CD3 выражение может быть недоступен модулированных в стимулированных культурах.
- Создать новую модель распространения помощью распространения мастера. Использование открытого файла данных (Start вкладки), загрузить нестимулированных PKH26 поз контроля файла и определять местоположение пика канала в родительском распределение, соответствующее безраздельно клеток.
- Проанализируйте файл для нестимулированных PKH26 управления поз, отметив значение для родительского положение пика и ширины (стандартное отклонение). Если фиксированная ширина пика (SD) желательно, проверьте блокировки SD.
- Загрузите PKH26 отрицательный контроль (например, 96 ч культуры клеток PKH26 нег контрастно, как и для труб 7 в таблице 1). Отрегулируйте число поколений, установив пик канал для тусклой поколения над PKH26 отрицательный контроль. Это определяет нюmber дочери поколения модели можно точно установить и, как правило, 6-9 поколениях.
- Откройте файл данных для вынужденного образца (например, стимулировали 96 час культуре клеток PKH26 поз контрастно, как и для труб 8 в таблице 1) и убедитесь, что регионы родительской позиции пика и SD, определенных в шаге 4,7 остаются неизменными. Если фиксированная поколений интервал необходимо, выберите Стандартный вариант модели, в противном случае выберите опцию плавающей.
- Анализ каждой экспериментальной файла в набор данных, используя те же модели, определенной в шаге 4.9. Незначительные изменения в родительской позиции пик может быть необходимо для самого наилучшего, как это определено как визуально, так и с пониженной хи-квадрат (RCS) значения.
- Запись желаемого распространения метрик в результате наиболее подходящую для каждой экспериментальной файла в набор данных. Для более полного описания возможных метрик см.. 22.
Результаты
Мембранные красители, как PKH26 пятно на почти мгновенное разбиение на клеточные мембраны, а не с помощью химических реакций (для CFSE) или равновесного связывания (на наличие антител). Недостаток внимания к критическим вопросам, изложенным на рисунке 1, может привести к тусклым или гетерогенных окрашивание типа, показанного на рисунке 2. В противоположность этому, использование оптимальных условий маркировки (рис. 1, таблица 2) результаты в ярких однородных распределений подходит для различных приложений, включая отслеживание клетки клеточного деления мониторинга на основе красителя разбавления (рис. 3). Dead / умирающей клетки теряют различное количество отслеживания красителем, который можно расширить и / или наклон интенсивности поколения дочь и осложнить распространение моделирования на основе красителя разбавлением 3,4,16,18. Использование жизнеспособность красителя поэтому рекомендуется при сборе данных красителей разведение в условиях, когда значительное количество мертвых клеток может быть предварительнопослал, такие как вынужденное культур (рис. 3) или более образцов (рис. 4).
Потому что отслеживание красителя маркировки обычно дает интенсивность флуоресценции на несколько порядков больше, чем иммунофенотипирование, важно включать соответствующие элементы управления компенсации (табл. 1) и убедиться, что присутствие отслеживания краситель не ухудшает способность решать антитела положительных и отрицательных клеток (рис. 4). Чтобы избежать необходимости чрезмерной компенсации цвета, предпочтительнее размещать яркие флуорохромом, или один не найден на клетки интереса, таких как краситель исключено живых клеток, в спектральных канала (ов), прилегающих к отслеживанию красителя (рис. 4а & B vs. 4C & D). При использовании пик программного обеспечения для моделирования количественно масштабы распространения, получения хорошо подходит требует соответствующих предположений в модели с характеристиками красителя проф разбавленияИль анализируемой (рис. 5 и таблица 3). При соответствующем выборе отслеживания красителей и жизнеспособность реагенты, это также можно охарактеризовать пролиферативные реакции в различных субпопуляций лимфоцитов одновременно. Например, как показано на рисунке 6, добавление второго красителя упрощает отслеживание дискриминации между регуляторными Т-клетками (помечены CellVue Claret) и весьма широкое распространение эффекторных Т-клеток (помечены CFSE) и обеспечивает гораздо более подробно об их взаимодействий, чем можно было бы получить с использованием 3 Н-тимидина маркировки 18,27.
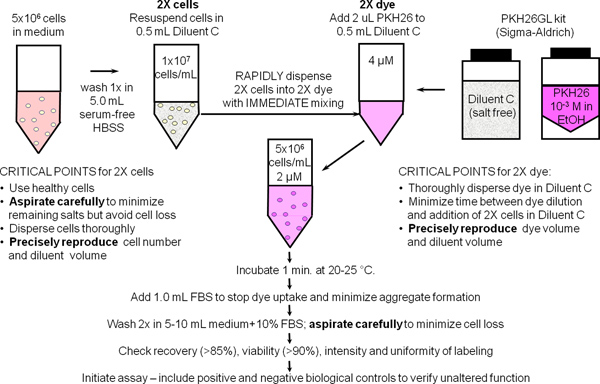
Рисунок 1. Генеральный протокол маркировки мембраны для PKH26, PKH67 и CellVue красителей. Разбиение этих очень липофильных красителей в клетке membraРЭШ происходит в основном мгновенно при смешивании с клетками, когда окрашивание осуществляется в бессолевой Разбавитель автомобиля C при условии максимального красителя в воде и окрашивание эффективности. Как показано в этой схеме для общей маркировки мембраны с PKH26, яркая, равномерная и воспроизводимых окрашивания, следовательно, наиболее легко получить: 1) сведение к минимуму количества белка и / или соли, присутствующие в шаге окрашивания и 2) с помощью смешивания технику, которая обеспечивает быстрое распространение однородных клеток в краситель (т. е. одновременно предоставляет доступ ко всем клеткам такой же концентрации красителя).
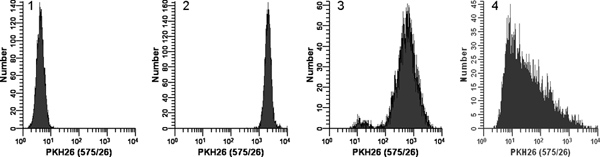
Рисунок 2. Эффект окрашивания условия на PKH26 флуоресценции распределения (перепечатано из работы. 18). Репликация образцов логарифмически растет, культурный U937 клетки окрашивали PKH26 (конечная концентрация: 1 х 10 7 клеток / мл, 12 - 15 мкм PKH26) в течение 3 мин при комнатной температуре, с или без непосредственного смешивания при добавлении 2x 2x клетки краситель. После мытья окрашенных клеток были проанализированы на Beckman Coulter CyAn проточной цитометрии с использованием постоянных параметров инструмента Гистограмма 1. Неокрашенных управления с PKH26 детектор напряжения отрегулирован на всех клеток по шкале в первое десятилетие с небольшим / нет клетках накапливается в первом канале. Гистограмма 2: окрашивание при 15 мкм с использованием красителя добавлением 2x 2x клеток красителем с немедленной смешение привело к яркой, однородно окрашенных, симметричный популяции клеток помещали в четвертое десятилетие, с немногими / нет клетках накапливается в последний канал (gMFI = . 2548, ВТС = 26,2%) Гистограмма 3: окрашивание при 15 мкМ использованием красителя добавлением 2x 2x клеток красителем, но без непосредственного смешения привело к уменьшению интенсивности и более широкого CV (gMFI = 505 , GCV = 116%), а также слабо окрашенные субпопуляции, возможно, из-за падения клеток отказаться от стенки трубки, а не в 2х раствор красителя Гистограмма 4:. Окрашивания ошибка привела к 3 мкл концентрированного спиртового красителя акции добавляется непосредственно в 2 раза клеток в Разбавитель C без дальнейшего перемешивания, а не использовать для подготовки 2x раствор красителя в Разбавитель C. Это привело к конечной концентрации красителя от 12 мкм, но дали весьма тусклым и гетерогенную окрашивания (gMFI = 32,9, GCV = 1020%). Наблюдается права косой, скорее всего, отражает совокупное воздействие: а) плохое перемешивание в связи с широко разрозненных клеток и красителей объемы и II) тот факт, что клетки ближе всего к точке дозирования красителей будут подвергаться более высокой концентрации красителя, чем дальше прочь. Нажмите, чтобы увеличить показатель .
Re 3 "SRC =" / files/ftp_upload/4287/4287fig3.jpg "FO: содержание ширина =" 4.5in "FO: SRC =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
Рисунок 3. Использование жизнеспособность зонд упрощает стробирования профилей пролиферацию Т-клеток hPBMC были помечены PKH26 (конечная концентрация клеток: 3x10 7 / мл; окончательное концентрации красителя: 10 мкм).. После культуре в течение 96 часов в присутствии (вынужденное) или отсутствия (нестимулированных) анти-CD3 и ИЛ-2, клетки контрастно с анти-CD3-FITC, анти-CD19-APC и 7-AAD, а также были проанализированы на FACSCalibur проточной цитометрии (см. Приложение 13 для подробной информации). Цвет компенсация была выполнена в момент приобретения данных с использованием проводных схем компенсации. Степень распространения была смоделирована как описано в шаге 4 с помощью мастера распространения в ModFit LT3.3. Данные из PKH26 отрицательный контроль (табл. 1, метро 7) накладываются друг на друга при условии ссылки (серыми заполнены гистограмм в столбец 3). Viabilities для нестимулированных и ИПППсформулированы культуры были 76% и 62% (ungated данных для панелей А и В, соответственно). Группа A. PKH26 окрашенные клетки культивировали в течение 96 ч в среде были закрытом включить жизнеспособное (7-AAD нег) CD3 поз клеток (R1). В дополнение к включению антител и 7-AAD мертвых ворота исключения клетки, рассеяния вперед (FSC) по сравнению сторону рассеяния (SSC) ворота (R2) была использована, чтобы исключить мусор и агрегатов. Обратите внимание на отсутствие мертвых клеток в последний сюжет в этой панели. Лучшие модели, пригодной для распространения PKH26 профиля (колонка 3) дал один пик с ЭПР = 2,1 (Донор 6, таблица 3), что указывает на хорошую симметрию, и был использован для определения родительской позиции и начать ширина пика для анализа вынужденных выборка из этого набора данных (Группа B). Группа B. повторных аликвоты PKH26 окрашенные клетки культивировали с анти-CD3 и ИЛ-2 в течение 96 ч и закрытый таким же образом, как и в панели A. Модель с плавающим положением пика и плавающей ширины пика дал лучше всего подходят для этих данных с ЭПР = 1,3 (Донор 6, таблица 3). Группа C. же файл данные на панели были проанализированы без использования 7-AAD данных. При первичном FSC против SSC был использован для частичного исключить мертвые клетки и агрегаты (R2) и вторичной ворота, чтобы выбрать CD3 позитивных событий (R3), небольшое остаточное население мертвые клетки остаются (0,2% закрытого мероприятия). Лучшие модели, пригодной дал один пик с ЭПР = 2,2. Группа D. же файл данные на панели B был закрытый, как и в панели C. Обратите внимание на большую остаточную населения от мертвых клеток в образце стимулировало (1,29% от закрытых мероприятий) для этого стробирования стратегии. Наилучшее модель была одной с плавающей положение пика и плавающей ширины пика (RCS = 1,3). Нажмите, чтобы увеличить показатель .
ig4.jpg "FO: содержание ширина =" 5 дюймов "FO: SRC =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
Рисунок 4. Влияние флуорохромом выбора и концентрации красителя на способность к иммунофенотип лимфоцитов помечены PKH26. HPBMC были изолированы от 24-часовой старой крови и помечены PKH26, как описано в шаге 1, с тем исключением, что окрашивание проводилось в 12 х 75 мм с круглым дном полистирол трубы, а не 12 х 75 мм конических труб из полипропилена. Сразу же после маркировки с PKH26, клетки контрастно с указанной иммунофенотипических и жизнеспособность реагентов, и анализировали на цитометре LSRFortessa потока с использованием стробирования стратегии 3А и следующие оптической конфигурации: 488 нм лазер: FSC-(488 нм); SSC A (488/10 ВР), FITC-A (530/30 ВР); PKH26-A (575/26 ВР); 7-AAD-или PerCP-A (695/40 ВР). 640 нм лазер: APC-или Topro-3-A (670/14 ВР). Цвет компенсация была выполнена в момент приобретения данных с помощью BD DiVa программного обеспечения. "Авто"указывает аутофлюоресценции нет антител контроля в соответствующих спектральное окно (APC для панелей А и В, PerCP для панелей C и D). Данные из PKH26 отрицательный контроль (табл. 1, метро 7) накладываются друг на друга при условии ссылки (серыми заполнены гистограммы, столбец 5). После окрашивания viabilities были одинаковы для всех образцов (88-92%). Группа A. клетки помечены PKH26 в конечной концентрации 2 мкМ контрастно с использованием анти-CD3-FITC, анти-CD4-APC, и 7-AAD ( Труба 8 таблицы 3). После стробирования на жизнеспособные (7-AAD нег) CD3 POS-лимфоцитов (столбец 1) и отчуждения от мусора и агрегатов на основе FSC и SSC (см. рисунок 3А), PKH26 интенсивность была оценена в сочетании с APC CD4 (столбцы 2 и 3). Если некомпенсированных (колонка 2) или компенсированной (колонка 3), это флуорохромом сочетание привело к хорошим разрешением между CD4 поз Т-клеток и CD4 Т-клеток отрицательный), а обоснован как не-ntibody, аутофлуоресцентной управления (Tube 6 таблицы 1, столбец 4) и двухцветный участок CD3 против. CD4 (столбец 6). Группа B. Используя тот же флуорохромом комбинации, как в панели, но увеличение окончательной PKH26 концентрации 4 мкМ не отрицательно сказаться на способности решать CD4 Т-клеток поз из нег CD4 Т-клеток. Группа C. повторных аликвоты клеток независимо помечены PKH26 в конечной концентрации 2 мкМ контрастно с использованием анти-CD3-FITC, анти-CD4-PerCP, и Topro-3. После стробирования на жизнеспособные (Topro-3 отрицательное) CD3 POS-лимфоцитов (столбец 1) и отчуждения от мусора и агрегатов на основе FSC и SSC (см. рисунок 3А), PKH26 интенсивность была оценена в сочетании с анти-CD4-PerCP (столбцы 2 и 3). Существенные спектрального перекрытия PKH26 в канал PerCP проявляется в некомпенсированных данных (колонка 2), и резолюция между PKH26 CD4 поз поз и PKH26 поз CD4 отрицательный событий является предельным после компенсации применяется (сравните колонки 3 с не-антитело, аутофлуоресцентной управления, указанным в колонке 4). Группа D. При PKH26 увеличении концентрации до 4 мкм, это уже не возможно использовать флуорохромом сочетание Группа C. спектрального перекрытия от PKH26 в канал PerCP превышает интенсивность сигнала от CD4 (колонка 2) и CD4 поз PKH26 поз событий не может быть решена с CD4 отрицательный PKH26 поз Т-клеток (колонка 3 Vs. столбец 4). Нажмите, чтобы увеличить показатель .
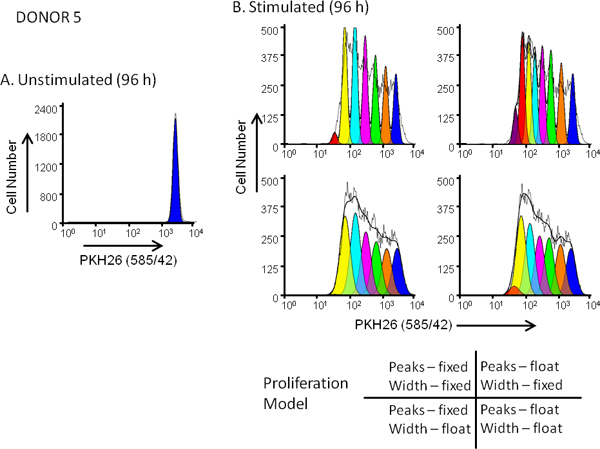
Рисунок 5. Влияние распространения выбора модели на. согласия для разведения красителя профилей hPBMC были помечены PKH26 (конечная концентрация клеток: 3x10 7 / мл; окончательное концентрации красителя: 10 мкм). После культуре в течение 96 часов в присутствии (вынужденное) или отсутствия (нестимулированных) анти-CD3 и IL-2, клетки собирали контрастно с анти-CD3-FITC, анти-CD19-APC и 7-AAD и анализировали на FACSCalibur проточной цитометрии (см. Приложение 13 для подробного методы). Цвет компенсация была выполнена в момент приобретения данных с использованием проводных схем компенсации. Группы. PKH26 профиль интенсивности от нестимулированных 96 часов культуры для доноров 5, умеренный ответчика, был закрытый, как показано на рисунке 3А и используется для обеспечения ModFit распространения Мастер с первой оценкой положения и ширины пика представляющих безраздельно родительских клеток. Группа B. PKH26 профиль интенсивности из параллельного стимулировали 96 часов культуры были проанализированы с использованием исходных оценкахПанели и 4 различные комбинации параметров "Распространение Wizard ', соответствующие фиксированной или плавающей пик интенсивности, и фиксированной или плавающей ширины пиков для последующих поколений дочь, как показано на рисунке. Как показано в таблице 3, модель, которая дала лучше всего подходит к наблюдаемым данным (низкий пониженной хи-квадрат; RCS) была "плавающей / плавающий" комбинация, в которой не только пик позиции, но и стандартного отклонения пиков дочь поколения было разрешено меняться (RCS = 1,5). Эта же модель дала наилучшим образом подходит для донора 6, отвечающий высоким (рис. 3В и табл. 3).
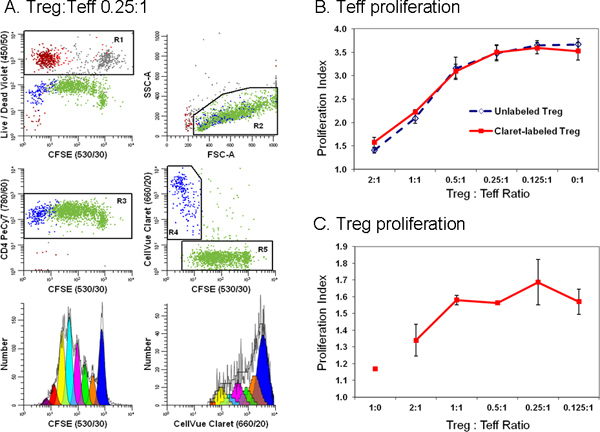
Рисунок 6. Добавление второго красителя отслеживания ячейки упрощает дискриминации между эффекторных и регуляторных Т-клеток в проточной цитометрии анализа подавления(Адаптировано из работы 18.) Моноциты обедненного лимфоциты получали из TRIMA фильтры лейкафереза окрашивали анти-CD127-PE, анти-CD4-PE-Cy7, и анти-CD25-APC и поток сортируются в популяции эффекторных (Teff. CD4 POS-CD127 яркие CD25 DIM), регулирующий (Treg; CD4 POS-CD127 тусклом CD25 поз) и аксессуаров (CD4 отрицательный) клеток. Упорядочить Treg клетки помечены CellVue Claret (конечная концентрация клеток: 1x10 6 / мл; окончательное концентрации красителя: 1 мкм) и отсортированные Teff помечены CFSE (конечная концентрация клеток: 5 × 10 7 / мл; окончательное концентрации красителя, 5 мкм) совместно культивировали при различных соотношениях в присутствии анти-CD3, анти-CD28 и облученных клеток аксессуар. После 96 часов, культуры собирали, контрастно с анти-CD4-PE-Cy7 и LIVE / DEAD поправимо Violet, и анализировали на цитометре LSRII потока и цветовой коррекцией была выполнена в момент данные ПРИОБРЕТЕНИЕN Использование BD DiVa программного обеспечения (см. номер 18 на детали, включая компенсацию управления). Распространение Индексы Teff и Treg были смоделированы как описано в шаге 4, используя распространения мастера в ModFit LT3.3. Данные пункты в панели B и C представляют собой средние значения ± 1 стандартное отклонение трех образцов панели данным А. Представитель показаны для одного из трех образцов трех экземплярах на Treg. Teff отношением 0,25:1. LIVE / DEAD поправимо реагента Фиолетовый был использован для исключения мертвых клеток (R1, левый верхний участок; вспомогательные клетки = красно-коричневый, нежизнеспособных Teff = серый и нежизнеспособных Treg = красный) от всех других участках данные. CellVue окрашивания Кларет был использован отличить жизнеспособные Treg (R4, справа от центра участка, синий) с жизнеспособной, но весьма широкое распространение Teff (R5, справа от центра участка; зеленый). Единственный параметр CFSE распространение профиль для Teff (левый нижний график) был создан путем стробирования на клетки, которые были CFSE поз (R5), CD4 поз (R3), жизнеспособным (не R1), и имел лимфоцитов SCAtter свойствами (R2). Единственный параметр CellVue Claret распространение профиль для Treg был создан путем стробирования на клетки, которые были CellVue Claret поз (R4), CD4 поз (R3), жизнеспособным (не R1), и имел лимфоцитов разброс свойств (R2). Обратите внимание на щедрое области лимфоцитов (R2) определяется включить лимфоцитов взрывов. Отметим также, что общее число клеток должны быть собраны, зависит от самой низкой частоты популяции. В эксперименте пролиферации клеток, где население интересов может быть распределена по широкому спектру интенсивности составляет до семи или восьми поколений большое количество клеток должна быть собрана для того, чтобы точно смоделировать и рассчитать количество клеток в каждом поколении. При изучении редких клеток, это может быть необходимо просто запустить пробирку почти сухой, чтобы собрать максимально возможное количество событий. Для примера здесь показано, делают это привело в общей сложности ~ 25,000 событий, из которых 11923 были Teff (распространению ЯNDEX 3,85) и 1380 были Treg (индекс пролиферации 1,83). Группа B. Как и ожидалось, увеличении доли настоящее Tregs во взаимодействии культур привело к большему подавлению пролиферации клеток Teff. Аналогичные результаты были получены и с CellVue Claret окрашенные (сплошная линия) или неокрашенные (пунктирная линия) Treg, указывая, что окрашивание CellVue Claret отслеживания красителя не влияет Treg потенции. Группа C. Treg относительно анергических и, как ожидается, сделал не размножаются, когда инкубировали с анти-CD3, анти-CD28 и вспомогательных клеток в отсутствие клеток Teff (Treg: Teff отношение 1:0). Однако, как доля настоящее Teff в сотрудничестве культур увеличилась (то есть, как Treg: Teff соотношение уменьшается), степень распространения Treg также увеличилось. Как правило, больше погрешности этих данных по крайней мере частично отражает ограниченные масштабы распространения, что приводит к меньшим количеством событий, собранных по отношению к Teff и более неопределеннымво в моделировании число клеток в каждом поколении. Нажмите, чтобы увеличить показатель .
| Труба номер (Цель) | PKH26 | Антитела (ы) | 7-AAD |
| 1 (установки компенсации) | - | - | - |
| 2 (Setup, компенсации) | + | - | - |
| 3 (Setup, компенсации) | - | - | + |
| 4 (компенсация) | - | CD8-FITC б | - |
| 5 (компенсации) | - | CD8-APC б | - |
| 6 (никакого контроля Ab) | + | - | + |
| 7 (без отслеживания красителя конуправления) | - | CD3-FITC CD4-APC и CD19-APC с | + |
| 8 (T0 управления) | + | CD3-FITC CD4-APC и CD19-APC с | + |
Таблица 1. Настройка инструмента управления управления, перечисленных подходят для 4-цветной CD4 Т-клеточной пролиферации мониторинга методом с использованием:. PKH26 (распространению красителя), CD3-FITC (пан-Т-клеточных маркеров) CD4-APC (Т-хелперов клеточного маркера), 7-aminoactinomycin D (7-AAD; мертвые клетки исключения) б яркие суррогатов CD3-FITC и CD4-APC (лучше способность обнаруживать ошибки компенсации) с Рисунок 3:.. CD3-FITC и CD19-APC. D Рисунок 4: CD3-FITC и CD4-APC.
| Сотовые типа | Окончательные концентрации клеток | Окончательные концентрации красителя </ STRONG> | Ссылка |
| hPBMC б | 1 х 10 7 / мл | 2 мкМ PKH67 | 10,17 |
| 5 х 10 6 / мл | 2 мкМ PKH26 | 12 | |
| 3 х 10 7 / мл | 10 мкМ PKH26 | 13 | |
| 5 х 10 7 / мл | 30 мкМ PKH26 | 18 | |
| 1 х 10 6 / мл | 1 мкМ CellVue Claret с | 18 | |
| 3 х 10 7 / мл | 4 мкМ Claret CellVue | 13 | |
| 5 х 10 7 / мл | 5 мкМ Claret CellVue | 18 | |
| Клетки в культуре | 5 х 10 5 / мл | 0,1 мкМ PKH26 (1 ° клеток молочной железы) | 8 |
| 1 х 10 7 / мл | 15 мкМ PKH26 (U937) | 18 | |
| 1 х 10 7 / мл | 12,5 -15 мкм PKH26 (U937) | 15 | |
| 1 х 10 7 / мл | 1 мкМ PKH67 (K562) | 18 | |
| 1 х 10 7 / мл | 1 мкМ PKH67 (линии Т-клеток) | 9 | |
| 1 х 10 7 / мл | 10 мкМ CellVue Claret (YAC-1) | 23 |
Таблица 2. Невозмущающие Мембрана-краска условия окрашивания. Адаптация и обновляется Ref. 18. Б низкой скорости мытья (300 мкг) был использован для минимизации загрязнения тромбоцитов. С Treg клеток (CD4 потока отсортированы поз поз CD25 CD127 нег лимфоциты).
| Модель Настройки | Результаты модели | ||||||||
| Донор | Лечение | Peak Position | Южная Дакота | Родительская позиция | Родительский SD | # Пиков установлены | RCS | PI | PF |
| 5 | Нестимулированные | Плавать | Плавать | 209 | 4,5 | 1 | 5,1 | 1,0 | 0 |
| 5 | Стимулированный | Исправлены | Исправлены | 209 | 4,5 | 7 | 35 | 3,9 | 31 |
| 5 | Стимулированный | Плавать | Исправлены | 209 | 4,5 | 8 | 19 | 4,3 | 30 |
| 5 | Стимулированный | Исправлены | Плавать | 209 | 9,2 | 6 | 1,9 | 3,8 | 30 |
| 5 | Стимулированный | Плавать | Плавать | 209 | 9,0 | 7 | 1,5 | 3,7 | 29 |
| 6 | Нестимулированные | Плавать | Плавать | 205 | 4,0 | 1 | 2,1 | 1,0 | 0 |
| 6 | Стимулированный | Исправлены | Исправлены | 205 | 4,0 | 6 | 42 | 6,6 | 60 |
| 6 | Стимулированный | Плавать | Исправлены | 205 | 4,0 | 7 | 12 | 7,4 | 60 |
| 6 | Стимулированный | Исправлены | Плавать | 205 | 8,6 | 6 | 6,9 | 6,8 | 62 |
| 6 | Стимулированный | Плавать | Плавать | 205 | 6,5 | 6 | 1,3 | 6,5 | 59 |
Таблица 3. Влияние распространения модели на степень согласия (RCS) и распространения метрик. Примеры окрашивания, сбор данных и стробирования как показано на рис 3А & B.
Обсуждение
Методы, описанные здесь, которые содержатся в наших совместных лабораторий наиболее надежно дать оптимальные результаты для hPBMC маркировки с помощью мембранных красителей 13,16,18 и лимфоцитов фенотипирование подмножества и распространение слежения с использованием либо мембранных белков или красители 2,11,13,16, 18. Как показано на рисунках 1 и 2, яркое равномерное маркировки легче всего достигается путем ограничения наличии физиологической соли и с помощью смешивания техники, что приводит к быстрому, однородные воздействия всех клеток в той же концентрации красителя. Потому что окрашивание мембраны красителей происходит путем разделения в липидный бислой, другие переменные, которые изменяют свободный концентрации красителя может также повлиять на маркировке эффективности. Например, маркировка в круглое дно полистирола труб приводит к менее эффективной вымывания солей до ресуспендирования в Разбавитель С, а также к снижению концентрации красителя бесплатно за счет красить адсорбции на стенках труб, в частности,при более низких концентрациях красителя. Оба эти фактора, как правило, дают широкие окрашивания распределения, чем когда маркировка осуществляется с помощью коническим днищем полипропиленовые трубы (рис. 3, 4 и неопубликованные результаты). Возраст образцов и типов также могут влиять на ширину пика даже при оптимизированной процедуры окрашивания используются. Например, резюме для PKH26 лимфоцитов поз изолированы от свеженарисованного крови колеблется от 14-20% (рис. 3, Ref. 13 и неопубликованные результаты), тогда как резюме для лимфоциты изолированы от 24 час старых образцов крови или TRIMA pheresis фильтров в диапазоне от 25-30 % (рис. 4 и Ref. 18).
Окрашивание однородность и степень, в которой нежизнеспособные клетки могут быть исключены из анализа как повлияет ли различимые пики дочь проявляются в профиль разведения красителя, который, в свою очередь, влияет на выбор модели распространения в соответствии с наблюдаемыми данными (рис. 5 и 6 ). Хотя ModFit (Verity Software House, Topsham, ME) используется здесь в качестве примера программного обеспечения, используемого для создания таких показателей, как индекс пролиферации и прекурсоров частоты (рис. 3, 5 и 6; таблица 3), другие программные пакеты также содержат модули для анализа Распространение данных. К ним относятся FCSExpress (De Novo программного обеспечения, Лос-Анджелес, Калифорния) и FlowJo (Tree Star, Inc, Ashland, OR). Все эти программы используют нелинейных наименьших квадратов анализ итеративно найти наиболее подходящий к необработанным данным, меняя положение, высоту и SD (или ширина) гауссовых пиков представляющие последовательные поколения дочь. Пролиферативный индекс (PI) и Предтечи частоты (PF) являются наиболее часто используемыми мерами степень распространения. PI, как это определено ModFit, является мерой увеличение количества клеток в течение анализа, аналогичного «индекс стимуляции 'из анализа поглощения тимидина. PF возвращает фракции клеток в начальной заселенияион, который ответил на стимула растет. Рекомендуется осторожность, однако, при чтении литературы, начиная с терминологии несколько различается среди программных пакетов (например, FlowJo и ModFit используют разные определения и расчеты для того, что имеется в виду под "распространением Index") 22.
Важнейшие вопросы обсуждаются здесь для маркировки и распространения анализ с мембраной красителей встречаются также при использовании белка красителей. Например, особое внимание на технику смешивания также необходимо соблюдать, наряду с исключением мертвых / отмирающих клеток, для получения равномерного распределения и различимых пиков дочь при использовании CFSE (рис. 6) 2-4,13,18,24. Соответствующий выбор флуорохромы для фенотипирования и жизнеспособности оценка также важна, чтобы избежать чрезмерного спектрального перекрытия и неспособность признать антитела положительных клеток, в частности, с видимым излучающих белка красители, такие как CFSE 2-4,11,13,16,18 . Снижение концентрации красителя уменьшается отслеживания компенсации проблем в соседних спектральных каналов, но также ограничивает число клеточных делений, которые могут быть проверены, прежде чем интенсивность дочерние клетки начинают перекрываться с автофлуоресценции. Кроме того, использование новой ячейки отслеживания красители, такие как далеко красный бордовый излучающих CellVue (Sigma-Aldrich, Сент-Луис, Миссури) или фиолетовый излучающих CellTrace Violet (Life Technologies, Grand Island, NY) может уменьшить компенсацию задач (рис. 6). Наконец, хотя мембрана красители обычно склонны проявлять меньшую токсичность 11,26, можно более-метки клетки либо с классом красителя. Поэтому всегда необходимо убедиться, что концентрация отслеживания красителя не изменило функциональные клетки, которые необходимо отслеживать (рис. 6) 3,13,16,18.
Раскрытие информации
К. Хамфри, JD Tario, младший и К. Уоллес получил предварительные коммерческие ячейки отслеживания реагентов для оценки от Life Technologies, Inc и BD Biosciences. AD Bantly и JS Мур получил предварительные коммерческие ячейки отслеживания реагентов для оценки от Life Technologies, Inc и финансирование из PTI Research, Inc для предварительного коммерческих характеристик различных клеточных CellVue отслеживания красителей. К. Muirhead работает на SciGro, Inc, которая оказывает консалтинговые услуги Phanos Technologies, Inc (владелец PKH и CellVue красители) и обеспечивает резервное копирование технической поддержки для Sigma-Aldrich и молекулярной Ориентация Technologies, Inc (дистрибьюторов этих красители).
Производство и свободный доступ к этой статье проводится при финансовой поддержке Sigma-Aldrich.
Благодарности
The authors would particularly like to thank the following individuals for their technical and intellectual contributions to the development of these methods through the years: Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis Cell Science and PTI Research), Brian Gray (PTI Research), Jan Fisher (Dartmouth Medical School), Alice Givan (Dartmouth Medical School), Betsy Ohlsson-Wilhelm (SciGro, Inc.), and Mary Waugh (Dartmouth Medical School). They would also like to thank the Bowdoin class of 2006 from the Annual Courses in Research Methods and Applications of Flow Cytometry, which generated the data shown in Figure 2.
Flow cytometry was performed at Roswell Park Cancer Institute's Flow Cytometry Laboratory, which was established in part by equipment grants from the NIH Shared Instrument Program, and receives support from the Core Grant (5 P30 CA016056-29) from the National Cancer Institute to the Roswell Park Cancer Institute, and at the Abramson Cancer Center Flow Cytometry and Cell Sorting Resource Laboratory of the University of Pennsylvania, which was established in part by equipment grants from the NIH Shared Instrument Program, and receives support from NIH #2P30 CA016520 from the National Cancer Institute. The work shown in Figures 3 and 5 was also supported in part by SBIR grant EB00228 from the National Institutes of Biomedical Imaging and Bioengineering (NIBIB) awarded to PTI Research, Inc.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагенты и оборудование | Компания | Номер в каталоге | Комментарии |
| Купленных | |||
| 7-Aminoactinomycin D | Sigma-Aldrich | A9400 | |
| Бычий сывороточный альбумин (BSA) | Sigma-Aldrich | A4503 | |
| Эмбриональной телячьей сыворотки (FBS) | Атланта биологические | S11150 | |
| Хэнкс сбалансированный солевой раствор (HBSS) | Life Technologies | 14175-079 | Кальций и магний бесплатно, без фенола красного |
| IgG человека Кон фракция II и III глобулины | Sigma-Aldrich | G-4386 | |
| Мышь анти-человеческим CD3-FITC | BD Biosciences | 349201 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-CD4 человека и АПК | BD Biosciences | 340672 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-человеческий CD4-PECy7 | BD Biosciences | 348799 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-человеческие CD8-FITC | BD Biosciences | 347313 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-человеческие CD8-APC | Caltag (Life Technologies) | MHCD0805 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-человеческим CD19-APC | Caltag (Life Technologies) | MHCD1905 | Saturating концентрации, как это определено лабораторией титрования |
| Мышь анти-человеческим CD25-APC | BD Biosciences | 340938 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-человеческий CD127-PE | BD Biosciences | 557938 | Насыщение концентрации, как это определено лабораторией титрования |
| Мышь анти-CD3 человека | eBiosciences | 16-0037-85 | 1,0 мг / мл; азид бесплатно |
| Мышь анти-CD28 человека | eBiosciences | 16-0289-85 | 1,0 мг / мл; азид бесплатно |
| PBS | Gibco | 21300-058 | |
| PKH26 красного флуоресцентного комплекта линкера ячейку, содержащую 10-3М PKH26 в этаноле и разведения C | Sigma-Aldrich | PKH26GL-1KT или MINI26-1KT | Процедуры в шаге 1 также применяютсяв наборы, содержащие PKH67 или другими красителями CellVue |
| CellVue Claret дальнего красного флуоресцентного комплекта линкера ячейку, содержащую 10-3М CellVue Claret в этаноле и разведения C | Sigma-Aldrich | MINCLARET-1KT или MIDCLARET-1KT | |
| 5 - (а-6)-карбоксифлуоресцеина диацетат, сукцинимидил эфира (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | Non-флуоресцентный; расщепляется мембраны эстераз с образованием флуоресцентного амино-реактивного карбоксифлуоресцеина сукцинимидил эфира (CFSE) |
| LIVE / DEAD поправимо Фиолетовый | Invitrogen (Life Technologies) | L34955 | |
| Стерильные 12 х 75 мм конической полипропиленовые трубы и крышки | VWR | 60818-102 | Дает лучше мембраны красителя окрашивание эффективности (снижение красителя адсорбции; меньше потери клеток в супернатант аспирация) |
| 12 х 75 мм Rounг нижний полистирол труб | Becton Dickinson | 21008-936 | |
| Проточный цитометр | BD Bioscience | FACSCalibur LSRFortessa | Любой цитометр в состоянии обнаружить FITC, PKH26, и 7-AAD (например, 488 нм;. EM 520 нм, 567 нм и 655 нм, соответственно) и APC отл. 633-640 нм; их. 660 нм) |
| Проточный цитометр | Beckman Coulter | LSRII CyAn | Любой цитометр в состоянии обнаружить FITC, PKH26, и 7-AAD (например, 488 нм;. EM 520 нм, 567 нм и 655 нм, соответственно) и APC отл. 633-640 нм; их. 660 нм) |
| Лаборатория Подготовлено | |||
| 7-Aminoactinomycin D, концентрированной складе | Не Доступно | Не Доступно | 1 мг / мл в PBS. Заморозить в аликвоты и хранят при температуре -20 ° C. |
| 7-Aminoactinomycin D, пристаЦарь складе | Не Доступно | Не Доступно | 100 мкг / мл в PBS; подготовить ежедневно с 1 мг / мл замороженного запаса. |
| IgG блок | Не Доступно | Не Доступно | HBSS + 10 мг / мл человеческого IgG фракции Кона II и III глобулинов + 10 мг / мл BSA. |
Ссылки
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены