Method Article
Optimisé méthodes de modélisation de coloration et de prolifération pour la surveillance division cellulaire en utilisant des colorants Suivi cellulaires
Dans cet article
Résumé
L'utilisation réussie des colorants cellulaires de suivi pour surveiller la fonction des cellules immunitaires et la prolifération implique plusieurs étapes cruciales. Nous décrivons des méthodes pour: 1) l'obtention brillante et uniforme, reproductible étiquette-ment avec des colorants membrane; 2) la sélection des fluorochromes et les conditions d'acquisition de données, et 3) le choix d'un modèle pour quantifier la prolifération cellulaire basée sur dilution de colorant.
Résumé
Colorants fluorescents de suivi des cellules, en combinaison avec le flux et la cytométrie en image, sont des outils puissants permettant d'étudier les interactions et les destins des différents types cellulaires in vitro et in vivo. 5.1 Bien qu'il existe littéralement des milliers de publications utilisant ces colorants, certains d'entre les applications les plus couramment rencontrés suivi cellulaires comprennent la surveillance de:
- la tige et la quiescence des cellules progénitrices, la prolifération et / ou différenciation 6-8
- transfert membrane entraînée antigène-9 et / ou la prolifération des cellules précurseurs 3,4,10-18 et
- la fonction immunitaire cellulaire réglementaire et effecteur 1,18-21.
Disponibles dans le commerce colorants suivi cellulaires varient considérablement dans leur composition chimique et les propriétés de fluorescence, mais la chute grande majorité dans l'une des deux classes en fonction de leur mécanisme de marquage cellulaire. "Colorants membrane", caractérisée par PKH26, sont des colorants fortement lipophiles tpartition chapeau de manière stable, mais de façon non covalente dans 1,2,11 membranes cellulaires. "Colorants protéines", caractérisée par CFSE, sont amino-réactifs colorants qui forment des liaisons covalentes stables avec les protéines cellulaires 4,16,18. Chaque classe a ses avantages et ses limites. La clé de leur bonne utilisation, en particulier dans les études multicolores où plusieurs colorants sont utilisés pour suivre les différents types de cellules, est donc de comprendre les questions essentielles permettant une utilisation optimale de chaque classe 2-4,16,18,24.
Les protocoles inclus ici souligner trois causes les plus fréquentes de mauvais résultats ou variable lors de l'utilisation de cellules de suivi des colorants. Il s'agit de:
- L'incapacité d'atteindre brillante et uniforme, l'étiquetage reproductible. C'est un point de départ obligé de toute étude de suivi cellulaire, mais nécessite une attention aux différentes variables lors de l'utilisation des colorants membrane que quand on utilise des colorants réactifs de protéines ou de liaison à l'équilibre telles que des anticorps.
- Sous-optimaux combinaisons de fluorochrome une / ou omission d'inclure commandes de compensation de critiques. Suivi fluorescence du colorant est typiquement 10 février au 10 mars de fois plus brillante que la fluorescence des anticorps. Il est donc essentiel de vérifier que la présence de colorant de suivi ne compromet pas la capacité de détecter d'autres sondes utilisées.
- Le défaut d'obtenir un bon ajustement avec le logiciel de modélisation de pointe. Ce type de logiciel permet une comparaison quantitative des réponses prolifératives différentes populations ou des stimuli en fonction de la fréquence précurseur ou d'autres paramètres. L'obtention d'un bon ajustement, cependant, exige l'exclusion des morts / cellules mourantes qui peuvent fausser les profils par dilution et la congruence des hypothèses du modèle avec les caractéristiques du profil de dilution d'un colorant observée.
Les exemples donnés ici illustrent la façon dont ces variables peuvent affecter les résultats lors de l'utilisation de membrane et / ou des colorants protéines pour contrôler la prolifération des cellules.
Protocole
1. Marquage membranaire général avec PKH26 Dye Suivi Cellulaire (Réf. 25; figure 1)
- Utiliser une technique stérile pour les étapes de 1,1 à 1,9. Préparer ~ 10 7 cellules humaines mononucléées du sang périphérique ou des lymphocytes (hPBMC, HPBL) en utilisant la méthode standard de laboratoire avec plus d'une finale 300 xg rotation pour minimiser la contamination des plaquettes. Remettre en suspension les cellules à 10 7 / ml dans du HBSS BSA +1% et le placer sur la glace, en réservant une aliquote de 500 ul (5x10 6 cellules) pour une utilisation dans l'étape 2.
- Lieu 5x10 6 cellules (500 ul) dans un tube de 12 x 75 mm en polypropylène coniques. Laver une fois avec HBSS ml 3.5. Aspirer soigneusement le surnageant en laissant pas plus de 15-25 ul du liquide résiduel, mais en prenant soin de ne pas enlever les cellules. Utiliser ce tube à préparer une suspension de cellules à l'étape 2x 1,4.
- Pendant la cellule laver à l'étape 1.2, ajoutez 0,5 ml de diluant étiquetage véhicule C (à partir du kit PKH26GL) à un 12 x 75 mm tube en polypropylène coniques. Utilisez ce tube pour préparersont une solution de 2x PKH26 à l'étape 1.5.
- Ajouter 0,5 ml de diluant véhicule étiquetage C à la cellule de l'étape culot lavé et 1,2 fois aspirer et distribuer 3-4 pour obtenir une suspension de cellules individuelles (2x cellules). Eviter la formation de bulles et de mélange excessive, ce qui peut réduire la viabilité cellulaire et la régénération.
- Immédiatement après la préparation de la suspension de cellules à l'étape 2x 1,4, préparer un 2x (4 M) en ajoutant une solution de colorant 2,0 l de 1,0 mM PKH26 langue colorant dans de l'éthanol (à partir de la trousse PKH26GL) pour le tube C diluant préparé dans l'étape de vortex et 1,3 disperser uniformément.
- Immédiatement après la préparation de la solution de colorant 2x à l'étape 1.5, pipeter rapidement la suspension cellulaire 2x partir de l'étape 1.4 dans la solution de colorant 2x et en même temps aspirer et distribuer 3-4 fois pour disperser complètement les cellules à colorant ne pas faire:. Ajoutez 1,0 mM colorant directement à cellules et verser cellules 2x 2x dans le colorant, ou ajouter des cellules 2x 2x colorant tout en vortex. Parce que la coloration est quasi instantanée, ces méthodes donnent moinsintensités uniformes que la méthode recommandée (Figure 2).
- Après 1 min, ajoutez 1,0 ml de sérum inactivé par la chaleur ou BSA HBSS +5% pour arrêter la montée du colorant dans les membranes cellulaires. Si vous n'utilisez pas suffisamment de protéines risque de la formation d'agrégats de colorants, qui peuvent culot avec les cellules pendant les étapes de lavage et de provoquer l'étiquetage involontaire d'autres cellules présentent dans une expérience. Si le milieu avec de la chaleur 10% de sérum inactivé (CM) ou du HBSS 1% de BSA doit être utilisé en tant que réactif d'arrêt, effectuer la coloration dans un tube en polypropylène de 15 ml conique et ajouter au moins 5,0 ml de réactif d'arrêt pour assurer l'adsorption de tous non constituée en société colorant.
- Centrifuger les cellules marquées pendant 5 min @ ~ 400 x g. Aspirer soigneusement le surnageant sans enlever les cellules. Laver le culot deux fois avec 4 ml de CM ou BSA HBSS +1%, la dispersion du culot bien avant recentrifugation. À minimiser la contamination de colorant adsorbé sur les parois du tube et d'optimiser l'efficacité du lavage, transférer les cellules dans un tube en polypropylène fraîche après la first remise en suspension. Remarque: de façon adéquate cellules colorées présentera une teinte rose distincte dans le culot.
- Remettre en suspension le culot lavé de cellules dans 1,0 ml de HBSS% de BSA +1. Compter le nombre de cellules, déterminer la récupération des cellules, et régler le volume pour donner une concentration finale de 10 7 / ml. Avec une aspiration prudente, la récupération des cellules doit être ≥ 85%. Si la récupération des cellules est <70%, de déterminer la cause avant de poursuivre. Retirer une aliquote de 150 pl (1.5x10 6 cellules) et les placer sur la glace pour une utilisation à l'étape 2.
2. Préparation des commandes de configuration des instruments et dosage (tableau 1)
- Aliquote 50 pi (5x10 5) de cellules non colorées de la suspension de cellules sauvegardé à l'étape 1,1 dans chacun des cinq tubes Eppendorf 1,8 ml: 1, 3, 4, 5, et 7. Aliquote de 50 ul (5x10 5) de cellules pos PKH26 de l'étape 1.9 dans chacun des trois tubes: 2, 6 et 8.
- Ajouter 10 ul d'IgG bloc (100 pg / tube d'IgG, voir tableau des réactifs) pour les tubes 8.1et incuber pendant 10 min à température ambiante (20-25 ° C).
- Ajouter une quantité saturante de l'anticorps (s) indiqué dans le tableau 1 pour les tubes 4, 5, 7, et 8 et incuber tous les tubes échantillons (1-8) pendant 30 min à température ambiante et à l'abri de la lumière.
- Ajouter 1,5 ml de BSA HBSS +1% à tous les échantillons, sédimenter les cellules par centrifugation (5 min à 400 xg) et laver une fois avec 1,5 ml de HBSS + 1% BSA, avec une aspiration prudente afin d'éviter la perte de cellules.
- Resuspendre chaque échantillon dans 500 ul de HBSS +1% BSA. Si nécessaire pour les échantillons à analyser sur votre cytomètre, transférer dans un tube de 12 x 75 mm en bas ronde. Ajouter 10 ul de 100 pg / ml 7-AAD quotidienne stock de travail (voir le tableau des réactifs) pour tubes 3, 6, 7 et 8 comme indiqué dans le tableau 1. Incuber dans la glace pendant 30 minutes avant de l'utiliser dans la configuration du cytomètre de flux et de vérification coloration (étape 3).
3. Configuration cytomètre de flux et de vérification de coloration
- Vérifiez que le flux de cytoter fonctionne correctement, en utilisant les procédures établies par le laboratoire de contrôle de qualité quotidien. Vérifier que les signaux peuvent être facilement détecté dans chaque fenêtre spectrale à être utilisé, et en ce que les réponses du détecteur sont linéairement proportionnelle à l'intensité du signal dans la fenêtre à utiliser pour la surveillance 14 prolifération.
- Acquérir FSC vs SSC données pour tube 1 en utilisant des échelles d'affichage linéaires. Réglage de l'amplification de chaque détecteur de telle sorte que la population de lymphocytes tombe dans le quadrant inférieur gauche du graphique de points n'est pas hors échelle dans les deux paramètres, et n'est pas interrompue en raison de seuillage. Recueillir des données non synchronisées FSC vs SSC pour tous les échantillons dans les étapes de 3,3 à 3,7.
- Acquérir des données pour le tube 1, en utilisant la couleur et aucune compensation échelles logarithmiques d'affichage pour les 4 détecteurs de fluorescence. Ajuster la haute tension de chaque détecteur (HV) pour placer l'autofluorescence des lymphocytes non colorées sur l'échelle de quelques / pas de cellules d'accumulation dans le premier canal. Définir une limite de l'analyse pour chaque histogrammecorrespondant à 2% les plus brillants de cellules non colorées.
- Utilisation sans compensation de couleur et les réglages HV établi dans les étapes 3.2 et 3.3, l'acquisition de données pour le tube 2, la collecte FSC, SSC et des signaux dans les 4 détecteurs de fluorescence. Pour le détecteur utilisé pour surveiller PKH26 fluorescence, vérifier que toutes les cellules PKH26 pos apparaissent sur l'échelle comme un seul pic symétrique dans la décennie ème 3 ème -4, avec quelques / aucune cellule dans le dernier canal. Si il ya des pics multiples ou la forme du pic est biaisée, répétez l'étape 1 avec une attention particulière au sel de minimisation et de la technique de mélange (Figure 2). Si nécessaire, ajuster la concentration de colorant.
- Utilisation des paramètres établis à l'étape 3.3, l'acquisition de données pour le tube 3, la collecte FSC, SSC et des signaux dans les 4 détecteurs de fluorescence. Pour le détecteur utilisé pour surveiller 7-AAD fluorescence, vérifiez que 7-AAD cellules pos tomber dessus de la limite de 2% établie à l'étape 3.3 (à savoir que les cellules non viables sont bien résolusà partir de cellules viables neg 7-AAD).
- Utilisation des paramètres établis à l'étape 3.3, l'acquisition de données pour le tube 4, la collecte FSC, SSC et des signaux dans les 4 détecteurs de fluorescence. Vérifiez que les cellules CD8 pos sont bien résolus à partir de cellules non colorées (c.-à-automne au-dessus de la limite des 2% fixé à l'étape 3.3 pour le détecteur FITC). Répéter avec le tube 5 et vérifier que les cellules CD8 pos sont bien résolus à partir de cellules non colorées (c.-à-automne au-dessus de la limite des 2% fixé à l'étape 3.3 pour le détecteur APC).
- Paramètres à l'aide établies à l'étape 3.3, l'acquisition de données pour les tubes de 6, 7 et 8, la collecte FSC, SSC et des signaux dans les 4 détecteurs de fluorescence.
- Utilisez les fichiers en mode liste collectées pour tubes 1-5 et votre logiciel de compensation de couleur pour établir une matrice de couleurs se chevauchent pour chaque fluorochrome dans les détecteurs utilisés pour le suivi des trois autres fluorochromes. Appliquer cette matrice dans le fichier mode liste pour l'échantillon 6 et vérifiez que la présence de PKH26 laboratoireeling ne modifie pas la capacité de détecter 7-AAD cellules pos.
- Appliquer la couleur se chevauchent matrice de l'étape 3.8 à la mode fichier liste pour l'échantillon 7 et vérifier que: a) 3 sous-populations bien résolus (CD3 CD4 neg neg, CD3 CD4 pos neg et CD3 CD4 pos pos) peuvent être identifiés sur un FITC vs APC dot plot, et b) la présence d'anticorps anti-CD3-FITC et anti-CD4-APC ne modifie pas la capacité de détecter 7-AAD cellules pos. Si la présence d'anticorps anti-CD3-FITC modifie la limite supérieure de 2% pour les données recueillies sur le détecteur PKH26, réajuster la frontière selon les besoins.
- Appliquer la matrice de couleur chevauchement de l'étape 3.8 à la mode fichier liste pour l'échantillon 8. Si la présence de PKH26 étiquetage modifie la limite des 2% pour le FITC, 7-AAD ou des détecteurs d'APC de ceux qui sont à l'aide de la commande autofluorescence à l'étape 3.3, réajuster la limite (s), si nécessaire en utilisant Tube 7 du tableau 1 et vérifiez qu'il est encore possible de Distinguish CD3 CD4 pos pos pos CD3 CD4 neg, et CD3 CD4 neg neg cellules en utilisant la limite réglée (s).
4. Sélection du modèle pour la surveillance de la prolifération cellulaire par la Division de dilution Dye
- Déterminer l'espacement entre les générations, ce qui est dépendante du nombre de canaux et des décennies logarithmiques sur votre cytomètre. Pour instruments numériques, cette valeur, typiquement 4 ou 5 ans, est déterminée par le nombre de casiers dans le processeur de signal numérique. Sur les instruments analogiques, où le nombre d'années est rarement un nombre entier, nécessite une modélisation précise le nombre exact des décennies à être déterminées expérimentalement. Pour ce faire, les données à partir d'un mélange de billes fluorescentes calibrées avec du fabricant attribuées par les intensités relatives sont acquises à même les paramètres du détecteur de haute tension utilisés dans l'expérience. La position des pics de talon permet le calibrage de l'échelle logarithmique en fonction de intgamme ensity par décennie journal. Plus précisément, cela se fait en traçant le numéro de canal pour chaque type de bourrelet contre le journal du fabricant attribué par valeur. La pente d'une droite de meilleur ajustement linéaire pour les valeurs de données de perles donne le nombre d'unités d'intensité relative par canal. Multiplié par le nombre de canaux, cette valeur sera alors le nombre de décennies de journal pour la pleine échelle, à partir de laquelle le nombre de canaux correspondant à une diminution de deux fois en intensité (c.-à espacement génération fille) peut être calculée à 14.
- Décidez si vous souhaitez utiliser un espacement fixe entre les générations ou pour permettre l'espacement de flotter. Un standard (fixe) de réglage va utiliser la valeur d'espacement déterminé à l'étape de génération 4,5 à assigner l'emplacement de chaque génération, et est généralement utilisé lorsque l'histogramme manque de pics distincts. Un réglage du flotteur permet à chaque position du pic de génération qui sera déterminée par la forme et l'histogramme est généralement utilisée lorsque distinguishable Les crêtes générationnelles sont évidents.
- Décidez si vous souhaitez utiliser une largeur de pic fixe pour toutes les générations ou une largeur variable. Une largeur fixe utilise la SD calculée pour l'échantillon témoin non stimulé de modéliser toutes les générations et est généralement choisi lorsque l'échantillon n'a pas distinguables des pics générations. Une largeur variable permet au programme de manière indépendante varier la SD pour chaque génération et est utilisée de préférence avec des pics distincts générations.
- Exécuter un programme contenant un module d'analyse de la prolifération (ici ModFit LT version 3.3). Chargez le fichier stimulé PKH26 pos de l'ensemble de données à analyser (par exemple, un stimulées 96 h de culture de cellules pos PKH26 contrecolorées que pour Tube 8 dans le tableau 1).
- Sélectionnez les paramètres pour l'analyse, dans ce cas PKH26 (585/42) fermée sur viables (7-AAD neg) lymphocytes CD3 pos FSC vs SSC et à exclure les petits débris et grands agrégats (figure 3). En définissantces régions soient pris soin d'inclure la zone de dispersion d'avancement élevée, où se trouvent généralement explosions et CD3 noter que l'expression peut être modulée en bas dans les cultures stimulées.
- Créer un modèle de prolifération aide de l'Assistant prolifération. Utilisation du fichier de données ouvert (onglet Démarrer), chargez le fichier de contrôle non stimulé PKH26 pos et définir l'emplacement du canal pic dans la distribution parentale correspondant à des cellules non divisées.
- Analyser le fichier pour le contrôle non stimulé PKH26 pos, en notant les valeurs pour la position de pointe des parents et de la largeur (écart-type). Si une largeur de pic fixe (SD) est souhaitée, vérifier verrouillage SD.
- Chargez le PKH26 neg contrôle (par exemple, une culture de cellules de 96 h neg PKH26 contrecolorées que pour le tube 7 dans le Tableau 1). Réglez le nombre de générations par le réglage du canal de pointe pour le plus obscur génération au-dessus du contrôle PKH26 neg. Ceci détermine le numbre de générations fille le modèle peut exactement en forme et est généralement 6-9 générations.
- Ouvrez le fichier de données pour l'échantillon stimulé (par exemple, un stimulées 96 h de culture de cellules pos PKH26 contrecolorées que pour Tube 8 dans le tableau 1) et de confirmer que les régions de la position du pic des parents et de la carte SD tel que défini à l'étape 4.7 restent inchangés. Si l'espacement fixe générationnelle est souhaitée, sélectionnez l'option Modèle standard, sinon sélectionnez l'option flottant.
- Analyser chaque fichier expérimental dans l'ensemble de données, en utilisant le même modèle défini à l'étape 4.9. Des ajustements mineurs à la position du pic parentale peut être nécessaire pour le meilleur ajustement très au sens à la fois visuellement et par la réduction de chi carré (RCS) de valeur.
- Enregistrer les paramètres souhaités prolifération résultant de l'ajustement optimal pour chaque fichier expérimental dans l'ensemble de données. Pour une description complète des paramètres possibles, voir Réf. 22.
Résultats
Colorants membranaires comme PKH26 tache par quasi-instantanée de partitionnement dans les membranes cellulaires plutôt que par réaction chimique (par CFSE) ou la liaison d'équilibre (pour les anticorps). Le manque d'attention aux questions essentielles décrites dans la figure 1 peut entraîner une coloration faible ou hétérogène du type représenté à la figure 2. En revanche, l'utilisation de conditions d'étiquetage optimisés (figure 1, tableau 2) se traduit par des distributions lumineuses homogènes adaptés à une variété d'applications de suivi de cellules, y compris la surveillance de la division cellulaire basée sur dilution de colorant (figure 3). Cellules mortes / mourantes perdre des quantités variables de colorant de suivi, ce qui peut élargir et / ou biaiser les intensités de production fille et compliquer la modélisation basée sur la prolifération dilution d'un colorant 3,4,16,18. Utilisation d'un colorant de viabilité est donc recommandé lors de la collecte de données par dilution dans des conditions où un nombre important de cellules mortes peuvent être préenvoyé, comme les cultures stimulées (figure 3) ou plus de spécimens (figure 4).
Parce que le suivi étiquetage colorant donne généralement des intensités de fluorescence de plusieurs ordres de grandeur plus grand que l'immunophénotypage, il est important d'inclure des contrôles de compensation appropriées (tableau 1) et de vérifier que la présence de colorant de suivi ne porte pas atteinte à la capacité de résoudre les cellules d'anticorps positifs et négatifs (figure 4). Afin d'éviter la nécessité d'une compensation de couleur excessive, il est préférable de placer un brillant fluorochrome, ou qu'il n'est pas présent sur les cellules d'intérêt, comme un colorant exclus par les cellules vivantes, dans le canal spectral (s) adjacente à la teinture de suivi (figure 4A & B vs. 4C et D). Pour l'utilisation de logiciels de modélisation de crête à quantifier l'étendue de la prolifération, l'obtention d'une bonne adéquation nécessite des hypothèses correspondant dans le modèle des caractéristiques de la dilution d'un colorant profiles en cours d'analyse (figure 5 et tableau 3). Avec une sélection appropriée des colorants réactifs de suivi et de viabilité, il est également possible de caractériser la réponse proliférative dans plusieurs sous-populations lymphocytaires simultanément. Par exemple, comme illustré à la figure 6, l'addition d'un colorant de suivi 2e simplifie la discrimination entre les cellules T régulatrices (étiqueté avec Claret CellVue) et hautement proliféré effectrices des cellules T (marqué avec CFSE) et fournit beaucoup plus de détails au sujet de leurs interactions que pourraient être obtenus l'aide de 3 H-thymidine étiquetage 18,27.
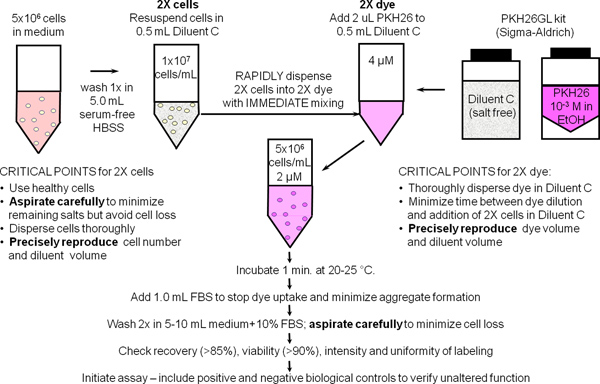
Figure 1. Protocole général pour le marquage membranaire PKH26, PKH67 et colorants CellVue. Partitionnement de ces colorants hautement lipophiles dans membra cellulenda se produit essentiellement instantanément lors du mélange avec les cellules lorsque la coloration est mise en oeuvre dans le exempte de sel C véhicule diluant fourni pour maximiser l'efficacité et la solubilité de colorant coloration. Comme l'a résumé dans ce schéma de marquage membranaire général avec PKH26, brillant, coloration uniforme et reproductible est donc plus facilement obtenue par: 1) réduire au minimum les quantités de protéines et / ou des sels présents dans l'étape de coloration et 2) en utilisant une technique de mélange qui assure rapide dispersion homogène de cellules dans colorant (par exemple, expose simultanément toutes les cellules de la même concentration de colorant).
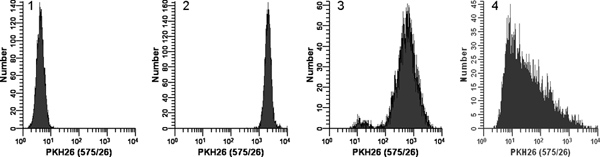
Figure 2. Effet de coloration conditions PKH26 distributions de fluorescence (tiré à part de Réf. 18). Échantillons de croissance logarithmique, U culture937 cellules ont été colorées avec PKH26 (concentrations finales: 1 x 10 7 cellules / ml, de 12 à 15 uM PKH26) pendant 3 min à température ambiante, avec ou sans mélange immédiat lors de l'addition des cellules 2x 2x colorant. Après lavage, les cellules colorées ont été analysées sur un cytomètre en flux Beckman Coulter CyAn en utilisant les paramètres d'instrument constants Histogramme 1:. Contrôle sans tache avec PKH26 détecteur de tension ajusté à placer toutes les cellules de l'échelle dans la première décennie avec quelques cellules / pas de s'accumuler dans le premier canal. Histogramme 2: coloration à 15 uM colorant en utilisant l'addition des cellules 2x 2x colorant avec mélange immédiat abouti à un brillant, coloré de façon homogène, symétrique de la population de cellules placées dans la quatrième décennie, avec peu / pas de cellules qui s'accumulent dans le dernier canal (GMFI = . 2548, gCV = 26,2%) Histogramme 3: coloration à 15 uM colorant en utilisant l'addition des cellules 2x 2x colorant mais sans mélange immédiat conduit à une intensité réduite et plus large d'un CV (GMFI = 505 , GCV = 116%) ainsi que d'une sous-population faiblement teinté, peut-être en raison d'une baisse des cellules délivrées sur la paroi du tube plutôt que dans la solution de colorant 2x Histogramme 4:. Une erreur de marquage conduit à 3 microlitres de colorant éthanolique concentrée stocks sont ajoutés directement à 2x cellules C Diluant sans mélange supplémentaire plutôt que d'être utilisé pour préparer une solution de colorant 2x dans le diluant C. Il en résulte une concentration de colorant finale de 12 uM, mais a donné une coloration très faible et hétérogène (GMFI = 32,9, gCV = 1020%). Le droit biais observé reflète très probablement des effets combinés de: i) un mauvais mélange en raison de cellule très disparates et les volumes de teinture, et ii) le fait que les cellules les plus proches du point de colorant de distribution seraient exposés à une concentration plus élevée de colorant que les observations plus loin. Cliquez ici pour agrandir la figure .
re 3 "src =" / files/ftp_upload/4287/4287fig3.jpg "fo: content-width =" 4.5in "fo: src =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
Figure 3. Utilisation d'une sonde de déclenchement simplifie la viabilité des profils de prolifération des cellules T hPBMC ont été marquées avec PKH26 (concentration cellulaire finale: 3x10 7 / ml, concentration finale colorant: 10 uM).. Après culture pendant 96 h en présence (stimulé) ou l'absence (non stimulé) d'anti-CD3 et d'IL-2, les cellules ont été contre-colorées avec anti-CD3-FITC, anti-CD19-APC et 7-AAD, et ont été analysés sur un FACSCalibur cytomètre de flux (voir référence 13 pour plus de détails). Compensation des couleurs a été réalisée au moment de l'acquisition de données en utilisant un circuit de compensation câblée. L'étendue de la prolifération a été modélisé comme décrit à l'étape 4 en utilisant l'assistant de prolifération dans ModFit LT3.3. Les données de la commande PKH26 neg (tableau 1, Tube 7) sont recouvertes de référence (gris histogrammes pleins dans la colonne 3). Viabilités pour non stimulées et sticultures formulées étaient de 76% et 62% (données non synchronisées pour les panneaux A et B, respectivement). Partie A. PKH26 cellules colorées en culture pendant 96 h en milieu fermé sont à inclure viables (7-AAD neg) cellules CD3 pos (R1). En plus de l'inclusion d'anticorps et 7-AAD porte morts exclusion de cellules, une diffusion vers l'avant (FSC) contre side scatter (SSC) porte (R2) a été utilisée pour exclure les débris et les granulats. Notez l'absence de cellules mortes dans la dernière parcelle dans ce panneau. Le meilleur modèle d'ajustement pour le profil PKH26 prolifération (colonne 3) a donné un seul pic avec RCS = 2,1 (bailleurs de fonds 6, tableau 3), ce qui indique une bonne symétrie, et a été utilisé pour définir la position de départ des parents et la largeur du pic pour l'analyse de la stimulé échantillon de cet ensemble de données (partie B). Partie B. Une aliquote de réplique de PKH26 cellules colorées ont été cultivées avec des anticorps anti-CD3 et d'IL-2 pendant 96 h et fermé de la même manière que dans la partie A. Un modèle avec la position de pointe flottante et la largeur de crête flottante donne la meilleure solution pour ces données avec RCS = 1,3 (bailleurs de fonds 6, tableau 3). Partie C. Le même fichier de données comme dans la partie A a été analysée sans l'utilisation de 7-AAD données. Quand un primaire FSC vs SSC a été en partie utilisés pour exclure les cellules mortes et les agrégats (R2) et une porte secondaire pour sélectionner CD3 événements positifs (R3), une petite population résiduelle de cellules mortes est restée (0,2% des événements dépendants). Le meilleur modèle d'ajustement donné un seul pic avec RCS = 2,2. Groupe D. Le fichier de données que dans le groupe B était fermée comme dans le Panneau de C. Notez l'ensemble de la population résiduelle de cellules mortes dans l'échantillon stimulé (1,29% des événements dépendants) pour cette stratégie de déclenchement. Le meilleur modèle d'ajustement a été l'une avec la position de pointe flottante et la largeur du pic flottant (RCS = 1,3). Cliquez ici pour agrandir la figure .
ig4.jpg "fo: content-width =" 5po "fo: src =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
Figure 4. Effet du choix et de la concentration du colorant fluorochrome sur la capacité des lymphocytes immunophénotype étiquetés avec PKH26. HPBMC ont été isolés à partir de 24 h vieux sang et étiqueté avec PKH26 comme décrit à l'étape 1, à l'exception que la coloration a été réalisée en fond 12 x 75 mm rond tubes en polystyrène plutôt que 12 tubes x 75 mm en polypropylène coniques. Immédiatement après marquage avec PKH26, les cellules ont été contre-indiqués avec les réactifs immunophénotypiques et la viabilité, et analysés sur un cytomètre en flux LSRFortessa en utilisant la stratégie de porte de la figure 3A et la configuration suivante optique: 488 nm laser: FSC-A (488 nm), SSC -A (488/10 BP), FITC-A (530/30 BP); PKH26-A (575/26 BP); 7-AAD-A ou PerCP-A (695/40 BP). 640 nm laser: APC-A ou TOPRO-3-A (670/14 BP). Compensation des couleurs a été réalisée au moment de l'acquisition de données à l'aide du logiciel BD DiVa. "Auto"indique autofluorescence de la commande de pas-anticorps dans la fenêtre correspondante spectrale (APC pour les panneaux A et B, PerCP pour panneaux C et D). Les données de la commande PKH26 neg (tableau 1, Tube 7) sont recouvertes de référence (gris histogrammes remplis, colonne 5). Post-coloration viabilités étaient similaires pour tous les échantillons (88-92%). Panel A. Les cellules marquées avec PKH26 à une concentration finale de 2 uM ont été contre utilisant des anticorps anti-CD3-FITC, anti-CD4-APC et 7-AAD ( Tube 8 du tableau 3). Après déclenchement sur viables (7-AAD neg) lymphocytes CD3 pos (colonne 1) et l'exclusion des débris et des agrégats basés sur FSC et SSC (voir la figure 3A), PKH26 intensité a été évalué en association avec CD4 APC (colonnes 2 et 3). Que non compensée (colonne 2) ou compensé (colonne 3), cette combinaison fluorochrome donné lieu à une bonne résolution entre les cellules T CD4 et CD4 pos neg cellules T), tel que vérifié tant par un no-antibody, le contrôle autofluorescente (Tube 6 du tableau 1; colonne 4) et la parcelle en deux couleurs de CD3 vs. CD4 (colonne 6). Panel B. Utilisation de la combinaison même fluorochrome comme dans le panel A, mais en augmentant la concentration finale PKH26 à 4 uM n'a pas nui à la capacité de résoudre des CD4 pos cellules T à partir de cellules T CD4 neg. Panel C. aliquote répétition de cellules marquées avec PKH26 indépendamment à une concentration finale de 2 uM a été contre-coloration utilisant des anticorps anti-CD3-FITC, anti-CD4-PerCP, et TOPRO-3. Après déclenchement sur viables (TOPRO-3 neg) lymphocytes CD3 pos (colonne 1) et l'exclusion des débris et des agrégats basés sur FSC et SSC (voir la figure 3A), PKH26 intensité a été évalué en association avec des anti-CD4-PerCP (colonnes 2 et 3). Substantielles chevauchement spectral de PKH26 dans le canal PerCP est évident dans les données sans compensation (colonne 2), et la résolution entre CD4 pos PKH26 pos et PKH26 CD4 pos neg événements est marginale après compensation est appliquée (comparer la colonne 3 avec le non-anticorps, le contrôle autofluorescente indiquée dans la colonne 4). Panneau D. Lorsque PKH26 concentration est augmentée à 4 uM, il n'est plus possible d'utiliser la combinaison de chevauchement fluorochrome C. Panneau spectrales de PKH26 dans le canal PerCP dépasse l'intensité du signal de CD4 (colonne 2) et CD4 pos pos PKH26 événements ne peuvent plus être résolus à partir de CD4 neg pos PKH26 cellules T (colonne 3 vs. colonne 4). Cliquez ici pour agrandir la figure .
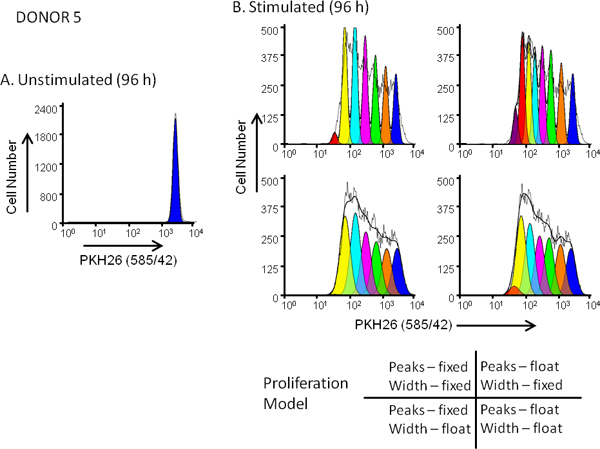
Figure 5. Effet de la sélection modèle de prolifération de. qualité de l'ajustement des profils par dilution hPBMC ont été marquées avec PKH26 (concentration cellulaire finale: 3x10 7 / ml, concentration finale colorant: 10 uM). Après culture pendant 96 h en présence (stimulé) ou l'absence (non stimulé) d'anti-CD3 et d'IL-2, les cellules ont été récoltées contraste avec de l'anti-CD3-FITC, anti-CD19-APC et 7-AAD et analysées sur un FACSCalibur cytomètre en flux (voir référence 13 pour les méthodes détaillées). Compensation des couleurs a été réalisée au moment de l'acquisition de données en utilisant un circuit de compensation câblée. Panel A. PKH26 Le profil d'intensité d'une culture non stimulé 96 h pour les donneurs 5, un répondeur modérée, était fermée comme illustré sur la figure 3A et utilisées pour fournir la prolifération ModFit Assistant à une première estimation de la position et la largeur du pic représentant indivis cellules parentales. Panel B. PKH26 Le profil d'intensité d'une stimulation parallèle 96 h de culture a été analysé à l'aide des estimations à partir dePanel A et 4 combinaisons différentes de paramètres "prolifération magicien", correspondant aux fixes ou flottantes intensités des pics et des largeurs fixes ou flottantes de pointe pour les générations successives fille comme illustré. Comme le résume le tableau 3, le modèle qui a donné le meilleur ajustement aux données observées (la plus basse réduit chi carré; RCS) était le «variable / variable" combinaison dans laquelle non seulement les positions des pics, mais aussi les écarts-types des pics de génération fille ont été autorisés de varier (RCS = 1,5). Le même modèle a donné le meilleur ajustement pour les donneurs 6, un taux de réponse élevé (figure 3B et tableau 3).
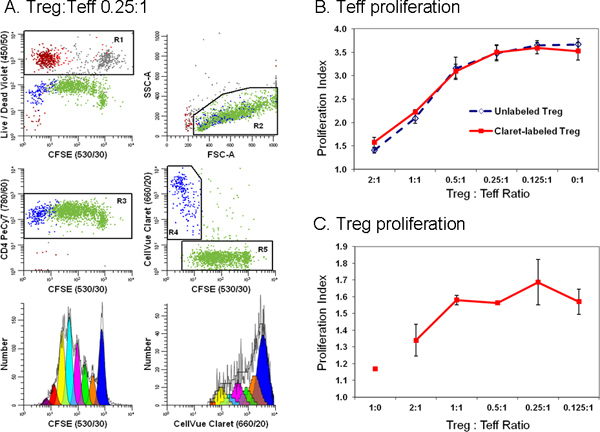
Figure 6. Addition d'un colorant deuxième cellule de suivi simplifie la discrimination entre les effecteurs et régulateurs des cellules T dans un essai de suppression de cytométrie en flux(D'après 18 Ref.) Lymphocytes de monocytes appauvri préparés à partir de filtres leucaphérèse Trima ont été colorées avec anti-CD127-PE, anti-CD4-PE-Cy7, et anti-CD25-APC et le flux trié dans les populations d'effecteur (Teff.; pos CD4 CD25 CD127 dim lumineux), réglementaires (Treg, CD4 pos CD127 dim CD25 pos) et accessoire (CD4 neg) des cellules. Triés cellules Treg marqués par Claret CellVue (concentration cellulaire finale: 1x10 6 / ml; concentration finale de colorant: 1 uM) et Teff triés marqué avec CFSE (concentration cellulaire finale: 5 x 10 7 / ml; concentration finale de colorant, 5 pM) étaient co-cultivées dans des proportions variables, en présence de cellules accessoires anti-CD3, anti-CD28 et irradiée. Après 96 h, les cultures ont été récoltées, contre-coloration avec des anticorps anti-CD4-PE-Cy7 et LIVE / DEAD Violet Fixable, et analysés sur un cytomètre en flux LSRII et compensation de couleur a été réalisée à la fois des données ACQUISITIOn à l'aide du logiciel BD DiVa (voir référence 18 pour plus de détails, y compris les contrôles de compensation). Les indices de prolifération de Teff et Treg ont été modélisés comme décrit à l'étape 4, en utilisant l'assistant de prolifération dans ModFit LT3.3. Les points de données dans les panneaux B et C représentent la moyenne ± 1 écart-type des échantillons en triple A. Les données de panel représentatif sont présentés pour l'un des trois échantillons en triple à un Treg:. Teff rapport de 0,25:1. LIVE / DEAD réactif Violet Fixable a été utilisé pour exclure les cellules mortes (R1, tracé supérieur gauche cellules accessoires = brun-rouge, non viable Teff = gris et non viables Treg = rouge) de toutes les parcelles d'autres données. Coloration Claret CellVue a été utilisé pour distinguer les Treg viable (R4, centre de la placette à droite, en bleu) à partir viable mais très proliféré Teff (R5, centre de la placette droite, vert). Un profil unique paramètre CFSE prolifération des Teff (graphique inférieur gauche) a été générée par le déclenchement des cellules qui étaient CFSE pos (R5), CD4 pos (R3), viable (pas R1), et a eu des lymphocytes scpropriétés Atter (R2). Un seul paramètre CellVue prolifération Claret profil de Treg a été générée par le déclenchement des cellules qui étaient Claret CellVue pos (R4), CD4 pos (R3), viable (pas R1), et a des propriétés de dispersion de lymphocytes (R2). Notez la région lymphocytes généreux (R2) définie pour inclure explosions lymphocytes. On notera également que le nombre total de cellules à collecter dépend de la fréquence la plus basse de la population d'intérêt. Dans une expérience prolifération cellulaire où la population d'intérêt peut être répartie sur une vaste gamme d'intensités représentant jusqu'à sept ou huit générations un grand nombre de cellules doivent être collectées pour modéliser avec précision et calculer le nombre de cellules dans chaque génération. Lors de l'étude des cellules rares, il peut être nécessaire d'exécuter simplement le tube d'échantillon presque à sec afin de recueillir le plus grand nombre possible d'événements. Pour l'exemple présenté ici, cette opération conduit à un total de 25.000 ~ manifestations, dont 11.923 étaient Teff (prolifération Index 3,85) et 1380 étaient Treg (prolifération indice 1,83). Partie B. Comme prévu, l'augmentation de la proportion des présents Tregs dans les co-cultures ont conduit à une plus grande suppression de la prolifération cellulaire Teff. Des résultats similaires ont été obtenus avec les deux CellVue Claret teinté (trait plein) ou non colorée (ligne pointillée) Treg, ce qui indique que la coloration avec le colorant Claret CellVue suivi n'a pas affecté Treg puissance. Partie C. Treg sont relativement anergiques et, comme prévu, a fait prolifèrent pas lorsqu'ils sont incubés avec des anticorps anti-CD3, anti-CD28, et des cellules accessoires, en l'absence de cellules Teff (Treg: Teff rapport de 1:0). Cependant, comme la proportion de Teff présente dans les co-cultures a augmenté (c'est à dire comme l'Treg: ratio a diminué Teff), l'étendue de la prolifération Treg a également augmenté. Les barres d'erreur généralement plus grandes de ces données, au moins en partie le reflet de l'étendue limitée de prolifération, ce qui conduit à un plus petit nombre d'événements collectés par rapport à Teff et une plus grande incertitudeté dans la modélisation du nombre de cellules dans chaque génération. Cliquez ici pour agrandir la figure .
| Tube No. (Objet) | PKH26 | Anticorps (s) | 7-AAD |
| 1 (installation, réparation) | - | - | - |
| 2 (installation, réparation) | + | - | - |
| 3 (installation, réparation) | - | - | + |
| 4 (indemnisation) | - | CD8-FITC b | - |
| 5 (indemnisation) | - | CD8-APC b | - |
| 6 (aucun contrôle Ab) | + | - | + |
| 7 (pas de con suivi colorantcontrôle) | - | CD3-CD4-FITC ou CD19 APC APC-c | + |
| 8 (T0 contrôle) | + | CD3-CD4-FITC ou CD19 APC APC-c | + |
. Instrument Setup tableau 1 permet de commander un contrôles répertoriés sont appropriés pour un 4-couleurs CD4 test T de surveillance prolifération en utilisant:. PKH26 (prolifération colorant), CD3-FITC (marqueur des cellules pan-T), CD4-APC (T-helper marqueur cellulaire), 7-aminoactinomycine D (7-AAD, l'exclusion des cellules mortes) b Grandir substituts pour CD3-FITC et CD4-APC (meilleure capacité à détecter les erreurs de compensation) c. Figure 3:. CD3-FITC et CD19-APC. Figure n 4: CD3-FITC et CD4-APC.
| Type de cellule | Concentration cellulaire finale | Concentration finale Dye </ Strong> | Référence |
| b hPBMC | 1 x 10 7 / ml | 2 uM PKH67 | 10,17 |
| 5 x 10 6 / ml | 2 uM PKH26 | 12 | |
| 3 x 10 7 / ml | 10 uM PKH26 | 13 | |
| 5 x 10 7 / ml | 30 uM PKH26 | 18 | |
| 1 x 10 6 / ml | 1 Claret CellVue uM c | 18 | |
| 3 x 10 7 / ml | 4 Claret CellVue uM | 13 | |
| 5 x 10 7 / ml | 5 Claret CellVue uM | 18 | |
| Cellules en culture | 5 x 10 5 / ml | 0,1 uM PKH26 (1 ° les cellules mammaires) | 8 |
| 1 x 10 7 / ml | 15 pM PKH26 (U937) | 18 | |
| 1 x 10 7 / ml | 12,5 uM -15 PKH26 (U937) | 15 | |
| 1 x 10 7 / ml | 1 uM PKH67 (K562) | 18 | |
| 1 x 10 7 / ml | 1 uM PKH67 (lignées de cellules T) | 9 | |
| 1 x 10 7 / ml | 10 Claret CellVue uM (YAC-1) | 23 |
Tableau 2. Non générateurs de perturbations Conditions coloration de la membrane en nouant un. Une. Adapté et mis à jour à partir Ref 18. B Un lavage à basse vitesse (300 xg) a été utilisé pour réduire la contamination des plaquettes. C cellules Treg CD4 (flux triés CD25 pos pos neg CD127 lymphocytes).
| Paramètres du modèle | Résultats du modèle | ||||||||
| Donateur | Traitement | Position de pic | Dakota du Sud | Position des parents | Parental SD | Nombre de Equipée Peaks | RCS | PI | PF |
| 5 | Non stimulées | Flotter | Flotter | 209 | 4,5 | 1 | 5,1 | 1,0 | 0 |
| 5 | Stimulé | Correction d' | Correction d' | 209 | 4.5 | 7 | 35 | 3,9 | 31 |
| 5 | Stimulé | Flotter | Correction d' | 209 | 4,5 | 8 | 19 | 4,3 | 30 |
| 5 | Stimulé | Correction d' | Flotter | 209 | 9,2 | 6 | 1,9 | 3,8 | 30 |
| 5 | Stimulé | Flotter | Flotter | 209 | 9.0 | 7 | 1,5 | 3,7 | 29 |
| 6 | Non stimulées | Flotter | Flotter | 205 | 4.0 | 1 | 2,1 | 1,0 | 0 |
| 6 | Stimulé | Correction d' | Correction d' | 205 | 4.0 | 6 | 42 | 6,6 | 60 |
| 6 | Stimulé | Flotter | Correction d' | 205 | 4.0 | 7 | 12 | 7,4 | 60 |
| 6 | Stimulé | Correction d' | Flotter | 205 | 8,6 | 6 | 6,9 | 6,8 | 62 |
| 6 | Stimulé | Flotter | Flotter | 205 | 6,5 | 6 | 1,3 | 6,5 | 59 |
Tableau 3. Impact de la prolifération du modèle sur Qualité de l'ajustement (RCS) et métriques prolifération d'un. Une coloration des échantillons, la collecte de données et de déclenchement tel que décrit à la figure 3A & B.
Discussion
Les méthodes décrites ici sont celles trouvées dans nos laboratoires combinés à la plus fiable pour obtenir des résultats optimaux étiquetage hPBMC utilisant des colorants membrane 13,16,18 et pour le phénotypage lymphocytaire sous-ensemble et le suivi prolifération en utilisant soit la membrane ou des colorants protéines 2,11,13,16, 18. Comme illustré sur les figures 1 et 2, l'étiquetage lumineux uniforme est plus facilement obtenue en limitant la présence de sels physiologiques et en utilisant une technique de mélange qui en résulte rapide, l'exposition homogène de toutes les cellules de la même concentration de colorant. Parce que la coloration avec des colorants membrane se fait par partitionnement dans la bicouche lipidique, d'autres variables qui modifient la concentration du colorant libre peut également avoir une incidence efficacité du marquage. Par exemple, l'étiquetage en rond tubes en polystyrène résultats inférieurs au lavage moins efficace des sels avant remise en suspension dans du diluant C et également en baisse de concentration du colorant libre en raison de teindre adsorption sur les parois du tube, en particulierà des concentrations plus faibles de colorant. Ces deux facteurs ont tendance à donner des distributions de coloration plus larges que lorsque l'étiquetage soient réalisés à l'aide des tubes en polypropylène coniques de fond (figures 3, 4 et résultats non publiés). L'âge et le type d'échantillon peut également affecter la largeur du pic, même si les procédures de coloration optimisés sont utilisés. Par exemple, les CV des lymphocytes pos PKH26 isolées à partir de sang fraîchement prélevé gamme de 14 à 20% (figure 3, Réf. 13 et résultats non publiés), tandis que les CV des lymphocytes isolés à partir d'échantillons sanguins h 24 anciens ou TRIMA aphérèse filtres gamme de 25 à 30 % (figure 4 et Réf. 18).
Coloration uniformité et la mesure dans laquelle les cellules non viables peuvent être exclus de l'analyse à la fois affecter si les pics fille distinctes sont évidentes dans le profil de dilution d'un colorant, qui à son tour affecte le choix d'un modèle de prolifération d'ajuster les données observées (figures 5 et 6 ). Bien que ModFit (Verity Software House, Topsham, ME) est utilisé ici comme un exemple de logiciel utilisé pour générer des indicateurs tels que l'indice de prolifération et de la fréquence des précurseurs (figures 3, 5 et 6; Tableau 3), d'autres progiciels contiennent également des modules pour analyser données prolifération. Ceux-ci comprennent FCSExpress (De Novo Software, Los Angeles, CA) et FlowJo (Star Tree, Inc, Ashland, OR). Tous ces programmes utilisent une formule non linéaire des moindres carrés itérativement pour trouver le meilleur ajustement aux données brutes en changeant la position, la hauteur et SD (ou largeur) de pics gaussiens représentant générations successives fille. Indice de prolifération (PI) et de la fréquence des précurseurs (PF) sont les mesures les plus couramment utilisées de mesure de la prolifération. PI, tels que définis par ModFit, est une mesure de l'augmentation du nombre de cellules au cours de l'essai, analogue à la «indice de stimulation 'un dosage de thymidine. PF renvoie la fraction de cellules dans la première populations qui ont répondu au stimulus par la prolifération. La prudence est recommandée, cependant, lors de la lecture de la littérature depuis la terminologie varie quelque peu entre les logiciels (par exemple, FlowJo et ModFit utilisent des définitions et des calculs différents de ce que l'on entend par «prolifération indice») 22.
Les questions essentielles abordées ici pour l'étiquetage et l'analyse prolifération de membranes avec des colorants sont également rencontrés lors de l'utilisation de colorants protéines. Par exemple, une attention particulière à la technique de mélange doivent être respectées, ainsi que l'exclusion des cellules mortes / meurt, afin d'obtenir des distributions uniformes et les sommets fille distinctes lors de l'utilisation CFSE (figure 6) 2-4,13,18,24. Choix approprié des fluorochromes pour le phénotypage et évaluation de la viabilité est également important d'éviter un chevauchement spectral excessives et l'incapacité à reconnaître les cellules d'anticorps positifs, en particulier avec des colorants visibles protéines émettrices telles que CFSE 2-4,11,13,16,18 . La réduction de la concentration de colorant de suivi à réduire les problèmes de rémunération dans adjacents canaux spectraux, mais limite également le nombre de divisions cellulaires qui peuvent être contrôlés avant intensités de cellules filles commencent à se chevaucher avec autofluorescence. Vous pouvez également utiliser des colorants cellulaires les plus récents tels que le suivi Claret CellVue électroluminescente rouge lointain (Sigma-Aldrich, St. Louis, MO) ou violet émettant CellTrace Violet (Life Technologies, Grand Island, NY) peut réduire les problèmes de compensation (figure 6). Enfin, bien que les colorants membrane généralement tendance à présenter moins de toxicité 11,26, il est possible de sur-label cellules avec soit la classe de colorant. Il est donc toujours nécessaire de vérifier que la concentration de colorant de suivi utilisé n'a pas modifié la fonctionnalité des cellules à suivre (Figure 6) 3,13,16,18.
Déclarations de divulgation
K. Humphrey, JD Tario, Jr. et PK Wallace ont reçu hématies pré-commerciaux de suivi pour l'évaluation de Life Technologies, Inc et BD Biosciences. AD Bantly et JS Moore ont reçu pré-commerciale cellule de suivi des réactifs pour l'évaluation de Life Technologies, Inc et le financement du PTI Research, Inc pour le pré-commerciale caractérisation des cellules CellVue divers colorants suivi. K. Muirhead est employé par SciGro, Inc, qui fournit des services de consultation aux Technologies Phanos, Inc (propriétaire de la PKH et colorants CellVue) et fournit un appui technique pour la sauvegarde Sigma-Aldrich et moléculaires technologies de ciblage, Inc (distributeurs de ces colorants).
Production et le libre accès à cet article est sponsorisé par Sigma-Aldrich.
Remerciements
Les auteurs tiennent à remercier tout particulièrement les personnes suivantes pour leurs contributions techniques et intellectuelles au développement de ces méthodes à travers les années: Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis cellulaire des sciences et de la recherche PTI) , Brian Gray (PTI recherche), Jan Fisher (Dartmouth Medical School), Alice Givan (Dartmouth Medical School), Betsy Ohlsson-Wilhelm (SciGro, Inc), et Mary Waugh (Dartmouth Medical School). Ils aimeraient également remercier la classe de 2006 Bowdoin des cours annuels dans les méthodes de recherche et les applications de la cytométrie en flux, qui ont généré les données présentées dans la figure 2.
La cytométrie en flux a été réalisée au Laboratoire de Roswell Park Cancer Institute de cytométrie en flux, qui a été créé en partie par des subventions d'équipement du programme NIH Instrument partagée, et reçoit le soutien de la Subvention de base (5 P30 CA016056-29) du NationalInstitut du cancer à l'Institut Roswell Park Cancer, et à la cytométrie en flux Abramson Cancer Center et Laboratoire de ressources tri cellulaire de l'Université de Pennsylvanie, qui a été créé en partie par des subventions d'équipement du programme NIH Instrument partagée, et reçoit le soutien du NIH # 2P30 CA016520 du National Cancer Institute. Le travail le montrent les figures 3 et 5 a également été soutenu en partie par subvention SBIR EB00228 de la National Institutes of imagerie biomédicale et de bio-ingénierie (NIBIB) attribué à PTI Research, Inc
matériels
telle que déterminée par titrage laboratoire
| Name | Company | Catalog Number | Comments |
| Réactif ou de l'équipement | Entreprise | Numéro de catalogue | Commentaires |
| Acheté dans le commerce | |||
| 7-aminoactinomycine D | Sigma-Aldrich | A9400 | |
| Albumine de sérum bovin (BSA) | Sigma-Aldrich | A4503 | |
| Sérum fœtal bovin (FBS) | Atlanta Biologicals | S11150 | |
| Solution saline équilibrée de Hanks (HBSS) | Life Technologies | 14175-079 | Le calcium et le magnésium libre, sans rouge de phénol |
| IgG humaine fraction de Cohn II et III globulines | Sigma-Aldrich | G-4386 | |
| Anticorps de souris anti-CD3-FITC humain | BD Biosciences | 349201 | Concentration saturante déterminée par titrage laboratoire |
| Souris anti-humain CD4-APC | BD Biosciences | 340672 | Concentration saturante déterminée par titrage laboratoire |
| Souris anti-humain CD4-PECy7 | BD Biosciences | 348799 | Concentration saturante déterminée par titrage laboratoire |
| Souris anti-humain CD8-FITC | BD Biosciences | 347313 | Concentration saturante déterminée par titrage laboratoire |
| Souris anti-humain CD8-APC | Caltag (Life Technologies) | MHCD0805 | Concentration saturante déterminée par titrage laboratoire |
| Souris anti-CD19 humain-APC | Caltag (Life Technologies) | MHCD1905 | |
| Souris anti-humain CD25-APC | BD Biosciences | 340938 | Concentration saturante déterminée par titrage laboratoire |
| Souris anti-humain CD127-PE | BD Biosciences | 557938 | Concentration saturante déterminée par titrage laboratoire |
| Anticorps de souris anti-CD3 humain | eBiosciences | 16-0037-85 | 1,0 mg / ml; azide libre |
| Souris anti-CD28 humain | eBiosciences | 16-0289-85 | 1,0 mg / ml; azide libre |
| PBS | Gibco | 21300-058 | |
| PKH26 rouge fluorescente kit de liaison cellulaire contenant 10-3M PKH26 dans EtOH et le Diluant C | Sigma-Aldrich | PKH26GL-1KT ou MINI26-1KT | Procédures à l'étape 1 s'appliquent égalementdes kits contenant PKH67 ou des colorants CellVue autres |
| CellVue Claret rouge lointain kit fluorescente linker cellule contenant 10-3M Claret CellVue dans EtOH et le Diluant C | Sigma-Aldrich | MINCLARET-1KT ou MIDCLARET-1KT | |
| 5 - (et-6)-carboxyfluorescéine diacétate, ester de succinimidyle (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | Non fluorescent, clivés par des estérases membrane pour former amino-réactif fluorescent carboxyfluorescéine succinimidyl ester (CFSE) |
| LIVE / DEAD Violet Fixable | Invitrogen (Life Technologies) | L34955 | |
| Stérile 12 x 75 mm conique des tubes en polypropylène et casquettes | VWR | 60818-102 | Donne une meilleure efficacité coloration de la membrane colorant (colorant réduit l'adsorption, la perte de cellules moins pendant l'aspiration surnageant) |
| 12 x 75 mm rounfond d des tubes de polystyrène | Becton Dickinson | 21008-936 | |
| Cytomètre en flux | BD Bioscience | FACSCalibur LSRFortessa | Toute cytomètre en mesure de détecter FITC, PKH26, et 7-AAD (ex. 488 nm;. Em 520 nm, 567 nm et 655 nm, respectivement) et APC ex. 633-640 nm; lui. 660 nm) |
| Cytomètre en flux | Beckman Coulter | LSRII CyAn | Toute cytomètre en mesure de détecter FITC, PKH26, et 7-AAD (ex. 488 nm;. Em 520 nm, 567 nm et 655 nm, respectivement) et APC ex. 633-640 nm; lui. 660 nm) |
| Laboratoire Préparé | |||
| 7-aminoactinomycine D, stock concentré | NA | NA | 1 mg / ml dans du PBS. Congeler en portions aliquotes et conserver à -20 ° C. |
| 7-aminoactinomycine D, worroi de stock | NA | NA | 100 pg / ml dans du PBS; préparer quotidienne de 1 mg / ml stock congelé. |
| IgG bloc | NA | NA | HBSS + 10 mg / ml d'IgG humaines fraction de Cohn II et III globulines + 10 mg / ml de BSA. |
Références
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon