Method Article
Optimiert Färbung und Proliferation Modeling-Methoden für die Zellteilung Überwachung mit Cell-Tracking Dyes
In diesem Artikel
Zusammenfassung
Erfolgreicher Einsatz von Zell-Tracking Farbstoffe Immunzellfunktion und Proliferation zu überwachen umfasst mehrere wichtige Schritte. Wir beschreiben Methoden zur: 1) Erhalten hell, einheitliche, reproduzierbare Label-ten mit Membran Farbstoffe; 2) Auswählen Fluorochrome und Datenerfassung Bedingungen, und 3) der Auswahl eines Modells, die Zellproliferation auf Farbstoffdilution zu quantifizieren.
Zusammenfassung
Fluoreszierende Zelle Tracking Farbstoffe in Kombination mit Durchfluss-und Bildzytometrie, sind leistungsfähige Werkzeuge, mit denen die Interaktionen und Schicksale verschiedener Zelltypen in vitro und in vivo zu studieren. 1-5 Obwohl es buchstäblich Tausende von Publikationen mit solchen Farbstoffen, einige die am häufigsten auftretenden Zell-Tracking-Anwendungen sind die Überwachung von:
- Stamm-und Progenitorzellen Ruhe, Proliferation und / oder Differenzierung 6-8
- Antigen-angetriebenen Membrantransfer 9 und / oder Vorläufer Zellproliferation 3,4,10-18 und
- immunregulatorische und Effektor-Zell-Funktion 1,18-21.
Kommerziell erhältliche Zelle Tracking Farbstoffe weisen in Bezug Chemien und Fluoreszenzeigenschaften aber die große Mehrheit fallen in eine von zwei Klassen auf ihren Mechanismus Zellmarkierung basiert. "Membrane Farbstoffe", verkörpert durch PKH26 sind stark lipophile Farbstoffe tHut Partition stabil, aber nicht kovalent in Zellmembranen 1,2,11. "Protein-Farbstoffe", verkörpert durch CFSE, sind Amino-Reaktivfarbstoffen, die stabile kovalente Bindungen mit Zellproteinen 4,16,18. Jede Klasse hat ihre eigenen Vor-und Nachteile. Der Schlüssel zu ihrem erfolgreichen Einsatz, vor allem in multicolor Studien, in denen mehrere Farbstoffe verwendet werden, um verschiedene Zelltypen zu verfolgen, ist es daher, die kritischen Fragen, die optimale Nutzung der einzelnen Klassen 2-4,16,18,24 verstehen.
Die Protokolle, die hier hervorzuheben drei häufigsten Ursachen für schlechte oder variable Ergebnisse bei der Verwendung von Zell-Tracking Farbstoffe. Diese sind:
- Nichtbeachtung helle, gleichmäßige, reproduzierbare Kennzeichnung zu erreichen. Dies ist ein notwendiger Ausgangspunkt für jede Zelle Tracking Studie, sondern erfordert Aufmerksamkeit auf verschiedene Variablen bei der Verwendung von Membran-Farbstoffe als bei Verwendung von Protein-Farbstoffe oder Gleichgewicht Bindungsreagenzien wie Antikörper.
- Suboptimal Fluorochrom Kombinationen and / oder Nichtbeachtung enthalten kritische Entschädigung Kontrollen. Tracking Farbstofffluoreszenz ist in der Regel 10. Februar - 10. März Mal heller als Antikörper-Fluoreszenz. Es ist daher unerlässlich, um sicherzustellen, dass die Anwesenheit von Markierungsfarbstoff beeinträchtigt nicht die Fähigkeit, andere Sonden verwendet erkennen.
- Failure, um eine gute Passform mit Peak-Modellierungs-Software zu erhalten. Solche Software ermöglicht quantitative Vergleich der proliferativen Reaktionen auf verschiedene Populationen oder Reize auf Vorstufe Frequenz oder anderen Metriken. Zur Erzielung eines guten Passform, erfordert jedoch Ausschluss von toten / sterbenden Zellen, die Farbstoffdilution Profile verzerren können und Abstimmung der dem Modell zugrundeliegenden Annahmen mit den Eigenschaften des beobachteten Farbstoffdilution Profil.
Hier genannten Beispiele veranschaulichen, wie diese Größen beeinflussen Ergebnisse bei Verwendung Membran und / oder Protein-Farbstoffe, die Zellproliferation zu überwachen.
Protokoll
Ein. Allgemeine Membrane Markierung mit PKH26 Handy-Tracking Dye (Ref. 25; Abbildung 1)
- Verwenden Sie sterile Technik für Schritte von 1,1 bis 1,9. Planen ~ 10 7 humanen peripheren mononukleären Blutzellen oder Lymphozyten (hPBMC, HPBL) unter Verwendung des Labors Standardmethode unter Zusatz eines endgültigen 300 xg Spin die Thrombozytenfunktion Kontamination zu minimieren. Resuspendieren Zellen bei 10 7 / ml in HBSS +1% BSA und auf Eis stellen, Reservierung eines 500 ul Aliquot (5x10 6 Zellen) für den Einsatz in Schritt 2.
- Ort 5x10 6 Zellen (500 ul) in einem 12 x 75 mm konische Polypropylen-Röhrchen. Waschen Sie einmal mit 3,5 ml HBSS. Vorsichtig den Überstand aspirieren, so dass nicht mehr als 15-25 ul von Restflüssigkeit, aber dabei nicht um Zellen zu entfernen. Dieses Röhrchen eine 2x Zellsuspension in Schritt 1,4 vorzubereiten.
- Während der Zelle Waschen in Schritt 1.2, 0,5 ml Verdünnungspuffer C Kennzeichnung Fahrzeugs (von der PKH26GL kit) zu einem 12 x 75 mm konischen Polypropylen-Röhrchen. Dieses Röhrchen zu prepsind ein 2x PKH26 Lösung in Schritt 1.5.
- 0,5 ml Verdünnungspuffer C Kennzeichnung Fahrzeugs zu der gewaschenen Zellpellet aus Schritt 1.2 und aspirieren und abzugeben 3-4 mal, um eine einzelne Zellsuspension (2x Zellen) erhalten. Vermeiden Sie Blasenbildung und übermäßige Vermischung, die die Lebensfähigkeit der Zellen und Recovery reduzieren kann.
- Unmittelbar nach der Herstellung der 2x Zellsuspension in Schritt 1,4, bereiten Sie einen 2x (4 uM) Farbstofflösung durch Zugabe von 2,0 ul von 1,0 mM PKH26 Farbstoff Lager in Ethanol (aus dem PKH26GL Kit) zur Diluent C Rohr in Schritt 1,3 und Vortex vorbereitet verteilen gleichmäßig.
- Unmittelbar nach der Herstellung der 2x Farbstofflösung in Schritt 1,5, schnell pipettieren 2x Zellsuspension aus Schritt 1.4 in den 2x Farbstofflösung und gleichzeitig absaugen und verzichten 3-4 mal vollständig zerstreuen Zellen in Farbstoff nicht tun sollten:. Hinzuzufügen 1,0 mM Farbstoff direkt an Zellen; gießen 2x Zellen in 2x Farbstoff; oder fügen 2x Zellen Farbstoff 2x unter Vortexen. Da Färbung ist fast augenblicklich, wie Methoden weniger Ertrageinheitliche Intensitäten als die empfohlene Methode (Abbildung 2).
- Nach 1 min, 1,0 ml hitzeinaktiviertes Serum oder HBSS + 5% BSA an Farbstoffaufnahme in die Zellmembranen zu stoppen. Andernfalls ausreichend Protein zu verwenden riskiert die Bildung von Farbstoff-Aggregaten, die mit Zellen können Pellet während der Waschschritte und unbeabsichtigte Kennzeichnung von anderen Zellen in einem Experiment. Wenn Medium mit 10% hitzeinaktiviertem Serum (CM) oder HBSS 1% BSA ist als Stop-Reagenz verwendet werden, durchzuführen Anfärben in einem 15 ml konischen Polypropylen-Röhrchen hinzu und mindestens 5,0 ml Stoppreagenz zur Adsorption aller versichern unincorporated Farbstoff.
- Zentrifugieren Sie die markierten Zellen für 5 min @ ~ 400 x g. Vorsichtig den Überstand aspirieren, ohne Zellen. Waschen des Pellets zweimal mit 4 ml HBSS CM oder 1% BSA, Dispergieren des Pellet gut vor erneuter Zentrifugation. Zur Übertragung von Farbstoff auf Rohrwänden adsorbiert minimieren und Reinigungswirkung, übertragen die Zellen in ein frisches Polypropylenröhrchen nach dem first Resuspension. Hinweis: ausreichend gefärbten Zellen wird eine deutliche rosa Schimmer im Pellet aufweisen.
- Resuspendieren der gewaschenen Zellpellet in 1,0 ml HBSS +1% BSA. Zählen Sie die Zellen, zu bestimmen Erholung der Zellen, und die Lautstärke um eine Endkonzentration von 10 7 / ml geben. Bei sorgfältiger Aspiration, sollte die Erholung der Zellen ≥ 85% betragen. Wenn die Erholung der Zellen <70%, die Ursache ermitteln, bevor Sie fortfahren. Ziehen Sie eine 150 ul Aliquot (1.5x10 6 Zellen) und auf Eis für den Einsatz in Schritt 2.
2. Vorbereitung der Instrumente und Assay-Setup Controls (Tabelle 1)
- Aliquot 50 ul (5x10 5) ungefärbter Zellen aus der Zellsuspension im Schritt 1.1 in jedem von fünf 1,8 ml Eppendorf-Röhrchen gespeichert: 1, 3, 4, 5 und 7. Aliquot 50 ul (5x10 5) des PKH26 pos Zellen aus Schritt 1.9 in jede der drei Röhren: 2, 6 und 8.
- Fügen Sie 10 ul IgG-Block (100 ug / Rohr IgG; siehe Tabelle der Reagenzien), um Tubes 1-8und 10 min bei Raumtemperatur (20-25 ° C) inkubiert.
- Hinzufügen eines sättigenden Menge des Antikörpers (e) in Tabelle 1 bis Rohre 4, 5, 7 gezeigt, und 8 und inkubieren alle Proben (Tubes 1-8) 30 min lang bei Umgebungstemperatur und vor Licht geschützt.
- 1,5 ml HBSS 1% BSA auf allen Proben, Pellet die Zellen durch Zentrifugation (5 Min. bei 400 × g) und wäscht einmal mit 1,5 ml HBSS 1% BSA, bei sorgfältiger Aspiration zu vermeiden Zellverlust.
- Resuspendieren jede Probe in 500 ul HBSS +1% BSA. Wenn für Proben auf Ihrem Durchflusszytometer analysiert werden benötigt, um ein 12 x 75 mm Rundbodengefäß übertragen. Fügen Sie 10 ul von 100 ug / ml 7-AAD täglichen Arbeitszeit Lager (siehe Tabelle der Reagenzien), um Rohre 3, 6, 7 und 8, wie in Tabelle 1 angegeben. Inkubieren auf Eis für 30 min vor der im Durchflußzytometer setup und Färbung Überprüfung (Schritt 3) zu verwenden.
3. Durchflusszytometer Setup und Färbung Verification
- Stellen Sie sicher, dass der Fluss cytometer einwandfrei funktioniert, mit der Labor etablierten Verfahren für die tägliche Qualitätskontrolle. Überprüfen, dass Signale, kann ohne weiteres in jedem spektralen Fenster verwendet werden detektiert werden, und daß Detektorreaktionen linear proportional zur Intensität in dem Fenster für die Proliferation Überwachung 14 verwendet werden signalisieren.
- Erwerben FSC vs SSC Daten für Rohr 1 mittels linearer Anzeige Waage. Passen eines jeden Detektors, so dass die Amplifikation Lymphozytenpopulation in dem unteren linken Quadranten des Dot-Plot fällt, ist nicht außerhalb des Messbereichs in beiden Parameter, und wird nicht unterbrochen durch Schwellenwertbildung. Sammle ungated FSC vs SSC Daten für alle Proben in den Schritten von 3,3 bis 3,7.
- Erfassung von Daten für Rohr 1 mit keine Farbe Entschädigung und logarithmische Darstellung Skalen für alle 4 Fluoreszenzdetektoren. Stellen Sie die einzelnen Detektors Hochspannung (HV), um die Autofluoreszenz von ungefärbten Lymphozyten auf der Skala stellen mit wenigen / keine Zellen, der sich in den ersten Kanal. Stellen Sie eine Analyse Grenze für jedes Histogrammentsprechend dem hellsten 2% ungefärbter Zellen.
- Mit keine Farbe Entschädigungen und der HV-Einstellungen in den Schritten 3,2 und 3,3 festgelegt, erwerben Daten für Tube 2, Sammeln FSC, SSC und Signale in allen 4 Fluoreszenz-Detektoren. Für den Detektor verwendet, um PKH26 Fluoreszenz zu überwachen, ob alle PKH26 pos Zellen auf der Skala erscheinen als einem einzigen symmetrischen Peak in der 3 rd -4 th Jahrzehnt mit wenigen / ohne Zellen in der letzten Kanal. Wenn es mehrere Gipfel sind oder Peakform schief ist, wiederholen Sie Schritt 1 mit besonderer Aufmerksamkeit zur Minimierung und Mischtechnik (Abbildung 2) salzen. Falls erforderlich, Farbstoffkonzentration.
- Mit Einstellungen in Step 3,3 etablierten erwerben Daten für Tube 3, Sammeln FSC, SSC und Signale in allen 4 Fluoreszenz-Detektoren. Für den Detektor verwendet, um 7-AAD-Fluoreszenz zu überwachen, zu überprüfen, ob 7-AAD pos Zellen oberhalb der 2%-Grenze in Schritt 3,3 festgelegt (dh die nicht-lebensfähigen Zellen gut gelöst werden fallenvon lebensfähigen 7-AAD neg Zellen).
- Mit Einstellungen in Step 3,3 etablierten erwerben Daten für Rohr 4, das Sammeln FSC, SSC und Signale in allen 4 Fluoreszenz-Detektoren. Überprüfen Sie, dass CD8 pos Zellen gut aus ungefärbten Zellen (dh, fall über der 2%-Grenze in Schritt 3,3 für die FITC-Detektor aufgebaut) gelöst. Wiederholen Sie mit Tube 5 und sicherstellen, dass CD8 pos Zellen gut aus ungefärbten Zellen (dh Herbst über der 2%-Grenze in Schritt 3,3 für die APC-Detektor aufgebaut) gelöst.
- Mit Einstellungen in Step 3,3 etablierten erwerben Daten für Rohre 6, 7 und 8, Sammeln FSC, SSC und Signale in allen 4 Fluoreszenz-Detektoren.
- Verwenden Sie die List-Modus Dateien für Tubes 1-5 und Ihre Farbkompensation Software, um eine Farbe zu etablieren überschneiden Matrix für jedes Fluorochrom in den Detektoren eingesetzt, um die drei anderen Fluorochromen Überwachung gesammelt. Wenden Sie diese Matrix List-Mode-Datei für die Probe 6 und sicherstellen, dass die Anwesenheit von PKH26 labeling verändert nicht die Fähigkeit, 7-AAD pos Zellen nachzuweisen.
- Übernehmen die Farbe überlagern Matrix aus Schritt 3,8 bis List-Mode-Datei für die Probe 7 und sicherstellen, dass: a) 3 gut gelöst Subpopulationen (CD3 neg CD4 neg, CD3 pos CD4 neg und CD3 pos CD4 pos) auf einem FITC vs identifiziert werden können APC Dot-Plot, und b) die Anwesenheit von anti-CD3-FITC und anti-CD4-APC verändert nicht die Fähigkeit, 7-AAD pos Zellen nachzuweisen. Wenn das Vorhandensein von Anti-CD3-FITC verändert die oberen 2%-Grenze für Daten auf dem PKH26 Detektor erfasst, stellen die Grenze nach Bedarf.
- Übernehmen Sie die Farbüberlappung Matrix aus Schritt 3,8 bis List-Mode-Datei für Probe 8. Wenn das Vorhandensein von PKH26 Kennzeichnung ändert sich die 2%-Grenze für das FITC, 7-AAD oder APC Detektoren von den Set mit der Autofluoreszenz-Steuerung in Schritt 3,3, stellen die Grenze (n) nach Bedarf mit Rohr 7 der Tabelle 1 und sicherzustellen, dass es ist dennoch möglich, distinguish CD3 pos CD4 pos, CD3 pos CD4 neg und CD3 neg CD4 neg Zellen unter Verwendung des eingestellten Grenze (n).
4. Proliferation Modellauswahl für die Zellteilung Überwachung von Dye Dilution
- Bestimmen Sie den Abstand zwischen den Generationen, die abhängig von der Anzahl der Kanäle und logarithmische Jahrzehnten auf Ihrem Zytometer ist. Für digitale Instrumente, wird dieser Wert, typischerweise 4 oder 5 Jahrzehnten durch die Anzahl der Behälter in dem digitalen Signalprozessor bestimmt. Bei analogen Instrumenten, wo die Zahl der Jahrzehnte selten ist eine ganze Zahl, erfordert eine genaue Modellierung die genaue Anzahl der Jahrzehnte experimentell bestimmt werden. Um dies zu tun, werden die Daten aus einer Mischung von kalibrierten fluoreszierenden Kügelchen in die herstellerspezifische zugeordneten relativen Intensitäten bei denselben Detektor Hochspannungs-Einstellungen in dem Experiment verwendet erworben. Die Position der Peaks Wulst direkt für die Kalibrierung der logarithmischen Skala in Bezug auf intichte Bereich pro log Jahrzehnt. Konkret wird dies durch Auftragen der Kanalnummer für jedes Kügelchen Typs gegen den log des herstellerspezifischen zugewiesenen Wert durchgeführt. Die Steigung einer Best-Fit-Geraden für den Wulst Datenwerte gibt die Anzahl der relativen Intensität pro Kanal. Multipliziert mit der Anzahl der Kanäle, wird dieser Wert dann die Anzahl von Log Jahrzehnten für die volle Skala, von dem die Anzahl von Kanälen, die einem Zwei-fache Abnahme der Intensität (dh Tochtergeneration Abstand) 14 berechnet werden kann.
- Entscheiden für einen festen Abstand zwischen den Generationen verwenden, bzw. dass der Abstand zu schweben. A Standard (fest) Einstellung verwenden, den Generationswechsel Abstandswert in Schritt 4,5 ermittelt, um die Position einer jeden Generation zuzuordnen und wird normalerweise verwendet, wenn das Histogramm fehlt deutliche Spitzen. Ein Float Einstellung erlaubt es jedem Generationswechsel Spitzenposition durch das Histogramm Form bestimmt werden und wird normalerweise verwendet, wenn distinguishable Generationswechsel Gipfel sind evident.
- Entscheiden Sie, ob eine feste Peakbreite für alle Generationen oder einer schwimmenden Breite zu verwenden. Ein fester Breite verwendet die SD berechnet für den unstimulierten Kontrollprobe alle Generationen modellieren und wird in der Regel dann gewählt, wenn die Probe fehlt unterscheidbare Generationswechsel Gipfel. Eine schwimmende Breite erlaubt das Programm unabhängig voneinander variieren die SD für jede Generation und wird am besten mit unterscheidbaren Generationswechsel Peaks verwendet.
- Führen Sie ein Programm mit einer Verbreitung Analyse-Modul (hier ModFit LT Version 3.3). Legen Sie die stimulierte PKH26 pos-Datei aus den Daten zu analysierenden (zB ein stimuliert 96 Stunden-Kultur PKH26 pos Zellen gegengefärbt für Rohr 8 in Tabelle 1).
- Wählen Sie die Parameter für die Analyse, in diesem Fall PKH26 (585/42) gated auf lebensfähigen (7-AAD neg) CD3 pos Lymphozyten und FSC vs SSC kleine Schutt und großen Aggregaten (Abbildung 3) auszuschließen. Bei der Festlegungdiese Regionen vorsichtig sein, um den hohen Vorwärtsstreuung Gebiet, wo Blasten typischerweise gefunden werden, gehören und beachten Sie, dass CD3 Expression kann down-moduliert stimulierten Kulturen.
- Erstellen Sie eine neue Verbreitung Modell mit der Proliferation Wizard. Mit dem Open Data File (Registerkarte Start), laden Sie die unstimulierten PKH26 pos Control-Datei und den Speicherort der Spitze Kanal in der elterlichen Verteilung entsprechend ungeteilten Zellen.
- Analysieren Sie die Datei für den unstimulierten PKH26 pos Kontrolle, unter Hinweis auf die Werte für die elterliche Spitzenposition und Breite (Standardabweichung). Wenn eine feste Peakbreite (SD) gewünscht wird, überprüfen Sie sperren SD.
- Legen Sie die PKH26 neg Kontrolle (z. B. eine 96 Stunden-Kultur PKH26 neg Zellen gegengefärbt für Rohr 7 in Tabelle 1). Anpassen der Anzahl der Generationen, indem die Peak-Kanal für den dunkelsten Generation über dem PKH26 neg. Kontrolle. Dies bestimmt die number der Tochter Generationen das Modell exakt passen und ist typischerweise 6-9 Generationen.
- Öffnen Sie die Datei für die stimulierte Probe (zB eine stimulierte 96 Stunden-Kultur PKH26 pos Zellen gegengefärbt für Rohr 8 in Tabelle 1) und bestätigen, dass die Regionen für die elterliche Spitzenposition und des SD, wie in Schritt 4,7 festgelegt sind, unverändert bleiben. Wenn feste Generationen Abstand gewünscht wird, wählen Sie Standard-Modell Option, ansonsten wählen Sie die Option Frei.
- Analysieren Sie jede experimentelle Datei im Datensatz, mit dem gleichen Modell in Schritt 4,9 definiert. Kleinere Anpassungen der elterlichen Spitzenposition kann, um die besten fit notwendigen definiert sowohl visuell als auch durch die reduzierte Chi-Quadrat (RCS)-Wert.
- Notieren Sie die gewünschte Verbreitung Metriken aus dem Best-Fit für jeden experimentellen Datei im Datensatz. Für eine umfassende Beschreibung der möglichen Kennzahlen siehe Ref. 22.
Ergebnisse
Membrane Farbstoffe wie PKH26 durch nahezu sofortige Aufteilung Flecken in Zellmembranen anstatt durch chemische Reaktion (CFSE) oder Gleichgewichts-Bindung (für Antikörper). Mangelnde Aufmerksamkeit auf die kritischen Fragen in Abbildung 1 dargestellt kann bei schwachem oder heterogene Färbung der in Abbildung 2 dargestellt führen. Im Gegensatz dazu optimierte Kennzeichnung Bedingungen zu nutzen (Abbildung 1, Tabelle 2) Ergebnisse in hellen homogenen Verteilungen geeignet für eine Vielzahl von Zell-Tracking-Anwendungen einschließlich der Zellteilung Überwachung auf Farbstoffdilution (Abbildung 3). Dead / absterbenden Zellen verlieren unterschiedliche Mengen von Tracking-Farbstoff, der zu erweitern und / oder neigen Tochter Generation Intensitäten und erschweren Verbreitung Modellierung auf Farbstoffdilution 3,4,16,18 basiert. Verwendung eines Lebensfähigkeit Farbstoff wird daher empfohlen, bei der Erhebung Farbstoffdilution Daten unter Bedingungen, bei denen eine erhebliche Zahl von toten Zellen vorbehandelt werden kanngesendet, wie stimulierten Kulturen (Figur 3) oder ältere Proben (Abb. 4).
Weil Tracking Farbstoff Kennzeichnung gibt typischerweise Fluoreszenzintensitäten mehrere Größenordnungen größer als Immunphänotypisierung, ist es wichtig, geeignete Kompensation Kontrollen (Tabelle 1) aufzunehmen und zu überprüfen, dass die Anwesenheit von Tracking Farbstoff nicht beeinträchtigen Fähigkeit, Antikörper positiven und negativen Zellen (beheben 4). Um die Notwendigkeit für übermäßige Farbkompensation vermeiden, ist es vorzuziehen, einen hellen Fluorochrom, oder nicht vorhanden auf Zellen von Interesse, wie ein Farbstoff von lebenden Zellen ausgeschlossen sind, in der spektralen Kanal (die) an der Tracking-Farbstoff platzieren (Abbildung 4A & B vs. 4C & D). Bei Verwendung Peak Modellierungssoftware um Ausmaß der Proliferation zu quantifizieren, um eine gute Passform erfordert übereinstimmenden Annahmen, die im Modell der Eigenschaften des Farbstoffes Verdünnung profiles analysiert (Abbildung 5 und Tabelle 3). Bei entsprechender Auswahl der Farbstoffe und Tracking Lebensfähigkeit Reagenzien, ist es auch möglich, proliferativen Reaktionen in mehreren Lymphozytensubpopulationen gleichzeitig zu charakterisieren. Zum Beispiel, wie in 6 dargestellt, vereinfacht Zugabe eines zweiten Markierungsfarbstoff Diskriminierung zwischen regulatorischen T-Zellen (markiert mit CellVue Claret) und stark proliferierten Effektor-T-Zellen (markiert mit CFSE) und bietet viel ausführlicher über ihre Interaktionen als dies erhalten werden mit 3 H-Thymidin Etikettierung 18,27.
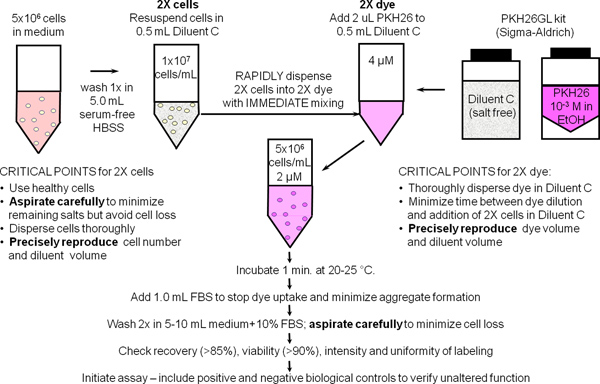
Abbildung 1. Allgemeine Membran Kennzeichnung Protokoll für PKH26, PKH67 und CellVue Farbstoffe. Partitionierung dieser hoch lipophile Farbstoffe in die Zelle membranes erfolgt im wesentlichen sofort nach dem Mischen mit Zellen, wenn Färbung erfolgt in der salzfreien Diluent C Fahrzeug zur Farbstofflöslichkeit und Färbung Effizienz zu maximieren. Wie in dieser schematischen für allgemeine Membran Kennzeichnung zusammengefaßt mit PKH26, ist hell, gleichmäßige und reproduzierbare Färbung daher am einfachsten erhalten: 1) Minimieren der Mengen an Protein und / oder Salze, die in den Färbeschritt und 2) unter Verwendung eines Misch-Technik, stellt sicher rasche homogene Verteilung von Zellen in Farbstoff (dh gleichzeitig macht alle Zellen auf die gleiche Konzentration an Farbstoff).
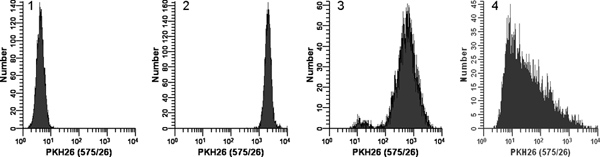
Abbildung 2. Wirkung der Färbung Bedingungen PKH26 Fluoreszenz-Distributionen (aus Lit. 18).. Parallelproben von logarithmisch wachsenden, kultiviert UFür 3 min bei Umgebungstemperatur mit oder ohne sofortige Vermischung auf Zusatz von 2x Zellen Farbstoff 2x -: 937 Zellen wurden mit PKH26 (15 uM PKH26 1 x 10 7 Zellen / ml, 12 Endkonzentrationen) angefärbt. Nach dem Waschen wurden gefärbten Zellen auf einem Beckman Coulter CyAn Durchflusszytometer mit konstanter Geräteeinstellungen analysiert Histogramm 1:. Ungefärbte Kontrolle mit PKH26 Detektorspannung eingestellt, um alle Zellen auf der Skala in der ersten Dekade stellen mit wenigen / keine Zellen, der sich in den ersten Kanal. Histogramm 2: Färbung bei 15 uM Farbstoff durch Addition von 2x Zellen Farbstoff mit sofortiger Mischen 2x ergab eine helle, homogen gefärbten, symmetrische Population von Zellen in der vierten Dekade platziert, wobei wenige / keine Zellen der sich in den letzten Kanal (= gMFI . 2548, GCV = 26,2%) Histogramm 3: Färbung bei 15 uM Farbstoff mittels Zugabe von Zellen 2x 2x Farbstoff aber ohne unmittelbare Durchmischung zu einer verminderten Intensität und eine breitere CV (gMFI = 505 , GCV = 116%) sowie eine dunkel gefärbte Subpopulation, möglicherweise aufgrund eines Abfalls der Zellen auf der Wand des Rohres statt in die 2x Farbstofflösung verzichtet Histogramm 4:. Eine Färbung Fehler führte zu 3 ul konzentrierter Farbstoff ethanolischer Lager direkt an Zellen in Diluent C ohne weiteres Mischen anstatt verwendet, um eine Farbstofflösung in 2x Diluent C. Diese in einem abschließenden Farbstoffkonzentration von 12 uM Folge vorzubereiten 2x zugegeben sondern gab extrem schwach und heterogene Färbung (gMFI = 32,9, GCV = 1020%). Die beobachtete richtigen Skew wahrscheinlich die kombinierten Effekte von widerspiegelt: i) schlechte Vermischung aufgrund weit auseinander Zelle und Farbstoff Bände, und ii) die Tatsache, dass die Zellen am nächsten an den Farbstoff Entnahmestelle zu einer höheren Konzentration des Farbstoffs wären als diejenigen weiter ausgesetzt werden entfernt. Klicken Sie hier für eine größere Abbildung zu sehen .
re 3 "src =" / files/ftp_upload/4287/4287fig3.jpg "fo: content-width =" 4.5in "fo: src =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
Abbildung 3. Verwendung einer Sonde Lebensfähigkeit vereinfacht Gating der T-Zellproliferation Profilen hPBMC mit PKH26 (Endzellkonzentration: 3x10 7 / ml; endgültige Farbstoffkonzentration: 10 uM) markiert wurden.. Nach der Kultur für 96 Stunden in Gegenwart (stimuliert) oder Abwesenheit (unstimulierten) von Anti-CD3 und IL-2 wurden die Zellen mit anti-CD3-FITC, anti-CD19-APC und 7-AAD gegengefärbt und wurden für ein analysiert FACSCalibur Durchflusszytometer (siehe Referenz 13 für Details). Farbkompensation wurde zum Zeitpunkt der Datenerfassung mit festverdrahteten Kompensationsschaltungsanordnung durchgeführt. Das Ausmaß der Proliferation wurde modelliert, wie in Schritt 4 beschrieben mit der Proliferation Assistenten in ModFit LT3.3. Daten aus dem PKH26 neg Kontrolle (Tabelle 1, Tube 7) werden als Referenz (grau ausgefüllt Histogramme in Spalte 3) überlagert. Bewohnbarkeit für unstimulierten und stiformulierten Kulturen waren 76% und 62% (ungated Daten für Felder A und B, jeweils). Systemsteuerung A. PKH26 gefärbten Zellen für 96 h in Medium kultiviert wurden gated um lebensfähige (7-AAD neg) CD3 pos Zellen (R1) umfassen. Zusätzlich zu dem Antikörper Eingliederung und 7-AAD toten Zellausschlussschicht Gate, einer Vorwärtsstreuung (FSC) versus Seitenstreuung (SSC) Gate (R2) wurde verwendet, um Debris und Aggregate auszuschließen. Beachten Sie das Fehlen von toten Zellen in der letzten Grundstück in diesem Panel. Die beste Anpassung Modell für die Proliferation PKH26 Profil (Spalte 3) ergab einen einzigen Peak mit RCS = 2,1 (Donor 6, Tabelle 3), was auf eine gute Symmetrie, und wurde verwendet, um die Position zu definieren elterlichen und Starten Peakbreite zur Analyse des stimulierten Probe aus diesem Datensatz (Panel B). Feld B. Ein Replikat Aliquot PKH26 gefärbten Zellen wurde mit Anti-CD3 und IL-2 für 96 Std. und gated in gleicher Weise kultiviert wie im Feld A. ein Modell mit schwimmenden Peakposition und variabel Peakbreite gab die beste Anpassung für diese Daten mit RCS = 1,3 (Donor 6, Tabelle 3). Systemsteuerung C. Das gleiche Datendatei wie in Tafel A ohne Verwendung von 7-AAD-Daten analysiert. Wenn ein primärer FSC vs SSC wurde verwendet, um teilweise auszuschließen toten Zellen und Zuschlagstoffen (R2) und einen sekundären Gate mit CD3 positive Ereignisse (R3) auszuwählen, blieb ein kleiner Rest-Population von toten Zellen (0,2% Gated Ereignisse). Die beste Anpassung Modell ergab eine einzelne Spitze mit RCS = 2,2. Systemsteuerung D. Das gleiche Datendatei als in Panel B gated war wie in Panel C Beachten Sie die größere restliche Bevölkerung von toten Zellen im stimulierten Probe (1,29% der gated events) für dieses Gating Strategie. Die beste Anpassung Modell war ein mit schwimmenden Spitzenposition und variabel Peakbreite (RCS = 1,3). Klicken Sie hier für eine größere Abbildung zu sehen .
ig4.jpg "fo: content-width =" 5in "fo: src =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
Abbildung 4. Wirkung von Fluorochrom Wahl und Farbstoffkonzentration auf die Fähigkeit zur Immunphänotyp Lymphozyten mit PKH26 beschriftet. HPBMC wurden aus 24-Stunden altes Blut isoliert und mit PKH26 wie in Schritt 1 beschrieben, mit der Ausnahme, dass Färbung erfolgte in 12 x 75 mm mit rundem Boden durchgeführt Polystyrolröhrchen anstatt 12 x 75 mm konische Polypropylen-Röhrchen. Unmittelbar nach der Markierung mit PKH26 wurden die Zellen mit den angegebenen immunphänotypische und Lebensfähigkeit Reagenzien gegengefärbt und analysiert auf einem LSRFortessa Durchflusszytometer unter Verwendung der Strategie der Gating 3A und die folgende optische Konfiguration: 488 nm-Laser: FSC-A (488 nm); SSC -A (488/10 BP), FITC-A (530/30 BP); PKH26-A (575/26 BP); 7-AAD-A oder PerCP-A (695/40 BP). 640-nm-Laser: APC-A oder TOPRO-3-A (670/14 BP). Farbkompensation wurde zum Zeitpunkt der Datenerfassung mittels BD DiVa Software durchgeführt. "Auto"zeigt Autofluoreszenz des no-Antikörper Kontrolle im relevanten spektralen Fenster (APC für Platten A und B, PerCP für Panels C und D). Daten aus dem PKH26 neg Kontrolle (Tabelle 1, Tube 7) werden als Referenz (grau ausgefüllt Histogramme, Spalte 5) überlagert. Post-Färbung Bewohnbarkeit waren ähnlich für alle Proben (88-92%). Feld A. Zellen mit PKH26 in einer Endkonzentration von 2 uM markiert wurden gegengefärbt Verwendung von anti-CD3-FITC, anti-CD4-APC, und 7-AAD ( Rohr 8 von Tabelle 3). Nach Gating auf lebensfähigen (7-AAD neg) CD3 pos Lymphozyten (Spalte 1) und den Ausschluss von Schutt und Aggregate auf FSC und SSC (siehe 3A) basiert, wurde PKH26 Intensität in Kombination mit APC CD4 (Spalten 2 und 3) ausgewertet. Ob unkompensierte (Spalte 2) oder kompensiert (Spalte 3), führte dies Fluorochrom Kombination in guter Auflösung zwischen CD4 pos T-Zellen und CD4 neg T-Zellen), als beide von einem no-a überprüftntibody, autofluoreszierenden Kontrolle (Tube 6 der Tabelle 1; Spalte 4) und die zweifarbige Darstellung der CD3 vs. CD4 (Spalte 6). Tafel B. Unter Verwendung des gleichen Fluorochrom-Kombination nach Panel A, aber die Erhöhung der endgültigen Konzentration PKH26 bis 4 uM beeinträchtigte nicht die Fähigkeit, CD4 T-Zellen aus pos CD4 T-Zellen neg. lösen. Systemsteuerung C. Replikat Aliquot von Zellen unabhängig mit PKH26 in einer Endkonzentration von 2 uM markiert war gegengefärbt Verwendung von Anti-CD3-FITC, anti-CD4-PerCP und TOPRO-3. Nach Gating auf lebensfähigen (TOPRO-3 neg) CD3 pos Lymphozyten (Spalte 1) und den Ausschluss von Schutt und Aggregate auf FSC und SSC (siehe 3A) basiert, wurde PKH26 Intensität in Kombination mit anti-CD4-PerCP (Spalten 2 und ausgewertet 3). Substanzieller spektraler Überlappung PKH26 in die PerCP-Kanal zeigt sich in den unkompensierten Daten (Spalte 2), Auflösung zwischen PKH26 pos CD4 pos und PKH26 pos CD4 neg Veranstaltungen ist marginal nach Kompensation angewendet wird (vgl. Spalte 3 mit dem no-Antikörper, autofluoreszierenden Kontrolle in Spalte 4 dargestellt). Systemsteuerung D. Wenn PKH26 Konzentration auf 4 uM erhöht wird, ist es nicht mehr möglich die Kombination von Fluorochrom Systemsteuerung C Spektrale Überlappung von PKH26 in die PerCP-Kanal verwenden übersteigt die Intensität des Signals von CD4 (Spalte 2) und CD4 pos PKH26 pos Ereignisse nicht mehr von CD4 gelöst werden neg. PKH26 pos T-Zellen (Spalte 3 vs. Spalte 4). Klicken Sie hier für eine größere Abbildung zu sehen .
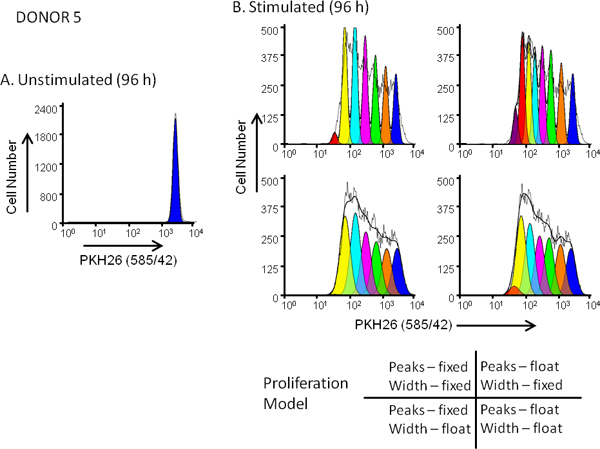
Abbildung 5. Effect der Proliferation Modell Auswahl auf. goodness of fit für Farbstoffdilution Profile hPBMC wurden mit PKH26 (:; endgültigen Farbstoffkonzentration 3x10 7 / ml: 10 uM Endzellkonzentration) markiert. Nach der Kultur für 96 Stunden in Gegenwart (stimuliert) oder Abwesenheit (unstimulierten) von Anti-CD3 und IL-2 wurden die Zellen geerntet gegengefärbt mit anti-CD3-FITC, anti-CD19-APC und 7-AAD und auf einer analysierten FACSCalibur Durchflusszytometer (siehe Referenz 13 für detaillierte Methoden). Farbkompensation wurde zum Zeitpunkt der Datenerfassung mit festverdrahteten Kompensationsschaltungsanordnung durchgeführt. Panel A. Die PKH26 Intensitätsprofils aus einem 96-Stunden-Kultur unstimulierten für abgebende 5, eine moderate Responder war gated wie in 3A gezeigt, und verwendet, um die Proliferation bereitzustellen ModFit Assistenten mit einer ersten Schätzung der Position und Breite für den Peak repräsentieren ungeteilten parentalen Zellen. Tafel B. Die PKH26 Intensitätsprofils aus einem parallelen stimuliert 96 Stunden Kultur wurde unter Verwendung der Ausgangsstoffe SchätzungenPanel A und 4 verschiedene Kombinationen von "Proliferation Wizard 'Einstellungen, entsprechend fest-oder variabel Peakintensitäten und fest-oder variabel Peakbreiten für aufeinanderfolgende Tochter Generationen gezeigt. Wie in Tabelle 3, das Modell, das die beste Anpassung an die beobachteten Daten ergab zusammengefasst (niedrigste reduzierte Chi-Quadrat; RCS) war das "Floating / Floating"-Kombination, in denen nicht nur Peak-Positionen, sondern auch Standardabweichungen der Tochter Generation Peaks wurden zugelassen zu variieren (RCS = 1,5). Das gleiche Modell hat die beste Passform für Donor 6 ist eine hohe Responder (3B und Tabelle 3).
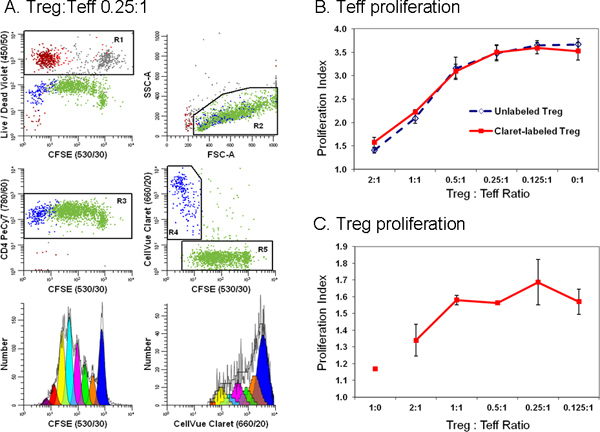
Abbildung 6. Zugabe einer zweiten Zelle Markierungsfarbstoff vereinfacht Diskriminierung zwischen Effektorzellen und regulatorische T-Zellen in einer flusszytometrischen Assay Unterdrückung(Aus Lit. 18). Monozyten-Lymphozyten aus abgereichertem TRIMA Leukapherese Filter hergestellt mit anti-CD127-PE, anti-CD4-PE-Cy7 gefärbt wurden, und Anti-CD25-APC und fließen in Populationen von Effektorzellen (Teff sortiert.; CD4 pos CD127 hellen CD25 dim), regulatorische (Treg; CD4 pos CD127 dim CD25 pos) und Zubehör (CD4 neg) Zellen. Sortiert Treg-Zellen mit CellVue Claret (Endzellkonzentration: 1x10 6 / ml; endgültigen Farbstoffkonzentration: 1 uM) beschriftet und sortiert Teff mit CFSE (Endzellkonzentration: 5 × 10 7 / ml; endgültigen Farbstoffkonzentration, 5 uM) markiert waren in unterschiedlichen Verhältnissen in Gegenwart von Anti-CD3, Anti-CD28 und bestrahlten akzessorischen Zellen co-kultiviert. Nach 96 Stunden wurden die Kulturen geerntet, gegengefärbt mit anti-CD4-PE-Cy7 und LIVE / DEAD Fixierbarer Violet, und analysiert auf einem LSRII Durchflusszytometer und Farbkompensation wurde zum Zeitpunkt von Daten durchgeführt AKQUISITIOn mit BD DiVa Software (siehe Referenz 18 für Einzelheiten einschließlich der Vergütung Kontrollen). Die Proliferation Indizes für Teff und Treg wurden modelliert, wie in Schritt 4 beschrieben, mit der Proliferation Assistenten in ModFit LT3.3. Datenpunkte in Abbildung B und C stellen den Mittelwert ± 1 Standardabweichung von dreifachen Proben Feld A. Repräsentative Daten sind für eine von drei Proben bei einer dreifach Treg gezeigt:. Teff Verhältnis von 0,25:1. LIVE / DEAD Fixierbarer Violet Reagenz wurde verwendet, um abgestorbene Zellen (R1, oben links Grundstück; akzessorischen Zellen = rot-braun, lebensfähig Teff = grau und lebensfähig Treg = rot) ausgeschlossen von allen anderen Diagrammen. CellVue Claret Färbung wurde verwendet, um tragfähige Treg (R4, Mitte rechts Grundstück; blau) zu unterscheiden von lebensfähigen, aber sehr vermehrt Teff (R5, Mitte rechts Grundstück; grün). Ein einzelner Parameter CFSE Proliferation Profil Teff (Plot unten links) wurde durch Gating auf Zellen, die CFSE pos (R5), CD4 pos (R3), lebensfähigen (nicht R1) generiert wurden, und hatten Lymphozyten scatter Eigenschaften (R2). Ein einzelner Parameter CellVue Claret Proliferation Profil Treg wurde durch Gating auf Zellen, die CellVue Claret pos (R4), CD4 pos (R3), lebensfähigen (nicht R1) generiert wurden, und hatten Lymphozyten Streueigenschaften (R2). Beachten Sie die großzügige Lymphozytenregion (R2) definiert Lymphozyten Blasten enthalten. Man beachte auch, dass Gesamtanzahl von Zellen gesammelt werden, auf der niedrigsten Frequenz Population von Interesse abhängen. In einer Zellproliferation Experiment, bei dem die Bevölkerung von Interesse über einen weiten Bereich von Intensitäten repräsentieren bis zu sieben oder acht Generationen eine große Anzahl von Zellen verteilt werden können, sollten gesammelt werden, um genau zu modellieren und berechnen die Anzahl der Zellen in jeder Generation werden. Bei der Untersuchung von seltenen Zellen, kann es notwendig sein, einfach das Probenröhrchen fast trocken, um die maximal mögliche Anzahl der Ereignisse zu sammeln. Für die hier gezeigten Beispiel, tun dies führte zu einer insgesamt ~ 25.000 Veranstaltungen, von denen 11.923 waren Teff (Proliferation Index 3,85) und 1380 waren Treg (Proliferationsindex 1,83). Feld B. Wie erwartet, Erhöhung des Anteils der Tregs in Co-Kulturen führte zu größeren Unterdrückung von Teff Zellproliferation. Ähnliche Ergebnisse wurden mit den beiden CellVue Claret gebeiztes (durchgezogene Linie) oder ungefärbt (gestrichelte Linie) Treg erhalten, was anzeigt, dass die Färbung mit dem Farbstoff CellVue Claret Tracking beeinflusste nicht Treg Potenz. Systemsteuerung C Treg sind relativ anergischen und, wie erwartet, tat nicht proliferieren, wenn sie mit Anti-CD3, Anti-CD28, und akzessorischen Zellen in Abwesenheit von Teff Zellen (Treg: Teff Verhältnis von 1:0) inkubiert. Wie jedoch der Anteil der Teff in Co-Kulturen erhöht (dh als Treg: Teff Verhältnis erniedrigt), das Ausmaß der Proliferation Treg ebenfalls erhöht. Die allgemein größer Fehlerbalken für diese Daten zumindest teilweise durch die begrenzte Ausdehnung der Proliferation, was zu einer kleineren Anzahl von Ereignissen gesammelt relativ zu Teff und größer unsicherty bei der Modellierung der Anzahl der Zellen in jeder Generation. Klicken Sie hier für eine größere Abbildung zu sehen .
| Rohrnummer (Zweck) | PKH26 | Antikörper (n) | 7-AAD |
| 1 (Setup, Schadensersatz) | - | - | - |
| 2 (Setup, Kompensation) | + | - | - |
| 3 (Setup, Kompensation) | - | - | + |
| 4 (Kompensation) | - | CD8-FITC b | - |
| 5 (Kompensation) | - | CD8-APC b | - |
| 6 (kein Ab-Steuerung) | + | - | + |
| 7 (keine Tracking-Farbstoff control) | - | CD3-FITC CD4-APC-oder CD19-APC c | + |
| 8 (T0 Kontrolle) | + | CD3-FITC CD4-APC-oder CD19-APC c | + |
. Tabelle 1 Instrument Setup Steuert a a aufgeführten Bedienungsvorgänge sind für eine 4-Farb-CD4 T-Zellproliferation Überwachung Assay mit:. PKH26 (Proliferation Farbstoff), CD3-FITC (pan-T-Zell-Marker), CD4-APC (T-Helfer- Zellmarker), 7-Aminoactinomycin D (7-AAD, tote Zellausschlussschicht) b Brighter Surrogate für CD3-FITC und CD4-APC (bessere Fähigkeit zur Kompensation Fehler zu erkennen) c. Abbildung 3:. CD3-FITC und CD19-APC. d Abbildung 4: CD3-FITC und CD4-APC.
| Zelltyp | Endzellkonzentration | Finale Dye Konzentration </ Strong> | Referenz |
| hPBMC b | 1 x 10 7 / ml | 2 uM PKH67 | 10,17 |
| 5 x 10 6 / ml | 2 uM PKH26 | 12 | |
| 3 x 10 7 / ml | 10 uM PKH26 | 13 | |
| 5 x 10 7 / ml | 30 uM PKH26 | 18 | |
| 1 x 10 6 / ml | 1 uM CellVue Claret c | 18 | |
| 3 x 10 7 / ml | 4 uM CellVue Claret | 13 | |
| 5 x 10 7 / ml | 5 uM CellVue Claret | 18 | |
| Zellen in Kultur | 5 x 10 5 / ml | 0,1 uM PKH26 (1 ° Milchdrüsenzellen) | 8 |
| 1 x 10 7 / ml | 15 uM PKH26 (U937) | 18 | |
| 1 x 10 7 / ml | 12,5 -15 uM PKH26 (U937) | 15 | |
| 1 x 10 7 / ml | 1 uM PKH67 (K562) | 18 | |
| 1 x 10 7 / ml | 1 uM PKH67 (T-Zell-Linien) | 9 | |
| 1 x 10 7 / ml | 10 uM CellVue Claret (YAC-1) | 23 |
Tabelle 2. Nicht-Stören Membran-Dye Färbung Bedingungen a. A Angepasst und aktualisiert Ref. 18. B A niedriger Geschwindigkeit Waschung (300 × g) wurde verwendet, um Blutplättchen Kontamination zu minimieren. C Treg-Zellen (Flow sortiert CD4 pos CD25 pos CD127 neg. Lymphozyten).
| Modell Settings | Model Ergebnisse | ||||||||
| Spender | Behandlung | Peak Position | SD | Parental Position | Parental SD | Anzahl der Peaks Ausgestattet | RCS | PI | PF |
| 5 | Unstimulierten | Schweben | Schweben | 209 | 4,5 | 1 | 5,1 | 1,0 | 0 |
| 5 | Angeregt | Behoben | Behoben | 209 | 4,5 | 7 | 35 | 3,9 | 31 |
| 5 | Angeregt | Schweben | Behoben | 209 | 4,5 | 8 | 19 | 4,3 | 30 |
| 5 | Angeregt | Behoben | Schweben | 209 | 9,2 | 6 | 1,9 | 3,8 | 30 |
| 5 | Angeregt | Schweben | Schweben | 209 | 9,0 | 7 | 1,5 | 3,7 | 29 |
| 6 | Unstimulierten | Schweben | Schweben | 205 | 4,0 | 1 | 2,1 | 1,0 | 0 |
| 6 | Angeregt | Behoben | Behoben | 205 | 4,0 | 6 | 42 | 6,6 | 60 |
| 6 | Angeregt | Schweben | Behoben | 205 | 4,0 | 7 | 12 | 7,4 | 60 |
| 6 | Angeregt | Behoben | Schweben | 205 | 8,6 | 6 | 6,9 | 6,8 | 62 |
| 6 | Angeregt | Schweben | Schweben | 205 | 6,5 | 6 | 1,3 | 6,5 | 59 |
Tabelle 3. Auswirkungen der Proliferation Modell auf Goodness of Fit (RCS) und Proliferation Metrics ein. Ein Sample Färbung, Datenerfassung und Gating wie in 3A & B beschrieben.
Diskussion
Die hier beschriebenen Methoden sind diejenigen in unserer gemeinsamen Labors gefunden, die meisten sicher geben, optimale Ergebnisse für hPBMC Kennzeichnung mit Membran Farbstoffe 13,16,18 und Lymphozyten Untergruppe Phänotypisierung und Proliferation Tracking entweder mit Membran-oder Protein-Farbstoffe 2,11,13,16, 18. Wie in den 1 und 2 dargestellt ist, ist hell einheitliche Kennzeichnung am leichtesten durch Begrenzung des Gehalts physiologische Salze und unter Verwendung eines Misch-Technik erreicht, dass zusätzlich eine schnelle, homogene Belichtung aller Zellen auf die gleiche Konzentration an Farbstoff. Weil Färbung mit Farbstoffen erfolgt Membran durch Partitionieren in die Lipid-Doppelschicht, können andere Variablen, die frei verändern Farbstoffkonzentration auch Auswirkungen Markierungseffizienz. Zum Beispiel die Kennzeichnung mit rundem Boden Polystyrolröhrchen Ergebnisse in weniger effizient Auswaschung von Salzen vor Resuspension in Diluent C und auch in reduzierten freien Farbstoffkonzentration durch Adsorption an Rohrwänden färben, insbesonderebei niedrigeren Farbstoffkonzentrationen. Beide Faktoren tendenziell breitere Färbung Distributionen, als wenn die Kennzeichnung erfolgt mit konischen Boden Polypropylenröhrchen (Abbildungen 3, 4 und geben unveröffentlichte Ergebnisse). Probe Alter und Art kann auch Auswirkungen Peakbreite selbst wenn optimierten Färbeverfahren verwendet werden. Zum Beispiel Lebensläufe PKH26 pos Lymphozyten aus frisch entnommenem Blut reichen von 14-20% (Abbildung 3, Nr. 13 und unveröffentlichte Ergebnisse), während Lebensläufe Lymphozyten von 24 Stunden alten Blutproben oder TRIMA Pherese Filter-Bereich isoliert 25 bis 30 % (Abbildung 4 und Nr. 18).
Färbung Einheitlichkeit und das Ausmaß, in dem sie nicht lebensfähige Zellen von der Analyse ausgeschlossen werden kann sowohl Einfluss darauf, ob unterscheidbare Tochter Gipfel zeigt sich in der Farbstoffdilution Profil, was sich wiederum auf Wahl eines Verbreitung Modell, um die beobachteten Daten (Abbildungen 5 und 6 passen ). Obwohl ModFit (Verity Software House, Topsham, ME) wird hier als ein Beispiel verwendet werden, um Software-Metriken wie Proliferationsindex und Zwischenprodukt Frequenz (Figuren 3, 5 und 6; Tabelle 3) zu erzeugen verwendet, andere Software-Module Pakete enthalten, zu analysieren Proliferation Daten. Dazu gehören FCSExpress (De Novo Software, Los Angeles, CA) und FlowJo (Baum Star, Inc., Ashland, OR). Alle diese Programme verwenden eine nicht-lineare Analyse der kleinsten Quadrate, iterativ zu finden die beste Anpassung an den Rohdaten durch Veränderung der Position, Höhe und SD (oder Breite) der Gauß-Peaks, welche sequentielle Tochter Generationen. Proliferativen Index (PI) und Precursor Frequency (PF) sind die am häufigsten verwendeten Maßnahmen Ausmaß der Proliferation. PI, wie durch ModFit definiert ist, ist ein Maß für die Zunahme der Zellzahl im Verlauf des Assays, analog zu den "Stimulationsindex 'eines Thymidinaufnahme Assay. PF gibt den Anteil der Zellen in der anfänglichen populatIonen, die auf den Stimulus von proliferierenden reagiert. Vorsicht ist geboten, aber beim Lesen der Literatur seit Terminologie variiert etwas zwischen den Software-Paketen (zB FlowJo und ModFit verwenden unterschiedliche Definitionen und Berechnungen für das, was durch die "Proliferation Index" gemeint) 22.
Die kritischen Fragen hier für die Kennzeichnung und die Proliferation Analyse mit Membran Farbstoffe diskutiert werden auch auftreten, wenn unter Verwendung von Protein-Farbstoffe. Zum Beispiel muss sorgfältig auf Mischtechnik auch beobachtet, zusammen mit Ausschluss tot / sterbenden Zellen werden, um eine gleichmäßige Verteilung und unterscheidbar Tochter Peaks erhalten bei Verwendung CFSE (Abbildung 6) 2-4,13,18,24. Geeignete Wahl der Fluorochrome zur Phänotypisierung und Rentabilitätsprüfung ist auch wichtig zu übermäßigen spektrale Überlappung und die Unfähigkeit, Antikörper positiv Zellen erkennen zu vermeiden, insbesondere mit sichtbarem emittierenden Protein Farbstoffe wie CFSE 2-4,11,13,16,18 . Verminderung der Konzentration von Tracking Farbstoff vermindert die Kompensation Probleme in benachbarten spektralen Kanälen, sondern begrenzt auch die Anzahl der Zellteilungen, die überwacht werden können, bevor Tochterzelle Intensitäten mit Autofluoreszenz überschneiden beginnen. Alternativ können Sie auch neuere Zellen Tracking Farbstoffe wie weit rot emittierenden CellVue Claret (Sigma-Aldrich, St. Louis, MO) oder violett emittierenden CellTrace Violet (Life Technologies, Grand Island, NY) kann die Entschädigung Probleme (Abbildung 6) zu reduzieren. Schließlich, obwohl Farbstoffe Membran allgemein geringere Toxizität aufweisen 11,26 neigen, ist es möglich, über-Label-Zellen mit entweder Klasse von Farbstoff. Daher ist es immer notwendig, zu überprüfen, dass die Konzentration von Tracking verwendete Farbstoff wurde nicht die Funktionalität der Zellen verfolgt werden (Abbildung 6) 3,13,16,18 verändert.
Offenlegungen
K. Humphrey, JD Tario, Jr. und PK Wallace haben vorkommerziellen Zelle Tracking Reagenzien für die Auswertung von Life Technologies, Inc. und BD Biosciences erhalten. AD Bantly und JS Moore haben vorkommerziellen Zelle Tracking Reagenzien zur Auswertung erhalten von Life Technologies, Inc. und die Finanzierung von PTI Research, Inc. für die vorkommerzielle Charakterisierung verschiedener CellVue Zelle Tracking Farbstoffe. K. Muirhead wird durch SciGro, Inc., das beratende Dienstleistungen für Phanos Technologies, Inc. (Inhaber des PKH und CellVue Farbstoffe) und bietet Backup technischen Support für Sigma-Aldrich und Molekulares Targeting Technologies, Inc. (beschäftigt Distributoren davon Farbstoffe).
Produktion und den freien Zugang zu diesem Artikel wird von Sigma-Aldrich gesponsert.
Danksagungen
Die Autoren möchte besonders den folgenden Personen für ihre technischen und intellektuellen Beiträge zur Entwicklung dieser Methoden im Laufe der Jahre danken: Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis Cell Science und PTI Research) , Brian Gray (PTI Research), Jan Fisher (Dartmouth Medical School), Alice Givan (Dartmouth Medical School), Betsy Ohlsson-Wilhelm (SciGro, Inc.), und Mary Waugh (Dartmouth Medical School). Sie würden auch gerne die Bowdoin Klasse von 2006 aus den jährlichen Kurse in Forschung Methoden und Anwendungen der Durchflusszytometrie, die die Daten in Abbildung 2 dargestellt generiert danken.
Durchflusszytometrie wurde am Roswell Park Cancer Institute Durchflusszytometrie Laboratory, die zum Teil durch Geräte Zuschüsse aus dem NIH Gemeinsame Instrument Programm wurde durchgeführt, und erhält Unterstützung von der Core-Stipendium (5 P30 CA016056-29) von der NationalCancer Institute der Roswell Park Cancer Institute und an der Abramson Cancer Center Durchflusszytometrie und Zellsortierung Ressource Laboratory der University of Pennsylvania, die zum Teil von Geräten Zuschüsse aus dem NIH Gemeinsame Instrument Program wurde gegründet und erhält Unterstützung von NIH # 2P30 CA016520 vom National Cancer Institute. Die Arbeit in den Abbildungen 3 und 5 gezeigt wurde teilweise auch durch SBIR Zuschuss EB00228 unterstützt von den National Institutes of Biomedical Imaging and Bioengineering (NIBIB) verliehen PTI Research, Inc.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenz oder Ausrüstung | Firma | Katalog-Nummer | Kommentare |
| Im Handel erworben | |||
| 7-D Aminoactinomycin | Sigma-Aldrich | A9400 | |
| Rinderserumalbumin (BSA) | Sigma-Aldrich | A4503 | |
| Fötales Rinderserum (FBS) | Atlanta Biologicals | S11150 | |
| Hanks balanced salt solution (HBSS) | Life Technologies | 14175-079 | Calcium und Magnesium frei, ohne Phenolrot |
| Human IgG Cohn-Fraktion II und III Globuline | Sigma-Aldrich | G-4386 | |
| Maus-Anti-Human-CD3-FITC | BD Biosciences | 349201 | Sättigungskonzentration von Labor-Titration |
| Maus-anti-human-CD4-APC | BD Biosciences | 340672 | Sättigungskonzentration von Labor-Titration |
| Maus-anti-human-CD4-PECy7 | BD Biosciences | 348799 | Sättigungskonzentration von Labor-Titration |
| Maus-anti-humanen CD8-FITC | BD Biosciences | 347313 | Sättigungskonzentration von Labor-Titration |
| Maus-anti-humanen CD8-APC | Caltag (Life Technologies) | MHCD0805 | Sättigungskonzentration von Labor-Titration |
| Maus-Anti-Human-CD19-APC | Caltag (Life Technologies) | MHCD1905 | Sättigungskonzentration von Labor-Titration |
| Maus-Anti-Human-CD25-APC | BD Biosciences | 340938 | Sättigungskonzentration von Labor-Titration |
| Maus-Anti-Human-CD127-PE | BD Biosciences | 557938 | Sättigungskonzentration von Labor-Titration |
| Maus-anti-humanem CD3 | eBiosciences | 16-0037-85 | 1,0 mg / ml; Azid freien |
| Maus anti-human CD28 | eBiosciences | 16-0289-85 | 1,0 mg / ml; Azid freien |
| PBS | Gibco | 21300-058 | |
| PKH26 rot fluoreszierende Zellen Linker Kit mit 10-3M PKH26 in EtOH und Diluent C | Sigma-Aldrich | PKH26GL-1KT oder MINI26-1KT | Verfahren in Schritt 1 gelten auchKits enthalten PKH67 oder andere CellVue Farbstoffe |
| CellVue Claret weit rot fluoreszierende Zellen Linker Kit mit 10-3M CellVue Claret in EtOH und Diluent C | Sigma-Aldrich | MINCLARET-1KT oder MIDCLARET-1KT | |
| 5 - (und-6)-Carboxyfluoresceindiacetat, Succinimidylester (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | Nicht-fluoreszierenden; gespalten durch die Membran Esterasen zu bilden fluoreszierende aminoreaktiven Carboxyfluorescein Succinimidylester (CFSE) |
| LIVE / DEAD Fixierbarer Violet | Invitrogen (Life Technologies) | L34955 | |
| Sterile 12 x 75 mm konische Polypropylenröhrchen & Mützen | VWR | 60818-102 | Eine bessere Membran Farbstoff Färbung Wirkungsgrad (reduzierte Farbstoffadsorption, weniger Zellverlust während Überstand Aspiration) |
| 12 x 75 mm round unten Polystyrolröhrchen | Becton Dickinson | 21008-936 | |
| Durchflusszytometer | BD Bioscience | FACSCalibur LSRFortessa | Jede Zytometer kann FITC, PKH26 und 7-AAD (ex. 488 nm.; Em 520 nm, 567 nm und 655 nm) zu erkennen und APC ex. 633-640 nm; em. 660 nm) |
| Durchflusszytometer | Beckman Coulter | LSRII CyAn | Jede Zytometer kann FITC, PKH26 und 7-AAD (ex. 488 nm.; Em 520 nm, 567 nm und 655 nm) zu erkennen und APC ex. 633-640 nm; em. 660 nm) |
| Labor hergestellt | |||
| 7-Aminoactinomycin D, konzentrierten Lager | NA | NA | 1 mg / ml in PBS. Frieren in Aliquots und bei -20 ° C. |
| 7-Aminoactinomycin D, worKönig Stock | NA | NA | 100 ug / ml in PBS; Vorbereitung von 1 mg / ml gefrorenen Vorrat täglich. |
| IgG-Block | NA | NA | HBSS + 10 mg / ml Human IgG Cohn-Fraktion II und III Globuline + 10 mg / ml BSA. |
Referenzen
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten