Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En electroporación in ovo de base miARN plásmidos en el tubo neural en desarrollo y evaluación de fenotipos por inyección de Dil en los preparativos libro abierto
En este artículo
Resumen
Un método por el cual la expresión de genes en el tubo neural puede ser regulada hacia abajo en un tipo de células específicas, de manera detectable se describe. Demostramos cómo In ovo de base microRNA-plásmidos que provocan interferencia de ARN espaciotemporalmente controlada puede ser usada para investigar guiado de los axones de la comisura en el tubo neural en desarrollo.
Resumen
Comisurales ED1 neuronas han sido ampliamente estudiados para elucidar los mecanismos que subyacen guía de axones durante el desarrollo 1,2. Estas neuronas se localizan en la médula espinal dorsal y envían sus axones a lo largo de trayectorias estereotipados. Axones de la comisura ventral inicialmente proyectar hacia y luego a través de la placa del piso. Después de cruzar la línea media, estos axones hacer un giro brusco rostral y proyecto longitudinalmente hacia el cerebro. Cada uno de estos pasos está regulado por las actividades coordinadas de señales de orientación de atracción y repulsión. La correcta interpretación de estas señales es crucial para la orientación de los axones a lo largo de su ruta demarcada. Por lo tanto, la contribución fisiológica de una molécula particular para guía de axones de la comisura está idealmente investigado en el contexto de la embrión vivo. Por consiguiente, desmontables de genes in vivo deben ser controlados con precisión con el fin de distinguir cuidadosamente las actividades de orientación axón de genes que pueden jugar múltiplesfunciones durante el desarrollo.
Aquí se describe un método para la expresión de gen desmontables en el tubo neural de pollo en un tipo de células específicas, de manera rastreable. Usamos nuevos vectores plasmídicos 3 albergar celulares específicos de tipo promotores / potenciadores que dirigen la expresión de un marcador de la proteína fluorescente, seguido directamente por un transcrito de miR30-RNAi 4 (localizado dentro de la UTR 3 'del ADNc que codifica la proteína fluorescente) ( Figura 1). Cuando electroporación en el tubo neural en desarrollo, estos vectores provocar downregulation eficiente de la expresión génica y expresar proteínas marcadoras fluorescentes brillantes para permitir el rastreo directo de las células que experimentan desmontables 3. Mezclando diferentes vectores de RNAi antes de la electroporación permite la caída simultánea de dos o más genes en regiones independientes de la médula espinal. Esto permite complejas interacciones celulares y moleculares que se examinaron durante el desarrollo, de una manera que es rápida, simple, preciso y barato. En combinación con Dil trazado de trayectorias de axones comisurales en preparaciones de libro abierto 5, este método es una herramienta útil para estudios in vivo de los mecanismos celulares y moleculares de crecimiento de los axones de la comisura y orientación. En principio, cualquier promotor / potenciador se podría utilizar, lo que podría hacer la técnica más ampliamente aplicable para estudios in vivo de la función de genes durante el desarrollo 6.
Este primer video muestra cómo controlar y huevos de ventana, la inyección de los plásmidos de ADN en el tubo neural y el procedimiento de electroporación. Para investigar guía de axones comisurales, la médula espinal se retira del embrión como una preparación a libro abierto, fijado, e inyectados con Dil, para permitir que las vías axonales a ser rastreado. La médula espinal está montado entre cubreobjetos y se visualizaron mediante microscopía confocal.
Protocolo
1. Preparación de ADN plásmido para RNAi silenciamiento génico tipo de células específicas
Plásmidos (Figura 1) se sintetizan usando técnicas de clonación molecular, como se describió anteriormente en detalle 3,4.
1.1 La clonación en los vectores: Diseño oligonucelotide
- Usamos los mismos oligonucleótidos universales y protocolos de clonación que se describen en la información de producto suministrado con el vector pRFPRNAiC 4 (ARK-Genómica).
- Para la clonación en el sitio de primera horquilla:
Cebador 5 'HP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
Cebador 3 'HP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - Para la clonación en el sitio segunda horquilla:
5 'cebador HP2:
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
Cebador 3 'HP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- Para la clonación en el sitio de primera horquilla:
- Utilizamos Buscador Genscript de siRNA Target para seleccionar genes específicos de secuencias diana: https://www.genscript.com/ssl-bin/app/rnai .
- Los cebadores para la clonación de los genes miARN genes específicos en el sitio de primera horquilla:
Un ejemplo para el silenciamiento de GFP se muestra a continuación.
Secuencia diana (22nt): 5'-GGCACAAGCTGGAGTACAACTA
GFP Forward HP1 = 59mer 
GFP Reverse HP1 = 58mer 
Hay secuencias comunes en estos oligos que forman parte de las secuencias de genes miARN acompañamiento (pollo específico), y comunes de loop / madre (secuencias de humano miRNA30). Las secuencias diana específicas de gen están subrayadas. Observe que no hay amIsMatch en la base 5 'de la hebra de avance (se muestra en negrita; G → A en este ejemplo) para imitar el desajuste natural en miRNA30 en esta posición.
- Los cebadores para la clonación de los genes miARN genes específicos en el sitio de horquilla segundos:
Un ejemplo para el silenciamiento LacZ se muestra a continuación.
Secuencia diana (22nt): 5'-CGCGCTGTATCGCTGGATCAAA
LacZ adelante HP2: 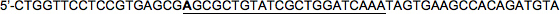
LacZ Reverse HP2: 
Tenga en cuenta que una vez más, la base 5 'de la secuencia diana en el capítulo adelante ha sido cambiada (en negrita; C → A en este ejemplo) de manera que no corresponde a la secuencia antisentido, que imitan miRNA30.
1,2 de reacción de PCR y subclonación
- Los oligos específicos del gen nos soned junto con los oligos universales en una reacción de PCR para generar la horquilla miRNA30-como con pollo miARN secuencias flanqueantes.
| La clonación en el sitio de primera horquilla: L 1 a 10 ng GFP Cebador directo HP1 1 l - 100 ng cebador 5 'HP1 100 ng cebador 3 'HP1 - 1 l 1 dNTPs mu l (10 mM) 5 l de 10x tampón de reacción de Pfu 1 l Pfu ADN polimerasa (Promega) 39 l de agua PCR-Grade | Oregón | Clonación en el sitio segunda horquilla: L 1 a 10 ng LacZ Cebador directo HP2 1 l - 100 ng cebador 5 'HP2 1 l - 100 ng cebador 3 'HP2 1 dNTPs mu l (10 mM) 5 l de 10x tampón de reacción de Pfu 1 l Pfu ADN polimerasa (Promega) 39 l de agua PCR-Grade |
Ciclos:
| 94 ° C | 94 ° C | 55 ° C | 72 ° C | 72 ° C | 4 ° C |
| 1 min | 30 sec | 30 sec | 1 min | 9 min | mantener |
| 30 ciclos | |||||
- Se purifica el producto de PCR, digestión con enzimas de restricción y subclone en el vector:
- En primer lugar horquilla: uso NheI y MluI
- En segundo lugar horquilla: uso MluI y SphI
- Siga técnicas estándar para la transformación de células bacterianas competentes. Las células de placas de agar LB (que contiene ampicilina) y el ADN de la cosecha por midipreparation plásmido (por ejemplo, Xtra Nucleobond Mediodía-kit, Machery-Nagel).
- Suspender ADN plásmido concentradoen ddH 2 0 estéril concentración medida por espectrofotometría y se almacena a -20 ° C.
1,3 plásmidos de secuenciación de genes miARN
Bajo condiciones estándar de la reacción de secuenciación a menudo falla debido a la fuerte estructura secundaria de las horquillas. Para mejorar esta 7:
- Realizar la reacción de secuenciación en 10 mM Tris-Cl con 0,01 mM EDTA (pH 8,0) en lugar de agua. Esto aumenta la conversión de ADN superenrollado a ssDNA, que es más susceptible para la secuenciación.
- Añadir un paso de desnaturalización por calor (98 ° C, 5 min) antes de la secuenciación. Esto convierte el ADN plásmido superenrollado a ssDNA.
2. La electroporación
2,1 Egg manejo
- Coloque los huevos en una incubadora a 38,5 ° C y ~ 45% de humedad.
- Incubar los huevos hasta que los embriones han alcanzado la fase de desarrollo deseada. Para estudiar la orientación axón de las neuronas comisurales, nos tipicay electroporar embriones cuando han alcanzado Hamburger & Hamilton (HH) etapa 17-18 (después de aproximadamente 3 días de incubación) 8. Sin embargo, la inyección y la electroporación se deben hacer antes de que la proteína de interés se ha acumulado, para hacer eficiente desmontables.
- Eliminar los huevos de la incubadora y las puso en una posición horizontal estable durante 20 min, para volver a colocar el embrión en la parte superior de la yema en el lado superior del huevo. Devolver los huevos a la incubadora durante este período.
2,2 Preparación de reactivos y equipos
- Preparar tampón fosfato salino (PBS) y esterilizar en autoclave o pasando la solución a través de un filtro de 0,2 micras.
- Hacer micropipetas de vidrio tirando capilares (World Precision Instruments 1B120F-4; 1,2 / 0,68 OD / ID (mm)) en un dispositivo adecuado de tracción (por ejemplo, Narishige PC-10). Rompa la punta de una micropipeta para obtener un diámetro de la punta de ~ 5 micras y conectarlo a un trozo de tubo conel diámetro apropiado.
- Montar los electrodos de platino (0,5 cm de largo) firmemente en un marco de mano, con una distancia entre electrodos de 0,5 cm. Conecte los electrodos a un generador de impulsos de onda cuadrada (BTX ECM 830).
- Ajuste el generador de impulsos con los siguientes parámetros:
- Para la electroporación unilateral: voltaje: 25 V, número de impulsos: 5, longitud de pulso: 50 ms, el intervalo entre impulsos: 1 sec
- Para bilateral electroporación: Tensión: 18 V, el número de pulsos: longitud 5 del pulso: 50 ms, el intervalo entre impulsos: 1 seg
- Preparar una jeringa con aguja 18 G, un bisturí, una botella spritz de 70% de etanol y cinta.
- Fundir la cera de parafina en un vaso de precipitados sobre una placa de calentamiento a 80 ° C.
2,3 de ventanas
- Limpiar los huevos utilizando un tejido empapado en 70% de etanol.
- Colocar una tira de cinta a lo largo del eje longitudinal del huevo.
- Haga dos agujeros en la cáscara del huevo utilizando un bisturí, uno enel extremo romo del huevo y el otro en la esquina de la zona a una ventana.
- Con una jeringa, retire aprox. 3 ml de albúmina de cada huevo mediante la inserción de la aguja en un ángulo de 45 ° en el orificio en el extremo romo del huevo. Cuidadosamente evitar dañar la yema.
- Corte una ventana en la cáscara de huevo con unas tijeras pequeñas, en posición horizontal para evitar dañar el embrión. Si es necesario, la posición del embrión puede ser verificado y marcado con un lápiz por la celebración de una luz fuerte contra el extremo romo del huevo. Una ventana de cuadrado de 1,5 cm a 2 es útil para la mayoría de aplicaciones.
- Sellar el orificio en el extremo romo del huevo y las grietas en la cáscara de huevo con cera de parafina fundida, aplicado con un pincel.
- Cierre la ventana con cinta adhesiva transparente (Magic por ejemplo, Scotch).
- Vuelva a colocar el huevo a la incubadora.
2.4 La electroporación
- Preparar las herramientas estériles y limpiar el área de trabajo con un 70% de etanol.
- Preparar la injection solución. La concentración de ADN apropiada debe ser determinada por el usuario y pueden variar de acuerdo con el potenciador / promotor utilizado para dirigir la expresión. A modo de guía, se utilizan típicamente 0.2-2.0 mg / l (ver Discusión). En un total de 20 l, la mezcla de inyección debe contener:
| RNAi plásmido de ADN (en H 2 0) | X l |
| 20x PBS | 1 l |
| 0,4% de azul de tripano | 2 l |
| estéril 2 ddH 0, hasta un volumen final de | 20 l |
Use succión suave para cargar la mezcla de ADN en el vaso microcapilar unido a la tubería.
- Retire la cinta de la ventana huevo y el embrión en escena de acuerdo a Hamburger y Hamilton 8.
- Use unas pinzas y tijeras de primavera para quitar cuidadosamente la extraemembranas mbryonic de la mitad caudal del embrión. Las membranas pueden ser fácilmente levantado del embrión en la región donde la mayor derecho e izquierdo venoso vitelino entrar en el tronco. Suavemente arrancar o cortar las membranas y tirar de ellos hacia la cola. Si se requiere, el embrión se puede visualizar mejor mediante la inyección de una solución de tinta china o Fast Green entre el disco embrionario y yema de huevo como se muestra en un vídeo por Boulland y colegas 9.
- Se inyecta la solución de ADN en el canal central del tubo neural, justo por encima de las extremidades posteriores. Controlar el volumen de inyección por vía oral. El tinte azul debe extenderse desde la punta de la cola hasta el ventrículo del cerebro en desarrollo.
- Añadir unas cuantas gotas de PBS estéril en la parte superior del embrión.
- Coloque los electrodos paralelos al eje anterior-posterior del embrión. Evitar tocar el embrión o los vasos sanguíneos.
- Mantenga los electrodos estables, y electroporación.
- Retire con cuidado los electrodos y enjuague conagua estéril para eliminar las proteínas desnaturalizadas de la clara de huevo.
- Para la electroporación bilateral, cambiar la polaridad de los electrodos, cambiar la posición de los electrodos paralelos al embrión y repetir la electroporación. Enjuagar los electrodos en agua estéril.
- Deja un poco más estéril PBS sobre el embrión. Selle de nuevo el huevo con cinta y devolverlo a la incubadora hasta la etapa de desarrollo deseado se alcanza. Sellado adecuado es crucial para evitar la deshidratación del embrión.
3. Preparativos Médula Espinal
3.1 La disección de embriones
- En HH25-26 (el día 5 de incubación), quitar el embrión del huevo con unas pinzas o una cuchara pequeña. Colocarlo en PBS en una placa de Petri recubiertas con silicona (elastómero de Sylgard).
- Retire las membranas extraembryonic y poner el embrión en su espalda. Estabilizar en el plato por sujetándola por el cuello y la cola (utilizando 0,20 pins de insectos mm), con s suavetretching.
- Embriones enteros (para seccionar más adelante) se puede fijar aquí, sustituyendo el PBS con 4% de paraformaldehído (PFA) y la incubación durante 1 hora a temperatura ambiente. Para hacer a libro abierto preparaciones, continuar con el protocolo de tejido no fijado como se describe a continuación.
3,2 Aislamiento de las médulas espinales de embriones
- Pin de las extremidades, lo que garantiza que los pasadores se insertan en un ángulo lejos del embrión, de manera que no interfieran con la disección. El embrión debe ser iluminado desde abajo para permitir que la densidad del tejido a ser percibidos en los pasos siguientes.
- Quitar el corazón y los órganos internos utilizando tijeras de primavera y raspando suavemente con unas pinzas. Las vértebras segmentado y la médula espinal debe ser visible si todos los órganos se han eliminado por completo.
- Usando tijeras resorte, hacer un corte poco profundo a través de las vértebras que recubre la médula espinal en el cuello. Gire el embrión 180 ° y hacer dos cortoscortes longitudinales a través de las vértebras a cada lado de la médula espinal, desde el cuello hacia la cola. Usar fórceps para levantar el colgajo de vértebras lejos de la médula espinal y la cáscara del tejido (que contiene todas las vértebras) en una sola tira hacia la cola.
- Estire suavemente y volver a fijar el embrión a través de la cola y las extremidades.
- Utilice un bisturí microquirúrgico fino (por ejemplo, Grieshaber 68101) o una aguja de tungsteno para cortar las meninges que recubren la médula espinal. Busque una línea oscura, densa de tejido entre el tubo neural y el ganglio de la raíz dorsal. Ajustar el ángulo de iluminación, si es necesario. Suavemente cortado longitudinalmente a lo largo de esta línea en cada lado de la médula espinal, desde el cuello hasta la cola. Las meninges se separe de la médula espinal debido a la suave estiramiento del embrión fijado.
- Cortar a través de la médula espinal a nivel de la yema del ala y caudal respecto a la yema de la extremidad, y levantar el conjunto de la médula espinal de embrión en una rostral a caudal suave movimiento, usando fórceps. La médula espinal aislada debe mantenerse sumergido en PBS durante este paso. No lo saque del plato.
3.3 Fijación de los libros abiertos
- Corre la médula espinal aislada en una espátula y se la transfiere a una nueva silicona revestido de placa de Petri que contiene 4% de paraformaldehído en PBS.
- Producir una preparación plano de montaje cuidadosamente depositadas en la médula espinal en seis posiciones (rostral, medial y caudal en cada lado, con 0,10 pins insectos mm). Tenemos etiqueta de cada preparación de un poco de "bandera" que no sólo identifica el embrión, pero también indica el extremo anterior de la preparación de libro abierto.
- Incubar a temperatura ambiente durante 30 min a 1 hr. Open-libros no debe ser sobre-fijado ya que esto reduce la eficiencia de Dil difusión 10 y aumenta fondo.
- Con cuidado, vierta el 4% PFA y reemplazarlo con PBS. Mantenga los platos a 4 ° C hasta el momento de inyectar con Dil o montaje.
- Observe los libros abiertos-bajo miscroscopy fluorescencia y seleccione el lado correspondiente del libro abierto para inyectar con Dil.
- Preparar Fast Dil (5 mg / ml en etanol) y extraer la solución en una micropipeta de vidrio conectada a un tubo de plástico. Parta el extremo de la micropipeta tan finamente como sea posible para obtener una punta de diámetro muy pequeño. Inserte la aguja en un recipiente de PBS y compruebe que el Dil no se escapa de la aguja. Si hay pérdidas de Dil, el diámetro de la aguja es demasiado grande. En ese caso, preparar una nueva aguja.
- Ilumine los preparativos libro abierto desde abajo. Buscar una franja longitudinal de tejido más denso, que se encuentra aproximadamente 1/5 de la anchura de un hemibook desde el borde lateral de la preparación. Esto corresponde a los cuerpos celulares de las neuronas comisurales, que se encuentran sólo ventral a la placa de techo. Comenzando en un extremo del libro abierto, insertar la aguja en el tejido de vidrio y, cuando la aguja is retirado, soplar en una pequeña cantidad de Dil usando una pipeta de boca.
- Trabaje con rapidez, por lo que varias inyecciones a lo largo de la longitud del libro abierto a intervalos regulares de aproximadamente 0,5 mm. Si la aguja se atasca, cuidadosamente claro con fórceps. Si la punta es demasiado grande (y fugas DII), vuelva a colocar la aguja.
- Cuando haya completado cada libro abierto, utilice una pipeta de transferencia para succionar y descartar cualquier exceso, se filtró Dil. No hacer esto dará como resultado un fondo elevado.
- Agregar los preparativos de aproximadamente tres días a 4 º C para permitir que el Dil a extenderse a lo largo de los axones.
3.5 Montaje de imágenes
- Usar una jeringa con una aguja de 18 G para difundir un borde fino, ininterrumpido de grasa de vacío (por ejemplo, Dow Corning # 976V) alrededor de los bordes de un 24 mm x 24 mm cubreobjetos de vidrio. Agregar varias gotas de PBS estéril al pozo. Tenga en cuenta que el medio de montaje que contiene glicerol con n-propil galato no pueden ser compatible con Dil 11. De manera similar, grasa de vacío de baja viscosidad puede mezclar con el PBS y el resultado en un fondo elevado.
- Retire los pasadores del libro abierto y la transfiere en la gota de PBS. Sumergir el libro abierto y la posición en el centro del pozo.
- Con suavidad, coloque otro de 24 mm x 24 mm cubreobjetos en la parte superior, asegurándose de que el libro abierto permanece abierto. Si es necesario, el cubreobjetos se puede quitar, y reposicionar el libro abierto. Presione suavemente alrededor de los bordes de la preparación para crear un sellado completo de grasa. El exceso de PBS serán expulsados durante este paso. Evitar burbujas de aire.
- Mantenga los preparativos en la oscuridad a 4 ° C hasta el momento de la inspección y documentación por microscopía de fluorescencia. Esto debe hacerse rápidamente (dentro de una semana), para asegurar que las preparaciones no se sequen.
4. Los resultados representativos
La electroporación y la expresión de plásmidos
Bajo elcondiciones descritas anteriormente, la proteína fluorescente debe ser claramente detectable en el tipo celular apropiado sin la necesidad de amplificación adicional de la señal, mediante el etiquetado de anticuerpos. La proteína fluorescente sólo deberían ser detectables en el tipo celular deseado / s. Ejemplos representativos de las preparaciones de libro abierto y secciones transversales de embriones electroporadas con los diferentes plásmidos se muestran en la Figura 2.
Eficiencia de miRNAs artificiales
MiRNAs artificiales contra un nuevo gen de interés debe ser examinado para la eficiencia y la especificidad de sus efectos desmontables. Encontramos que la actina β-promotor impulsado construcciones, electroporación a 0,25 g / l, son apropiados para este 3. Knockdown in vivo puede ser probado por inmunohistoquímica o hibridación in situ.
Dil etiquetado
Apropiados de las inyecciones de Dil en embriones de tipo salvajedebe producir más de 80% de los sitios de inyección con trayectorias ideales, arquetípicos 3, como se muestra en la Figura 3. Animal de la variabilidad animal debe ser baja.
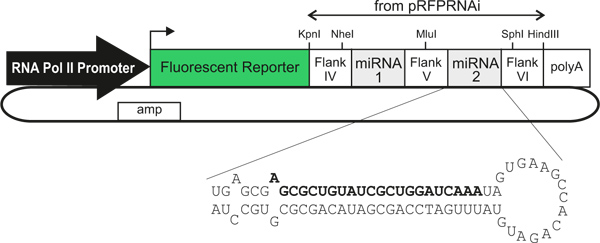
Figura 1. Esquemático generalizado de los vectores que expresan los genes miARN-plásmido. El uso de diferentes ARN polimerasa II promotores / potenciadores permite tipo de células específicas de expresión. Las células transfectadas se identifican por la expresión de un indicador fluorescente que está directamente vinculado (dentro de una única transcripción) a uno o dos miRNAs artificiales, que derriban la expresión génica. El texto en negrita indica la cadena de sentido de un miARN artificial contra LacZ, como se describe en el texto.
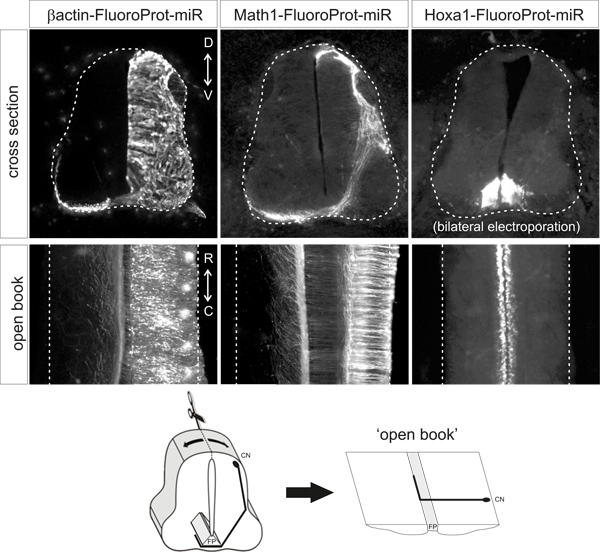
Figura 2. Representante ejemplos of fluorescentes patrones de expresión de proteínas obtenido después de la electroporación de los vectores plásmidos indicados. Las secciones transversales y libros abiertos son a partir de embriones de pollo HH25-26 que se sometieron a electroporación en HH18. β-actina promotor dirige la expresión ubicua, Math1 potenciador conduce la expresión en las neuronas y ED1 Hoxa1 potenciador conduce la expresión específica en la placa de piso. CN, comisural neurona, FP, placa de piso.
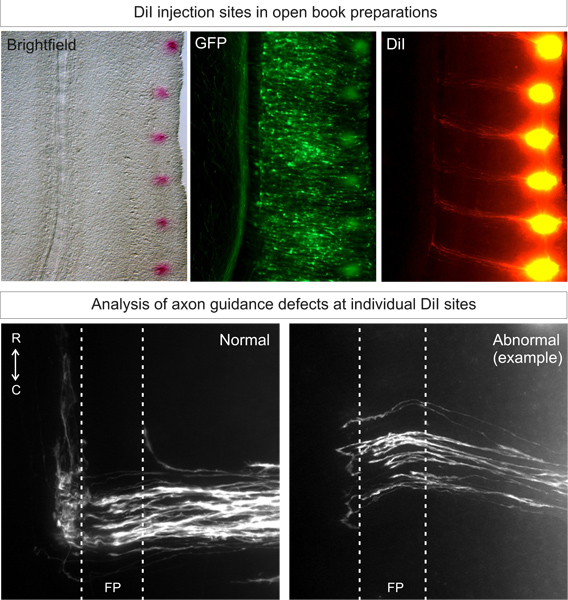
Figura 3. Aplicación y análisis de los sitios de inyección de Dil en preparaciones libro abierto. Dil se debe inyectar en un patrón puntiforme, cerca del margen lateral del libro abierto, en el lado electroporada (identificado por la expresión de proteína fluorescente). Después de 3 días de difusión, comisurales trayectorias axón debe ser capaz de ser visualizado bajo microscopía de fluorescencia. Trayectorias normales axón crecerá hacia el suelo Ptarde, cruce la placa de piso y luego girar y crecer rostral. Fenotipos anormales que surgen de golpe gen abajo se puede comparar con esta trayectoria arquetípico. En el ejemplo, algunos axones puesto en la placa de piso o hacer decisiones erróneas de giro en el lado contralateral.
Access restricted. Please log in or start a trial to view this content.
Discusión
Esta simple, basado en vectores de expresión de miARN estrategia artificial puede ser utilizado para la expresión del gen endógeno caída en el tubo neural de pollo. Estas herramientas funcionales ofrecer silenciamiento de genes múltiples, control temporal y la especificidad de tipo celular, para facilitar la dilucidación de complejas vías de desarrollo. En particular, se ha demostrado la utilidad de estos plásmidos en guía de axones comisurales, ya que los plásmidos se pueden utilizar para distintos genes desm...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
El trabajo en el laboratorio de ES con el apoyo de la Fundación Nacional Suiza para la Ciencia. Nos gustaría dar las gracias al Dr. Beat Kunz para obtener ayuda con el rodaje.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de reactivo | Empresa | Número de catálogo | |
| 0,5 mm capilares de vidrio | World Precision Instruments | 1B120F-4 | |
| Vidrio aguja extractor | Narishige | PC-10 | |
| Electroporador | BTX | ECM 830 | |
| Sylgard de elastómero de silicona | World Precision Instruments | SYLG184 | |
| Alambre de tungsteno, 0,075 mm | World Precision Instruments | TGW0325 | |
| Los alfileres entomológicos, 0,20 mm | Herramientas Artes Ciencias | 26002-20 | |
| Los alfileres entomológicos, 0,10 mm | Herramientas Artes Ciencias | 26002-10 | |
| Tijeras de primavera | Ciencia Para Fineoles | 15003-08 | |
| Dumont # 5 fórceps | Herramientas Artes Ciencias | 11252-20 | |
| Dumont # 55 pinzas | Herramientas Artes Ciencias | 11255-20 | |
| Fast Dil | Molecular Probes | D-7756 | |
| Microscopios de fluorescencia | Olimpo | SZX12, BX51 |
Referencias
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21(2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133(2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071(2010).
- Kim, B. G., Dai, H. -N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. ene Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados