É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Em Eletroporação ovo de miRNA-base de plasmídeos no Tubo Neural Desenvolvimento e Avaliação de Fenótipos por Dil Injeção em livro aberto Preparações
Neste Artigo
Resumo
Um método através do qual a expressão do gene no tubo neural pode ser downregulated em um tipo de célula específico forma rastreável é descrito. Demonstramos como In ovo Electroporação de microRNA baseados em plasmídeos que eliciam espaço-temporalmente controlada RNA de interferência pode ser utilizada para investigar a orientação do axónio comissural no tubo neural em desenvolvimento.
Resumo
Comissurais ED1 neurônios têm sido extensivamente estudadas para elucidar os mecanismos subjacentes a orientação axônio durante 1,2 desenvolvimento. Esses neurônios estão localizados na medula espinhal dorsal e enviar seus axônios ao longo de trajetórias estereotipados. Axônios comissurais inicialmente projetar ventralmente para e, em seguida, do outro lado da placa ventral. Depois de cruzar a linha média, esses axônios fazer uma curva acentuada rostral e projeto longitudinalmente para o cérebro. Cada uma dessas etapas é regulado pelas atividades coordenadas de pistas de orientação atrativas e repulsivas. A correta interpretação dessas pistas é fundamental para a orientação dos axônios ao longo de seu percurso demarcado. Assim, a contribuição fisiológica de uma molécula particular de orientação encontra-se idealmente axônio comissural investigado no contexto do embrião vivo. Por conseguinte, knockdown gene in vivo devem ser controlados com precisão, a fim de distinguir cuidadosamente actividades de orientação de axónios de genes que podem desempenhar múltiplaspapéis durante o desenvolvimento.
Aqui, nós descrevemos um método para a expressão do gene knockdown no tubo neural galinha em uma célula de tipo específico forma rastreável. Usamos novos vectores plasmídicos 3 abrigar células específicas do tipo promotores / intensificadores que dirigem a expressão de um marcador de proteína fluorescente, seguido directamente por uma transcrição miR30 RNAi-4 (localizado dentro da 3'-UTR do ADNc que codifica para a proteína fluorescente) ( Figura 1). Quando electroporado para dentro do tubo neural em desenvolvimento, estes vectores de eliciar downregulation eficaz da expressão do gene e expressar proteínas marcadoras fluorescentes brilhantes para permitir o rastreio directo das células experimentam knockdown 3. Misturando diferentes vetores de RNAi antes da electroporação permite que o knockdown simultânea de dois ou mais genes de regiões independentes da medula espinhal. Isto permite complexas interacções celulares e moleculares a serem examinados durante o desenvolvimento, de um modo que é rápido, sim, preciso e de baixo custo. Em combinação com Dil rastreamento de trajetórias axônios comissurais em livro aberto preparações 5, este método é uma ferramenta útil para estudos in vivo dos mecanismos celulares e moleculares do crescimento do axônio comissural e orientação. Em princípio, qualquer promotor / intensif icador poderiam ser utilizados, o que poderia tornar a técnica mais extensamente aplicável para estudos in vivo da função do gene durante o desenvolvimento 6.
Este primeiro vídeo demonstra como manipular e ovos de janela, a injecção de plasmídeos de ADN para dentro do tubo neural e do procedimento de electroporação. Para investigar orientação axônio comissural, a medula espinhal é retirado do embrião como uma preparação de livro aberto, fixo, e injetado com Dil para permitir percursos de axónios a ser traçada. A medula espinal é montado entre lamelas e visualizadas por microscopia confocal.
Protocolo
1. Preparação de RNAi DNA plasmídeo para celular silenciamento de genes específicos do tipo
Os plasmídeos (Figura 1) são sintetizados utilizando técnicas padrão de clonagem molecular, tal como anteriormente descrito em pormenor 3,4.
1,1 Clonagem nos vetores: projeto oligonucelotide
- Usamos os mesmos oligonucleótidos universais e protocolos de clonagem que são descritos na informação sobre o produto fornecida com o vector pRFPRNAiC 4 (ARK-Genomics).
- Para a clonagem no site hairpin primeiro:
Iniciador 5 'HP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
Iniciador 3 'HP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - Para a clonagem no local hairpin segundo:
5 'HP2 primer:
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
Iniciador 3 'HP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- Para a clonagem no site hairpin primeiro:
- Usamos Localizador Genscript do alvo siRNA para selecionar seqüências de genes-alvo específicos: https://www.genscript.com/ssl-bin/app/rnai .
- Os iniciadores para a clonagem de um gene específico do miRNA no local hairpin em primeiro lugar:
Um exemplo para o silenciamento GFP é mostrado abaixo.
Sequência alvo (22nt): 5'-GGCACAAGCTGGAGTACAACTA
GFP frente HP1 = 59mer 
GFP reversa HP1 = 58mer 
Há sequências comuns nestes oligos que formam parte das sequências de miRNA de acompanhamento (galinha-específica), e comum de laço / haste seqüências (de humano miRNA30). As sequências do gene-alvo específicos estão sublinhados. Note-se que existe amIsMatch na extremidade 5 'da cadeia de base para a frente (em negrito; G → A, neste exemplo) para imitar a incompatibilidade natural em miRNA30 nesta posição.
- Primers para clonagem de um gene microRNA específico no site hairpin segunda:
Um exemplo para o silenciamento LacZ é mostrado abaixo.
Sequência alvo (22nt): 5'-CGCGCTGTATCGCTGGATCAAA
LacZ frente HP2: 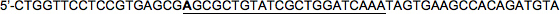
LacZ reversa HP2: 
Note-se que, novamente, a extremidade 5 'de base da sequência alvo na fita para a frente foi alterado (indicado em negrito; C → A neste exemplo) de modo que a sequência anti-sentido de desfasamentos, mimetizando miRNA30.
1,2 Reacção de PCR e subclonagem
- Os oligos específicos do gene são nósed juntamente com os oligos universais em uma reacção de PCR para gerar o hairpin miRNA30-como frango com miRNA sequências flanqueadoras.
| Clonagem em local hairpin primeiro: 1 pi - 10 ng de primer GFP Encaminhar HP1 1 ul - 100 ng de primer 5 'HP1 100 ng de primer 3 'HP1 - 1 uL 1 ul de dNTPs (10 mM) 5 ul de tampão de reacção Pfu 10x 1 uL de ADN Polimerase Pfu (Promega) 39 água de PCR-Grade ul | OU | Clonagem em local hairpin segundo: 1 pi - 10 ng de primer LacZ Encaminhar HP2 1 ul - 100 ng de primer 5 'HP2 1 ul - 100 ng de primer 3 'HP2 1 ul de dNTPs (10 mM) 5 ul de tampão de reacção Pfu 10x 1 uL de ADN Polimerase Pfu (Promega) 39 água de PCR-Grade ul |
Ciclos:
| 94 ° C | 94 ° C | 55 ° C | 72 ° C | 72 ° C | 4 ° C |
| 1 min | 30 seg | 30 seg | 1 min | 9 min | segurar |
| 30 ciclos | |||||
- Purifica-se o produto de PCR, digestão com enzimas de restrição e subclone no vector:
- Site de hairpin primeiro: uso NheI e MluI
- Site de hairpin segunda: uso MluI e SphI
- Seguir as técnicas padrão para a transformação de células bacterianas competentes. Células da placa de agar LB (contendo ampicilina) e DNA colheita por midipreparation plasmídeo (por exemplo, Nucleobond Xtra Midi Kit, Machery-Nagel).
- Suspender DNA plasmídeo concentradoem estéril DDH concentração medida 2 0, por espectrofotometria e armazenar a -20 ° C.
1,3 miRNA plasmídeos Sequencing
Em condições normais a reação de seqüenciamento muitas vezes falha devido a estrutura secundária forte dos grampos. Para melhorar esta 7:
- Realizar a reacção de sequenciação de 10 mM Tris-Cl, com 0,01 mM de EDTA (pH 8,0) em vez de água. Isto aumenta a conversão de ADN super-enrolado de ssDNA, o que é mais receptiva para a sequenciação.
- Adicionar um passo de desnaturação térmica (98 ° C, 5 min) antes da sequenciação. Isto converte DNA de plasmídeo super-enrolado de ssDNA.
2. Eletroporação
2,1 manipulação de ovo
- Coloque os ovos em um conjunto incubadora a 38,5 ° C e umidade ~ 45%.
- Incubar os ovos até os embriões terem atingido o estádio de desenvolvimento desejado. Para estudar a orientação do axônio dos neurônios comissurais, nós typically electroporate embriões depois de terem atingido Hamburger & Hamilton fase (HH) 17-18 (após cerca de 3 dias de incubação) 8. No entanto, a injecção e de electroporação precisa ser feito antes de a proteína de interesse foi acumulado, para fazer knockdown eficiente.
- Remover os ovos da incubadora e colocá-los numa posição horizontal estável, durante 20 min, para reposicionar o embrião em cima da gema, no lado superior do ovo. Devolver os ovos para a incubadora durante este período.
2.2 Preparação de reagentes e equipamento
- Preparar tampão fosfato salino (PBS) e esterilizar em autoclave ou passar a solução através de um filtro de 0,2 um.
- Fazer micropipetas de vidro puxando capilares (World Precision Instruments 1B120F-4, 1,2 / 0,68 OD / ID (mm)) em um dispositivo adequado de puxar (por exemplo Narishige PC-10). Parta a ponta de uma micropipeta para se obter um diâmetro da ponta de ~ 5 ^ m e ligá-lo a uma peça de tubo como diâmetro apropriado.
- Monte os eletrodos de platina (0,5 cm de comprimento) com firmeza em um quadro de mão, com uma distância inter-eletrodos de 0,5 cm. Conectar os eletrodos a uma onda quadrada de gerador de pulsos (BTX ECM 830).
- Ajuste o gerador de impulsos com os seguintes parâmetros:
- Para eletroporação unilateral: Tensão: 25 V, número de pulsos: 5, comprimento de pulso: 50 ms, intervalo interpulso: 1 seg
- Para eletroporação bilateral: Tensão: 18 V, número de pulsos: 5, comprimento de pulso: 50 ms, intervalo interpulso: 1 seg
- Prepara-se uma seringa com agulha 18 G, um bisturi, uma garrafa spritz de etanol a 70% e de fita.
- Fundir a cera de parafina numa proveta sobre uma placa de aquecimento a 80 ° C.
2,3 Windowing
- Limpar os ovos usando um tecido embebido em etanol a 70%.
- Coloque uma tira de fita adesiva ao longo do eixo do ovo.
- Fazer dois pequenos furos na casca utilizando um bisturi e uma noa extremidade romba do ovo e do outro, no canto da área a ser em janelas.
- Utilizando uma seringa, remover aprox. 3 ml de albumina a partir de cada ovo através da inserção da agulha com um ângulo de 45 ° para o buraco no extremo cego do ovo. Cuidadosamente evitar danificar a gema.
- Corte uma janela para a casca com uma tesoura pequena, realizada horizontalmente para evitar danificar o embrião. Se necessário, a posição do embrião pode ser verificada e marcadas com um lápis, segurando uma luz forte contra a extremidade romba do ovo. Uma janela de 1,5-2 cm quadrado é útil para a maioria das aplicações.
- Selar o buraco no fim brusco do ovo e todas as rachaduras na casca de ovo com cera de parafina derretida, aplicada com um pincel.
- Selar a janela usando fita adesiva transparente (por exemplo Mágica Scotch).
- Devolver o ovo para a incubadora.
2,4 Eletroporação
- Preparar instrumentos estéreis e limpe a área de trabalho com etanol 70%.
- Prepare o injection solução. A concentração de ADN adequada deve ser determinada pelo utilizador e vai variar de acordo com o potenciador / promotor utilizado para conduzir a expressão. Como um guia, que normalmente usam 0,2-2,0 g / ul (ver Discussão). Num total de 20 ul, a mistura de injecção deve conter:
| RNAi ADN plasmídico (em H 2 0) | X ul |
| 20x PBS | 1 ul |
| 0,4% azul de tripan | 2 ul |
| estéril DDH 2 0, para um volume final de | 20 ul |
Use sucção suave para carregar a mistura de DNA no vidro microcapilar ligado à tubagem.
- Remova a fita do ovo janela e encenar o embrião de acordo com Hamburger e Hamilton 8.
- Use uma pinça e tesouras de mola para remover cuidadosamente a extraemembranas mbryonic da metade caudal do embrião. As membranas podem ser facilmente levantada longe do embrião na região onde o principais direito e esquerdo veias vitelinas entrar no tronco. Gentilmente rasgar ou cortar as membranas e trazê-los para a cauda. Se necessário, o embrião pode ser melhor visualizado por injecção de uma solução de tinta da Índia ou Verde Rápido entre o disco embrionário e gema de ovo, como mostrado em um vídeo por Boulland e colegas 9.
- Injectar a solução de DNA para dentro do canal central do tubo neural, um pouco acima dos membros posteriores. Controlar o volume de injeção por via oral. O corante azul deve espalhar a partir da ponta da cauda até ao ventrículo do cérebro em desenvolvimento.
- Adicionar algumas gotas de PBS estéril sobre o embrião.
- Colocar os eléctrodos paralelos ao eixo ântero-posterior do embrião. Evite tocar o embrião ou vasos sanguíneos.
- Segurar os eletrodos constante, e electroporate.
- Remova cuidadosamente os eletrodos e lavá-los comágua esterilizada para remover as proteínas desnaturadas, a partir da clara de ovo.
- Para a electroporação bilateral, alternar a polaridade dos eléctrodos, reposicionar os eléctrodos paralelos ao embrião e repetir a electroporação. Lavar os eletrodos com água estéril.
- Abandonar algumas PBS mais estéril para o embrião. Feche o ovo com fita e devolvê-lo para a incubadora até o estágio de desenvolvimento desejado seja alcançado. Vedação adequada é essencial para evitar a desidratação do embrião.
3. Spinal Cord Preparações
3,1 Dissecação de embriões
- No HH25-26 (dia 5 de incubação), remover o embrião do ovo usando uma pinça ou uma pequena colher. Colocá-lo em PBS numa placa de Petri revestidas com silicone (elastómero Sylgard).
- Remova as membranas extraembryonic e colocar o embrião no seu dorso. Estabilizá-lo na placa fixando-o através do pescoço e da cauda (com 0,20 milímetros pinos de insectos), com s suavetretching.
- Embriões inteiros (por seccionamento posterior) pode ser fixado aqui, substituindo o PBS com paraformaldeído a 4% (PFA) e incubando durante 1 hr à temperatura ambiente. Para fazer com que as preparações de livro aberto, continuar com o protocolo de tecido não fixado, tal como descrito abaixo.
3,2 Isolamento de medulas espinais de embriões
- Pin os membros, assegurando que os pinos são inseridos em um ângulo de distância a partir do embrião de modo que eles não interfiram com a dissecção. O embrião deve ser iluminado a partir de baixo para permitir que a densidade do tecido a ser percebidos nas etapas seguintes.
- Retire o coração e os órgãos internos utilizando tesoura primavera e delicadamente raspando com uma pinça. As vértebras segmentado e medula espinal devem ser visíveis se todos os órgãos foram removidos completamente.
- Com uma tesoura de mola, faça um corte superficial através das vértebras que recobre a medula espinhal no pescoço. Gire o embrião 180 ° e fazer dois curtacortes longitudinais através das vértebras em ambos os lados da coluna vertebral, do pescoço para a cauda. Use uma pinça para levantar a aba de vértebras para longe da medula espinal e o tecido da casca (que contém todas as vértebras) em uma única tira no sentido da cauda.
- Esticar suavemente e re-pin o embrião através da cauda e membros.
- Usar um fino bisturi microcirúrgico (por exemplo, Grieshaber 68101) ou uma agulha de tungsténio para cortar as meninges que cobrem a medula espinhal. Procurar uma linha escura, densa de tecido entre o tubo neural e os gânglios da raiz dorsal. Ajustar o ângulo de iluminação, se necessário. Suavemente cortado longitudinalmente ao longo desta linha de cada lado da coluna vertebral, do pescoço até à cauda. As meninges deve separar da medula espinhal devido ao alongamento suave do embrião fixado.
- Cortar a medula espinhal no nível do broto asa e caudal ao broto de membro, e levante o cabo de toda a coluna vertebral do embrião em um rostro lisas para caudal movimento, utilizando fórceps. A medula espinhal isolado deve ser mantida imersa em PBS durante este passo. Não retire-o do prato.
3,3 Fixação do Open-livros
- Espalhar o cabo isolado espinal para uma espátula e transferi-lo para uma nova placa de Petri de silicone revestido contendo paraformaldeído a 4% em PBS.
- A preparação de uma televisão de montagem cuidadosamente prendendo a medula espinhal em seis posições (rostralmente, medial e caudalmente em cada lado, com 0,10 milímetros de insetos pinos). Nós rotular cada preparação de uma 'bandeira' pouco que não só identifica o embrião, mas também indica a extremidade anterior da preparação de livro aberto.
- Incubar à temperatura ambiente durante 30 min a 1 h. Open-livros não devem ser sobre-fixado, irá reduzir a eficiência da difusão DiI 10 e aumenta o fundo.
- Cuidadosamente despeje a PFA 4% e substituí-lo com PBS. Manter os pratos a 4 ° C até que esteja pronto para injetar com Dil ou montagem.
- Observe os livros abertos sob miscroscopy-fluorescência e selecione o lado apropriado do livro aberto para injetar com DII.
- Prepare rápida DiI (5 mg / ml em etanol) e extrair a solução em uma micropipeta de vidro ligado a tubagem de plástico. Parta a extremidade da micropipeta tão finamente quanto possível para se obter uma ponta de diâmetro muito pequeno. Inserir a agulha em um prato de PBS e verificar se o DiI não vazar da agulha. Se os vazamentos de DII, o diâmetro da agulha é muito grande. Nesse caso, a preparação de uma nova agulha.
- Iluminar as preparações de livro aberto de baixo. Olhar para uma faixa de tecido mais denso longitudinal, localizado a cerca de 1/5 da largura de um hemibook a partir da borda lateral da preparação. Isto corresponde aos corpos celulares dos neurónios comissurais, que são encontrados apenas ventral para a placa para telhado. A partir de uma extremidade do livro aberto, inserir a agulha no tecido de vidro e, como a agulha de is retiradas, inchar em uma pequena quantidade de DiI, utilizando uma pipeta boca.
- Trabalhar rapidamente, fazendo várias injecções ao longo do comprimento do livro aberto, a intervalos regulares de, aproximadamente, 0,5 mm. Se a agulha se torna entupido, limpá-la cuidadosamente com uma pinça. Se a ponta torna-se muito grande (e vazamentos DII), substituir a agulha.
- Quando tiver concluído a cada livro aberto, use uma pipeta de transferência para sugar e eliminar qualquer excesso, vazou Dil. Não fazer isso resultará em fundo de alta.
- Deixar a preparação de cerca de três dias, a 4 ° C para permitir que o DiI para espalhar ao longo dos axónios.
3.5 Montagem para imagens
- Use uma seringa com uma agulha de 18 G para espalhar uma borda fina ininterrupta de graxa de vácuo (por exemplo, Dow Corning # 976V) em torno das bordas de uma lamela de vidro de 24 mm x 24 mm. Adicionar algumas gotas de PBS estéril para o poço. Note-se que de meio de montagem contendo glicerol com n-propil galato não podem ser compatible com DiI 11. Da mesma forma, graxa de vácuo de baixa viscosidade pode misturar-se com o PBS e resultar em fundo elevado.
- Remover os pinos do livro aberto e transferi-lo para a gota de PBS. Mergulha-se o livro aberto e posicioná-la no meio do poço.
- Delicadamente, coloque outro de 24 mm x 24 mm lamínula em cima, certificando-se o livro aberto fica aberto. Se necessário, as lamelas podem ser removidos, e o livro aberto reposicionada. Pressione suavemente em torno das bordas da preparação para criar uma vedação completa de graxa. PBS excesso será espremido durante esta etapa. Evite bolhas de ar.
- Manter as preparações no escuro a 4 ° C até estar pronto para a inspecção e documentação por microscopia de fluorescência. Isto deve ser feito rapidamente (dentro de uma semana), para assegurar que a preparação não sequem.
4. Resultados representativos
Electroporação e expressão de plasmídeos
Sob acondições acima descritas, proteína fluorescente deve ser claramente detectável no tipo de célula apropriada, sem a necessidade de amplificação do sinal adicional através da rotulagem de anticorpos. A proteína fluorescente deve ser apenas detectáveis no tipo de célula desejado / s. Exemplos representativos de livro aberto preparações e as secções transversais dos embriões electroporadas com os diferentes plasmídeos são apresentados na Figura 2.
Eficiência de miRNAs artificiais
MiRNAs artificiais contra um novo gene de interesse deve primeiro ser rastreados para a eficiência e a especificidade dos seus efeitos knockdown. Descobrimos que β-actina orientados construções promotoras, electroporadas a 0,25 ug / uL, são apropriados para este 3. Knockdown in vivo pode ser testada por imuno-histoquímica, ou hibridação in situ.
DiI rotulagem
Adequadamente dirigidas injeções DII em embriões de tipo selvagemdeve ter mais do que 80% dos locais de injecção com ideais, trajectórias arquetípicas 3, como mostrado na Figura 3. Animal a variabilidade animal deve ser baixo.
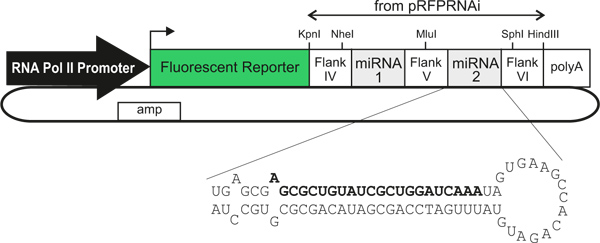
Figura 1. Esquemática generalizada dos vetores miRNA expressam plasmídeo. A utilização de diferentes promotores de ARN polimerase II / intensificadores permite a expressão em células de tipo específico. As células transf ectadas são identificadas pela expressão de um repórter fluorescente que está directamente ligado (dentro de um único transcrito) a um ou dois miRNAs artificiais, que derrubar a expressão do gene. O texto em negrito indica a cadeia com sentido de um miRNA artificial contra LacZ, tal como descrito no texto.
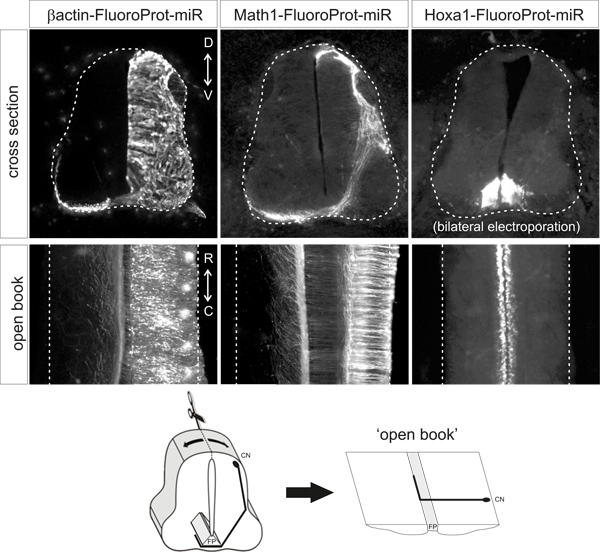
Figura 2. Exemplos representativos of padrões de expressão de proteínas fluorescentes obtidos após a electroporação dos vectores plasmídeos indicados. Seções transversais e livros abertos são a partir de embriões de galinha HH25-26 que foram electroporated em HH18. β-actina promotor conduz a expressão ubíqua, Math1 enhancer conduz a expressão em neurónios e ED1 Hoxa1 enhancer dirige a expressão específica na placa de fundo. CN, comissural neurônio; FP, placa de fundo.
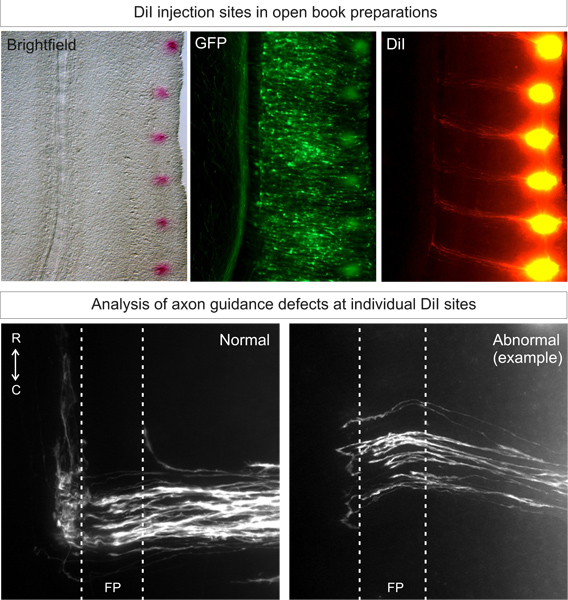
Figura 3. Aplicação e análise de locais de injecção DII em preparações livro aberto. DiI deve ser injectado num padrão punctata, perto da margem lateral do livro aberto, no lado electroporated (identificados por expressão de proteína fluorescente). Após 3 dias de difusão, as trajectórias de axónios comissurais deve ser capaz de ser visualizada por microscopia de fluorescência. Trajetórias normais axônio crescerá para o chão ptarde, atravessar a placa de fundo e, em seguida, virar e crescer rostralmente. Fenótipos anormais resultantes de pancada gene para baixo pode ser comparada a esta trajectória arquétipo. No exemplo, alguns axónios tenda na placa de fundo, ou fazer decisões erradas que giram sobre o lado contralateral.
Discussão
Esta simples, baseado em vectores de expressão artificial miRNA estratégia pode ser usada para knockdown expressão do gene endógeno no tubo neural frango. Estas ferramentas funcionais oferecer silenciamento de genes múltiplos, o controlo temporal e especificidade do tipo de célula, a fim de facilitar a elucidação das complexas vias de desenvolvimento. Em particular, foi demonstrado a utilidade destes plasmídeos em orientação axon comissural, uma vez que os plasmídeos podem ser usados para genes distint...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Trabalho no laboratório do ES é apoiado pela National Science Foundation suíço. Gostaríamos de agradecer ao Dr. batida Kunz para a assistência com as filmagens.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| 0,5 milímetros capilares de vidro | Instrumentos de Precisão mundo | 1B120F-4 | |
| Vidro agulha extrator | Narishige | PC-10 | |
| Electroporator | BTX | ECM 830 | |
| Sylgard elastómero de silicone | Instrumentos de Precisão mundo | SYLG184 | |
| Fio de tungstênio, 0,075 milímetros | Instrumentos de Precisão mundo | TGW0325 | |
| Pinos de insetos, 0,20 milímetro | Belas Science Tools | 26002-20 | |
| Pinos de insetos, 0,10 milímetro | Belas Science Tools | 26002-10 | |
| Tesoura Primavera | Ciência Fineols | 15003-08 | |
| Dumont n º 5 fórceps | Belas Science Tools | 11252-20 | |
| Dumont # 55 fórceps | Belas Science Tools | 11255-20 | |
| Rápido DiI | Molecular Probes | D-7756 | |
| Microscópios fluorescentes | Olimpo | SZX12, BX51 |
Referências
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21 (2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133 (2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071 (2010).
- Kim, B. G., Dai, H. -. N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. e. n. e. Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados