Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В ово Electroporation микроРНК основе плазмид в развивающихся нервной трубки и оценки фенотипов по DiI инъекций в открытом книгу Препараты
В этой статье
Резюме
Метод, которым экспрессию генов в нервной трубке может быть подавляется в клетку определенного типа, прослеживается образом описано. Мы показываем, как В ово Электропорации микроРНК основе плазмид, которые вызывают spatiotemporally контролируемых РНК-интерференции может быть использован для исследования спаечный руководством аксонов в развивающейся нервной трубки.
Аннотация
Commissural dI1 neurons have been extensively studied to elucidate the mechanisms underlying axon guidance during development1,2. These neurons are located in the dorsal spinal cord and send their axons along stereotyped trajectories. Commissural axons initially project ventrally towards and then across the floorplate. After crossing the midline, these axons make a sharp rostral turn and project longitudinally towards the brain. Each of these steps is regulated by the coordinated activities of attractive and repulsive guidance cues. The correct interpretation of these cues is crucial to the guidance of axons along their demarcated pathway. Thus, the physiological contribution of a particular molecule to commissural axon guidance is ideally investigated in the context of the living embryo. Accordingly, gene knockdown in vivo must be precisely controlled in order to carefully distinguish axon guidance activities of genes that may play multiple roles during development.
Here, we describe a method to knockdown gene expression in the chicken neural tube in a cell type-specific, traceable manner. We use novel plasmid vectors3 harboring cell type-specific promoters/enhancers that drive the expression of a fluorescent protein marker, followed directly by a miR30-RNAi transcript4 (located within the 3'-UTR of the cDNA encoding the fluorescent protein) (Figure 1). When electroporated into the developing neural tube, these vectors elicit efficient downregulation of gene expression and express bright fluorescent marker proteins to enable direct tracing of the cells experiencing knockdown3. Mixing different RNAi vectors prior to electroporation allows the simultaneous knockdown of two or more genes in independent regions of the spinal cord. This permits complex cellular and molecular interactions to be examined during development, in a manner that is fast, simple, precise and inexpensive. In combination with DiI tracing of commissural axon trajectories in open-book preparations5, this method is a useful tool for in vivo studies of the cellular and molecular mechanisms of commissural axon growth and guidance. In principle, any promoter/enhancer could be used, potentially making the technique more widely applicable for in vivo studies of gene function during development6.
This video first demonstrates how to handle and window eggs, the injection of DNA plasmids into the neural tube and the electroporation procedure. To investigate commissural axon guidance, the spinal cord is removed from the embryo as an open-book preparation, fixed, and injected with DiI to enable axon pathways to be traced. The spinal cord is mounted between coverslips and visualized using confocal microscopy.
протокол
1. Подготовка RNAi плазмидной ДНК для сотовых Тип конкретных генов
Плазмиды (рис. 1) синтезируется с использованием стандартных методов молекулярной клонирование, как ранее подробно описана 3,4.
1,1 клонирования в векторах: oligonucelotide дизайн
- Мы используем те же универсальные олигонуклеотидов и клонирование протоколов, описанных в произведении информации с pRFPRNAiC вектор 4 (ARK-Genomics).
- Для клонирования в первом сайта шпильку:
5 'праймер HP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
3 'праймер HP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - Для клонирования во втором сайта шпильку:
5 'праймер HP2:
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
3 'праймер HP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- Для клонирования в первом сайта шпильку:
- Мы используем миРНК GenScript в целевой Finder, чтобы выбрать ген-специфических последовательностей цели: https://www.genscript.com/ssl-bin/app/rnai .
- Праймеры для клонирования генов конкретных микроРНК в первом сайта шпильку:
Пример для глушителей GFP показано ниже.
Целевая последовательность (22nt): 5'-GGCACAAGCTGGAGTACAACTA
GFP вперед HP1 = 59mer 
GFP обратного HP1 = 58mer 
Есть общие последовательности в этих олигонуклеотидов, которые формируют часть микроРНК фланкирующие последовательности (куриные конкретного), а общий цикл / стволовых последовательности (от человеческого miRNA30). Ген-специфических последовательностей целевой подчеркнуты. Заметим, что существует утраIsMatch на 5 'база вперед нити (выделены жирным шрифтом; G → A в этом примере), чтобы имитировать естественные несоответствия в miRNA30 на этой позиции.
- Праймеры для клонирования генов конкретных микроРНК во втором сайта шпильку:
Пример для глушителей LacZ показано ниже.
Целевая последовательность (22nt): 5'-CGCGCTGTATCGCTGGATCAAA
LacZ вперед HP2: 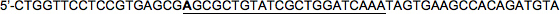
LacZ обратного HP2: 
Обратите внимание, что опять же, 5 'база целевой последовательности в прямом прядь была изменена (выделены жирным шрифтом; C → A в этом примере), так что это не соответствует антисмысловые последовательности, имитируя miRNA30.
1,2 ПЦР-реакции и Субклонирование
- Геноспецифических олигонуклеотиды являются намЭд вместе с универсальным олигонуклеотидов в полимеразной цепной реакции для создания miRNA30 подобные шпильки с курицей микроРНК фланкирующие последовательности.
| Клонирование в первый сайта шпильку: 1 мкл - 10 нг GFP Прямой праймер HP1 1 мкл - 100 нг 5 'праймер HP1 1 мкл - 100 нг 3 'праймер HP1 1 мкл дНТФ (10 мМ) 5 мкл 10х буфера реакции Pfu 1 мкл ДНК-полимеразы Pfu (Promega) 39 мкл ПЦР-Grade воды | ИЛИ | Клонирование на втором месте шпильку: 1 мкл - 10 нг LacZ Прямой праймер HP2 1 мкл - 100 нг 5 'праймер HP2 1 мкл - 100 нг 3 'праймер HP2 1 мкл дНТФ (10 мМ) 5 мкл 10х буфера реакции Pfu 1 мкл ДНК-полимеразы Pfu (Promega) 39 мкл ПЦР-Grade воды |
Циклы:
| 94 ° C | 94 ° C | 55 ° C | 72 ° C | 72 ° C | 4 ° C |
| 1 мин | 30 сек | 30 сек | 1 мин | 9 мин | держать |
| 30 циклов | |||||
- Очищают продукт ПЦР, перевариваются ферментами рестрикции и субклона в векторе:
- Первый сайта шпильку: использование NheI и MluI
- Второе место шпильку: использование MluI и SphI
- Следуйте стандартным методам преобразования компетентные бактериальных клеток. Пластина клеток на агар LB (содержащий ампициллин) и урожай ДНК плазмиды midipreparation (например, NucleoBond Xtra Midi комплект, Machery-Nagel).
- Suspend концентрированном плазмидной ДНКв стерильных DDH 2 0, мера концентрации спектрофотометрии и хранить при -20 ° C.
Секвенирование плазмид 1,3 микроРНК
При стандартных условиях реакции секвенирования часто не удается из-за сильного вторичной структуры шпильки. Для улучшения этой 7:
- Выполните реакции секвенирования в 10 мМ Трис-Cl с 0,01 мМ ЭДТА (рН 8,0) вместо воды. Это увеличивает конверсию суперспиральной ДНК в одноцепочечной, который является более пригодным для секвенирования.
- Добавить шаг тепловой денатурации (98 ° C, 5 мин) до секвенирования. Это превращает суперспиральной плазмидной ДНК в одноцепочечной.
2. Electroporation
2,1 Egg обработки
- Положите яйца в инкубатор до 38,5 ° C и ~ 45% влажности.
- Инкубировать яйца, пока эмбрионы достигли желаемого стадии развития. Для изучения аксона руководством спаечный нейронов, мы TypicallУ electroporate эмбрионов, когда они достигли Hamburger & Hamilton (HH) этап 17-18 (примерно через 3 суток инкубации) 8. Тем не менее, инъекции и электропорации необходимо сделать до того, как белок накопил, чтобы сделать нокдаун эффективным.
- Удалите яйца из инкубатора и поместить их в устойчивом горизонтальном положении в течение 20 мин, чтобы изменить положение эмбриона в верхней части желтка в верхней части яйца. Вернуться яиц в инкубаторе в течение этого периода.
2.2 Подготовка реагентов и оборудования
- Подготовка фосфатным буферным раствором (PBS) и стерилизовать в автоклаве или пропускание раствора через фильтр 0,2 мкм.
- Сделайте стекло микропипетки, потянув капилляров (World Precision Instruments 1B120F-4, 1,2 / 0,68 OD / ID (мм)) в подходящем тянущее устройство (например, Narishige PC-10). Оторвать кончике микропипетки получить чаевые диаметром ~ 5 мкм и подключить его к кусок трубы ссоответствующего диаметра.
- Установите платиновыми электродами (0,5 см) плотно в ручной рамке, с межэлектродном расстоянии 0,5 см. Подключите электроды к квадратной волны импульсного генератора (BTX ECM 830).
- Установить генератор импульсов со следующими параметрами:
- Для одностороннего электропорации: Напряжение: 25 V, число импульсов: 5, длина импульса: 50 мс, интервал паузы: 1 сек
- Для двусторонних электропорации: напряжение: 18 V, число импульсов: 5, длина импульса: 50 мс, интервал паузы: 1 сек
- Подготовить шприц с иглой 18 G, скальпель, бутылка брызгать из 70% этанола и лентой.
- Растопить парафин в стакан на нагревательной пластины при температуре 80 ° C.
2,3 Windowing
- Протрите яйца использованием ткани пропитанной 70% этанолом.
- Поместите полоску ленты вдоль длинной оси яйца.
- Сделать два маленьких отверстия в скорлупе с помощью скальпеля, по одномутупом конце яйца, а другой на углу области, которая будет оконном.
- Используя шприц, снимите ок. 3 мл белка из каждого яйца, вставив иглу под углом 45 ° в отверстие на тупом конце яйца. Осторожно Во избежание повреждения желток.
- Прорубил окно в яичной скорлупе с помощью небольших ножниц, в горизонтальном положении, чтобы избежать повреждения эмбриона. При необходимости положение эмбриона могут быть проверены и помечены карандашом, держа яркий свет от тупого конца яйца. Окно от 1,5 до 2 см квадратных полезна для большинства приложений.
- Закройте отверстие на тупом конце яйца и любые трещины в скорлупе с расплавленным парафином, наносится с помощью кисти.
- Закройте окно с помощью прозрачной лентой (например, Scotch Magic).
- Вернуться яйца в инкубатор.
2,4 Electroporation
- Подготовить стерильные инструменты и протереть рабочую зону с 70% этанола.
- Подготовьте яnjection решение. Соответствующей концентрации ДНК должны быть определены пользователем, и будет варьироваться в зависимости от энхансер / промотор используется для привода выражение. В качестве ориентира, мы обычно используют 0,2-2,0 мкг / мкл (см. Обсуждение). В общей сложности 20 мкл, инъекции смеси должны содержать:
| RNAi ДНК плазмиды (в H 2 0) | X мкл |
| 20x PBS | 1 мкл |
| 0,4% трипанового синего | 2 мкл |
| стерильной DDH 2 0, в конечном объеме | 20 мкл |
Используйте нежные всасывающие, чтобы загрузить ДНК смесь в стеклянную микрокапиллярной прикреплены к трубке.
- Удалите ленту с оконным яйцом и поставить эмбриона в соответствии с гамбургеров и Гамильтон 8.
- Используйте щипцы и ножницы, чтобы весной осторожно удалить extraembryonic мембраны из хвостовой половины эмбрионов. Мембраны могут быть легко сняты от эмбриона в регионе, где основным правом и левом вены желточного войти в багажнике. Аккуратно оторвать или отрезать мембран и тянуть их к хвосту. Если требуется, то эмбрион может визуализироваться лучше путем введения раствора тушью или быстро Зеленый между зародышевого диска и яичного желтка, как показано на видео, Boulland и коллег 9.
- Вводят раствор ДНК в центральный канал нервной трубки, чуть выше задних конечностей. Управление объемом впрыска через рот. Синяя краска должна распространяться от кончика хвоста до желудочка развивается мозг.
- Добавить несколько капель стерильного PBS в верхней части эмбриона.
- Поместите электроды параллельно передне-задней оси эмбриона. Старайтесь не прикасаться к эмбриону или кровеносных сосудов.
- Держите электродов устойчивый, и electroporate.
- Осторожно снимите электроды и промойте ихстерильной водой для удаления денатурированной белков из яичного белка.
- Для двусторонних электропорации, переключение полярности электродов, изменить электроды параллельно эмбриона и повторить электропорации. Промойте электроды в стерильной воде.
- Оставьте несколько стерильной PBS на эмбрион. Заново загерметизируйте яйца с лентой и вернуть его в инкубатор нужный стадия развития будет достигнута. Правильное уплотнение имеет решающее значение, чтобы избежать обезвоживания эмбриона.
3. Спинной Подготовка кабеля
3,1 Dissection эмбрионов
- В HH25-26 (5-й день инкубации), удалить эмбриона из яйцеклетки с помощью пинцета или небольшой ложкой. Поместите его в PBS в чашке Петри покрыта силиконом (Sylgard эластомер).
- Снимите внеэмбриональной мембран и заложить эмбриона на его спине. Стабилизировать его на пластине, закрепив его через шею и хвост (с помощью контактов 0,20 мм, насекомое), с нежным сtretching.
- Всего эмбрионов (для резки позже) может быть установлен здесь, заменив PBS с 4% параформальдегида (PFA) и инкубации в течение 1 часа при комнатной температуре. Для того, чтобы открытые книги препараты, продолжают протокол с нефиксированной ткани, как описано ниже.
3,2 Выделение спинного мозга из эмбрионов
- Pin конечностей, убедившись, что штифты вставляются под углом от эмбриона, чтобы они не мешали при вскрытии. Эмбриона должны быть освещены снизу, чтобы плотность ткани воспринимается в следующих шагах.
- Удалить сердца и внутренних органов с помощью пружинных ножниц и аккуратно очищая щипцами. Сегментирован позвонков и спинного мозга должны быть видны, если все органы были полностью удалены.
- Использование весной ножницами, сделать неглубокий порез через позвонки покрывающей спинной мозг в шею. Поверните эмбриона на 180 ° и сделать два короткихпродольные разрезы через позвонки по обе стороны от спинного мозга, от шеи к хвосту. Используйте пинцет, чтобы поднять крышку позвонков от спинного мозга и очистить ткани (содержащего все позвонки) в одной полосы в направлении хвоста.
- Аккуратно растянуть и заново прикрепить эмбрион через хвост и конечности.
- С помощью микрохирургического скальпеля штрафа (например, Grieshaber 68101) или вольфрамовой иглы, чтобы срезать мозговых оболочек покрывающей спинной мозг. Посмотрите на темной, плотной линией ткани между нервной трубкой и спинной ганглии. Регулировка угла освещения, если это необходимо. Аккуратно разрезать продольно вдоль этой линии с каждой стороны спинного мозга, от шеи до хвоста. Мозговых оболочек следует отделить от спинного мозга в связи с нежным растяжения возлагали эмбриона.
- Разрезать спинного мозга на уровне крыла и хвостового бутон в зачатках конечностей, и поднять весь спинной мозг из эмбриона в одной гладкой ростральнее хвостовой движения, с помощью пинцета. Изолированного спинного мозга должны быть погружены в PBS в течение этого шага. Не поднимайте ее из блюда.
3,3 Фиксация открытой книги
- Распространение изолированные спинного мозга на шпатель и передать его на новое силиконовой подкладкой чашке Петри, содержащей 4% параформальдегидом в PBS.
- Продукция с плоским креплением подготовке тщательно закрепления спинного мозга в шести позициях (рострально, медиально и каудально на каждой стороне, используя 0,10 мм контакты насекомых). Мы маркировать каждую подготовке немного "флаг", который не только определяет эмбриона, но также указывает на переднем конце открытой книгой подготовки.
- Выдержите при комнатной температуре в течение 30 мин до 1 часа. Открытый книги не должны быть чрезмерно зафиксировано, так как это снижает эффективность DiI диффузии 10 и увеличивает фон.
- Аккуратно слейте 4% PFA и заменить его на PBS. Держите блюд при 4 ° С до готовности вводят с DiI или горы.
- Соблюдайте открытой книги под флуоресценции miscroscopy и выберите соответствующую сторону открытой книгой для введения с DiI.
- Подготовка Быстрый DiI (5 мг / мл в этаноле) и нарисуйте раствор в стеклянной микропипетки прикреплен к пластиковой трубки. Оторвать концу микропипетки, как тонко, как можно получить очень малого диаметра чаевых. Вставьте иглу в блюдо PBS и убедитесь, что DiI не вытекает из иглы. Если DiI утечки, диаметр иглы слишком велик. В этом случае подготовить новую иглу.
- Illuminate открытой книгой препаратов снизу. Посмотрите на плотной продольной полосой ткани, расположенной примерно 1/5 ширины hemibook от бокового края подготовки. Это соответствует клеточных тел нейронов спаечный, которые находятся всего в вентральной на крышу тарелку. Начиная с одного конца открытая книга, вставить стекла иглы в ткани и, как игла яс отозваны, пыхтеть в небольшом количестве DiI использованием рот пипеткой.
- Работают быстро, сделав несколько инъекций по длине открытой книги с регулярными интервалами примерно 0,5 мм. Если игла забивается, тщательно очистите его с помощью пинцета. Если кончик становится слишком большим (и DiI утечек), замените иглу.
- После завершения каждой открытой книге, используют передачу пипетки отсасывать и выбросить излишки, утечка DiI. Неспособность сделать это приведет к высоким фоном.
- Оставьте препараты в течение приблизительно трех дней при 4 ° С для того, чтобы DiI распространяться вдоль аксонов.
3.5 Монтаж для работы с изображениями
- С помощью шприца с иглой 18 G распространяться тонкий, непрерывный границе вакуумной смазкой (например, Dow Corning # 976V) по краям 24 мм х 24 мм покровным стеклом. Добавить несколько капель стерильного PBS к колодцу. Обратите внимание, что установка среде, содержащей глицерин с н-пропил галлат не могут быть совместноmpatible с DiI 11. Кроме того, вакуумные смазки с низкой вязкостью может смешиваться с PBS и в результате высокого фона.
- Снимите штифты из открытой книги и передать ее в капле PBS. Погрузитесь открытой книги и поместите его в середину хорошо.
- Аккуратно поместите еще 24 мм х 24 мм покровным на вершине, убедившись, что открытая книга остается открытым. Если необходимо, покровное могут быть удалены, а открытой книге приложена. Аккуратно нажмите на краях подготовки для создания полного уплотнения смазки. Превышение PBS будет выдавливаться на этом этапе. Избегайте пузырьков воздуха.
- Хранить препараты в темноте при 4 ° С до готовности для контроля и документации флуоресцентной микроскопии. Это должно быть сделано оперативно (в течение одной недели), чтобы гарантировать, что препараты не высыхают.
4. Представитель Результаты
Electroporation и выражения плазмиды
В соответствии сописанным выше условиям, флуоресцентного белка должно быть четко обнаруживается в соответствующем типе клеток без необходимости дополнительного усиления сигнала на антитела маркировки. Флуоресцентного белка должно быть только обнаружить в нужную ячейку типа / с. Типичные примеры открытой книги препараты и сечений эмбрионов электропорации с различными плазмидами показано на рисунке 2.
Эффективность искусственных микроРНК
Искусственные микроРНК против нового гена интереса должны сначала пройти обследование на эффективность и специфичность их воздействия нокдаун. Мы считаем, что β-актин промотора управляемые конструкции, электропорации на уровне 0,25 мкг / мкл, являются подходящими для этого 3. Нокдаун в естественных условиях могут быть проверены с помощью иммуногистохимии или гибридизация.
DiI маркировки
Соответственно целевые DiI инъекции в эмбрионы дикого типадолжны дать более 80% от инъекции с идеальной, архетипической траектории 3, как показано на рисунке 3. Животного к животному изменчивости должны быть низкими.
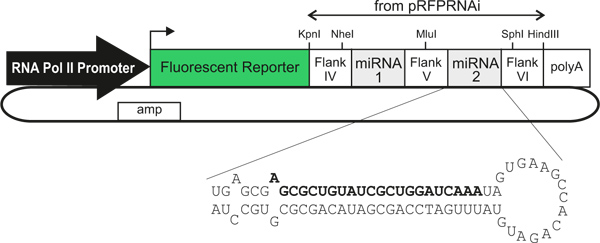
Рисунок 1. Обобщенная схема микроРНК-экспрессирующие плазмиды векторов. Использование различных РНК-полимеразы II промоутеров / усилители позволяют клетки определенного типа выражения. Трансфицированные клетки можно идентифицировать по выражению флуоресцентные репортеру, что непосредственно связано (в пределах одного стенограмма) на один или два искусственных микроРНК, которые сбивают экспрессии генов. Жирный текст означает смысловой нити искусственные микроРНК против LacZ, как описано в тексте.
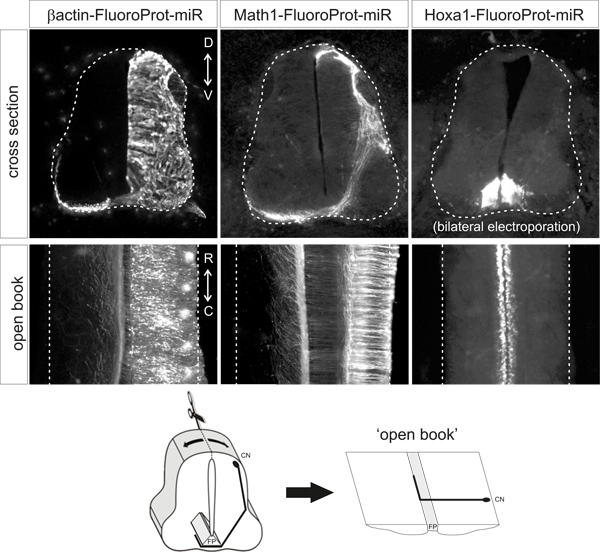
Рисунок 2. Типичные примеры оF флуоресцентный паттерны экспрессии белка, полученного после электропорации указанных плазмид векторов. Сечения и открытой книги с HH25-26 куриных эмбрионов, которые были электропорации в HH18. β-актин промотора диски повсеместное выражение, Math1 усилитель дисков выражение в dI1 нейронов и Hoxa1 усилитель диски выражении в частности, в плиты пола. CN, спаечный нейрона; FP, плиты перекрытия.
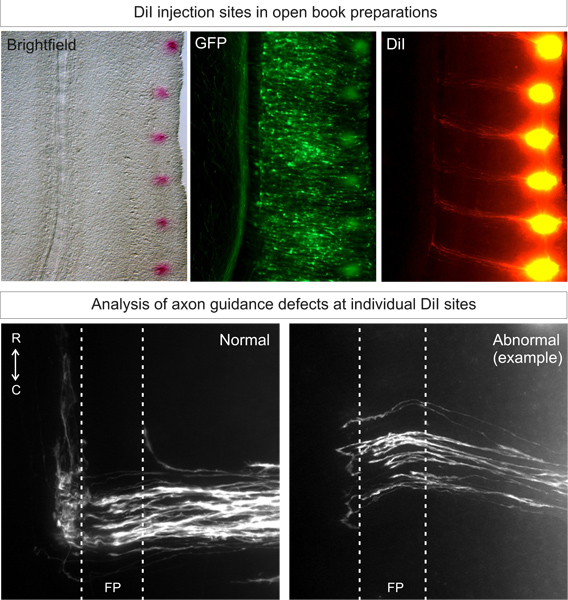
Рисунок 3. Применение и анализ DiI инъекции препаратов в открытой книгой. DiI должны быть введены в точечный узор, близкий к боковому краю раскрытой книги, на электропорации сторону (определяется по выражению флуоресцентных белков). После 3 дней диффузии, спаечный траектории аксонов должны быть в состоянии быть визуализированы при люминесцентной микроскопии. Нормальный траектории аксонов будет расти к полу рконца, пересечь плиты перекрытия, а затем включите и расти рострально. Аномальная фенотипы, связанные с генной нокдаун можно сравнить с этим архетипическим траектории. В примере, некоторые аксоны ларька в панели пола или сделать ошибочные решения поворота на противоположной стороне.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Этот простой, векторную искусственных стратегия выражение микроРНК могут быть использованы для нокдаун эндогенной экспрессии генов в куриных нервной трубки. Эти функциональные инструменты предлагают несколько глушителей гена, временной контроль и камерного типа специфичности, что?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа в лаборатории ES при поддержке Швейцарского национального фонда науки. Мы хотели бы поблагодарить д-ра Удар Kunz за помощь в съемках.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| 0,5 мм стеклянных капилляров | Инструменты Всемирной Precision | 1B120F-4 | |
| Стеклянные иглу съемника | Narishige | PC-10 | |
| Электропоратора | BTX | ECM 830 | |
| Sylgard силиконового эластомера | Инструменты Всемирной Precision | SYLG184 | |
| Вольфрамовой проволоки, 0,075 мм | Инструменты Всемирной Precision | TGW0325 | |
| Насекомое булавки, 0,20 мм | Средства изобразительных наук | 26002-20 | |
| Насекомое булавки, 0,10 мм | Средства изобразительных наук | 26002-10 | |
| Весна ножницы | Изобразительное наукиолы | 15003-08 | |
| Дюмон # 5 щипцы | Средства изобразительных наук | 11252-20 | |
| Дюмон № 55 щипцы | Средства изобразительных наук | 11255-20 | |
| Быстрый DiI | Молекулярные зонды | D-7756 | |
| Флуоресцентные микроскопы | Олимп | SZX12, BX51 |
Ссылки
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21(2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133(2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071(2010).
- Kim, B. G., Dai, H. -N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. ene Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены