このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
オープンブックの準備におけるDiIを注入による開発神経管と表現型の評価におけるmiRNAベースのプラスミドのインオボエレクトロで
要約
神経管における遺伝子発現は、細胞型特異的、トレーサブルな方法でダウンレギュレートすることができる方法が記載されている。我々はどのように実証するエレクトロポレーションは、途上神経管における交連軸索ガイダンスを調査するために使用することができます。
要約
DI1交連ニューロンは広範囲に開発1,2の間に軸索ガイダンスのメカニズムを解明するために研究されてきた。これらのニューロンは脊髄背側に位置し、紋切り型の軌跡に沿ってその軸索を送っています。交連軸索は、最初は腹側に向かって、その後floorplate渡って投影します。正中線を越えた後、これらの軸索は、長手方向に向かって鋭い脳吻側ターンして、プロジェクトを作成します。これらの各手順は、魅力と反発指導の手がかりの協調活動によって規制されています。これらの手がかりの正しい解釈は、その区画経路に沿って軸索の指導のために重要である。したがって、交連軸索ガイダンスに特定の分子の生理的貢献は、理想的に生きている胚の文脈で検討されている。したがって、in vivoでの遺伝子ノックダウンを正確に慎重に複数プレイしてもよい遺伝子の軸索ガイダンス活動を区別するために制御されなければならない開発時の役割。
ここでは、細胞型特異的、トレーサブルな方法で、チキン神経管におけるノックダウン遺伝子発現にメソッドを記述します。我々は、小説のプラスミドベクターの蛍光タンパク質マーカーの発現を駆動する3形質細胞型特異的プロモーター/エンハンサーを使用し、miR30-RNAiのトランスクリプト4(コードするcDNAの3'-UTR内の蛍光タンパク質にあります)により直接続く( 図1)。開発神経管にエレクトロとき、これらのベクターは、遺伝子発現の効率的なダウンレギュレーションを誘発し、ノックダウン3を経験した細胞のトレースを直接有効にする明るい蛍光マーカータンパク質を発現している。エレクトロポレーションの前に別のRNAiベクターを混合することにより、脊髄の独立した領域内の2つ以上の遺伝子の同時ノックダウンすることができます。これにより、s、高速な方法で、開発中に検討するために、複雑な細胞と分子の相互作用を可能にする、実装、正確かつ安価。オープンブックの準備5の交連軸索軌道のDIIトレースとの組み合わせでは、このメソッドは、交連軸索の成長と指導の細胞および分子機構のin vivo研究のための便利なツールです。原則的に、任意のプロモーター/エンハンサーは、潜在的な技術をより広く適用開発6における遺伝子機能のin vivo研究のために作り、使用することができる。
このビデオでは、最初に処理する方法について説明して、ウィンドウの卵、神経管へのDNAプラスミドの注入、エレクトロポレーション手順。交連軸索ガイダンスを調査するために、脊髄は、固定されたオープンブックの準備として、胚から除去され、軸索経路をトレースできるようにするためにDIIで注入される。脊髄は、カバーガラスとの間に装着し、共焦点顕微鏡を用いて可視化されています。
プロトコル
1。細胞型特異的遺伝子サイレンシングのためのRNAiプラスミドDNAの調製
プラスミド( 図1)は、以前に詳細3,4で説明したように、標準的な分子クローニング技術を用いて合成される。
ベクターへのクローニング1.1:oligonucelotide設計
- 我々はpRFPRNAiCベクトル4(ARK-ゲノミクス)に付属の製品情報に記載されているのと同じ普遍的オリゴヌクレオチドおよびクローニングプロトコルを使用します。
- 第1ヘアピン部位にクローニングするため:
5 'プライマーHP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
3 'プライマーのHP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - 第二ヘアピン部位にクローニングするため:
5 'プライマーのHP2:
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
3 'プライマーのHP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- 第1ヘアピン部位にクローニングするため:
- :我々は、遺伝子特異的な標的配列を選択するGenscriptのsiRNA標的Finderを使用https://www.genscript.com/ssl-bin/app/rnaiを 。
- クローニングするためのプライマー第1ヘアピンサイトへの遺伝子特異的なmiRNA:
サイレンGFPの例を以下に示します。
標的配列(22nt):5'-GGCACAAGCTGGAGTACAACTA
GFPフォワードHP1 = 59mer 
GFPリバースHP1 = 58mer 
miRNAのフランキング配列(鶏固有)、共通ループ/ステム配列(ヒトmiRNA30から)の一部を形成し、これらのオリゴで共通の配列があります。遺伝子特異的な標的配列には下線を付してある。午前があることに注意してくださいこの位置でmiRNA30における自然ミスマッチを模倣するために、(G→この例では、太字で示されている)はフォワード鎖の5 '付け根ismatch。
- クローニングするためのプライマー第二ヘアピンサイトへの遺伝子特異的なmiRNA:
サイレンLacZのための例を以下に示します。
標的配列(22nt):5'-CGCGCTGTATCGCTGGATCAAA
LacZをフォワードHP2: 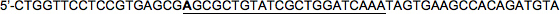
LacZをリバースHP2: 
再び、前方ストランド中の標的配列の5 '塩基が変更されていることに注意してください(太字で示されている、C→この例では)ので、ミスマッチアンチセンス配列を、miRNA30を模倣している。
1.2 PCR反応およびサブクローニング
- 遺伝子特異的オリゴは私達アール鶏のmiRNA隣接配列とmiRNA30ようなヘアピンを生成するために、PCR反応におけるユニバーサルオリゴとともにエド。
| 第1ヘアピン部位にクローニング: μlの1から10 ngのGFPのフォワードプライマーHP1 1μlの - 100 ngの5 'プライマーHP1 1μlの - 100 ngの3 'プライマーHP1 1μlのdNTPを(10mM)を 5μlの10×Pfuポリメラーゼ反応バッファー 1μlのPfu DNAポリメラーゼ(プロメガ) 39μlのPCRグレードの水 | OR | 第二ヘアピン部位にクローニング: μlの1から10 ngのLacZをフォワードプライマーのHP2 μlの1から100 ngの5 'プライマーのHP2 μlの1から100 ngの3 'プライマーのHP2 1μlのdNTPを(10mM)を 5μlの10×Pfuポリメラーゼ反応バッファー 1μlのPfu DNAポリメラーゼ(プロメガ) 39μlのPCRグレードの水 |
サイクル:
| 94℃ | 94℃ | 55℃ | 72℃ | 72℃ | 4℃ |
| 1分 | 30秒 | 30秒 | 1分 | 9分 | ホールド |
| 30サイクル | |||||
- ベクターに制限酵素とサブクローンで消化、PCR産物を精製する:
- 第1ヘアピンサイト:使用をNheIおよびMluI
- 第二ヘアピンサイト:使用をMluIおよびSphI
- 有能な細菌細胞の形質転換のための標準的な技術に従ってください。 LB寒天培地(アンピシリンを含む)およびプラスミドmidipreparationによって収穫DNA( 例えば NucleobondエクストラMidiキット、Machery-ナーゲル)で細胞をプレート。
- 濃縮されたプラスミドDNAをサスペンド-20℃で分光光度計や店舗によって滅菌蒸留H 2 0、測定濃度の
1.3シーケンシングのmiRNAプラスミド
標準的な条件下で配列決定反応は、多くの場合、ヘアピンの強い二次構造が原因で失敗します。この7を向上させるには :
- 水の代わりに0.01 mMのEDTA(pH8.0)で10mMのトリス-Clのシーケンシング反応を行う。これは、配列決定のために、より適している一本鎖DNA、超らせんDNAへの変換を向上させます。
- 前のシーケンスへの熱変性ステップ(98℃、5分)を追加します。これは、一本鎖DNAにスーパーコイルプラスミドDNAに変換します。
2。エレクトロポレーション
2.1卵の取り扱い
- 38.5℃、〜45%の湿度のインキュベーターセットに卵を置きます。
- 胚が発達の所望の段階に到達するまで卵をインキュベートする。交連ニューロンの軸索ガイダンスを研究するために、我々はtypicall彼らはハンバーガー&ハミルトン(HH)、ステージ17から18まで(インキュベーションの約3日後)8に達したときに yが胚をエレクトロポ。しかし、インジェクション、エレクトロポレーションは、ノックダウン効率のよいものとするため、目的のタンパク質が蓄積してきた前に実行する必要があります。
- インキュベーターから卵を取り出して、20分間安定した水平な位置に置いて、卵の上側に卵黄の上胚の位置を変更します。この期間中にインキュベーターに卵を返します。
試薬や機器の準備2.2
- 生理食塩水(PBS)、リン酸緩衝を準備し、0.2μmのフィルターをオートクレーブまたはを通して溶液を通過させることによって滅菌する。
- 適当引っ張っデバイス(例えばナリシゲPC-10)に、毛細血管(1.2 / 0.68外径/内径(mm)の世界精密機器1B120F-4)を引いてガラスマイクロピペットを作る。 〜5μmの先端径を得るために、マイクロピペットの先端を断つとしてチューブの部分に接続します適切な直径。
- 0.5cmの電極間距離で、しっかりと手持ちのフレームに白金電極を(0.5センチ)を取り付けます。方形波パルス発生器(BTX ECM 830)に電極を接続してください。
- 次のパラメータを使用して、パルス発生器を設定します。
- 一方的なエレクトロポレーション用:電圧:25 V、パルス数:5、パルスの長さ:50ミリ秒、パルス間隔:1秒
- 二国間のエレクトロポレーション用:電圧:18V、パルス数:5、パルスの長さ:50ミリ秒、パルス間隔:1秒
- 18G針、メス、70%エタノールとテープのスプリッツボトルを用いて注射器を準備します。
- 80℃で加熱プレート上にビーカー内のパラフィンワックスを溶かす
2.3ウィンドウ表示
- 70%エタノールに浸したティッシュを使って卵を拭いてください。
- 卵の長軸に沿ってテープのストリップを置きます。
- に1基、メスを用いて卵殻に2つの小さな穴を作るウィンドウ表示される領域の隅に卵や他の平滑末端。
- シリンジを用いて、約を削除します。卵の鈍端にある穴に45°の角度で針を挿入して、それぞれの卵から卵白の3ミリリットル。慎重に卵黄の損傷を防ぐ。
- 胚の損傷を防ぐために水平に保持され、小さなハサミを使って卵殻にウィンドウを切り取ります。必要であれば、胚の位置は卵の鈍端部に対して強い光を保持することによって検証され、鉛筆でマークすることができます。 1.5〜2センチメートルの正方形の窓は、ほとんどのアプリケーションに有用です。
- ブラシで適用された溶けたパラフィンワックスと卵の鈍端にある穴と卵殻内の任意の亀裂をシールします。
- 透明テープ( 例えばスコッチマジック)を使ってウィンドウを封印。
- インキュベーターに卵を返します。
2.4エレクトロ
- 無菌のツールを準備し、70%エタノールで作業領域を拭いてください。
- 私の準備njectionソリューション。適切なDNA濃度はユーザによって決定されなければならないと発現を駆動するために使用エンハンサー/プロモーターに応じて異なります。ガイドとして、我々は一般的に0.2から2.0μg/μLのを(説明を参照)を使用します。 20μlの合計では、注射混合物が含まれているはずです。
| RNAiのプラスミドDNA(H 2 O)に | μlのX |
| 20X PBS | 1μlの |
| 0.4%トリパンブルー | 2μlの |
| 最終容量を滅菌蒸留H 2 0、 | 20μlの |
チューブに接続されているマイクロキャピラリーガラスにDNA混合物をロードするために穏やかな吸引を使用しています。
- ウィンドウ卵からテープを外し、ハンバーガーとハミルトン8に従って胚を上演。
- 慎重extraeを除去するために鉗子と春のはさみを使用胚の尾側半分からmbryonic膜。膜は簡単に主要な左右の卵黄静脈がトランクに入る地域での胚から離れて持ち上げることができる。そっと涙またはカット膜をとテールに向かってそれらを引き出します。必要であれば、胚はBoullandら9によって映像に示すように、胚盤と卵黄の間に墨汁またはファストグリーンの溶液を注入することによって、より良い可視化することができる。
- ちょうど後肢の上、神経管の中心管にDNA溶液を注入します。口から注入量を制御します。青色色素は最大発達中の脳の脳室に、尾の先端から広がるはずです。
- 胚の上に滅菌PBSを数滴を追加します。
- 胚の前後軸と平行に電極を配置します。胚や血管に触れないようにしてください。
- 電極は安定したまま、エレクトロポ。
- 慎重に電極を取り外し、それらをすすぎ卵白から変性したタンパク質を除去する滅菌水。
- 二国間のエレクトロポレーションは、電極の極性を切り替えて、胚に平行電極を再配置し、エレクトロポレーションを繰り返します。滅菌水で電極を洗浄します。
- 胚にいくつかのより多くの滅菌PBSをドロップします。テープで卵を封印し、目的の発達段階に到達するまでインキュベーターに戻します。適切なシールは、胚の脱水を避けることが重要です。
3。脊髄準備
胚の3.1解剖
- HH25-26(孵卵5日目)で、鉗子または小さいスプーンを使って卵から胚を削除します。シリコーン(シルガードエラストマー)でコーティングされたペトリ皿にPBSにそれを置きます。
- 胚体外膜を取り外して、その裏に胚を置く。穏やかsで、首と尾(0.20ミリメートル虫ピンを使用)を介して、それを固定することによって、プレートの上に、それを安定させるtretching。
- 全胚は(後でセクショニング用)4%パラホルムアルデヒド(PFA)を含むPBSを交換し、室温で1時間インキュベートすることにより、ここで固定することができます。開いた本の準備をするために、以下に説明するように固定されていない組織でプロトコルを続けています。
胚から脊髄の単離3.2
- 彼らは解剖の邪魔にならないようにピンが離れて胚からの角度で挿入されていることを確認しながら、手足をピン。胚は、以下の手順で認識されるべき組織の密度を有効にするには、下から照らされるべきである。
- 心と春のはさみを使って内臓を取り出して、そっとピンセットでこする。すべての器官が完全に削除されている場合はセグメント化された脊椎と脊髄が見えるはずです。
- 春のはさみを使用して、首で脊髄を覆う椎骨を通して浅いカットを行う。胚を180°回転させ、2を短くする尾に向かって首から脊髄のいずれかの側の椎骨を通る縦方向カット、。離れて脊髄からとテールに向かって単一のストリップにおける組織(すべての椎骨を含む)皮椎骨のフラップを持ち上げるためにピンセットを使用しています。
- そっと尻尾や手足を通して胚を伸ばし、再度ピン。
- 脊髄を覆う髄膜を切り取って微顕微メス( 例えば Grieshaber 68101)またはタングステン針を使用します。神経管および後根神経節間の組織の濃い、密な行を探します。必要に応じて、照射角度を調整します。優しく首から尾部に、脊髄の両側にこの線に沿って長手方向に切断。髄膜は、固定された胚のストレッチ穏やかに起因する脊髄から分離する必要があります。
- 翅芽のレベルで脊髄を切断し、肢芽への尾と、尾に1回でスムーズに吻側の胚の脊髄全体を持ち上げモーション、鉗子を使用しています。隔離された脊髄は、このステップでPBSに浸し保たれるべきである。皿から持ち上げないでください。
オープンブックの3.3ギャグ
- へらの上に隔離された脊髄を広げ、PBS中の4%パラホルムアルデヒドを含む新しいシリコーンライニングペトリ皿に移します。
- 慎重に6箇所(吻方、内側と尾側にそれぞれの側に、0.10ミリメートル虫ピンを使用して)で脊髄を固定することによって、フラットマウント製剤を製造。私たちは、胚を識別するだけでなく、オープンブックの準備の前端を示すだけでなく、少し 'フラグ'で各製剤にラベルを付けます。
- 30分〜1時間室温でインキュベートする。これはDiIを拡散10の効率を低下させると背景が増えるので、オープンブックは過剰修正されるべきではありません。
- 慎重に4%PFAを捨て、PBSでそれを交換してください。 ℃のDiIまたはマウントで注入する準備ができるまで4で料理をしてください。
- 蛍光miscroscopyの下、オープンブックを観察し、DIIで注入するために、オープンブックの適切な側を選択します。
- ファストDIIを(エタノール中の5 mg / ml)を準備し、プラスチックチューブに接続されたガラスマイクロピペットに溶液を描く。非常に小径の先端を得ることなど細かくできるだけマイクロピペットの端を折ります。 PBSの皿に針を挿入するとDIIが針から漏れていないことを確認します。 DIIのが漏れた場合、針径が大きすぎます。その場合には、新しい注射針を用意します。
- 下から開いているブックの準備を照らす。準備の外側縁からhemibookの幅の約1/5に位置する組織の密度が高い縦ストライプを探してください。これは、屋根板にちょうど腹発見さ交連ニューロンの細胞体に対応しています。オープンブックの一端から始まって、私は針のように、組織の中にガラス針を挿入し、撤回sは、口のピペットを用いてDiIの少量のパフ。
- 約0.5mmの等間隔に開いたブックの長さに沿っていくつかの注射を作り、素早く作業。針が詰まった場合は、慎重にピンセットでそれをクリアしてください。先端が大きすぎる(およびDII漏れ)になった場合は、針を交換してください。
- あなたが開いている各書籍が完了したら、余分な距離を吸うと破棄するホールピペットを使用し、DIIは漏れた。これを怠ると、高いバックグラウンドになります。
- 4℃で約3日のための準備を残す℃のDiIをは軸索に沿って広がるのを可能にする。
イメージング用取付3.5
- 24ミリメートル×24 mmのカバーガラスの縁の周りに真空グリースの薄い、途切れない境界線( 例えばダウコーニング#976V)を広めるために18Gの針で注射器を使用しています。ウェルに滅菌PBSを数滴を追加します。 n-プロピル没食子酸とグリセロールを含む封入剤が共存できないことに注意してくださいDiIを11にmpatible。同様に、低粘度の真空グリースは、PBSや高いバックグラウンドでの結果と混ざることがあります。
- オープンブックからピンを取り除き、PBS滴にそれを転送します。オープンブックを浸し、よくの中央に配置します。
- 優しくオープンブックを開いたままにしていることを確認しながら、上に別の24ミリメートル×24 mmのカバーガラスを配置します。必要な場合は、カバーガラスを除去し、オープンブックは再配置することができる。グリースの完全なシールを作成するための準備のエッジの周りにゆっくりと押します。過剰のPBSは、このステップで絞り出されます。気泡を避けてください。
- ℃の蛍光顕微鏡による検査やドキュメントの準備が整うまで4℃の暗所で準備しておいてください。これは、準備が乾燥しないように確認するために、(1週間以内)迅速に行われる必要があります。
4。代表的な結果
プラスミドのエレクトロポレーションと表現
下上記の条件では、蛍光タンパク質は、抗体標識による信号の追加の増幅を必要とせずに、適切な細胞型で明確に検出可能である必要があります。蛍光タンパク質は、所望の細胞型/ sで検出可能である必要があります。オープンブックの準備と異なるプラスミドでエレクトロ胚の断面の代表的な例を図2に示します。
人工miRNAの効率
興味のある新規遺伝子に対する人工miRNAは最初にノックダウン効果の効率性と特異性のスクリーニングをする必要があります。私たちは、0.25μg/μLのでエレクトロβ-アクチンプロモーター駆動コンストラクトは、この3に対して適切であることを見つける。 in vivoでのノックダウンは、免疫組織化学により、またはin situハイブリダイゼーションでテストすることができます。
DiIをラベリング
野生型胚への適切なターゲットDiIを注入図3に示すように、理想的な、典型的な軌道3の注射部位の80%以上が得られるはずです。動物のばらつきに動物が低くなければならない。
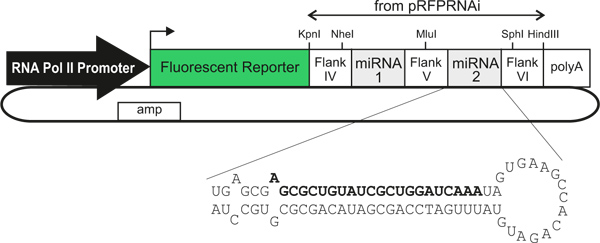
図1 miRNA発現プラスミドベクターの一般概略図。別のRNAポリメラーゼIIプロモーター/エンハンサーを使用することは、細胞型特異的な発現を可能にします。トランスフェクトされた細胞は、直接遺伝子発現をノックダウンする1つまたは2つの人工のmiRNAに(単一のトランスクリプト内で)リンクされている蛍光レポーターの発現によって識別できます。文章で説明しているように、太字のテキストは、LacZ遺伝子に対する人工miRNAのセンス鎖を示しています。
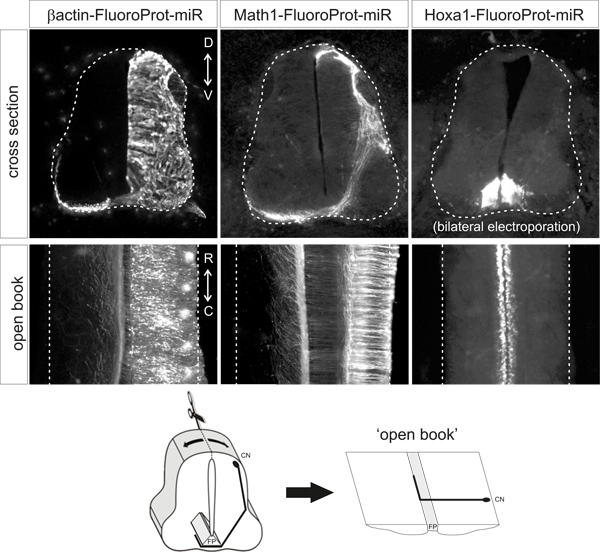
図2代表的な例Ofの蛍光タンパク質の発現パターンは、指示されたプラスミドベクターをエレクトロポレーション後に得られる。断面とオープンブックはHH18でエレクトロポレーションしたHH25-26ニワトリ胚からのものである。 β-アクチンプロモーターがユビキタスな発現を駆動する、Math1のエンハンサーは、DI1ニューロンに発現を駆動するとHoxa1エンハンサーは床板で特異的に発現を駆動する。 CN、交連ニューロン、FP、床板。
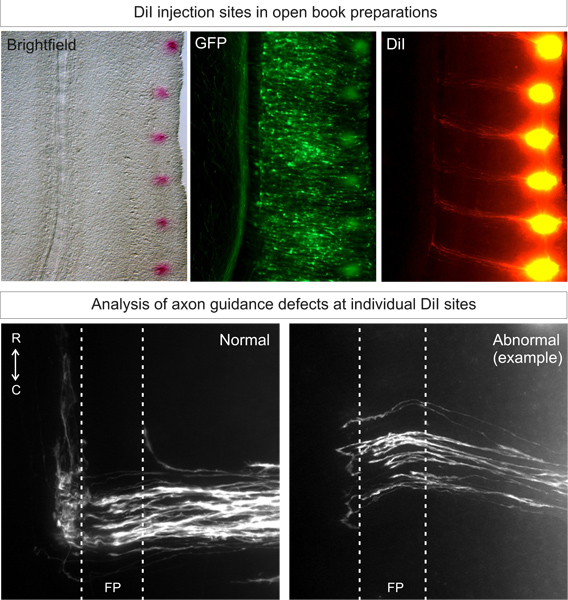
図3:開いた本製剤中のDIIの注射部位の応用と分析。 DiIをエレクトロポレーションした側は、(蛍光タンパク質発現によって識別される)上に、近くに開いた本の横方向の余白に、斑点状のパターンに注入する必要があります。拡散の3日後、交連軸索軌道は、蛍光顕微鏡下で可視化することができるはずです。正常な軸索軌道は床Pに向かって成長します後半、床板を渡り、次に回すと吻方育つ。遺伝子ノックダウンから生じる異常な表現型は、この典型的な軌跡と比較することができます。床板の例では、いくつかの軸索は、ストールまたは反対側に誤ったターニング決定を下す。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この単純な、ベクトルベースの人工miRNA発現戦略は鶏神経管におけるノックダウン内在性遺伝子の発現に使用することができます。これらの機能のツールは、複雑な発達経路の解明を容易にするために、複数の遺伝子サイレンシング、時間的制御と細胞型特異性を提供します。プラスミドは交連ニューロンやそれらの中間目標、floorplate 3ノックダウンの異なる遺伝子を使用するこ...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
ESのラボの仕事はスイス国立科学財団によってサポートされています。我々は撮影の支援については博士ビートクンツに感謝したいと思います。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| 0.5ミリメートルガラスキャピラリー | ワールド·精密機器 | 1B120F-4 | |
| ガラス針プラー | ナリシゲ | PC-10 | |
| エレクトロポ | BTX | ECM 830 | |
| シルガードシリコーンエラストマー | ワールド·精密機器 | SYLG184 | |
| タングステン線、0.075ミリメートル | ワールド·精密機器 | TGW0325 | |
| 虫ピン、0.20ミリメートル | ファイン科学ツール | 26002から20 | |
| 虫ピン、0.10ミリメートル | ファイン科学ツール | 26002から10 | |
| 春のはさみ | ファイン科学へOLS | 15003から08 | |
| デュモン#5鉗子 | ファイン科学ツール | 11252から20 | |
| デュモン第55鉗子 | ファイン科学ツール | 11255から20 | |
| ファストDiIを | 分子プローブ | D-7756 | |
| 蛍光顕微鏡 | オリンポス | SZX12、BX51 |
参考文献
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21(2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133(2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071(2010).
- Kim, B. G., Dai, H. -N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. ene Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved