Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Las investigaciones sobre alteraciones de la función del circuito del hipocampo después de una lesión cerebral traumática leve
En este artículo
Resumen
Un enfoque multifacético para investigar cambios funcionales en los circuitos del hipocampo se explica. Técnicas electrofisiológicas se describen junto con el protocolo de lesión, las pruebas de comportamiento y método de disección regional. La combinación de estas técnicas se pueden aplicar de forma similar para otras regiones del cerebro y preguntas científicas.
Resumen
Lesión Cerebral Traumática (TBI) afecta a más de 1,7 millones de personas en los Estados Unidos cada año e incluso lesión cerebral traumática leve puede conducir a alteraciones neurológicas persistentes 1. Dos síntomas generalizados e incapacitantes que experimentan los supervivientes de LCT, déficit de memoria y una reducción en el umbral de convulsiones, se piensa que es mediado por TBI inducida por disfunción del hipocampo 2,3. Con el fin de demostrar cómo la función alterada de circuito del hipocampo afecta adversamente el comportamiento después de la LCT en ratones, se emplean lesión lateral percusión de fluido, un modelo animal comúnmente usado de TBI que recrea muchas características de humano TBI, incluyendo la pérdida celular neuronal, gliosis, y perturbación iónica 4 - 6.
Aquí se demuestra un método combinatorio para investigar TBI inducida por disfunción del hipocampo. Nuestro enfoque incorpora múltiples técnicas ex vivo fisiológicas junto con el comportamiento animal y el análisis bioquímico, con el fin de analizarpost-TBI cambios en el hipocampo. Comenzamos con el paradigma experimental de lesión junto con análisis de comportamiento para evaluar la discapacidad cognitiva después de TBI. A continuación, se presentan tres diferentes técnicas de grabación ex vivo: grabación de campo potencial extracelular, visualizados de células enteras parche de sujeción y tensión de grabación de tinte sensible. Por último, demostrar un método para regionalmente disección subregiones del hipocampo que puede ser útil para el análisis detallado de alteraciones neuroquímicas y metabólica post-TBI.
Estos métodos han sido utilizados para examinar las alteraciones en los circuitos del hipocampo después de TBI y para investigar los cambios opuestos en función de la red de circuito que se producen en el giro dentado y CA1 subregiones del hipocampo (ver Figura 1). La capacidad de analizar los cambios post-TCE en cada subregión es esencial para la comprensión de los mecanismos subyacentes que contribuyen a la lesión cerebral traumática inducida conductual y cognitivo deficits.
El sistema multifacético descrito aquí permite a los investigadores a empujar más allá de la caracterización de la fenomenología inducida por un estado de enfermedad (en este caso TBI) y determinar los mecanismos responsables de la patología observada asociada con lesión cerebral traumática.
Protocolo
1. Fluid lateral Lesión Percusión
- Anestesiar el ratón utilizando una mezcla de vía intraperitoneal dado ketamina y xilazina. A continuación, preparar la cabeza del ratón para la incisión utilizando un exfoliante yodo.
- Realizar una craniectomía sobre el área parietal derecha usando 3 mm (diámetro exterior) trépano.
- Secure Luer-loc cubo de la aguja (diámetro interior 3 mm) sobre el uso de la craniectomía acrílico cyanoarylate y dental.
- 24 horas más tarde, anestesiar el ratón utilizando isoflurano mediante inhalación.
- Una vez que reanude la respiración normal, pero antes de que el ratón se convierte en sensible a la estimulación, entregar 20 ms de pulso de solución salina en el cráneo a través del dispositivo de percusión lesión fluido.
- Inmediatamente después de la lesión retirar el cubo, reanaesthetize el ratón utilizando isoflurano, y suturar el cuero cabelludo cerrado.
Sham controles operados recibirá un procedimiento idéntico con el paso 1,5 omitido.
2. Behavioral Analysis - Resp miedo condicionadoOnse
- Maneje los ratones en dos días consecutivos antes de la respuesta de miedo condicionado (CFR) de formación.
- Coloque el ratón en la cámara de aire durante 3 minutos antes de la administración de 1,5 choque piso mA durante 2 segundos. Deja ratón en la cámara durante 30 segundos.
- Después de período de retardo (normalmente 24 horas), volver a la cámara de acondicionamiento del ratón durante 5 min. Evaluar la congelación a intervalos de 5 seg.
Análisis consiste en comparar la cantidad relativa de tiempo de congelación en dos poblaciones, en nuestro caso con lesión cerebral ratones y controles con operación simulada. Las menores tasas de congelación (en comparación con el control) indica la incapacidad de retener la asociación entre el contexto y el choque piso, una indicación de deterioro de la memoria y la disfunción cognitiva.
3. Preparación agudas rodajas de hipocampo
* Nota: anestesia utilizando una campana de vidrio sólo puede ser implementado para los procedimientos de terminales (tales como la disección de cerebro se describe aquí).
- 7 días después delesión, hacer 1 L de líquido cefalorraquídeo artificial (ACSF) y 250 ml de solución de sacarosa de corte.
- Use hielo liberalmente para garantizar que todos los instrumentos y soluciones utilizados durante la preparación de cortes de cerebro son helada.
- Anestesiar ratón utilizando isoflurano. Rápidamente y con cuidado retire cerebro de ratón y colocar en sacarosa.
- Recortar cerebro y el lugar en la superficie de corte sobre una gota de pegamento en frente de un bloque de agar.
- Cortar 350 micras de espesor cortes coronales, usted debería ser capaz de obtener 4 o 5 rodajas con el circuito del hipocampo intacto.
- Incubar las rebanadas durante al menos 1 hora a 37 ° C.
4. Campo extracelular de registro de potenciales
- Tire de electrodos de vidrio de borosilicato de 2-5 MΩs utilizando extractor vertical.
- Lugar rebanada en la cámara y el electrodo de inserción en el soporte del electrodo.
- Baje electrodo de estimulación en el segmento en un tracto axonal como el camino perforante o colaterales Schaffer. De grabación inferior electrodoen posición mientras trazas de salida de vigilancia para asegurarse de que los electrodos están en el mismo nivel Z (profundidad). Cuando una respuesta máxima se consigue, manteniendo el nivel de estimulación de corriente constante, los electrodos están en el mismo nivel Z.
- La traza resultante consta de tres componentes: el voleibol fibra presináptica, el campo extracelular potencial postsináptico (fEPSP) y el pico de población postsináptica. Los componentes se pueden superponer temporalmente en algunas preparaciones, haciendo el análisis más difícil. Si hay ambigüedad entre si las respuestas son presináptica o postsináptica, APV y CNQX se puede añadir al baño para bloquear la transmisión excitatoria, y todas las señales restantes serán de origen presináptica.
- Protocolos de estimulación variar para producir tres tipos de experimentos distintos: entrada / salida de las curvas, los pares de grabaciones pulso y experimentos a largo plazo plasticidad.
Análisis consiste típicamente en mediciones comparando la pendiente de la fEPSP través en ambos ratones con lesiones cerebrales y ShamFuncionan con los controles, el control de la fuerza de entrada mediante la medición de la descarga de la fibra.
5. Visualizado Patch-clamp grabación
- Preparar rebanadas, electrodos y del equipo de perforación para grabar como se ha descrito anteriormente, hasta el paso 4,2.
- Sólo considerar células más profundo que 80 micras en el tejido como las células más cercanas a la superficie será muerto y / o se han reducido conectividad. Enfoque de una célula con una presión positiva sobre el electrodo para asegurarse de que no se obstruya medida que se mueve hacia abajo a través del tejido. Cuando el electrodo toca suavemente la célula de aplicar presión negativa a fin de crear un "gigaseal 'entre el electrodo y la membrana plasmática.
- Aplicar ráfagas cortas de presión negativa con el fin de romper la membrana plama bajo el electrodo y lograr configuración de célula completa.
- Eliminar los transitorios de capacitancia utilizando un amplificador y compensar la resistencia de serie. La compensación de la resistencia en serie de la célula es esencial para asegurar unaccurate mediciones.
- Dos modos de grabaciones de células individuales se puede realizar: pinza de corriente (voltaje de la membrana de medición) y la abrazadera de tensión (medición de corriente que pasa a través de los canales iónicos de la membrana).
Los posibles tipos de análisis son numerosos, pero en nuestro caso, principalmente, de análisis biofísico cuantificar la tasa y el tamaño de las corrientes sinápticas espontáneas, tanto en ratones con lesiones cerebrales y los controles sham-operados.
6. Tensión Sensitive imágenes Dye (VSD)
- Preparar las rebanadas y el aparejo para grabar como se ha descrito anteriormente, hasta el paso 4.2.
- Preparar acciones tinte mezclando 1 mg di-3-ANEPPDHQ en 50 l de etanol; suministrar 2 alícuotas en tubos de embalaje flexible, almacenar a -20 ° C. Hacer trabajar solución colorante diaria, mediante la dilución de 1:200 en LCRa.
- Incubar rebanada en LCRa papel de filtro humedecido y se tiñen con 90 l de colorante durante 16 minutos, enjuague con LCRa y lugar en la cámara de interface de grabación.
- Ajuste la luz stimulation intensidad hasta que la respuesta se centra en el medio del rango de la cámara. Las imágenes se adquirieron típicamente a una velocidad de 500-1,000 fotogramas por segundo.
- Disparador del obturador para la luz estimulación de 200 ms antes de la estimulación eléctrica para permitir photobleaching rápida inicial se estabilice. Ensayos alternativos de adquisición entre estimulado eléctricamente, y se estimularon eléctricamente no, para permitir la posterior sustracción de fondo no estimulado. Registro de la intensidad de luz en reposo (lectura de fluorescencia con el obturador cerrado) antes de la apertura del obturador. Cada ensayo será un VSD x píxeles por Y píxeles por hora "película" de las lecturas de fluorescencia. Registro de 10 a 12 ensayos VSD en cada condición de prueba.
- Todas las mediciones se realizan en el cambio de fluorescencia intra-pixel pre-eléctrica-estímulo normalizado, dF / F, que se calcula como sigue:
Reste la intensidad de la luz en reposo de la CIV prueba prima adquirida. Para cada píxel en cada ensayo, normalizar de acuerdo con el valor medio pre-eléctrica-estímulo para quejuicio, y restando la unidad. Para ello, tanto para los ensayos eléctricamente estimulados y no estimulados eléctricamente. Crea un promedio de "fluorescencia de fondo" juicio de los ensayos no estimulado eléctricamente, y reste este juicio de fondo de los ensayos estimulados eléctricamente. Un análisis más detallado se realiza típicamente en el promedio de 10 a 12 tales ensayos, que generalmente también se filtra en el espacio y tiempo para mejorar la relación señal a ruido.
7. Las disecciones regionales para análisis bioquímicos
- Eliminar el cerebro del ratón como se ha descrito previamente.
- Preparar rebanadas utilizando cortador de tejidos.
- Lay sección plana, microdissect área CA1 y DG.
- Inmediatamente sumerja en el inhibidor de la proteasa que contiene tampón de lisis. Congelar en nitrógeno líquido y se almacena a -80 ° C.
8. Los resultados representativos
Nuestros experimentos suelen comenzar con los datos de comportamiento para confirmar la esperaed déficits cognitivos que existen en ratones con lesiones cerebrales. Empleamos contextual pruebas acondicionado respuesta de miedo ya que es un comportamiento dependiente del hipocampo que es fiable y requiere sólo una sesión de entrenamiento y una sesión de pruebas. Los datos representados en la Figura 2 representa las pruebas de comportamiento para medir la memoria anterógrada, sin embargo, la prueba también se puede utilizar para medir la memoria retrógrada si la sesión de entrenamiento se lleva a cabo antes de la lesión.
Campo potenciales postsinápticos excitatorios (fEPSPs) se miden para determinar la eficacia sináptica neta de una gran población de células (Figura 3A). Nos emplean comúnmente tres tipos diferentes de patrones de estimulación, cada uno proporcionando sus propios resultados y conclusiones. En primer lugar, mediante el aumento de la intensidad de estimulación a través de una serie de pasos, se crea una curva de entrada / salida (Figura 3B / C).
A continuación, mediante la entrega de dos estímulos de la misma intensidad por separadod por un breve intervalo de tiempo (normalmente 50 ms) se investigan posibles alteraciones en la liberación de vesículas sinápticas probabilidad;. Adicionalmente, se realizan a menudo potenciación a largo plazo (LTP) experimentos. Después de establecer una respuesta de línea base, la estimulación de alta frecuencia breve (generalmente de 100 Hz) en la misma intensidad se entrega, causando una cascada intracelular que conduce a una respuesta sináptica potenciada cuando la estimulación normal se reanuda.
La actividad eléctrica de células enteras patch-sujetada células se puede grabar en dos modos. En el modo de fijación de voltaje, el experimentador controla la tensión de la membrana de la célula de patch-sujeta en referencia a la bañera, a través de software de ordenador asociado con el amplificador. En este caso las corrientes postsinápticas que median los eventos son registrados, proporcionando información sobre la frecuencia de liberación presináptica, número de receptores postsinápticos activados y la concentración de neurotransmisor vesicular (Figura 4A). En el modo de abrazadera de corriente del experimentadormanipula la corriente inyectada y mide la respuesta de tensión. Esto puede ser útil para determinar las características del potencial de acción, tales como umbral del potencial de acción y medio de ancho. Estas características permiten la clasificación funcional de las neuronas excitadoras o inhibidoras como en base a sus patrones de disparo del potencial de acción (figura 4B). Con el fin de verificar la identidad celular se recomienda rellenar celdas con Amarillo Lucifer después de la grabación y de la identidad confirmar visualmente por la presencia o ausencia de las espinas dendríticas. (Figura 4C, D).
Un ejemplo de los resultados de un experimento utilizando colorante sensible al voltaje para medir los cambios en la tensión de la membrana se muestra en la Figura 5. En este caso, un electrodo de estimulación se ha colocado en la vía colateral Schaffer y la actividad resultante neuronal en el área CA1 se analiza. Tinte sensible a la tensión no informa de los valores absolutos de voltaje de la membrana, sino más bien tque el cambio en la tensión de un estado básico sin estimulación. Sin embargo, los análisis que comparan dos condiciones (por ejemplo una lesión cerebral vs operado de forma simulada) se puede utilizar para determinar los parámetros espaciotemporales de alteraciones fisiológicas que no pueden medirse utilizando fEPSPs o de células enteras de grabación de patch-clamp.

Figura 1. Diagrama del circuito del hipocampo. Una sección horizontal a través del hipocampo. Las principales vías a través del hipocampo se muestran en amarillo. Los axones de las neuronas en la corteza entorrinal proyecto a través de la vía perforante en el giro dentado formar sinapsis con las dendritas de las células del gyrus dentado gránulo. Axones de células gránulo proyecto través de la vía de fibras musgosas a CA3 donde forman sinapsis con las dendritas de las neuronas CA3. Los axones de las neuronas CA3 proyecto a través de la vía colateral Schaffer en el DendritES de células piramidales de CA1. Los axones de las células piramidales CA1 proyectar fuera del hipocampo a través del subículo. Nota: También se representa son piramidales CA3 colaterales axonales de células que se proyectan hacia el hipocampo contralateral a través de la fimbria. (CA1: Cornu Ammonis 1, CA2: Cornu Ammonis 2, CA3: Cornu Ammonis 3, DG: giro dentado, línea discontinua indica capa de células del cuerpo, línea continua indica los límites estructurales.)
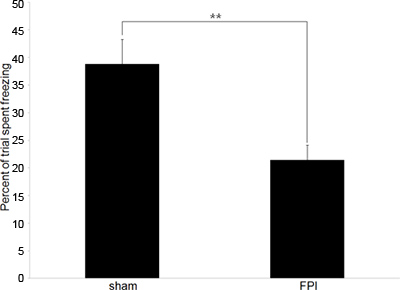
Figura 2. Datos representativos del comportamiento A:. Datos de comportamiento que representan la diferencia en las tasas de congelación entre ratones con lesiones cerebrales (FPI) y los controles de operación simulada (sham) en el paradigma del miedo respuesta condicionada. Formación ocurrió el día de la lesión 6 ª siguiente, con el período de prueba se producen 24 horas más tarde. (** Denota p <.01).

Figura 3. Los datos representativos registro extracelular A:. Un ejemplo de un campo de excitación potencial postsináptico (fEPSP) de grabación en el área CA1. La desviación hacia abajo primero es el artefacto del estímulo, seguida de la volea fibra presináptica y finalmente la fEPSP. B: entrada / salida de las curvas que representan una disminución de la eficacia sináptica neta en CA1 después de una lesión percusión fluido (FPI). C: Entrada / salida de las curvas que representan un aumento de la eficacia sináptica neta en el giro dentado (DG) después de FPI. (* Indica p <0,05). Haga clic aquí para ampliar la cifra .
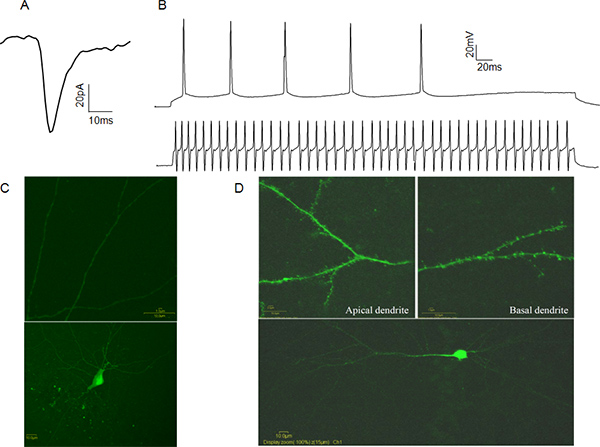
Figura 4. Representante Plenario de células patch-clamp de datos A: Un ejemplo espontáneo.excitatorios postsinápticos actual (sEPSC) a partir de una célula piramidal CA1. B: Ejemplos de los trenes de potencial de acción de una célula piramidal CA1 (traza superior) y un rápido spiking CA1 interneuron (traza inferior). C: Ejemplo de un amarillo Lucifer lleno CA1 interneuronas inhibitorias. Nótese la ausencia de espinas dendríticas (panel superior). D: Ejemplo de Lucifer amarillo lleno CA1 neurona piramidal. Cabe destacar la presencia de espinas dendríticas (panel superior). Haga clic aquí para ampliar la cifra .
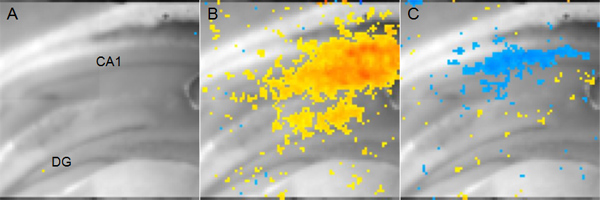
Figura 5. Tensión representativa de datos sensibles por imágenes Dye A:. Ratón coronal rebanada hipocampo aparece para mostrar la anatomía. (DG: giro dentado, CA1: Cornu Ammonis 1) B: Amarillo a píxeles rojos representan la actividad excitatoria en el área CA1 14 mseg después de la estimulación aferente garantía Schaffer. Red endica más despolarización mientras que el amarillo indica una despolarización más bajo, pero aún significativa. C: pixeles azules que representan los sitios de actividad inhibitoria en el área CA1 56 mseg después de la estimulación aferente misma garantía Schaffer muestran en azul oscuro B. indica más hiperpolarización.
Discusión
Cada técnica descrita anteriormente contribuye a la mejor comprensión del mecanismo subyacente que causa el déficit de comportamiento observado. Al combinar la información obtenida de cada uno único método que es capaz de examinar los mecanismos biológicos con mayor precisión.
FEPSPs de medida es útil para cuantificar la eficacia sináptica neta de grandes regiones, espacialmente definidas de neuronas. También puede proporcionar información sobre el potencial de un grupo de célul...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Elliot Bourgeois por su asistencia técnica. Este trabajo fue financiado por los Institutos Nacionales de Salud subvenciones R01HD059288 y R01NS069629.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del equipo | Empresa | Número de catálogo | Comentarios (opcional) |
| Axopatch 200B amplificador | Molecular Devices | Axopatch 200B | Patch-clamp plataforma |
| Digidata 1322A digitalizador | Molecular Devices | Patch-clamp plataforma | |
| MP-225 micromanipulador | Sutter | MP-225 | Patch-clamp plataforma |
| DMLFSA microscopio | Leica | Patch-clamp plataforma | |
| MultiClamp amplificador 700B | Molecular Devices | MultiClamp 700B | Múltiples (campo)aparejo |
| Digidata 1440 digitalizador | Molecular Devices | Multipurpos (campo) rig | |
| MPC-200 micromanipulador | Sutter | MPC-200 | Múltiples (campo) rig |
| BX51WI microscopio | Olimpo | BX51WI | Múltiples (campo) rig |
| Axoclamp amplificador 900A | Molecular Devices | Axoclamp 900A | VSD plataforma |
| Digidata 1322 digitalizador | Molecular Devices | VSD plataforma | |
| Camisas rojas cámara CCD-SMQ | Camisas rojas | NCS01 | VSD plataforma |
| VT 1200S Vibratome | Leica | 14048142066 | |
| P-30 Electrodo extractor | Sutter | P-30 / P | |
| inhibidor de la proteasa completar | Roche | 11697498001 |
Referencias
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados