É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Investigações sobre alterações da função Circuito Hippocampal Após lesão cerebral traumática leve
Neste Artigo
Resumo
Uma abordagem multi-facetada para investigar alterações funcionais para circuitos do hipocampo é explicado. Técnicas electrofisiológicas são descritos em conjunto com o protocolo de lesão, testes comportamentais e método de dissecação regional. A combinação destas técnicas pode ser aplicada de forma semelhante para outras regiões do cérebro e perguntas científicas.
Resumo
Traumatismo crânio-encefálico (TCE) atinge mais de 1,7 milhões de pessoas nos Estados Unidos a cada ano e até TCE leve pode levar a prejuízos neurológicos persistentes 1. Dois sintomas difusos e incapacitante vividas por sobreviventes de TCE, déficits de memória e uma redução no limiar de convulsão, são pensados para ser mediado pelo TCE induzida por disfunção do hipocampo 2,3. A fim de demonstrar como as alterações da função do hipocampo circuito afeta negativamente o comportamento após o TCE em camundongos, que empregam lesão percussão lateral do fluido, um modelo animal comumente usado do TCE que recria vários recursos do TCE humana, incluindo a perda de células neuronais, gliose e perturbação iônica 4 - 6.
Aqui demonstramos um método combinatorial para investigar TBI induzida disfunção do hipocampo. A nossa abordagem incorpora técnicas ex vivo fisiológicos múltiplos em conjunto com o comportamento dos animais e a análise bioquímica, a fim de analisarpós-TCE alterações no hipocampo. Começamos com o paradigma experimental de lesão juntamente com a análise comportamental para avaliar a deficiência cognitiva após TCE. Em seguida, apresentam três diferentes técnicas ex vivo de gravação: gravação campo extracelular potencial, visualizado de células inteiras patch-fixação e gravação de corante tensão sensível. Finalmente, demonstramos um método para dissecar regionalmente sub-regiões do hipocampo que pode ser útil para uma análise detalhada de alterações neuroquímicas e metabólicos pós-TCE.
Estes métodos têm sido usados para avaliar as alterações no sistema de circuitos do hipocampo após TBI e para sondar as alterações opostas em função do circuito de rede que ocorrem no giro dentado e CA1 sub-regiões do hipocampo (ver Figura 1). A capacidade de analisar as mudanças pós-TCE, em cada sub-região é essencial para a compreensão dos mecanismos subjacentes que contribuem para o TCE induzida comportamental e cognitiva deficits.
O sistema multi-facetado descrito aqui permite aos investigadores para empurrar passado caracterização da fenomenologia induzida por um estado de doença (neste caso TBI) e determinar os mecanismos responsáveis pela patologia observada associada com TCE.
Protocolo
1. Lesão de percussão lateral Fluido
- Anestesiar o rato, utilizando uma mistura de cetamina e xilazina administrado intraperitonealmente. Em seguida, preparar a cabeça do rato para incisão usando um matagal iodo.
- Realizar uma craniotomia sobre a área parietal direita com 3 mm (diâmetro externo) trefina.
- Hub agulha seguro Luer-loc (dentro mm de diâmetro 3) sobre a craniectomia usando o acrílico cyanoarylate e odontológica.
- 24 horas depois, anestesiar o rato com isoflurano através de inalação.
- Resumos de respiração normais uma vez, mas antes que o rato torna-se sensível ao estímulo, entregar 20 mseg pulso de solução salina no crânio através do dispositivo de percussão fluido lesão.
- Imediatamente após a lesão remover o hub, reanaesthetize o mouse utilizando isoflurano, e sutura no couro cabeludo fechado.
Sham operados controles receberá um procedimento idêntico ao passo 1,5 omitido.
2. Análise Comportamental - Resp medo condicionadoOnse
- Lidar com ratos em dois dias consecutivos anteriores à resposta de medo condicionado (CFR) de treinamento.
- Coloque o rato na câmara de condicionamento por 3 min antes da administração de 1,5 choque chão mA por 2 seg. Deixar rato na câmara durante mais 30 seg.
- Após o período de atraso (geralmente 24 horas), o retorno do mouse para câmara de ar por 5 min. Avaliar congelamento em intervalos de 5 seg.
Análise consiste em comparar a quantidade relativa de congelamento do tempo em duas populações, no nosso caso com lesões cerebrais ratos e controle-operados controles. Menores taxas de congelamento (em comparação com o controlo) indicam a incapacidade de manter a associação entre o contexto e o choque chão, uma indicação da perda de memória e disfunções cognitivas.
3. Preparando agudas fatias do hipocampo
* Nota: anestesiados utilizando uma redoma de vidro só pode ser implementado para os procedimentos de terminais (tais como o cérebro dissecção aqui descrito).
- 7 dias apósferimento, fazer 1 litro de fluido cerebral espinal artificial (aCSF) e 250 ml de solução de sacarose de corte.
- Use gelo liberalmente para assegurar que todos os instrumentos e as soluções utilizadas durante a preparação da fatia do cérebro são gelado.
- Anestesiar mouse usando isoflurano. Rapidamente e retire cuidadosamente cérebro de rato e coloque em sacarose.
- Cérebro guarnição e no lugar da superfície de corte sobre uma gota de supercola na frente de um bloco de agar.
- Corte 350 mm de espessura cortes coronais, você deve ser capaz de conseguir 4 ou 5 fatias com o circuito intacto hipocampo.
- Incubar fatias para, pelo menos, 1 hora a 37 ° C.
4. Gravação de potencial extracelular Campo
- Puxar eléctrodos de vidro de borossilicato para 2-5 usando MΩs puxador vertical.
- Fatia lugar na câmara e eletrodo de inserção para suporte do eletrodo.
- Abaixe eletrodo estimulante em fatia em um trato axonal como o caminho perfurante ou colaterais Schaffer. Eletrodo de gravação inferiorpara a posição de saída, enquanto os traços de monitorização para assegurar que os eléctrodos estão no mesmo nível de z (profundidade). Quando uma resposta máxima é alcançada, mantendo o nível de estimulação de corrente constante, os eléctrodos estão no mesmo nível de z.
- O traço resultante é constituída por três componentes: o voleibol fibra pré-sináptica, o campo potencial pós-sináptico extracelular (fEPSP), e o pico de população pós-sináptica. Os componentes podem sobrepor temporalmente em algumas preparações, tornando a análise mais difícil. Se há uma ambiguidade entre se as respostas são pré-sináptica ou pós-sináptica, APV e CNQX podem ser adicionados ao banho para bloquear a transmissão de excitação, e todos os sinais remanescentes serão de origem pré-sináptica.
- Protocolos de estimulação variar para produzir três tipos de experiência distintos: entrada / saída de curvas, gravações de pulsos pareados, e experimentos de longo prazo da plasticidade.
Análise tipicamente consiste de medições comparando a inclinação da fEPSP transversalmente em ambos os ratinhos com lesões cerebrais e sham-Operado controles, controlando-se a força de entrada através da medição da rajada de fibra.
5. Gravação de patch-clamp visualizados
- Prepare fatias, eletrodos e sonda para gravar como já descrito acima até o passo 4.2.
- Considerar apenas as células mais profundo do que 80 um no tecido como células mais próximas da superfície serão mortos e / ou de ter reduzido a conectividade. Aproximar de uma célula com uma pressão positiva sobre o eléctrodo para garantir que ele não fique entupido, uma vez que se move para baixo através do tecido. Quando o eléctrodo de toque suavemente a célula aplica pressão negativa com o fim de criar um "gigaseal 'entre o eléctrodo e a membrana plasmática.
- Aplicar rajadas curtas de pressão negativa com o fim de romper a membrana plama sob o eléctrodo e alcançar configuração de célula inteira.
- Eliminar transientes de capacitância usando amplificador e compensar a resistência série. Compensar a resistência em série das células é essencial para assegurar umaccurate medições.
- Dois modos de gravações de células individuais podem ser realizadas: grampo de corrente (voltagem da membrana de medição) e fixador de tensão (medição corrente que passa através de canais iónicos na membrana).
Tipos possíveis de análise são numerosas, mas no nosso caso consistem principalmente de análise biofísica quantificar a taxa e tamanho das correntes sinápticas espontâneas em ambos os ratos com lesões cerebrais e controle-operados controles.
6. Tensão sensível Dye Imaging (VSD)
- Prepare fatias e equipamento para gravar como já descrito acima até o passo 4.2.
- Preparar estoque corante misturando 1 mg de di-3-ANEPPDHQ em 50 ul de etanol; dispensar alíquotas de 2 ul em tubos de folha embrulhado, armazenam-se a -20 ° C. Tornar a solução de trabalho de corante diariamente, por diluição de 1:200 em aCSF.
- Incubar a fatia em aCSF papel de filtro umedecido e manchar com 90 ul de corante por 16 min; enxaguar com ACSF e lugar na câmara de gravação interface.
- Ajuste da luz stimulation intensidade até que a resposta está centrado no meio do alcance da câmera. As imagens são normalmente adquiridas a uma taxa de 500-1000 quadros por segundo.
- Obturador disparador para a luz estimulação de 200 milissegundos antes de estimulação elétrica para permitir fotodegradação inicial rápida para se estabilizar. Ensaios de aquisição alternados entre electricamente estimulado e não-estimuladas electricamente, para permitir mais tarde a subtracção do fundo não estimulada. Registro intensidade de luz de repouso (leitura de fluorescência com o obturador fechado) antes da abertura do obturador. Cada ensaio será um VSD pixels x por Y pixels por "filme" tempo de leituras de fluorescência. Gravar 10-12 VSD ensaios em cada condição de teste.
- Todas as medições são executadas no intra-pixel alteração pré-estímulo eléctrico normalizado de fluorescência, dF / F, que é calculada como se segue:
Subtrair a intensidade de descanso luz do julgamento prima VSD adquirido. Para cada pixel em cada ensaio, de acordo com a normalizar o valor médio pré-estímulo eléctrico para quejulgamento, e subtraindo unidade. Faça isso para ambos os ensaios eletricamente estimuladas e não estimuladas eletricamente. Criar uma média "fundo de fluorescência" julgamento dos ensaios não-estimulado eletricamente, e subtrair este julgamento fundo dos ensaios eletricamente estimuladas. Uma análise adicional é tipicamente realizada na média de 10-12 tais ensaios, os quais são também normalmente filtrada no espaço e no tempo para melhorar a relação sinal-ruído.
7. Dissecções regionais para análises bioquímicas
- Remover o cérebro do rato, como descrito anteriormente.
- Preparar fatias utilizando cortador de tecidos.
- Lay parte plana, microdissect área CA1 e DG.
- Imediatamente mergulhe em lise tampão contendo inibidor de protease. Congelar em nitrogênio líquido e armazenar a -80 ° C.
8. Resultados representativos
As nossas experiências começam tipicamente com os dados de comportamento para confirmar a esperardéficits cognitivos ed que existem no cérebro lesado camundongos. Nós empregamos o teste de resposta contextual condicionado medo, pois é um comportamento dependente do hipocampo que é confiável e requer apenas uma sessão de treinamento e uma sessão de testes. Os dados representados na Figura 2 representa o teste comportamental para medir memória anterógrada, no entanto, o ensaio pode também ser usado para medir a memória retrógrada se a sessão de treino é executada antes da lesão.
Campo potenciais pós-sinápticos excitatórios (fEPSPs) são medidos para determinar a eficácia sináptica líquida de uma grande população de células (Figura 3A). Nós geralmente empregam três tipos diferentes de padrões de estimulação, cada um dando seus próprios resultados e conclusões. Em primeiro lugar, através do aumento da intensidade de estimulação através de uma série de passos, criar uma curva de entrada / saída (Figura 3B / C).
Em seguida, através da apresentação de dois estímulos de mesma intensidade separadod por um breve período de tempo (geralmente 50 ms) investigamos as possíveis alterações na probabilidade da vesícula sináptica libertação;. Além disso, muitas vezes executar potenciação de longa duração (LTP) experimentos. Depois de estabelecer uma resposta de linha de base, a estimulação de frequência breve elevada (normalmente de 100 Hz) com a mesma intensidade é entregue, causando uma cascata intracelular que leva a uma resposta potenciada quando a estimulação sináptica normal é retomada.
Atividade elétrica da célula inteira patch-preso células podem ser gravados em dois modos. No modo de fixação da tensão, o experimentador controla a tensão da membrana da célula de patch-fixada em referência ao banho, por meio de software de computador associado ao amplificador. Neste caso, as correntes que medeiam eventos pós-sinápticos são gravadas, fornecendo informação sobre a frequência de libertação pré-sináptica, o número de receptores pós-sinápticos activados e da concentração do neurotransmissor vesicular (Figura 4A). No modo de grampo de corrente do experimentadormanipula injetado atual e mede a resposta de tensão. Isto pode ser útil para determinar as características do potencial de acção, tais como limiar do potencial de acção e de meia largura. Estas características permitem a categorização funcional dos neurónios como excitatório ou inibitório com base nos seus padrões de disparo de acção potenciais (Figura 4B). A fim de verificar a identidade celular recomendamos enchimento células com Lucifer Yellow depois da gravação e da identidade visualmente a confirmação da presença ou ausência de espinhas dendríticas. (Figura 4C, D).
Um exemplo dos resultados de uma experiência utilizando corante sensível tensão para medir as variações de tensão de membrana está descrito na Figura 5. Neste caso, um eléctrodo de estimulação foi colocado na via colateral de Schaffer e a actividade neuronal, resultando na área CA1 é analisada. Corante sensível tensão não informa valores absolutos de tensão de membrana, mas sim tele mudar de tensão de um estado inicial, sem estimulação. No entanto, análises comparando duas condições (por exemplo, cérebro-ferido vs sham-operated) pode ser usado para determinar os parâmetros espaço-temporais de alterações fisiológicas que não podem ser medidos utilizando fEPSPs ou de células inteiras de gravação de patch-clamp.

Figura 1. Diagrama de Circuito do hipocampo. Uma seção horizontal através do hipocampo. As principais vias através do hipocampo são mostrados a amarelo. Os axônios dos neurônios no córtex entorrinal projeto pela via perfurante no giro denteado formando sinapses com os dendritos de células granulares do giro denteado. De células granulares do projecto axónios através da via de fibras musgosas para CA3 onde formam sinapses com os dendritos de neurônios CA3. Os axônios dos neurônios CA3 projeto através da via colateral de Schaffer para o Dendrites de CA1 células piramidais. Os axônios de células piramidais CA1 projetar para fora do hipocampo através da subículo. Nota: Também são descritos CA3 colaterais celulares piramidais axônios projetam para o hipocampo contralateral através da fímbria. (CA1: Cornu Ammonis 1, CA2: Cornu Ammonis 2, CA3: Cornu Ammonis 3, DG: giro denteado, linha pontilhada indica camada de corpo celular, linha sólida indica limites estruturais.)
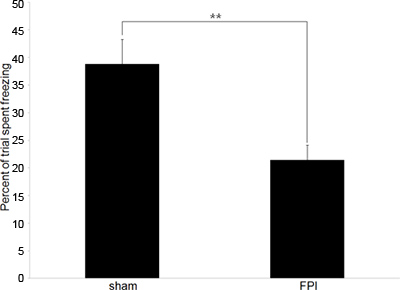
Figura 2. Representante dados comportamentais A:. Dados comportamentais que descrevem a diferença nas taxas de congelamento entre cérebro lesado ratos (FPI) e controle-operados controles (sham) no paradigma condicionado medo resposta. Formação ocorreu no ferimento 6 º dia seguinte, com o período de teste de 24 horas que ocorre mais tarde. (** Denota p <0,01.)

Figura 3. Dados representativos de gravação Extracelular A:. Um exemplo de um campo de potencial pós-sináptico excitatório (fEPSP) gravação na área CA1. A primeira deflexão descendente é o artefacto de estímulo, seguida pela rajada de fibras pré-sináptica e, finalmente, o fEPSP. B: entrada / saída das curvas representando uma diminuição da eficácia sináptica líquido em CA1 após lesão fluido percussão (FPI). C: entrada / saída das curvas representando um aumento de eficácia sináptica líquido no giro denteado (DG), após FPI. (* Indica p <0,05). Clique aqui para ver maior figura .
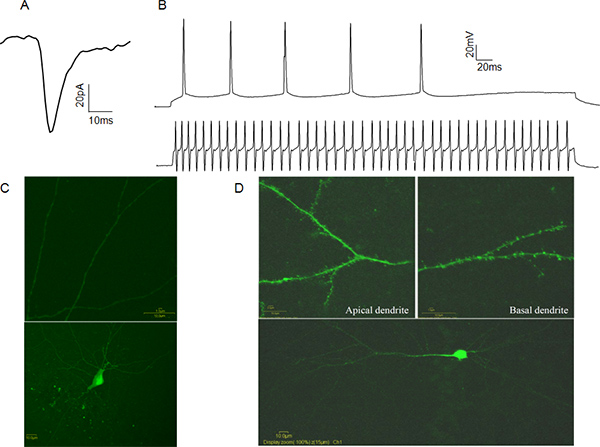
Figura 4. Representante Whole-cell patch-clamp Dados A: Um exemplo espontânea.excitatório pós-sináptico corrente (sEPSC) a partir de uma célula de CA1 piramidal. B: Exemplos de trens de acção potenciais a partir de uma célula piramidal CA1 (traço superior) e uma rápida spiking CA1 interneurônio (traço inferior). C: Exemplo de uma Amarelo Lúcifer cheio CA1 interneurônio inibitória. Note a ausência de espinhas dendríticas (painel superior). D: Exemplo de Lucifer Yellow cheio CA1 neurônio piramidal. Observe a presença de espinhas dendríticas (painel superior). Clique aqui para ver maior figura .
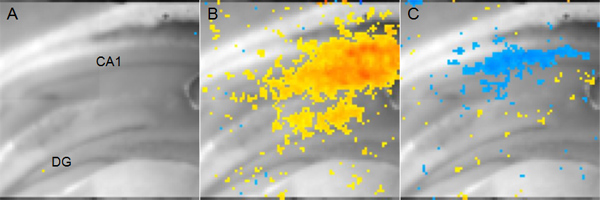
Figura 5. Representante voltagem sensível dados de imagem Dye A:. Fatia Rato coronal hipocampo exibido para mostrar anatomia. (DG: giro denteado, CA1: Cornu Ammonis 1) B: Amarelo para pixels vermelhos representando atividade excitatória na área CA1 14 ms após a estimulação aferente garantia Schaffer. Vermelho emvão indica mais despolarização, enquanto o amarelo indica uma despolarização menor, mas ainda significativo. C: pixels azuis representam sítios de atividade inibitória na área CA1 56 ms após a estimulação aferente garantia Schaffer mesmo mostrado na B. azul mais escuro indica mais hiperpolarização.
Discussão
Cada técnica descrito acima contribui para a melhor compreensão do mecanismo subjacente causando o défice comportamental observada. Ao combinar a informação original obtida a partir de cada um dos métodos que são capazes de analisar os mecanismos biológicos com mais precisão.
FEPSPs medição é útil para quantificar a eficácia sináptica líquida de grandes regiões espacialmente definidos de neurônios. Ele também pode fornecer informação sobre o potencial de um grupo de cél...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer Elliot Bourgeois por sua assistência técnica. Este trabalho foi financiado pelos Institutos Nacionais de Saúde dos subsídios R01HD059288 e R01NS069629.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do equipamento | Companhia | Número de catálogo | Comentários (opcional) |
| Axopatch 200B amplificador | Molecular Devices | AXOPATCH 200B | Patch-clamp plataforma |
| Digidata 1322A digitador | Molecular Devices | Patch-clamp plataforma | |
| MP-225 micromanipulador | Sutter | MP-225 | Patch-clamp plataforma |
| Microscópio DMLFSA | Leica | Patch-clamp plataforma | |
| Multiclamp amplificador 700B | Molecular Devices | MULTICLAMP 700B | Multiuso (campo)equipamento |
| Digidata 1440 digitador | Molecular Devices | Multipurpos (campo) rig | |
| MPC-200 micromanipulador | Sutter | MPC-200 | Multiuso (campo) rig |
| Microscópio BX51WI | Olimpo | BX51WI | Multiuso (campo) rig |
| Axoclamp amplificador 900A | Molecular Devices | AXOCLAMP 900A | VSD plataforma |
| Digidata 1322 digitador | Molecular Devices | VSD plataforma | |
| Redshirt câmera CCD-SMQ | Redshirt | NCS01 | VSD plataforma |
| VT 1200S Vibratome | Leica | 14048142066 | |
| P-30 extrator Eletrodo | Sutter | P-30 / P | |
| inibidor de protease completo | Roche | 11697498001 |
Referências
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados