Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchungen über Veränderungen der hippokampalen Schaltung Funktion Nach Mild Traumatic Brain Injury
In diesem Artikel
Zusammenfassung
Ein vielschichtiger Ansatz zur Untersuchung funktionelle Veränderungen im Hippocampus Schaltung erläutert. Elektrophysiologischen Verfahren werden zusammen mit der Schädigung Protokoll Verhaltenstests und regionalen Dissektionsverfahren beschrieben. Die Kombination dieser Techniken können in ähnlicher Weise für andere Hirnregionen und wissenschaftlichen Fragen angewendet werden.
Zusammenfassung
Schädel-Hirn-Trauma (SHT) leiden mehr als 1,7 Millionen Menschen in den Vereinigten Staaten jedes Jahr und sogar milde TBI kann permanente neurologische Beeinträchtigungen 1 führen. Zwei allgegenwärtig und behindernden Symptome von TBI Überlebenden, Gedächtnisstörungen und eine Verringerung der Krampfschwelle erlebt, sind vermutlich durch TBI-induzierte Hippocampus Dysfunktion 2,3 vermittelt werden. Um zu demonstrieren, wie veränderte hippocampalen Schaltungsfunktion beeinträchtigt Verhalten bei Mäusen nach SHT beschäftigen wir seitlichen Fluid Schlagwerk Verletzung, eine häufig verwendete Tiermodell der TBI die viele Merkmale der menschlichen TBI einschließlich neuronaler Zellverlust, Gliose und ionischen Perturbation 4 nachbildet - 6.
Hier zeigen wir eine kombinatorische Methode zur Untersuchung von TBI-induzierte Hippocampus Dysfunktion. Unser Ansatz umfasst mehrere ex vivo physiologische Techniken zusammen mit Tierverhalten und biochemische Analyse, um zu analysieren,post-SHT Veränderungen im Hippocampus. Wir beginnen mit dem experimentellen Verletzungen Paradigma zusammen mit Verhaltensanalyse, um kognitive Behinderung nach TBI beurteilen. Anschließend bieten wir drei verschiedene ex vivo Aufnahmetechnik: extrazelluläre Feldpotential Aufnahme visualisiert whole-cell Patch-Clamp und Spannung Farbstoff Aufnahme. Schließlich zeigen wir eine Methode für regional Sezieren Teilbereiche des Hippocampus, die nützlich sein können für eine detaillierte Analyse der neurochemischen und metabolische Veränderungen post-TBI.
Diese Methoden wurden verwendet, um die Veränderungen im Hippocampus Schaltung nach TBI zu untersuchen und die entgegengesetzten Änderungen im Netzwerk Schaltung Funktion, die im Gyrus dentatus und CA1 Teilbereiche des Hippocampus (siehe Abbildung 1) auftreten, zu untersuchen. Die Fähigkeit, die post-TBI Änderungen in jedem Teilbereich zu analysieren ist wesentlich für das Verständnis der zugrunde liegenden Mechanismen einen Beitrag zur TBI-induzierten Verhaltens-und kognitiven deficits.
Das vielseitige System hier skizzierten ermöglicht Ermittler in der Vergangenheit Charakterisierung der Phänomenologie von einem Krankheitszustand (in diesem Fall TBI) induziert schieben und bestimmen die verantwortlichen Mechanismen für die beobachteten Pathologie mit TBI verbunden.
Protokoll
Ein. Lateral Flüssigkeit Percussion Injury
- Betäuben die Maus mit einem Gemisch aus Ketamin und Xylazin intraperitoneal gegeben. Dann bereiten Sie die Maus den Kopf zur Inzision mit einer Jod-Peeling.
- Durchführen einer Kraniektomie über dem rechten parietalen Region unter Verwendung von 3 mm (Außendurchmesser) Trepan.
- Sichere Luer-Lok Nadelnabe (Innendurchmesser 3 mm) über die Verwendung Kraniektomie cyanoarylate und zahnmedizinischen Acryl.
- 24 Stunden später, betäuben Sie die Maus mit Isofluran durch Inhalation.
- Sobald die normale Atmung wieder aufgenommen wird, aber bevor die Maus wird empfindlich auf Stimulation, liefern 20 ms Puls von Kochsalzlösung in den Schädel über das Fluid Schlagwerk Verletzungen Vorrichtung.
- Unmittelbar nach der Verletzung entfernen Sie den Hub, reanaesthetize die Maus mit Isofluran und vernähen die Kopfhaut geschlossen.
Sham-operierten Kontrollen eine identische Prozedur mit Schritt 1,5 weggelassen erhalten.
2. Behavioral Analysis - konditionierte Furcht RespOnse
- Griff Mäusen an zwei aufeinanderfolgenden Tagen vor der konditionierten Angstreaktion (CFR) Ausbildung.
- Bewegen Sie die Maus in Klimakammer für 3 min vor der Verabreichung von 1,5 mA Boden Schock für 2 sek. Hinterlegen Maus in der Kammer für weitere 30 sek.
- Nach Verzögerungszeit (in der Regel 24 Stunden), Rückkehr Maus Klimakammer für 5 min. Bewerten Einfrieren bei 5 sec Intervallen.
Analyse besteht aus den Vergleich der relativen Höhe der Zeit Einfrieren in zwei Populationen, in unserem Fall hirnverletzte Mäusen und Sham-Kontrollen. Niedrigeren Gefrierpunkt Raten (im Vergleich zur Kontrolle) weisen Unfähigkeit, die Zuordnung zwischen dem Rahmen und dem Boden Schock, ein Indiz für Gedächtnisstörung und kognitiver Dysfunktion zurückzuhalten.
3. Vorbereiten Akute Hippocampusschnitte
* Hinweis: Betäubung mit einem Bell Jar kann nur für Terminal-Verfahren (wie das Gehirn Dissektion beschrieben) umgesetzt werden.
- 7 Tage nachVerletzungen, stellen 1 l künstlicher Zerebrospinalflüssigkeit (aCSF) und 250 ml Saccharose Schneidlösung.
- Verwenden ice freizügig um sicherzustellen, dass alle Instrumente und Lösungen während Hirnschnitt Zubereitung verwendet eiskalt sind.
- Betäuben Maus mit Isofluran. Schnell und schonend zu entfernen Gehirn von Mäusen und in Saccharose.
- Trim Gehirn und auf Schneidfläche auf einem Tropfen Sekundenkleber vor einem Agar-Block.
- Cut 350 um dicke koronale Schnitte, sollten Sie in der Lage sein 4 oder 5 Scheiben mit dem intakten Hippocampus Schaltung zu bekommen.
- Inkubieren Scheiben für mindestens 1 h bei 37 ° C.
4. Extrazelluläre Feldpotential Recording
- Ziehen Sie Borosilikatglas Elektroden 2-5 MΩs mit vertikalen Puller.
- Ort Scheibe in Kammer und Insert Elektrode auf Elektrodenhalter.
- Senken Stimulationselektrode in Bereich in einer axonalen Trakt wie die perforans oder Schaffer Kollateralen. Lower Aufnahme-Elektrodein Position während Überwachungsausgang Spuren um sicherzustellen, daß Elektroden zur gleichen z-Ebene (Tiefe) sind. Wenn eine maximale Reaktion erzielt wird, anhält Reizstrom konstant sind Elektroden zur gleichen z-Ebene.
- Der resultierende Messkurve besteht aus drei Komponenten: dem präsynaptischen Faser volley, das Feld extrazellulären postsynaptischen Potentials (fEPSP) und der postsynaptischen Bevölkerung spike. Die Komponenten können zeitlich überlappen bei einigen Präparaten, was die Analyse erschwert. Wenn nicht eindeutig zwischen ob Antworten sind präsynaptischen oder postsynaptische kann APV und CNQX zu dem Bad, um exzitatorischen Übertragungsblocks hinzugefügt werden, und alle verbleibenden Signale werden von präsynaptischen Ursprungs sein.
- Stimulationsprotokolle variieren drei verschiedene Experimente Arten erzeugen: Input / Output-Kurven, gepaart Puls Aufnahmen und langfristige Plastizität Experimente.
Analyse typischerweise aus Messungen Vergleichen der Steigung der fEPSP quer in beiden hirnverletzte Mäusen und scheinBetrieben Kontrollen Steuerung zur Eingabe Stärke durch Messung der Faser volley.
5. Visualisierte Patch-Clamp-Aufzeichnung
- Planen Scheiben, Elektroden und rig aufzuzeichnen, wie zuvor oben bis zu 4,2 Schritt beschrieben.
- Man überlege Zellen tiefer als 80 um in das Gewebe als Zellen näher an der Oberfläche wird tot sein und / oder reduziert haben Konnektivität. Nähern einer Zelle mit positiven Druck an der Elektrode zu gewährleisten, dass sie nicht verstopfen, wie es unten bewegt durch das Gewebe. Wenn die Elektrode leicht berührt die Zelle gelten Unterdruck um eine "Giga" zwischen der Elektrode und der Plasmamembran zu erstellen.
- Anwenden von kurzen Bursts Unterdruck, um einem Bersten der Membran plama unter der Elektrode und erreichen Ganzzell-Konfiguration.
- Beseitigen Kapazität Transienten mit dem elektrischen Verstärker und einen Ausgleich für Serienwiderstand. Kompensation der Serienwiderstand der Zelle ist unabdingbar, um eine sicherccurate Messungen.
- Zwei Modi der einzelnen Zelle Aufnahmen können durchgeführt werden: Stromzange (Messmembran Spannung) und Voltage-Clamp (Messung Strom durch Ionenkanäle in der Membran).
Mögliche Arten der Analyse sind zahlreich, aber in unserem Fall bestehen meist aus biophysikalische Analyse quantifiziert die Geschwindigkeit und Größe der spontanen synaptischen Ströme in beiden hirnverletzte Mäusen und Sham-Kontrollen.
6. Voltage Sensitive Dye Imaging (VSD)
- Bereiten Scheiben und rig zu erfassen, wie zuvor oben bis zu 4,2 Schritt beschrieben.
- Bereiten Farbstoff Lager durch Mischen von 1 mg di-3-ANEPPDHQ in 50 ul Ethanol; verzichten 2 ul Aliquots in Folie eingewickelt Rohre, bei -20 ° C. Machen die Arbeit Farbstofflösung täglich, durch Verdünnen 1:200 in aCSF.
- Inkubieren Scheibe auf aCSF angefeuchtetem Filterpapier und Flecken mit 90 ul von Farbstoff für 16 min; gründlich mit aCSF und in-Schnittstelle Aufnahme Kammer.
- Passen Licht stimulation Intensität, bis Antwort in der Mitte der Kamera-Sortiment zentriert. Bilder werden typischerweise mit einer Rate von 500-1.000 Frames pro Sekunde erfasst.
- Trigger Shutter für leichte Stimulation 200 ms vor elektrischer Stimulation zu ermöglichen anfängliche schnelle Ausbleichen zu stabilisieren. Mögliche Akquisition Studien zwischen elektrisch stimulierten und nicht-elektrisch stimuliert, um später Subtraktion nicht stimulierten Hintergrund ermöglichen. Rekord Ruhestätte Lichtintensität (Fluoreszenz Lesung mit Shutter geschlossen) vor dem Öffnen Verschluss. Jedes VSD-Studie wird ein x Pixel mal y Pixel betragen by time "Film" der Fluoreszenz Lesungen. Rekord 10 bis 12 VSD Studien in jedem Test Zustand.
- Alle Messungen an dem Intra-Pixel vor elektrische Stimulus-normalisierte Fluoreszenz Änderung durchgeführt werden, folgt dF / F, die wie folgt berechnet wird:
Subtrahieren Sie die Ruhe Lichtintensität von der VSD raw erworbenen Studie. Für jedes Pixel in jedem Versuch nach dem Pre-elektrische Stimulus-Mittelwert für die NormalisierungStudie und Subtrahieren Einheit. Tun Sie dies für beide den elektrisch stimulierten und nicht-elektrisch stimuliert Studien. Erstellen einer mittleren "Hintergrundfluoreszenz" trial von den nicht-elektrisch stimuliert Studien und subtrahieren diesem Hintergrund Studie aus den elektrisch stimulierten Studien. 12 solche Studien, die auch üblicherweise in Raum und Zeit, um das Signal-Rausch-Verhältnis zu verbessern filtriert - weitere Analyse wird typischerweise auf dem Durchschnitt von 10 durchgeführt.
7. Regional Dissektionen für Biochemische Analysen
- Entfernen des Gehirns aus der Maus, wie zuvor beschrieben.
- Bereiten Scheiben mit Gewebe-Chopper.
- Lay Abschnitt flach, microdissect Area CA1 und DG.
- Sofort tauchen in Lysepuffer Protease-Inhibitor. Einfrieren in flüssigem Stickstoff und bei -80 ° C.
8. Repräsentative Ergebnisse
Unsere Experimente beginnen in der Regel mit einer Verhaltenstherapie Daten, um die erwarten, bestätigened kognitiven Defiziten, die in hirnverletzte Mäusen existieren. Wir beschäftigen kontextuellen konditionierte Angstreaktion Tests, da es eine Hippocampus abhängige Verhalten, die zuverlässig ist und nur ein Training und ein Test-Session ist. Die Daten in Abbildung 2 dargestellt darstellt Verhaltenstests an anterograde Speicher zu messen, jedoch kann die Prüfung auch zur retrograden Speicher zu messen, wenn das Training vor der Verletzung durchgeführt wird.
Feld exzitatorischen postsynaptischen Potentiale (fEPSPs) gemessen werden, um das Netz synaptische Wirksamkeit einer großen Population von Zellen (3A) zu bestimmen. Wir verwenden üblicherweise drei verschiedene Arten von Erregungsmuster, die jeweils BIETEN seine eigenen Ergebnisse und Schlussfolgerungen. Erstens durch eine Erhöhung der Stimulationsintensität durch eine Reihe von Schritten, erzeugen wir eine Eingangs / Ausgangskennlinie (3B / C).
Anschließend wird durch Zuführen zwei Stimulationen von der gleichen Intensität separatend von einer kurzen Verzögerung (in der Regel 50 ms) untersuchen wir potenzielle Veränderungen in der synaptischen Vesikel-Freisetzung Wahrscheinlichkeit;. Außerdem haben wir oft durchführen Langzeit-Potenzierung (LTP) Experimente. Nach dem Herstellen einer Basislinienantwort, kurze Hochfrequenzstimulation (üblicherweise 100Hz) mit derselben Intensität abgegeben wird, was eine Kaskade intrazellulärer, die zu einer potenzierten synaptischen Reaktion führt, wenn die normale Stimulation wieder aufgenommen wird.
Elektrischer Aktivität von Ganzzell-Patch-eingespannt Zellen in zwei Modi aufgezeichnet werden können. In Spannungsklammer Modus steuert der Experimentator der Membranspannung des Pflasters eingespannten Zelle in Bezug auf das Bad, über Computersoftware, die mit dem Verstärker verbunden ist. In diesem Fall Ströme Vermittlung postsynaptischen Ereignisse aufgezeichnet werden, die Informationen über präsynaptische Freisetzung Frequenz, Anzahl der postsynaptischen Rezeptoren aktiviert und vesikulären Neurotransmitter-Konzentration (Abbildung 4A). In Stromzange Modus der Experimentatormanipuliert eingespeisten Strom und misst die Spannung Antwort. Dies kann nützlich sein, um Eigenschaften des Aktionspotential, wie Aktionspotential Schwelle und Halbwertsbreite bestimmen. Diese Merkmale ermöglichen die funktionelle Zuordnung der Neuronen als exzitatorische oder inhibitorische basierend auf ihren Aktionspotential Abfeuern Mustern (4B). Um die zelluläre Identität zu überprüfen wir empfehlen Befüllen Zellen mit Lucifer Yellow nach dem Aufzeichnen und visuell bestätigt Identität durch die Anwesenheit oder Abwesenheit von dendritischen Dornen. (4C, D).
Ein Beispiel für Ergebnisse aus einem Versuch mit spannungsempfindlichen Farbstoff auf Veränderungen der Membran Spannung zu messen ist in Abbildung 5 dargestellt. In diesem Fall hat eine stimulierende Elektrode in der Schaffer Sicherheiten Weges gelegt und das resultierende neuronaler Aktivität im Bereich CA1 analysiert wird. Spannung Farbstoff nicht meldet absoluten Werte der Membran Spannung, sondern tEr Änderung in der Spannung von einem Ausgangszustand ohne Stimulation. Allerdings können Analysen Vergleich von zwei Bedingungen (zB gegen Sham-Hirn-Verletzte) verwendet, um die räumlich-zeitliche Parameter der physiologischen Veränderungen, die nicht gemessen mit fEPSPs oder Ganzzell-Patch-Clamp-Aufzeichnung kann ermittelt werden.

Abbildung 1. Hippocampus Schaltplan. Ein horizontaler Schnitt durch den Hippocampus. Die wichtigsten Wege durch den Hippocampus werden gelb dargestellt. Die Axone von Neuronen im entorhinalen Kortex Projekt über das perforans Weg in den Gyrus dentatus bilden Synapsen mit den Dendriten Gyrus dentatus Körnerzellen. Granule Axone Projekt über das Moosfaser Weg zu CA3 wo sie Synapsen mit den Dendriten von CA3 Neuronen. Die Axone der CA3 Neuronen Projekt über die Schaffer Sicherheiten Weg auf den Dendrites von CA1 Pyramidenzellen. Die Axone der CA1 Pyramidenzellen projizieren aus dem Hippocampus durch die Subiculum. Hinweis: Ebenfalls dargestellt sind CA3 Pyramidenzellen Axon Sicherheiten Projektion zur kontralateralen Hippocampus über die Fimbrien. (CA1: Cornu Ammonis 1, CA2: Cornu Ammonis 2, CA3: Cornu Ammonis 3, DG: Gyrus dentatus, zeigt gestrichelte Linie Zellkörperschicht, durchgezogene Linie zeigt strukturelle Grenzen.)
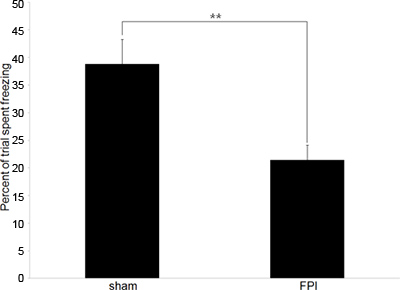
Abbildung 2. Vertreter Behavioral Data A:. Behavioral Daten Darstellung der Unterschied in Gefrierraten zwischen Gehirn-verletzten Mäuse (FPI) und Sham-Kontrollen (Sham) in der konditionierten Angstreaktion Paradigma. Ausbildung erfolgte am 6. Tag nach der Verletzung, mit der Testphase auftretende 24 Stunden später. (** Bezeichnet p <.01).

Abbildung 3. Vertreter Extrazelluläre Recording Data A:. Ein Beispiel für ein Feld exzitatorischen postsynaptischen Potentials (fEPSP) Aufnahme im Bereich CA1. Die erste Auslenkung nach unten ist der Stimulus Artefakt, von der präsynaptischen Faser volley und schließlich die fEPSP gefolgt. B: Input / Output-Kurven darstellen einen Rückgang der Netto-synaptische Wirksamkeit in CA1 folgenden Fluid Percussion Verletzungen (FPI). C: Input / Output-Kurven, das ein Anstieg der Netto-synaptischen Wirksamkeit in Gyrus dentatus (DG) nach FPI. (* Bedeutet p <.05). Klicken Sie hier für eine größere Abbildung zu sehen .
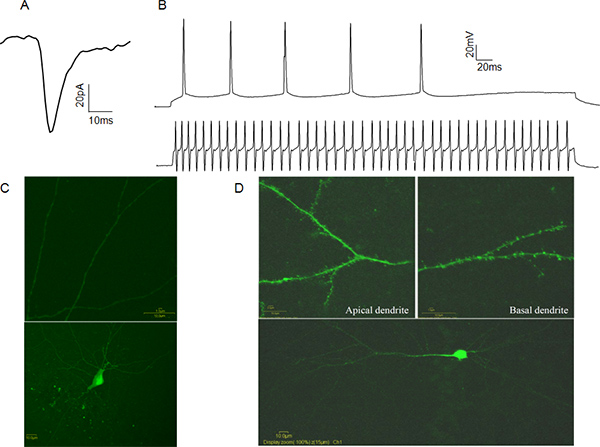
Abbildung 4. Vertreter Whole-Cell-Patch-Clamp-Daten A:. Ein Beispiel spontaneexzitatorischen postsynaptischen Strom (sEPSC) von einem CA1 Pyramidenzellen. B: Beispiele Aktionspotential Züge von einem CA1-Pyramidenzellen (obere Kurve) und eine schnelle Spiking CA1 Interneuron (untere Kurve). C: Beispiel einer Lucifer Yellow gefüllt CA1 hemmende Interneuronen. Beachten Sie das Fehlen von dendritischen Dornen (oberes Bild). D: Beispiel Lucifer Yellow gefüllt CA1 pyramidalen Neuronen. Beachten Sie die Anwesenheit von dendritischen Dornen (oberes Bild). Klicken Sie hier für eine größere Abbildung zu sehen .
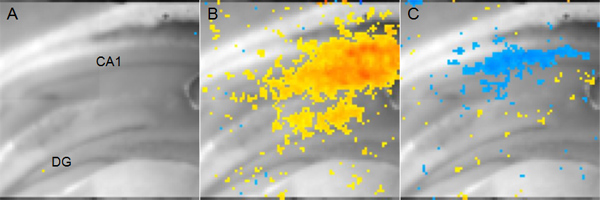
Abbildung 5. Vertreter Voltage Sensitive Dye Imaging Data A:. Maus koronalen Hippocampusschnitt angezeigt Anatomie zeigen. (DG: Gyrus dentatus, CA1: Cornu Ammonis 1) B: gelb bis rot Pixeln, die exzitatorischen Aktivität im Bereich CA1 14 ms nach afferenten Schaffer Sicherheiten Stimulation. Red indicates weitere Depolarisation während Gelb deutet auf eine geringere, aber immer noch signifikant Depolarisation. C: Blau Pixeln, die Seiten der inhibitorischen Aktivität im Bereich CA1 56 ms nach dem gleichen afferenten Schaffer Sicherheiten Stimulation B. Darker blau dargestellt zeigt mehr Hyperpolarisation.
Diskussion
Jede Technik skizzierten trägt zum besseren Verständnis der zugrunde liegende Mechanismus Veranlassen des beobachteten Verhaltens Defizit. Durch die Kombination der eindeutigen Information von jedem Verfahren gewonnenen können wir die biologischen Mechanismen mit größerer Präzision zu untersuchen.
Messen fEPSPs ist nützlich für die Quantifizierung des Netto synaptische Wirksamkeit von großen, räumlich definierten Bereichen von Neuronen. Es kann auch über das Potenzial einer Gruppe...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken Elliot Bourgeois für seine technische Unterstützung. Diese Arbeit wurde von den National Institutes of Health Zuschüsse R01HD059288 und R01NS069629 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Bezeichnung des Geräts | Firma | Katalog-Nummer | Kommentare (optional) |
| Axopatch 200B Verstärker | Molecular Devices | Axopatch 200B | Patch-Clamp-rig |
| Digidata 1322a Digitizer | Molecular Devices | Patch-Clamp-rig | |
| MP-225 Mikromanipulator | Sutter | MP-225 | Patch-Clamp-rig |
| DMLFSA Mikroskop | Leica | Patch-Clamp-rig | |
| Multiclamp 700B Verstärker | Molecular Devices | MultiClamp 700B | Multipurpose (Feld)Takelage |
| Digidata 1440 Digitizer | Molecular Devices | Multipurpos (Feld) rig | |
| MPC-200 Mikromanipulator | Sutter | MPC-200 | Multipurpose (Feld) rig |
| BX51WI Mikroskop | Olymp | BX51WI | Multipurpose (Feld) rig |
| Axoclamp 900A Verstärker | Molecular Devices | AXOCLAMP 900A | VSD rig |
| Digidata 1322 Digitizer | Molecular Devices | VSD rig | |
| Redshirt CCD-SMQ Kamera | Redshirt | NCS01 | VSD rig |
| VT 1200S Vibratom | Leica | 14048142066 | |
| P-30 Electrode Abzieher | Sutter | P-30 / P | |
| Komplette Protease-Inhibitor | Roche | 11697498001 |
Referenzen
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten