Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Enquêtes sur les altérations de la fonction hippocampique Circuit suite de traumatisme craniocérébral léger
Dans cet article
Résumé
Une approche multi-facettes pour étudier les changements fonctionnels de circuits de l'hippocampe est expliqué. Les techniques électrophysiologiques sont décrits avec le protocole blessures, les tests comportementaux et méthode de dissection régional. La combinaison de ces techniques peuvent être appliquées de la même façon pour les autres régions du cerveau et les questions scientifiques.
Résumé
Traumatisme cranio-cérébral (TCC) touche plus de 1,7 millions de personnes aux États-Unis chaque année et même une légère TBI peut conduire à des troubles neurologiques persistants 1. Deux symptômes envahissants et la désactivation vécues par les survivants traumatisés crâniens, des déficits de mémoire et d'une réduction du seuil de saisie, sont pensés pour être médiée par TBI induite par un dysfonctionnement hippocampique 2,3. Afin de démontrer comment altération de la fonction hippocampique circuit affecte le comportement après TCC chez la souris, nous employons latérale blessures percussion fluide, un modèle animal couramment utilisé de TBI qui recrée de nombreuses caractéristiques de TBI humaine, y compris la perte de cellules neuronale, une gliose et la perturbation ionique 4 - 6.
Ici, nous démontrons une méthode combinatoire pour enquêter sur TBI induite par un dysfonctionnement hippocampique. Notre approche intègre plusieurs techniques ex vivo physiologiques ainsi que le comportement des animaux et de l'analyse biochimique, afin d'analyserpost-TCC changements dans l'hippocampe. Nous commençons avec le paradigme de lésion expérimentale ainsi que l'analyse comportementale pour évaluer déficience cognitive après un traumatisme cérébral. Ensuite, nous présentons trois groupes distincts techniques ex vivo d'enregistrement: enregistrement extracellulaire champ potentiel, visualisées cellule entière patch-clamp, et la tension d'enregistrement colorant sensible. Finalement, nous démontrons une méthode de dissection sous-régions régionale de l'hippocampe qui peut être utile pour l'analyse détaillée des modifications neurochimiques et métaboliques post-TCC.
Ces méthodes ont été utilisées pour examiner les modifications de circuits de l'hippocampe après TBI et de sonder les modifications opposées dans la fonction circuit de réseau qui se produisent dans le gyrus denté et sous-régions CA1 de l'hippocampe (voir Figure 1). La capacité d'analyser les changements post-TCC dans chaque sous-région est essentielle pour comprendre les mécanismes sous-jacents qui contribuent à TCC induite comportementale et cognitive deficits.
Le système multi-facettes décrite ici permet aux enquêteurs de pousser la caractérisation passé de la phénoménologie induite par un état de maladie (dans ce cas TBI) et de déterminer les mécanismes responsables de la pathologie observée associée à un traumatisme cérébral.
Protocole
1. Latérale des blessures Percussion fluide
- Anesthésier la souris en utilisant un mélange de intrapéritonéale de kétamine et de la xylazine. Ensuite, préparez la tête de la souris pour l'incision à l'aide d'un gommage iode.
- Effectuer une craniectomie sur la région pariétale droite à l'aide de 3 mm (diamètre extérieur) trépan.
- Sécurisé moyeu d'aiguille Luer-loc (diamètre intérieur 3 mm) au cours de la craniectomie utilisant l'acrylique cyanoarylate et dentaires.
- 24 heures plus tard, anesthésier la souris en utilisant l'isoflurane par inhalation.
- Une fois la respiration reprend normales, mais avant la souris devient sensible à la stimulation, fournir 20 ms d'impulsion de solution saline dans le crâne par l'intermédiaire du dispositif de percussion de fluide blessure.
- Immédiatement après la blessure retirer le moyeu, reanaesthetize la souris en utilisant l'isoflurane, et suturer le cuir chevelu fermé.
Sham commandes actionnées recevrez une procédure identique à l'étape 1.5 omis.
2. Analyse comportementale - Resp peur conditionnéeonse
- Manipuler la souris sur deux jours consécutifs avant la réaction de peur conditionnée (CFR) de formation.
- Placez la souris dans la chambre de conditionnement pendant 3 min avant d'administrer un choc 1,5 mA sol pendant 2 secondes. Laisser la souris dans la chambre pour un supplément de 30 sec.
- Après la période de retard (généralement 24 heures), retournez la souris pour chambre de conditionnement pendant 5 min. Évaluer le gel à des intervalles de 5 secondes.
L'analyse consiste à comparer la valeur relative de congélation temps dans deux populations, dans notre cas, lésions cérébrales des souris et des contrôles opérés de manière fictive. La baisse des taux de congélation (par rapport au contrôle) indiquent incapacité à conserver l'association entre le contexte et le choc au sol, une indication de troubles de la mémoire et de troubles cognitifs.
3. Préparation aigus coupes d'hippocampe
* Remarque: Anesthésie aide d'un Bell Jar ne peut être mis en œuvre pour les procédures terminales (la dissection du cerveau décrit ici).
- 7 jours aprèsblessures, assurez-1 L de liquide céphalo-rachidien artificiel (ACSF) et 250 ml de saccharose solution de découpe.
- Utilisez de la glace généreusement afin de s'assurer que tous les instruments et solutions utilisées lors de la préparation de tranches de cerveau sont très froid.
- Anesthésier la souris en utilisant l'isoflurane. Rapidement et retirer délicatement le cerveau de la souris et le placer dans le saccharose.
- Garniture cerveau et le placer sur la surface de coupe sur une goutte de superglue en face d'un bloc de gélose.
- Couper 350 um d'épaisseur coupes coronales, vous devriez être en mesure d'obtenir 4 ou 5 tranches laissant le circuit intact l'hippocampe.
- Incuber tranches pendant au moins 1 heure à 37 ° C.
4. Enregistrement extracellulaire potentiel de champ
- Tirez électrodes en verre borosilicate à 2-5 MΩs utilisant extracteur vertical.
- Tranche de place dans la chambre et l'électrode d'insertion sur le porte-électrode.
- Abaissez électrode de stimulation dans la tranche dans un appareil axonal comme la voie perforante ou collatérales de Schaffer. Electrode d'enregistrement inférieureen position alors que des traces de sortie de surveillance pour s'assurer que les électrodes sont au même niveau z (profondeur). Quand une réponse maximale est atteinte, maintenir le niveau de stimulation de courant constant, les électrodes sont au même niveau z.
- La trace résultante se compose de trois éléments: le volley fibre présynaptique, le champ potentiel extracellulaire post-synaptique (fEPSP), et la pointe de la population post-synaptique. Les éléments peuvent se chevaucher dans le temps dans certaines préparations, ce qui rend l'analyse plus difficile. S'il ya ambiguïté entre si les réponses sont présynaptique ou postsynaptique, APV et CNQX peut être ajouté au bain de bloquer la transmission excitatrice, et tous les autres signaux seront d'origine présynaptique.
- Les protocoles de stimulation varient de produire trois types d'expériences distinctes: entrée / sortie des courbes, des enregistrements impulsions appariées, et les expériences de plasticité à long terme.
Analyse consiste typiquement en comparant les mesures de la pente de la fEPSP travers de deux lésions cérébrales des souris et des simulacres-Exploité contrôles, le contrôle de la force d'entrée en mesurant le volley fibres.
5. Visualisées patch-clamp
- Préparer tranches, électrodes et appareils de forage pour enregistrer comme précédemment décrit ci-dessus jusqu'à l'étape 4.2.
- Ne considérer les cellules plus profondes de 80 um dans le tissu que les cellules près de la surface sera mort et / ou ont réduit la connectivité. Approcher d'une cellule avec une pression positive sur l'électrode de sorte qu'elle ne soit pas obstrué lors de son déplacement vers le bas à travers le tissu. Lorsque l'électrode touche doucement la cellule appliquer une pression négative dans le but de créer un «gigaseal 'entre l'électrode et la membrane plasmique.
- Appliquer de courtes rafales de pression négative afin de rompre la membrane plama sous l'électrode et à réaliser la configuration à cellules entières.
- Éliminer les transitoires de capacité moyen d'un amplificateur et compenser la résistance série. Compensation de la résistance série de la pile est essentielle pour assurer uneccurate mesures.
- Deux modes d'enregistrements unicellulaires peuvent être effectuées: pince de courant (tension de la membrane de mesure) et le collier tension (mesure de courant traversant les canaux ioniques de la membrane).
Types d'analyse possibles sont nombreuses, mais dans notre cas, consistent principalement en l'analyse biophysique quantifier la fréquence et l'ampleur des courants synaptiques spontanés dans les deux lésions cérébrales des souris et des contrôles opérés de manière fictive.
6. Tension colorant sensible d'imagerie (VSD)
- Préparer des tranches et des appareils de forage à enregistrer comme précédemment décrit ci-dessus jusqu'à l'étape 4.2.
- Préparer actions colorant en mélangeant 1 mg de di-3-ANEPPDHQ dans 50 ul d'éthanol; distribuer 2 aliquotes dans des tubes enveloppés de feuilles, magasin à -20 ° C. Rendre le travail quotidien solution de colorant, par dilution de 1:200 dans aCSF.
- Incuber tranche sur aCSF papier filtre humidifié et colorer avec 90 ul de colorant pendant 16 minutes, rincez à l'aCSF et sa place dans la chambre d'enregistrement d'interface.
- Réglage de la lumière stimulation jusqu'à ce que l'intensité de la réponse est centrée au milieu du champ de la caméra. Les images sont généralement acquises à raison de 500-1000 images par seconde.
- Trigger Shutter pour la lumière de stimulation de 200 ms avant la stimulation électrique pour permettre initiale photoblanchiment rapide à se stabiliser. Acquisition essais alternés entre stimulé électriquement, et non stimulé électriquement, afin de permettre par la suite de soustraction d'arrière-plan non stimulé. Intensité de la lumière d'enregistrement de repos (lecture de fluorescence avec volet fermé) avant l'ouverture de l'obturateur. Chaque essai VSD sera un x pixels par y pixels par le temps "film" de lectures de fluorescence. Enregistrement de 10 à 12 essais VSD dans chaque condition d'essai.
- Toutes les mesures sont effectuées sur le changement intra-pixel fluorescence pré-stimulus électrique-normalisé, dF / F, qui est calculé comme suit:
Soustraire l'intensité lumineuse de repos de l'essai VSD acquises brutes. Pour chaque pixel de chaque essai, normaliser en fonction de la valeur moyenne-électrique-relance pré pour queprocès, et en soustrayant l'unité. Pour ce faire, tant pour les essais stimulées électriquement et non stimulées électriquement. Créer une moyenne "fluorescence de fond« procès des essais non stimulé électriquement, et soustraire cette épreuve de fond à partir des essais stimulées électriquement. Une analyse plus poussée est généralement effectuée sur la moyenne des 10 à 12 ces essais, qui sont aussi généralement filtrée dans l'espace et le temps d'améliorer le rapport signal sur bruit.
7. Les dissections régionaux pour les analyses biochimiques
- Enlever le cerveau de la souris, comme décrit précédemment.
- Préparer tranches à l'aide tissue chopper.
- Lay section plate, microdissect région CA1 et de la DG.
- Immédiatement immerger dans un tampon de lyse contenant un inhibiteur de protéase. Congeler dans de l'azote liquide et conserver à -80 ° C.
8. Les résultats représentatifs
Nos expériences commencent généralement avec les données comportementales pour confirmer l'attendented déficits cognitifs qui existent dans le cerveau des souris blessées. Nous employons contextuelle tests conditionné réaction de peur que c'est un comportement hippocampe dépend de qui est fiable et ne nécessite qu'une seule session de formation et une session de test. Les données représentées dans la figure 2 représente les tests comportementaux pour mesurer la mémoire antérograde, mais le test peut également être utilisé pour mesurer la mémoire rétrograde si la formation est effectuée avant la blessure.
Terrain potentiels postsynaptiques excitateurs (fEPSPs) sont mesurés pour déterminer l'efficacité synaptique nette d'une grande population de cellules (figure 3A). Nous employons couramment trois types de modèles de stimulation, chacune offrant ses propres résultats et conclusions. Tout d'abord, en augmentant l'intensité de stimulation à travers une série d'étapes, on crée une courbe d'entrée / sortie (Figure 3B / C).
Ensuite, en livrant deux stimulations de la même intensité séparéed par un bref délai (généralement 50 ms), nous étudions d'éventuelles modifications de la probabilité de libération synaptique de vésicules;. De plus, nous avons souvent effectuer potentialisation à long terme (LTP) des expériences. Après l'établissement d'une réponse de base, bref stimulation à haute fréquence (100 Hz en général) à la même intensité est délivré, ce qui provoque une cascade intracellulaire qui conduit à une réponse synaptique potentialisé lorsque la stimulation normale est reprise.
L'activité électrique à partir de cellules entières de patch-serré cellules peuvent être enregistrées dans deux modes. En mode de verrouillage de tension, l'expérimentateur contrôle la tension de la membrane de la cellule de patch-serrée dans le bain de référence, par l'intermédiaire d'un logiciel associé à l'amplificateur. Dans ce cas, les courants post-synaptiques de médiation événements sont enregistrés, fournissant des informations sur la fréquence libération présynaptique, le nombre de récepteurs post-synaptiques activés et la concentration des neurotransmetteurs vésiculaire (figure 4A). En mode courant imposé l'expérimentateurmanipule le courant injecté et mesure la réponse en tension. Cela peut être utile pour déterminer les caractéristiques du potentiel d'action, comme seuil de potentiel d'action et de demi-largeur. Ces caractéristiques permettent à la catégorisation fonctionnelle des neurones comme excitateur ou inhibiteur en fonction de leurs modes d'action de tir potentiels (figure 4B). Afin de vérifier l'identité cellulaire, nous recommandons de remplir les cellules avec du jaune Lucifer après l'enregistrement et de l'identité visuelle confirmant par la présence ou l'absence d'épines dendritiques. (Figure 4C, D).
Un exemple de résultats d'une expérience utilisant la tension colorant sensible à mesurer les changements de tension de la membrane est représentée sur la figure 5. Dans ce cas, une électrode de stimulation a été placé dans la voie collatérale de Schaffer et l'activité neuronale résultant dans la zone CA1 est analysé. Tension colorant sensible ne relève pas des valeurs absolues de tension de la membrane, mais plutôt te changement de tension à partir d'un état initial sans stimulation. Toutefois, les analyses comparant les deux conditions (par exemple, le cerveau blessé vs opération fictive) peut être utilisée pour déterminer les paramètres spatio-temporels de modifications physiologiques qui ne peuvent être mesurées à l'aide fEPSPs ou cellule entière de patch-clamp enregistrement.

Figure 1. Schéma hippocampique. Une coupe horizontale à travers l'hippocampe. Les principales voies par le biais de l'hippocampe sont affichés en jaune. Les axones des neurones dans le cortex entorhinal projet via la voie perforante dans le gyrus denté formant des synapses avec les dendrites des cellules granulaires du gyrus denté. Axones des cellules granulaires du projet par la voie des fibres moussues à CA3, où ils forment des synapses avec les dendrites des neurones CA3. Les axones des neurones CA3 projet par la voie collatérale de Schaffer sur la Dendrites des cellules pyramidales CA1. Les axones des cellules pyramidales CA1 projeter hors de l'hippocampe dans le subiculum. Remarque: Sont également représentés sont pyramidales CA3 collatéraux axones des cellules se projetant vers l'hippocampe controlatéral via la frange. (CA1: Cornu Ammonis 1, CA2: Cornu Ammonis 2, CA3: Cornu Ammonis 3, DG: Gyrus Denté, ligne en pointillés indique couche de corps cellulaire, ligne pleine indique les limites structurelles.)
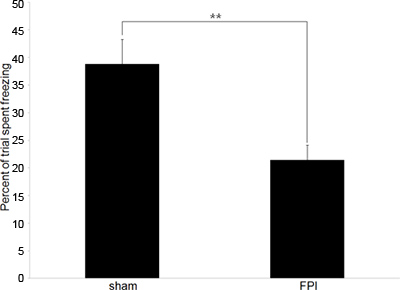
Figure 2. Représentatifs des données comportementales A:. Données comportementales décrivant la différence dans les taux de congélation entre lésions cérébrales chez la souris (FPI) et les contrôles opérés de manière fictive (fictive) dans le paradigme de la réponse de peur conditionnée. La formation a eu lieu le 6 e jour blessures suivante, la période d'essai se produire 24 heures plus tard. (** Représente p <.01).

Figure 3. Représentatifs des données d'enregistrement extracellulaire A:. Un exemple d'un champ excitateur potentiel post-synaptique (fEPSP) d'enregistrement dans la zone CA1. La déflexion vers le bas est le premier artefact de stimulation, suivie par la salve de fibres pré-synaptique et enfin la fEPSP. B: entrée / sortie des courbes représentant une diminution de l'efficacité synaptique net dans CA1 blessures fluide de percussion suivant (FPI). C: entrée / sortie des courbes représentant une augmentation de l'efficacité synaptique dans le gyrus dentelé net (DG) à la suite du FPI. (* Indique p <.05). Cliquez ici pour agrandir la figure .
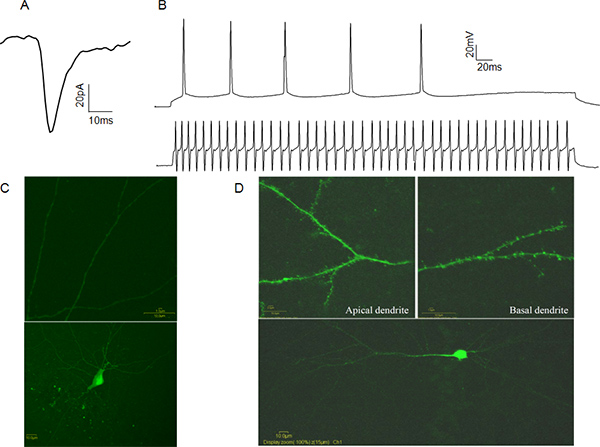
Figure 4. Représentant cellules entières Patch-clamp données. A: Un exemple spontanéeexcitateurs post-synaptiques de courant (sEPSC) à partir d'une cellule pyramidale CA1. B: Exemples de trains de potentiels d'action d'une cellule pyramidale CA1 (tracé supérieur) et un rapide dopage CA1 interneurone (trace inférieure). C: Exemple d'un jaune Lucifer rempli CA1 interneurone inhibiteur. Notez l'absence des épines dendritiques (panneau supérieur). D: Exemple de jaune Lucifer rempli CA1 neurone pyramidal. Notez la présence d'épines dendritiques (panneau supérieur). Cliquez ici pour agrandir la figure .
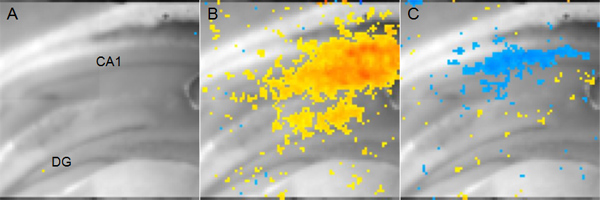
Figure 5. Représentant sensible à la tension de données d'imagerie Dye A:. Souris tranche coronale hippocampe affichée pour montrer l'anatomie. (DG: gyrus denté, CA1: Cornu Ammonis 1) B: Jaune à pixels rouges représentant l'activité excitatrice dans la région CA1 14 ms après la stimulation garantie afférente Schaffer. Rouge àdicates plus dépolarisation tandis que le jaune indique une dépolarisation plus faible, mais néanmoins significative. C: Pixel bleus représentant des sites d'activité inhibitrice dans la zone CA1 56 ms après la stimulation même garantie afférente Schaffer en bleu foncé B. indique plus hyperpolarisation.
Discussion
Chaque technique décrite ci-dessus contribue à une plus grande compréhension du mécanisme sous-jacent sorte que le déficit observé de comportement. En combinant les informations uniques tirés de chaque méthode, nous sommes en mesure d'examiner les mécanismes biologiques avec plus de précision.
FEPSPs mesure est utile pour quantifier l'efficacité synaptique net des grandes régions spatialement définies de neurones. Il peut également fournir des informations sur le potent...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier Elliot Bourgeois pour son aide technique. Ce travail a été financé par le National Institutes of Health des subventions R01HD059288 et R01NS069629.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'équipement | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Axopatch 200B amplificateur | Molecular Devices | Axopatch 200B | Plate-forme de patch-clamp |
| Digidata 1322A numériseur | Molecular Devices | Plate-forme de patch-clamp | |
| MP-225 micromanipulateur | Sutter | MP-225 | Plate-forme de patch-clamp |
| Microscope DMLFSA | Leica | Plate-forme de patch-clamp | |
| Multiclamp amplificateur 700B | Molecular Devices | MultiClamp 700B | Multifonction (sur le terrain)plate-forme |
| Digidata 1440 numériseur | Molecular Devices | Multipurpos (champ) rig | |
| MPC-200 micromanipulateur | Sutter | MPC-200 | Polyvalent (champ) rig |
| Microscope BX51WI | Olympe | BX51WI | Polyvalent (champ) rig |
| Axoclamp amplificateur 900A | Molecular Devices | AXOCLAMP 900A | VSD plate-forme |
| Digidata 1322 numériseur | Molecular Devices | VSD plate-forme | |
| Redshirt CCD-SMQ caméra | Redshirt | NCS01 | VSD plate-forme |
| VT 1200S Vibratome | Leica | 14048142066 | |
| P-30 extracteur d'électrode | Sutter | P-30 / P | |
| inhibiteur de la protéase complète | Roche | 11697498001 |
Références
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon