Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cuantificación de las propiedades mecánicas de la glicocálix endotelial con la Microscopía de Fuerza Atómica
En este artículo
Resumen
Las características mecánicas de glicocálix endotelial se midieron por indentación usando esferas micrón en voladizo de AFM. Las células endoteliales se cultivaron en una cámara de costumbre bajo condiciones de flujo fisiológico para inducir la expresión glicocálix. Los datos se analizaron utilizando un modelo de película delgada para determinar el espesor y el módulo de glicocálix.
Resumen
Nuestro entendimiento de la interacción de los leucocitos y la pared del vaso durante la captura de leucocitos está limitado por una comprensión incompleta de las propiedades mecánicas de la capa de la superficie endotelial. Se sabe que las moléculas de adhesión en los leucocitos se distribuyen de manera no uniforme en relación con topografía de la superficie 3, que limita la formación de topografía unión adhesiva con otras superficies 9, y que las fuerzas de contacto fisiológicas (≈ 5,0 a 10,0 pN por microvellosidades) puede comprimir las microvellosidades como poco como un tercio de su longitud en reposo, el aumento de la accesibilidad de las moléculas a la superficie opuesta 3, 7. Consideramos el endotelio como una estructura de dos capas, el cuerpo celular relativamente rígido, además de la glucocáliz, un recubrimiento de azúcar blando protectora en la superficie luminal 6. Se ha demostrado que el glicocáliz puede actuar como una barrera para reducir la adhesión de los leucocitos a la superficie endotelial 4.En este informe se empiezan a abordar la deformabilidad de las superficies endoteliales para entender cómo la rigidez mecánica del endotelio puede afectar la formación del enlace. Las células endoteliales cultivadas en cultivo estático no expresan un glicocalix robusta, pero las células cultivadas bajo condiciones de flujo fisiológico comienzan a aproximar el glucocáliz observado in vivo 2. El módulo del cuerpo de células endoteliales ha sido medida mediante microscopía de fuerza atómica (AFM) para ser aproximadamente de 5 a 20 kPa 5. El espesor y la estructura del glicocálix se han estudiado utilizando microscopía electrónica de 8, y el módulo de la glicocálix se ha aproximado mediante métodos indirectos, pero a nuestro conocimiento, no se han publicado informes de una medición directa del módulo glicocálix en células vivas . En este estudio, se presentan experimentos de indentación realizadas con una sonda AFM novela en células que han sido cultivadas en condiciones para maximizar su expresión glicocálix a make mediciones directas del módulo y el espesor de la glicocálix endotelial.
Protocolo
1. Métodos
1,1 Celular Cámara de Flujo
Una cámara de flujo, que se muestra en la Figura 1, fue construido de manera que las células pueden ser cultivadas bajo un esfuerzo cortante de 1,0 Pa (10 dinas / cm 2) y luego se transfiere directamente a un asilo MFP3D AFM (Santa Barbara, CA).
- La cámara de flujo se preparó para el experimento por primera limpieza de los portaobjetos de vidrio en solución Piranha (3:1 H 2 SO 4: H 2 O 2) durante 15 min y después de lavarlas con agua destilada. Ellos se cocieron luego a seco y recubierto con trietoxi aminopropil silano (APTES) en una cámara de deposición en vacío.
- Una junta de silicona se cortan con una herramienta de corte Silhouette SD. Esto nos permitió controlar finamente las dimensiones de la cámara de flujo para el control de la velocidad de flujo y la tensión de cizallamiento durante el crecimiento celular. Típicamente, un canal se cortó 6,4 mm de ancho por 19 mm de largo a partir de una lámina de silicona 0,4 mm. El caudal necesario para géneroste una tensión de cizalladura de 1,0 Pa (10 dinas / cm 2) se calcula suponiendo que el flujo laminar en un canal rectangular con la ecuación:
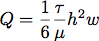
donde Q es el caudal, τ es el esfuerzo cortante, μ es la viscosidad del medio, que aquí suponen 1,0 mPa (0,01 dyn * s / cm 2), h es la altura y w es la anchura de la cámara de flujo .
- La pieza superior de la cámara de flujo se alinea con la junta en la placa de cultivo celular y se fija con un anillo magnético. El conjunto se llenó con alcohol isopropílico (IPA) para la esterilización.
- El sistema de flujo total fue montado. Los puertos de flujo en la placa de cultivo celular se conecta a las válvulas de tres vías. Las válvulas se conectaron a abrir 30 ml jeringas. IPA se eliminan a través del sistema, que después se lavó con 30 ml de medio de McCoy con 4% de suero fetal de ternera (FCS). El sistema se llenó entonces con 20 ml del medio de Vec Tecnologías de crecimiento celular. Las cubiertas fueron colocados en la parte superior de las jeringas. El depósito de captura tapa de la jeringa tenía una aguja en su lugar para mover medio de vuelta al depósito de alimentación. Estéril de 0,2 micras filtros se fijaron a las entradas de aire en las cubiertas para evitar la contaminación del sistema. La cámara de flujo estaba entonces listo para la siembra de células.
1,2 Cultivo Celular
- Humanos de las células endoteliales de vena umbilical humana (HUVEC) y el medio de crecimiento se compraron Tecnologías de Vec (Rensselaer, NY) y se cultivaron hasta confluencia en un matraz T25.
- El medio de crecimiento se retiró del matraz y la monocapa de células liberadas con 2 ml de tripsina al 2,5%. Una vez que las células estaban en solución, la tripsinización se detuvo con la adición de 10 ml de medio de cultivo celular al matraz.
- Thsuspensión e celular se centrifugó durante 5 min y se eliminó el sobrenadante. Las células se resuspendieron en 1 ml de medio de cultivo celular (que contiene suero) para la inyección en la cámara de flujo.
- La suspensión de células (0,5 ml, ~ 50.000 células) se cargó en una jeringa y se inyecta en la cámara de flujo a través de una válvula de tres vías.
- Las células se dejaron sedimentar y se adhieren al sustrato de vidrio durante 2 horas antes de flujo se inició. Las células fueron cultivadas bajo flujo en una incubadora a 37 ° C durante 1 a 5 días hasta confluencia.
1,3 Cantilever Preparación y sangría Celular
- Sin punta de AFM (voladizos nanomundo, Suiza) se limpiaron en ácido nítrico durante 5 min y se funcionaliza con trietoxi aminopropil silano (APTES) en una cámara de deposición de vapor.
- Una solución de 5 mg / ml en peso NHS-sulfo-LC-biotina en solución salina tamponada de Hank (HBSS) se preparó. Los voladizos se sumergieron en la solución durante 15 min a conjula puerta del silano con N-hidroxisuccinimida (NHS) química.
- Una solución de medio de biotina libre se realizó mediante la incubación de 20 ml de medio de cultivo Vec Cell Technologies (incluido el suero) con 200 l de perlas de estreptavidina durante 12 h. Las perlas se retiraron del medio con un imán y el medio se filtró a través de un filtro estéril de 0,22 micras.
- La cámara de flujo fue retirado de la placa de cultivo celular y las células se lavaron en 37 ° C biotina libre de soporte.
- Una solución stock de 1 l de 2,4 micras perlas recubiertas con estreptavidina en 1 ml de medio libre de biotina fue preparado, y 100 l de la madre se añadió a la placa de cultivo celular.
- Perlas de estreptavidina fueron recogidos con el voladizo por el aterrizaje de la punta en la superficie de vidrio junto a una retracción de bolas, posicionando el vértice de la viga en voladizo sobre el cordón, y después presionando el voladizo hacia abajo sobre los varios segundos de talón y de descanso para.
- La sensibilidad de la medida era voladizod por el sangrado en una región de vidrio desnudo y utilizando la pendiente de la curva para ajustar la desviación de la punta como una función de la tensión.
- La constante de resorte de la viga en voladizo se calculó a continuación a partir de una calibración térmica en el software MFP3D.
- El voladizo calibrado se utilizó a continuación para sangrar las muestras, como se muestra en la Figura 2. Estas perlas de 2,4 micras ofrecer una mayor área de contacto con la superficie de la célula de modo que las propiedades mecánicas de la capa blanda glicocálix puede ser detectado. El voladizo se coloca sobre una celda cerca del núcleo de la célula y un enfoque suave de la punta en la celda se usa para ajustar la altura del voladizo aproximadamente 3 m por encima de la superficie de la célula. El software se fijó para 20 muescas repetidos a una velocidad de 1 m / seg a una fuerza máxima de 7 nN. Aproximadamente 6 segundos transcurrido entre los contactos sucesivos. Es posible utilizar diferentes tasas de sangría para la prueba de tiempo que dependen de las propiedades del glicocálix, aunque en estos inicial experimentos, sólo una tasa de indentación simple (1 m / seg) se utilizó.
2. Sangría Theory
Indentación en un semiespacio elástico con una esfera de radio R puede ser descrito usando la teoría de Hertz, donde se da la fuerza de indentación, F, por la ecuación:
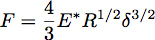
Donde δ es la profundidad de penetración y * E es el módulo reducida del material bajo prueba (Figura 3). En el caso de un indentador infinitamente rígido uniforme que incide un semiespacio elástico, E * viene dada por la ecuación:
3/50163eq3.jpg "/>
donde E es el módulo de elasticidad y ν es el coeficiente de Poisson del material. El trabajo reciente con películas de polímero ha inspirado el desarrollo de un modelo de dos capas para la determinación del módulo de elasticidad y espesor de las películas delgadas 1. Estamos aplicando este modelo a la biología celular mediante el tratamiento de la glicocálix como una película uniforme suave delgada sobre la superficie del cuerpo de la célula. Usando este modelo, el módulo reducida del sistema se convierte en:
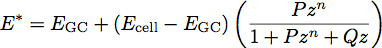
Donde E es el módulo de GC del glicocálix, célula E es el módulo de la célula cuerpo, P, Q y n son constantes que han sido determinados empíricamente a partir del polímero se ajusta, y z viene dada por la ecuación:
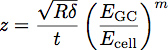
Donde t es el espesor de la capa de glicocálix. Un esquema de estos parámetros se muestra en la Figura 3. El modelo ha demostrado ser una forma precisa de determinar el módulo y el espesor de una película delgada sobre el agravamiento de sustrato 1. Esta ecuación se puede utilizar para adaptarse a las curvas obtenidas a partir de indentación en las células para determinar el módulo y el espesor de la glicocálix endotelial, como se muestra en la Figura 4.
Resultados
En un experimento típico, 20 fuerza-distancia-vs curvas se obtuvieron a partir de una región determinada de la célula, típicamente en la región perinuclear, cerca, pero no en, el núcleo (a menos de ~ 2 micras). Las curvas se ajustaron para tener en cuenta cualquier deriva de la muestra durante toda la duración de la medición y se promediaron para eliminar el ruido en voladizo, como se muestra en la Figura 4. Las curvas se analizaron y encajar con el modelo de dos capas que fue desarrollado para ...
Discusión
Se utilizaron los valores calculados a partir del modelo de dos capas y la teoría de Hertz para modelar la interacción de un leucocito circulante en la sangre con la pared endotelial. Hemos calculado que un microvellosidades en el recuento de leucocitos con un diámetro de 50 nm bajo una carga de 10 pN guión sería de aproximadamente 150 nm en el glucocáliz, sólo una fracción del espesor total. Esto indica que el glucocáliz, con propiedades como medidos en este experimento, es una barrera significativa para la in...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean dar las gracias a Elena Lomakina, Bauserman Richard Youngman Margaret, Vaknin Shay, Snyder Jessica, Striemer Chris, Nataraj Nakul, Hung Li Chung, Khire Tejas, y Eric Lam por su ayuda en este proyecto. Este proyecto fue financiado por el NIH PO1 HL # 018208.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / material | Empresa | Número de Catálogo | Comentarios |
| Medio de McCoy | Gibco | 16600-082 | |
| Suero de ternero fetal | Hyclone | SH30070 | |
| La célula endotelial Medio de Crecimiento | Vec Tecnologías | MCDB-131 | |
| Humano agrupado Las células endoteliales de vena umbilical | Vec Tecnologías | PHUVEC/T-25 | |
| Ácido sulfúrico | JT Baker | 9681-02 | |
| Peróxido de hidrógeno | VWR | BDH3742-1 | |
| (3-aminopropil) trietoxisilano | Aldrich | 440140-100ML | |
| Alcohol isopropílico | VWR | BDH8999-4 | |
| Tripsina | Cellgro | 25-054 C1- | |
| Tamponada de Hank Solución salina | Gibco | 14175-095 | |
| sulfo-NHS-LC-biotina | Thermo Scientific | 21335 | |
| Estreptavidina cuentas | Dynabeads | 112.06D | |
| MFP-3D AFM | Asylum Research | ||
| Cantilevers sin punta | Nanomundo | ARROW-TL1-50 | |
| Silhouette SD | Quickutz | Silueta-SD | |
| Caucho de silicona | Stockwell Elastomerics | SE50-RS | |
| 30 ml Jeringas | Benton Dickinson | 309650 | |
| 18 agujas de calibre | Benton Dickinson | 305196 | |
| Sets de extensión | Hospira | 4429-48 | |
| Válvulas de 4 vías | Teleflex | W21372 | |
| Hombre / Mujer Caps puerto | Smith Medical | MX491B | |
| Bomba peristáltica | Watson-Marlow | 401U / D | |
| Tubería peristáltica | Watson-Marlow | 903.0016.016 | |
| filtros estériles | Pall Life Science | 4652 |
Referencias
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados