Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification des propriétés mécaniques de la Glycocalyx endothéliale par microscopie à force atomique
Dans cet article
Résumé
Les caractéristiques mécaniques du glycocalyx endothéliale ont été mesurées par indentation à l'aide des sphères micrométriques sur des cantilevers AFM. Les cellules endothéliales ont été cultivées dans une chambre de mesure dans des conditions physiologiques de flux pour induire l'expression glycocalyx. Les données ont été analysées en utilisant un modèle de film mince pour déterminer l'épaisseur et le module glycocalyx.
Résumé
Notre compréhension de l'interaction des leucocytes et la paroi de la cuve lors de la capture des leucocytes est limitée par une compréhension incomplète des propriétés mécaniques de la couche de surface endothéliale. Il est connu que les molécules d'adhésion sur les leucocytes sont répartis non uniformément par rapport à la topographie de surface 3, que la topographie limite la formation de liaison adhésive avec d'autres surfaces 9, et que les forces de contact physiologiques (≈ 5,0 à 10,0 pN par microvillosités) permet de compresser les microvillosités comme moins un tiers de leur longueur au repos, ce qui augmente l'accessibilité des molécules à la surface opposée 3, 7. On considère que l'endothélium d'une structure à deux couches, le corps de cellule relativement rigide, plus la glycocalyx, un enrobage de sucre souple de protection sur la surface luminale 6. Il a été démontré que le glycocalyx peut agir comme une barrière pour réduire l'adhérence des leucocytes à l'endothélium 4 Surface.Dans ce rapport, nous commençons à aborder la déformabilité des surfaces endothéliales de comprendre comment la rigidité mécanique endothéliale pourrait affecter la formation de liaisons. Les cellules endothéliales en culture statique n'expriment pas un glycocalyx robuste, mais les cellules cultivées dans des conditions d'écoulement physiologiques commencent à approcher le glycocalyx observée in vivo 2. Le module de l'organisme des cellules endothéliales a été mesurée par microscopie à force atomique (AFM) à environ 5 à 20 kPa 5. L'épaisseur et la structure du glycocalyx ont été étudiés en microscopie électronique à 8, et le module du glycocalyx a été estimés à l'aide des méthodes indirectes, mais à notre connaissance, il n'y a pas eu de rapports publiés par une mesure directe du module glycocalyx des cellules vivantes . Dans cette étude, nous présentons des expériences faites avec indentation une nouvelle sonde AFM sur des cellules qui ont été cultivées dans des conditions de maximiser leur expression glycocalyx à mamesures directes de la ke module et de l'épaisseur de la glycocalyx endothéliale.
Protocole
1. Méthodes
1.1 Chambre débit cellulaire
Une chambre d'écoulement, illustré à la figure 1, a été construit de telle sorte que les cellules peuvent être cultivées sous un cisaillement de 1,0 Pa (10 dynes / cm 2), puis transféré directement à un asile MFP3D AFM (Santa Barbara, CA).
- La chambre de circulation a été préparé pour l'expérience d'abord nettoyer les lames de verre dans une solution piranha (3:1 H 2 SO 4 H 2 O 2) pendant 15 min, puis les laver avec de l'eau distillée. Ils ont ensuite été cuit à sec et revêtue d'aminopropyltriéthoxysilane (APTES) dans une chambre de dépôt sous vide.
- Un joint en silicone a été coupé à l'aide d'un outil de coupe Silhouette SD. Cela nous a permis de contrôler finement les dimensions de la chambre de débit pour le contrôle du débit et de la contrainte de cisaillement au cours de la croissance cellulaire. Typiquement, un chenal a été creusé de 6,4 mm de large par 19 mm de longueur à partir d'une feuille de 0,4 mm de silicone. Le débit nécessaire à des genreste une contrainte de cisaillement de 1,0 Pa (10 dynes / cm 2) est calculé en supposant un écoulement laminaire dans un canal rectangulaire à l'équation:
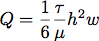
où Q est le débit, τ est la contrainte de cisaillement, μ est la viscosité du milieu, supposé ici être 1,0 mPa (0,01 dynes * s / cm 2), h est la hauteur et w est la largeur de la chambre d'écoulement .
- La pièce supérieure de la chambre d'écoulement est alignée avec le joint d'étanchéité dans la boîte de culture de cellules et fixé avec un anneau magnétique. L'ensemble a été rempli avec de l'alcool isopropylique (IPA) pour la stérilisation.
- Le système en circuit principal a été assemblé. Les orifices d'écoulement dans la boîte de culture cellulaire sont connectés à trois voies. Les vannes ont été raccordés à ouvrir seringue de 30 mls. IPA est passée dans le système, qui a été ensuite lavée avec 30 ml de milieu McCoy avec 4% de sérum de veau foetal (FCS). Le système a ensuite été rempli avec 20 ml du milieu Vec Technologies croissance cellulaire. Couvertures ont été placés sur les sommets des seringues. Le capuchon de la seringue capture réservoir avait une aiguille en place pour aller moyennes vers le réservoir d'alimentation. Stériles filtres de 0,2 pm ont été attachés à des entrées d'air dans les couvertures pour éviter la contamination du système. La chambre d'écoulement est alors prêt pour l'ensemencement des cellules.
1.2 Culture Cellulaire
- Les cellules endothéliales de veine ombilicale (HUVEC) et le milieu de croissance ont été achetés auprès Technologies Vec (Rensselaer, État de New York) et cultivées jusqu'à confluence dans un flacon T25.
- Le milieu de croissance a été retiré de la fiole et la monocouche de cellules du modèle avec 2 ml de trypsine 2,5%. Une fois que les cellules sont en solution, le traitement à la trypsine a été stoppée par l'ajout de 10 ml de milieu de culture cellulaire dans le ballon.
- Thsuspension cellulaire est centrifugée e pendant 5 min et le surnageant a été éliminé. Les cellules ont été remises en suspension dans 1 ml de milieu de culture cellulaire (contenant du sérum) pour l'injection dans la chambre d'écoulement.
- La suspension de cellules (0,5 ml, ~ 50.000 cellules) a été chargée dans une seringue et injecté dans la chambre d'écoulement à travers une vanne à trois voies.
- Les cellules ont été autorisés à s'installer et à adhérer au substrat de verre pendant 2 heures avant que le débit a été lancé. Les cellules ont été cultivées dans des flux dans un incubateur à 37 ° C pendant 1 à 5 jours jusqu'à confluence.
1.3 Préparation Cantilever et par pénétration cellulaire
- Sans pointe cantilevers AFM (NanoWorld, Suisse) ont été nettoyés dans de l'acide nitrique pendant 5 min et fonctionnalisés avec aminopropyltriéthoxysilane (APTES) dans une chambre de dépôt en phase vapeur.
- Une solution de 5 mg / ml en poids NHS-sulfo-LC-biotine dans une solution saline tamponnée de Hank (HBSS) a été préparé. Les consoles ont été immergés dans la solution pendant 15 min à conjuguésporte le silane avec du N-hydroxysuccinimide (NHS) chimie.
- Une solution de biotine milieu exempt a été faite par incubation de 20 ml de Vec Technologies milieu de culture cellulaire (y compris le sérum) avec 200 ul de billes streptavadin pour 12 h. Les billes sont séparées du milieu d'un aimant et le milieu a été filtré à travers un filtre stérile 0,22 um.
- La chambre d'écoulement a été retiré de la boîte de culture cellulaire et les cellules ont été lavées à 37 ° C sans biotine milieu.
- Une solution mère de 1 ul de 2,4 um perles recouvertes de streptavidine dans 1 ml de biotine libre milieu a été préparé, et 100 ul du stock a été ajouté à la boîte de culture cellulaire.
- Billes de streptavidine ont été ramassés en porte à faux avec l'atterrissage par la pointe sur la surface du verre à côté d'une perle, se rétractant, en positionnant le sommet de la console sur le talon, puis en appuyant vers le bas sur le cantilever les secondes de perles et de repos pour plusieurs.
- La sensibilité de la mesure était en porte à fauxd par indentation sur une région de verre nu et en utilisant la pente de la courbe pour définir la déviation pointe en fonction de la tension.
- La constante de rappel du levier a ensuite été calculé à partir d'un calibrage thermique dans le logiciel MFP3D.
- Le cantilever calibré a ensuite été utilisé pour indenter les échantillons, comme le montre la figure 2. Ces billes 2,4 um offrir une plus grande surface de contact avec la surface de la cellule de telle sorte que les propriétés mécaniques de la couche douce glycocalyx peut être détectée. Le cantilever a été placé sur une cellule près du noyau cellulaire et une approche douce de la pointe sur la cellule a été utilisée pour régler la hauteur cantilever environ 3 um-dessus de la surface de la cellule. Le logiciel a été créé pour 20 empreintes répétées à un taux de 1 um / s à une force maximale de 7 nN. Environ 6 secondes écoulé entre les contacts successifs. Il est possible d'utiliser différents taux de retrait pour tester les propriétés dépendant du temps du glycocalyx, bien que dans ces premiers expériences, seul un taux unique indentation (1 um / s) a été utilisé.
2. Théorie indentation
Indentation dans un demi-espace élastique avec une sphère de rayon R peut être décrite en utilisant la théorie de Hertz, où la force d'indentation, F, est donnée par l'équation:
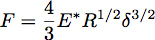
Où δ est la profondeur de pénétration et * E est le module de réduction de la matière en cours de test (figure 3). Dans le cas d'un pénétrateur infiniment rigides projeter un uniforme élastique demi-espace, E * est donné par l'équation:
3/50163eq3.jpg "/>
où E est le module d'élasticité et ν est le coefficient de Poisson du matériau. Les travaux récents de films polymères a inspiré le développement d'un modèle à deux couches pour déterminer le module et l'épaisseur des couches minces 1. Nous appliquons ce modèle pour la biologie cellulaire en traitant le glycocalyx comme un film uniforme mince souple sur la surface du corps de cellule. En utilisant ce modèle, le module réduit du système devient:
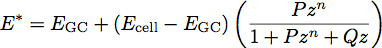
Où E est le module CA du glycocalyx, cellule E est le module d'élasticité du corps de cellule, P, Q et n sont des constantes qui ont été déterminées empiriquement, à partir du polymère s'insère, et z est donnée par l'équation:
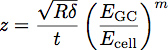
Où t est l'épaisseur de la couche de glycocalyx. Un schéma de ces paramètres est illustré à la figure 3. Le modèle a été montré pour être un moyen précis de déterminer le module et l'épaisseur d'un film mince sur substrat rigide 1. Cette équation peut être utilisée pour ajuster les courbes obtenues à partir de l'indentation dans les cellules pour déterminer le module et l'épaisseur du glycocalyx endothéliale, comme le montre la figure 4.
Résultats
Dans une expérience typique, 20 force vs distance courbes ont été obtenues à partir d'une région donnée de la cellule, généralement dans la région périnucléaire, à proximité, mais pas sur le noyau (dans ~ 2 um). Les courbes ont été alignés pour tenir compte de toute dérive échantillon au cours de la durée de la mesure, puis la moyenne pour éliminer le bruit en porte à faux, comme le montre la figure 4. Les courbes ont été analysés et qui cadrent avec le modèle à deux couche...
Discussion
Nous avons utilisé les valeurs calculées à partir du modèle à deux couches et la théorie de Hertz pour modéliser l'interaction d'un leucocyte circulant dans le sang avec la paroi endothéliale. Nous avons calculé qu'une microvillosités sur les leucocytes d'un diamètre de 50 nm sous une charge de 10 pN aurait tiret environ 150 nm dans le glycocalyx, seule une fraction de l'épaisseur totale. Ceci indique que le glycocalyx, avec des propriétés telles que mesurées dans cette expérience, es...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier Elena Lomakina, Richard Bauserman, Margaret Youngman, Shay Vaknin, Jessica Snyder, Chris Striemer, Nakul Nataraj, Hung Li Chung, Tejas Khire, et Eric Lam pour leur aide dans ce projet. Ce projet a été financé par le NIH # 018208 PO1 HL.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif / Matériel | Entreprise | Numéro de catalogue | Commentaires |
| McCoy moyen | Gibco | 16600-082 | |
| Sérum de veau foetal | Hyclone | SH30070 | |
| Endothelial Cell Growth Medium | Technologies Vec | MCDB-131 | |
| Communs cellules humaines endothéliales de veine ombilicale | Technologies Vec | PHUVEC/T-25 | |
| Acide sulfurique | JT Baker | 9681-02 | |
| Peroxyde d'hydrogène | VWR | BDH3742-1 | |
| (3-aminopropyl) triéthoxysilane | Aldrich | 440140-100ML | |
| Alcool isopropylique | VWR | BDH8999-4 | |
| Trypsine | Cellgro | 25-054 C1- | |
| Hank solution saline tamponnée | Gibco | 14175-095 | |
| sulfo-NHS-LC-biotine | Thermo Scientific | 21335 | |
| Perles Streptavadin | Dynabeads | 112.06D | |
| MFP-3D AFM | Asylum Research | ||
| Cantilevers sans pointe | Nanomonde | ARROW-TL1-50 | |
| Silhouette SD | Quickutz | Silhouette-SD | |
| Le caoutchouc de silicone | Stockwell Elastomerics | SE50-RS | |
| 30 seringues ml | Benton Dickinson | 309650 | |
| 18 aiguilles de calibre | Benton Dickinson | 305196 | |
| Prolongateurs | Hospira | 4429-48 | |
| Vannes 4 voies | Teleflex | W21372 | |
| Casquettes Port Mâle / Femelle | Smith médicale | MX491B | |
| Pompe péristaltique | Watson-Marlow | 401U / D | |
| Tuyau péristaltique | Watson-Marlow | 903.0016.016 | |
| filtres stériles | Pall Life Science | 4652 |
Références
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon