このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
原子間力顕微鏡と内皮グリコカリックスの機械的性質の定量化
要約
内皮グリコカリックスの機械的特性は、AFMカンチレバー上にミクロンサイズの球を使用して、インデントによって測定した。内皮細胞は糖衣発現を誘導する生理的な流動条件下でカスタム室で培養した。データはグリコカリックス厚さと弾性率を決定するために、薄膜モデルを用いて分析した。
要約
白血球と白血球キャプチャ時の血管壁の相互作用についての我々の理解は、内皮表面層の機械的特性の不完全な理解によってのみ制限されます。それは、白血球上の接着分子が表面トポグラフィー3に対して不均一に分布していることが知られており、その地形が他の表面9に接着結合の形成を制限し、その生理的な接触力(≈5.0 -微絨毛あたり10.0 PNが)と微絨毛を圧縮することができます対向面3,7に分子のアクセシビリティを増やし、彼らの休憩の長さの3分の少し。我々は2層構造と、比較的剛性の細胞体、プラス糖衣、腔面6に柔らかい保護糖コーティングなどの内皮を検討してください。それはグリコカリックスは内皮表面4への白血球の付着を低減するための障壁として作用し得ることが示されている。本稿では、内皮の機械剛性が結合形成に影響を与える可能性のある方法を理解する内皮表面の変形に対処するために開始されます。静置培養で増殖した内皮細胞は、堅牢な糖衣を発現しないが、生理的な流動条件下で培養した細胞は 、in vivo で観察された2近似糖衣し始める。内皮細胞体の弾性率は、約5〜20kPaで5であることが、原子間力顕微鏡(AFM)を用いて測定されています。グリコカリックスの厚さや構造は電子顕微鏡8を使用して研究されており、グリコカリックスの弾性率は、間接的な方法を用いて近似されていますが、私たちの知る限りでは、生きた細胞で糖衣弾性率の直接測定は発表報告されていない。そこで本研究では、MAに彼らの糖衣式を最大化するための条件で培養した細胞上で小説AFMプローブで作られたインデントの実験を提示内皮グリコカリックスの弾性率と厚さのke直接測定。
プロトコル
1。メソッド
1.1セル·フローチャンバー
細胞は1.0 Paの(10ダイン/ cm 2)のせん断下で成長してから、アサイラムMFP3D AFM(サンタバーバラ、カリフォルニア州)に直接転送することができるように、図1に示すフローチャンバーは、構築した。
- 15分間、次いで蒸留水でそれらを洗濯:フローチャンバーは最初ピラニア溶液(H 2 O 2 3:01、H 2 SO 4)内にスライドガラスを洗浄することにより、実験のために用意された。彼らはその後に焼成した乾燥した真空蒸着チャンバー内のシランアミノプロピルトリエトキシシラン(APTES)で被覆した。
- シリコーンガスケットはシルエットSDの切削工具を用いて切断した。これは、私たちは細かく細胞増殖時の流速とせん断応力を制御するためのフローチャンバーの寸法を制御することができました。典型的には、チャネル、0.4 mmのシリコンのシートから長い19ミリメートルで幅の広い6.4ミリメートルを切断した。属に必要な流量TE 1.0 PA(10ダイン/ cm 2)のせん断応力は、次式を有する矩形チャネル内の層流を仮定して計算されます:
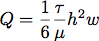
Qは流量であり、τはせん断応力であり、μは 、1.0メガパスカル(0.01ダイン*秒/ cm 2)であることがここで想定媒体の粘度であり、hは高さであり、wはフローチャンバーの幅です。
- フローチャンバーのトップピースは、細胞培養皿にガスケットと整列し、磁気リングで固定した。アセンブリは、滅菌のためにイソプロピルアルコール(IPA)で満たされていた。
- フルフローシステムを組み立てた。細胞培養皿内のフローポートは三方弁に接続されていた。バルブは30ミリリットルのシリンジを開くために接続されていたsである。 IPAは、その後4%ウシ胎児血清(FCS)をマッコイ培地30mlで洗浄したシステムを介して流した。システムは、その後、Vecはテクノロジーズ細胞増殖培地20mlを充填した。カバーはシリンジのトップスの上に置かれた。キャッチ·リザーバーシリンジキャップ、フィードタンクに戻ってメディアを移動する場所に針を持っていた。滅菌0.2μmのフィルターは、システムの汚染を防止するためにカバーに空気口に取り付けた。フローチャンバーは、次に細胞播種の準備ができていた。
1.2細胞培養
- ヒト臍帯静脈内皮細胞(HUVECの)と増殖培地はVecはテクノロジーから購入(レンセラー工科大学、ニューヨーク州)とT25フラスコでコンフルエントになるまで増殖させた。
- 増殖培地をフラスコと2.5%トリプシンの2ミリリットルでリリースされた細胞の単層から除去された。細胞は溶液中であったら、トリプシン処理をフラスコに細胞培養培地10mlを加えてクエンチした。
- 木曜日eの細胞懸濁液を5分間遠心分離した上清を除去した。細胞は、フローチャンバーに注入するための細胞培養培地(血清を含む)1mlに再懸濁した。
- 細胞懸濁液(0.5ミリリットル、〜50,000細胞)をシリンジに装填し、三方弁を介してフローチャンバーに注入した。
- 細胞は、フローが開始される前に2時間のために解決し、ガラス基板に付着させた。細胞がコンフルエントになるまで1〜5日間37℃でインキュベーター内の流れの下で成長させた。
1.3カンチレバーの作製と細胞のインデント
- チップレスのAFMカンチレバー(ナノワールド、スイス)を5分間硝酸で洗浄、蒸着室でシランアミノプロピルトリエトキシシラン(APTES)で官能化された。
- ハンクス緩衝塩溶液中の重量のNHS-スルホ-LC-ビオチンで5 mg / mlの溶液(HBSS)を調製した。カンチレバーは、コンジュ〜15分間溶液中に浸漬したN-ヒドロキシスクシンイミド(NHS)化学とシランゲート。
- ビオチンを含まない培地の溶液を12時間streptavadinビーズ200μlでVecは技術、細胞培養培地(血清を含む)の20ミリリットルをインキュベートすることにより行った。ビーズを磁石で培地から除去し、培地を0.22μm滅菌フィルターで濾過した。
- フローチャンバーは、細胞培養皿から除去し、細胞を37℃ビオチンを含まない培地で洗浄した。
- ビオチンを含まない培地を1mlのストレプトアビジンでコーティングされた2.4μmのビーズ1μlの原液を調製し、株式100μlの細胞培養皿に添加した。
- ストレプトアビジンビーズは、ビーズ、後退の横のガラス表面上の先端を着陸ビーズ上にカンチレバーの頂点を配置した後、ビーズとの憩いの数秒にカンチレバーを押し下げることによってカンチレバーで拾い上げた。
- カンチレバーの感度は、メジャーだった裸のガラスの領域にインデントや電圧の関数としての先端のたわみを設定するには、曲線の傾きを指定することで、D。
- カンチレバーのばね定数は、次にMFP3Dソフトウェアの熱キャリブレーションから算出した。
- 図2に示すように校正されたカンチレバーは、その後、サンプルをインデントするために使用された。これらの2.4μmのビーズは柔らかい糖衣層の機械的特性を検出することができるように、細胞表面との接触面積を提供します。カンチレバーは、セルに細胞核と先端の柔らかいアプローチに近いセルの上に配置された細胞表面上約3μmカンチレバーの高さを設定するために使用された。ソフトウェアは7 NNの最大の力〜1μmで/秒の速度で20繰り返さくぼみに設定されました。約6秒の連続接点間経過。これらの初期ではあるが、グリコカリックスの時間依存特性をテストするためにインデントの異なるレートを使用することが可能です実験は、単一のインデント率は(1ミクロン/秒)を用いた。
2。インデント論
半径Rの球との半空間弾性にインデントはインデントの力Fは 、式で与えられるヘルツ理論を用いて説明することができます:
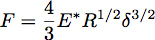
押し込み深さここで、δであり、E * は 、被試験材料( 図3)の減少率である。均一な弾性半空間を無限に当たる硬い圧子の場合、E *は次式で与えられます。
3/50163eq3.jpg "/>
Eはどこ弾性率、νは材料のポアソン比である。ポリマーフィルムと最近の研究では、薄膜1の弾性率と厚さを決定するための2層モデルの開発にインスピレーションを与えてきました。我々は、細胞体の表面に均一な薄膜軟質フィルムとして糖衣を扱うことによって、細胞生物学に本モデルを適用しています。このモデルを使用して、システムの縮小率は次のようになります。
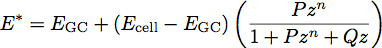
Eの GCはグリコカリックスの係数であり、E 細胞は細胞体の弾性率であり、P、Qおよびnは、経験的にポリマー収まるから決定された、 および z は次式で与えられる定数です。
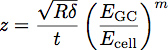
ここで、t は、糖衣層の厚さである。これらのパラメータの概略を図3に示します。モデルは硬めの基板1上に薄膜の弾性率と厚さを決定する正確な方法であることが示されている。 図4に示すように、この式は、内皮グリコカリックスの弾性率と厚さを決定するために、細胞内にインデントから得られた曲線に合わせて使用することができます。
結果
典型的な実験では、20力片対距離曲線は近くではなく、核(〜2μm以内)に、通常は核周辺領域で、セルの指定された領域から得られた。曲線は測定期間にわたって任意のサンプルのドリフトを考慮するために整列した後、図4に示すように、カンチレバーのノイズを除去するために平均化した。曲線を分析し、薄いポリマーフィルム1の弾性率と厚さを決定するために?...
ディスカッション
我々は、2層モデルと内皮壁と血液中を循環する白血球の相互作用をモデル化するためのヘルツ理論から算出した値を使用していました。我々は、10 PN荷重下50nmの直径を持つ白血球上の微絨毛は糖衣に約150nmをインデントすることを全体の厚さのほんの一部を計算した。これは、この実験で測定された特性を持つグリコカリックスは、細胞間相互作用に大きな障害となり、細胞は白血球の接着?...
開示事項
特別な利害関係は宣言されません。
謝辞
著者は、このプロジェクトと彼らの支援のためのエレナLomakina、リチャードBauserman、マーガレットヤングマン、シェイVaknin、ジェシカ·スナイダー、クリスStriemer、Nakulナタラジ、鴻李鄭、テジャスKhire、エリックラムに感謝したいと思います。このプロジェクトは、NIH#PO1 HL 018208によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/材料の名称 | 会社 | カタログ番号 | 注釈 |
| マッコイミディアム | ギブコ | 16600-082 | |
| ウシ胎仔血清 | Hyclone社 | SH30070 | |
| 内皮細胞増殖培地 | VEC Technologies社 | MCDB-131 | |
| プールしたヒト臍帯静脈内皮細胞 | VEC Technologies社 | PHUVEC/T-25 | |
| 硫酸 | JTベーカー | 9681から02 | |
| 過酸化水素 | VWR | BDH3742-1 | |
| (3 - アミノプロピル)トリエトキシシラン | アルドリッチ | 440140-100ML | |
| イソプロピルアルコール | VWR | BDH8999-4 | |
| トリプシン | Cellgro | 25から054-C1 | |
| ハンクス緩衝塩溶液 | ギブコ | 14175-095 | |
| スルホ-NHS-LC-ビオチン | サーモサイエンティフィック | 21335 | |
| Streptavadinビーズ | ダイナ | 112.06D | |
| MFP-3D AFM | アサイラムリサーチ | ||
| チップレスカンチレバー | ナノワールド | ARROW-TL1-50 | |
| シルエットのSD | Quickutz | シルエット-SD | |
| シリコーンゴム | ストックウェルElastomerics | SE50-RS | |
| 30mlのシリンジ | ベントンディッキンソン | 309650 | |
| 18ゲージの針 | ベントンディッキンソン | 305196 | |
| 拡張セット | ホスピーラ | 4429から48 | |
| 4方弁 | Teleflexは | W21372 | |
| 男性/女性ポートキャップ | スミスの医療 | MX491B | |
| 蠕動ポンプ | ワトソン·マーロー | 401U / D | |
| 蠕動チューブ | ワトソン·マーロー | 903.0016.016 | |
| 滅菌フィルター | ポールライフサイエンス | 4652 |
参考文献
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved