Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная Механические свойства эндотелиальных гликокаликса с атомно-силовой микроскопии
В этой статье
Резюме
Механические свойства эндотелиальных гликокаликса были измерены отступ использованием микронных размеров сферы на консоли АСМ. Эндотелиальные клетки культивировали в пользовательской камеры в физиологических условиях потока, чтобы вызвать гликокаликса выражение. Данные были проанализированы с помощью тонкой моделью фильм для определения толщины и гликокаликса модуля.
Аннотация
Наше понимание взаимодействия лейкоцитов и стенки сосуда во время захвата лейкоцитов ограничен неполное понимание механических свойств эндотелия поверхностного слоя. Известно, что молекулы адгезии на лейкоцитах распределены неравномерно по отношению к топографии поверхности 3, рельеф ограничивает клей формирование связей с другими поверхностями 9, и что физиологические силы контакта (≈ 5,0 - 10,0 пН в микроворсинок) может сжимать микроворсинки как лишь треть их длины покоя, повышение доступности молекул на противоположной поверхности 3, 7. Рассмотрим, как эндотелий двухслойной структурой, относительно жесткой тела клетки, а также гликокаликса, мягкий защитный слой сахара на просвет поверхность 6. Было показано, что гликокаликса может выступать в качестве барьера для уменьшения адгезии лейкоцитов к эндотелиальной поверхности 4.В этом докладе мы приступить к решению деформируемость поверхности эндотелиальных понять, как эндотелиальные механическая жесткость может повлиять на образовании связи. Эндотелиальных клеток, выращенных в культуре статического не выражают надежные гликокаликса, но клетки, выращенные в физиологических условиях потока начинают приближенных гликокаликса наблюдается в естественных условиях 2. Модуль эндотелиальные клетки тела были измерены с помощью атомно-силовой микроскопии (АСМ) составляет примерно от 5 до 20 кПа 5. Толщина и структура гликокаликса были изучены с помощью электронного микроскопа 8 и модуль гликокаликса были аппроксимированы с использованием косвенных методов, но насколько нам известно, не было никаких опубликованных отчетов прямого измерения модуля гликокаликса в живых клетках . В этом исследовании мы представляем отступ эксперименты с новым АСМ зонда на клетки, которые культивировались в условиях максимизировать свои гликокаликса выражение маке прямые измерения модуля упругости и толщины эндотелиального гликокаликса.
протокол
1. Методика
1,1 Проточная ячейка палата
Проточной камеры, как показано на рисунке 1, была построена так, что клетки могут быть выращены при сдвиге от 1,0 Па (10 дин / см 2), а затем передаются непосредственно в убежище MFP3D AFM (Санта-Барбара, Калифорния).
- Проточная камера была подготовлена для проведения эксперимента по первому очистки стекла слайды в пираньи решение (3:1 H 2 SO 4: H 2 O 2) в течение 15 минут, а затем вымойте их с дистиллированной водой. Затем они были запеченные в сухом и покрытые аминопропил триэтокси силана (APTES) в камере вакуумного напыления.
- Прокладка силиконовая было сокращено использование режущего инструмента Silhouette SD. Это позволило нам точно управлять потоком размеры камеры для контроля расхода и напряжения сдвига в процессе клеточного роста. Как правило, канал был сокращен 6,4 мм шириной и длиной 19 мм из листа 0,4 мм силикон. Расход необходимо родовТе напряжения сдвига от 1,0 Па (10 дин / см 2), рассчитаны исходя из ламинарного потока в прямоугольном канале с уравнением:
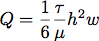
где Q является расходом, τ является напряжение сдвига, μ-вязкость среды, предполагается здесь, чтобы быть 1,0 МПа (0,01 дин * сек / см 2), Н-высота и W-ширина потока камеры .
- Верхняя часть потока камера была приведена в соответствие с прокладкой в блюдо клеточной культуры и крепится с помощью магнитного кольца. Сборка была наполнена изопропилового спирта (IPA) для стерилизации.
- Система полного потока была собрана. Поток портов в блюдо клеточной культуры были связаны с трехходовыми клапанами. Клапаны были связаны открыть 30 мл шприцас. IPA продувают через систему, которую затем промывают 30 мл среды Маккоя с 4% эмбриональной телячьей сыворотки (FCS). Эта система была затем заполняют 20 мл ячейки Vec среднего роста технологий. Материалы были размещены на вершинах шприцы. Шприц вылов резервуара крышка была иглу в место для перемещения средних обратно в канал водохранилища. Стерильные фильтры 0,2 мкм были прикреплены к воздухозаборники в крышке для предотвращения загрязнения системы. Проточная камера была готова к клетке посева.
1,2 культуре клеток
- Человека эндотелиальных клеток пупочной вены (HUVEC) и рост средней были приобретены у Vec технологий (Rensselaer, Нью-Йорк) и выращивали до слияния в T25 Flask.
- Рост среду удаляли из колбы и монослоя клеток выпущен с 2 мл 2,5% трипсина. Как только клетки в раствор, трипсинизации гасили добавлением 10 мл клеточной культуральной среде в колбу.
- ThПодвеска электронной клетки центрифугировали в течение 5 мин и супернатант удаляли. Клетки суспендируют в 1 мл клеточной культуральной среде (содержащей сыворотки) для инъекций в проточной камеры.
- Суспензию клеток (0,5 мл, ~ 50000 клеток) была загружена в шприц и вводят в поток камеру через трехходовой клапан.
- Эти клетки дают отстояться и присоединиться к стеклянной подложке в течение 2 часов, прежде чем поток был запущен. Клетки, выращенные в поток в инкубаторе при температуре 37 ° С в течение от 1 до 5 дней, пока не вырожденная.
1.3 Подготовка Консольные и сотовый отступов
- Tipless AFM консолей (наномира, Швейцария) были убраны в азотной кислоте в течение 5 мин и функционализированных аминопропил триэтокси силана (APTES) в камере осаждения из паровой фазы.
- Раствор 5 мг / мл по весу NHS-сульфо-LC-биотин в буферном солевом растворе Хэнка (HBSS) был подготовлен. Консолей были погружены в раствор на 15 минут, чтобы сопряженныхВорота силана с N-гидроксисукцинимида (NHS) химии.
- Решение биотин среде, свободной была сделана путем инкубации 20 мл Век технологий клеточной культуры средой (в том числе сыворотки) с 200 мкл streptavadin бусины в течение 12 часов. Бусины были выведены из среды с магнитом и среднего фильтровали через 0,22 мкм стерильный фильтр.
- Проточной камеры был снят с блюдом культуре клеток и клетки промывали в 37 ° C биотин-бесплатная среда.
- Маточный раствор из 1 мкл 2,4 мкм шарики, покрытые стрептавидином в 1 мл среды биотин бесплатно был подготовлен, и 100 мкл фондовый был добавлен в блюдо клеточной культуры.
- Стрептавидин бисером были подобраны с консольной при посадке кончик на поверхности стекла рядом с бисером, втягивания, позиционируя вершине консольные за борт, а затем нажать консоли вниз на борт и отдыха в течение нескольких секунд.
- Чувствительность консольной была мераD с помощью отступов на область голом стекле и с помощью наклона кривой, чтобы установить наконечник отклонения в зависимости от напряжения.
- Весной кантилевера Затем рассчитывается от теплового калибровки в MFP3D программного обеспечения.
- Калиброванные консольные затем был использован для отступа образцов, как показано на рисунке 2. Эти бусины 2,4 мкм предлагают большую площадь контакта с поверхностью клетки таким образом, что механические свойства мягкого слоя гликокаликса могут быть обнаружены. Кантилевера была расположена над клеткой вблизи ядра клетки и мягкий подход кончика на ячейки используются для установки консольных высоте примерно 3 мкм над поверхностью клетки. Программное обеспечение было установлено на 20 повторяют углубления со скоростью 1 мкм / сек до максимальной силы из 7 нн. Около 6 секунд, прошедшее между последовательными контактами. Можно использовать различные темпы углубления для проверки зависящих от времени свойств гликокаликса, хотя в этих первоначальных Эксперименты, только единая ставка отступ (1 мкм / сек) была использована.
2. Отступы теории
Отступы в упругое полупространство с шар радиуса R может быть описана с помощью теории Герца, где сила отступы, F, определяется по формуле:
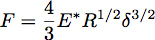
Там, где δ является глубина отступа и Е * приведенный модуль испытуемого материала (рис. 3). В случае бесконечно жесткой индентора падающих равномерное упругое полупространство, E * задается уравнением:
3/50163eq3.jpg "/>
где Е-модуль упругости и ν является коэффициент Пуассона материала. Недавние работы с полимерными пленками вдохновил развитие двухслойной модели для определения модуля упругости и толщины тонких пленок 1. Мы применяем эту модель клеточной биологии, рассматривая гликокаликса как единый тонкой мягкой пленки на поверхности клетки тела. Используя эту модель, приведенного модуля системы становится:
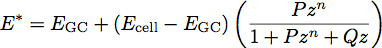
Где E GC-модуль гликокаликса, E ячейки модуля тела клетки, P, Q и п-константы, которые были определены эмпирически из полимера подходит, и г задается уравнением:
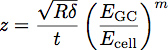
Где Т-толщина слоя гликокаликса. Схема этих параметров показан на рисунке 3. Модель была показана, чтобы быть точным способом определения модуля и толщину тонкой пленки на жесткой подложке 1. Это уравнение может быть использовано в соответствии с кривыми, полученными от отступа в клетки, чтобы определить модуль и толщина эндотелия гликокаликса, как показано на рисунке 4.
Результаты
В типичном эксперименте, 20 силы против расстоянии кривые были получены от определенного региона клетки, как правило, в перинуклеарной области, рядом, но не на, ядра (в пределах ~ 2 мкм). Кривые были выровнены по счету за любой образец дрейф в течение периода измерения и затем усредняются, ч...
Обсуждение
Мы использовали значения, вычисленные из двухслойной модели и теории Герца для моделирования взаимодействия лейкоцитов, циркулирующих в крови с эндотелиальной стенкой. Мы подсчитали, что микроворсинок на лейкоциты с диаметром 50 нм при нагрузке в 10 пН бы отступ около 150 нм в гликокалик?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Елена Ломакина, Ричард Баузерман, Маргарет Youngman, Шей Вакнин, Джессика Снайдер, Крис Striemer, Nakul Nataraj, Хун Ли Чунг, Tejas Khire, и Эрик Лам за их помощь в этом проекте. Этот проект был профинансирован NIH # PO1 HL 018208.
Материалы
| Name | Company | Catalog Number | Comments |
| Название Реагенты / Материал | Компания | Номер в каталоге | Комментарии |
| Маккоя Средний | Gibco | 16600-082 | |
| Эмбриональной телячьей сыворотки | Hyclone | SH30070 | |
| Эндотелиальная среднего роста клеток | Век технологий | MCDB-131 | |
| Объединенный человека эндотелиальных клеток пупочной вены | Век технологий | PHUVEC/T-25 | |
| Серная кислота | JT Baker | 9681-02 | |
| Перекись водорода | VWR | BDH3742-1 | |
| (3-аминопропил) триэтоксисилана | Aldrich | 440 140-100мл | |
| Изопропиловый спирт | VWR | BDH8999-4 | |
| Трипсин | Cellgro | 25-054-C1 | |
| Buffered Соль Хэнка решение | Gibco | 14175-095 | |
| сульфо-NHS-LC-биотина | Thermo Scientific | 21335 | |
| Streptavadin бисера | Dynabeads | 112.06D | |
| MFP-3D AFM | Asylum Research | ||
| Tipless Консоли | Наномир | СТРЕЛКА-TL1-50 | |
| Силуэт SD | Quickutz | Силуэт-SD | |
| Силиконовая резина | Stockwell Эластомеры | SE50-RS | |
| 30 мл шприцев | Benton Dickinson | 309650 | |
| 18 игл калибровочных | Benton Dickinson | 305196 | |
| Расширение наборы | Hospira | 4429-48 | |
| 4-ходовой клапан | Teleflex | W21372 | |
| Мужчина / Женщина Caps порт | Смит Медицинский | MX491B | |
| Перистальтический насос | Watson-Marlow | 401U / D | |
| Перистальтические труб | Watson-Marlow | 903.0016.016 | |
| стерильных фильтров | Наука Pall жизни | 4652 |
Ссылки
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены