Method Article
Extracción y análisis de prostaglandina en
En este artículo
Resumen
En este trabajo se describe un procedimiento optimizado para la extracción y el análisis de las prostaglandinas y otros eicosanoides de C. elegans Usando LC-MS/MS.
Resumen
Caenorhabditis elegans se está convirtiendo en un modelo animal de gran alcance para estudiar la biología de los lípidos de 1-9. Las prostaglandinas son una clase importante de los eicosanoides, que son señales de lípidos derivados a partir de ácidos grasos poliinsaturados (PUFAs) 10-14. Estas moléculas de señalización son difíciles de estudiar debido a su baja abundancia y la naturaleza reactiva. El rasgo característico de las prostaglandinas es una estructura de anillo de ciclopentano situado dentro de la estructura de ácido graso. En los mamíferos, las prostaglandinas se pueden formar a través de la ciclooxigenasa enzima dependiente de las vías independientes-y 10,15. C. elegans sintetiza una amplia gama de prostaglandinas independientes de las ciclooxigenasas 6,16,17. Una gran clase de prostaglandinas de la serie F ha sido identificado, pero el estudio de los eicosanoides se encuentra en una fase temprana, con un amplio espacio para nuevos descubrimientos. Aquí se describe un procedimiento para la extracción y el análisis de las prostaglandinas y otros eicosanoides. Lípido cargados se extraen a partir de cultivos de gusano de masas utilizando una técnica de extracción líquido-líquido y se analizaron por cromatografía líquida acoplada a la ionización por electrospray y espectrometría de masas en tándem (LC-ESI-MS/MS). La inclusión de análogos deuterados de prostaglandinas, tales como PGF 2 α-d 4 como se recomienda un patrón interno para el análisis cuantitativo. Control de la reacción múltiple o MRM se pueden utilizar para cuantificar y comparar los tipos de prostaglandinas específicas entre los animales de tipo salvaje y mutante. Descomposición inducida por colisión o MS / MS se pueden utilizar para obtener información sobre características estructurales importantes. La cromatografía líquida espectrometría de masas (LC-MS) rastreos de reconocimiento de un rango de masas seleccionado, tales como m / z 315 a 360 se puede utilizar para evaluar los cambios globales en los niveles de prostaglandina. Proporcionamos ejemplos de los tres análisis. Estos métodos proporcionan a los investigadores un conjunto de herramientas para el descubrimiento de nuevos eicosanoides y delinear sus vías metabólicas.
Introducción
Las prostaglandinas (PGs) son una clase importante de hormonas de lípidos que se han investigado e implicado en la regulación de la reproducción, la inmunidad, y el desarrollo en una amplia gama de organismos 12-14 ampliamente. PGs son ideales para sistemas completos análisis de biología, ya que comprenden una serie de lípidos derivados de un precursor común (s). El nematodo C. elegans es uno de los organismos modelo más utilizado para abordar las cuestiones fundamentales de la genética y la biología de sistemas.
Hemos demostrado que C. elegans sintetiza PGs de la serie F que guían espermatozoides móviles de los ovocitos 3,6,16. PGs de la serie F derivadas de PUFA de 20 carbonos con tres, cuatro, y cinco dobles enlaces, que comprende la F1, F2, F3 y clases, respectivamente, se han identificado 3,16. Estos PGs se sintetizan independiente de las enzimas ciclooxigenasa, sin embargo, estereoisómeros PGF 2α 1α y PGF son todavía GEnerated. Para los análisis cualitativos y cuantitativos de C. elegans PGs, LC-MS/MS es un potente y sensible técnica analítica. Antes de realizar este análisis, es importante desarrollar un método de extracción optimizado debido a que el rendimiento del proceso analítico depende en gran medida de la calidad del extracto. La cromatografía líquida y espectrometría de masas sólo pueden proporcionar masa anticipado a carga (m / z), así como la forma de pico deseable y tiempo de retención del ion primario PG. Perfiles metabólicos de las PGs en C. elegans es una tarea difícil que requiere diferentes estrategias de adquisición de MS.
Escaneo o exploración completa encuesta CL-EM (Q1 escaneado) tiene la ventaja de asegurar que las PGs más ionizables generarán una respuesta de espectrometría de masas. Si bien la exploración encuesta proporciona información útil en el perfil total de PGs en relación con el de tipo salvaje y mutante C. elegans, la detección de PGs menores se ve comprometida debido a la baja sensibilidad. Neverthemenos, escaneo CL-EM encuesta puede dar una visión global de las PGs y es particularmente útil para el análisis de mutantes predichos para afectar el metabolismo de una población PG grande.
En la identificación de metabolitos, el análisis LC-MS/MS de normas PG síntesis química se lleva a cabo primero para obtener su espectro de iones producto como compuestos de referencia. Estos espectros se puede comparar con el espectro de un metabolito desconocido. El modo de monitorización de reacción múltiple (MRM) se usa para mejorar la sensibilidad y la especificidad. Un experimento MRM se lleva a cabo mediante la especificación de la de iones / iones de producto padre transición masa de un compuesto. Al conocer la masa y la estructura de los analitos diana, es posible predecir transiciones de MRM teóricos para muchos metabolitos desconocidos.
Un método LC-MS/MS optimizado para perfilar PGs isómeros en C. No se ha informado elegans. A continuación se describe la extracción y el enfoque integrado de espectrometría de masas consiste en LC-MS y LC-MS / MS métodos para detectar, cuantificar, y la investigación de C. elegans metabolitos PG. Este enfoque se puede aplicar a otros eicosanoides.
Protocolo
El protocolo que se describe a continuación se divide en tres secciones: cultura gusano, la extracción de la prostaglandina, y el análisis de la prostaglandina. Como se ha señalado, hay varios puntos cuando las muestras se pueden almacenar temporalmente a -80 ° C o -20 ° C.
1. Gusano Cultura
Recomendamos aproximadamente 6 g de gusanos mixtos etapa para LC-MS/MS integrales. Esto debería proporcionar suficiente material para la detección de al menos seis inyecciones separadas. Para la cuantificación de los PGs conocidos por MRM en una sola inyección o dos, 1-2 g son suficientes. El análisis de extractos de cultivos sincronizados que consisten en una etapa específica también es posible. Hasta 4 cepas diferentes pueden ser cultivadas simultáneamente. Por ejemplo, un control de tipo salvaje y tres cepas mutantes diferentes.
- Preparar 65 X-grandes (16 cm) NGM placas y bacterias concentradas de alimentación suplementaria. Utilice NA22 bacterias para la siembra. Para que las bacterias concentradas de alimentación suplementaria, grow al menos cuatro litros de NA22 en medio LB durante 16-24 horas. Centrifugar, eliminar el sobrenadante y volver a suspender las bacterias en 100 ml de tampón M9. Puede ser requerido de 200 a 400 ml de esta solución bacteriana concentrada para cada cepa gusano. Almacenar a 4 ° C.
- Iniciar culturas gusano en 5 X-grandes placas. Crecer gusanos de aproximadamente 3 a 4 generaciones hasta platos están llenos de adultos grávidas. Bacterias concentradas deben añadirse a las placas para evitar el hambre, según sea necesario (~ 1 ml / placa y dejar que se seque por completo antes de volver a la tapa).
- Lave grávidas hermafroditas en platos con tampón M9 y recoger los gusanos en un ml tubo cónico de polipropileno 50.
- Permitir hermafroditas grávidas se depositen en la parte inferior (por lo general alrededor de 3-5 min). Aspirar el sobrenadante, incluyendo bacterias, huevos y gusanos etapa larval. Volver a suspender en 15 ml de tampón M9 y mezclar suavemente.
- Transferir 200 l de suspensión de tornillo sin fin a cada una de 60 placas sembradas NGM. Dispersar los gusanos a través de las placas. Mantenga solución gusano mezcladosasí hasta que todos los platos se han sembrado para asegurarse de que reciben aproximadamente el mismo número de gusanos.
- Suplemento por bacterias concentradas según sea necesario (~ 1 hr período ml/plate/12 a 24) para evitar el hambre. Permitir platos se sequen al aire antes de volver a las tapas. Gusanos crecer durante 2-4 generaciones, dependiendo de la cantidad original de gusanos cabezas de serie, o hasta que las placas están llenas de adultos grávidas.
- Placas gusano cosecha una cepa a la vez. Lavar los gusanos de las placas con tampón de M9 y recoger en tubos de polipropileno de 50 ml (por ejemplo, 6 tubos). Utilice M9 buffer para lavar un plato, a continuación, transferir el tampón gusano lleno a la siguiente placa. Después de lavar un número (por ejemplo,. 10 º) de las placas, la transferencia de la memoria intermedia de gusano lleno al tubo de 50 ml. Llenar el tubo hasta el tope con tampón M9. Repetir el lavado para el resto de las placas.
- Como los adultos grávidas se depositan en la parte inferior en 5-6 min, eliminar el sobrenadante (~ 35 ml) y consolidar en uno o dos tubos. Llenar los tubos de 50 ml con frM9 buffer esh, deje reposar durante 3 a 5 minutos, y retirar el sobrenadante dejando adultos grávidas. Repita 3 veces o hasta que el líquido sobrenadante transparente.
- El uso de un gran pipeta Pasteur de boquilla, como la transferencia de muchos gusanos como sea posible para dos tubos cónicos de 15 ml de polipropileno. Centrifugar a 1.000 FCR (~ 3500 rpm en CentraSL2) durante 5 min en una centrífuga clínica. Aspirar el sobrenadante y repetir hasta que todos los gusanos se transfieren y se sedimentaron en el mismo tubo. Retire tanto sobrenadante como sea posible y gusanos almacenar a -80 ° C. Repita el procedimiento para todas las cepas.
2. Extracción prostaglandina
Los reactivos necesarios para la extracción se muestran a continuación. El método se modificó a partir de la de Golovko y Murphy 17 e incluye extracción con acetona seguida por la purificación líquido-líquido, lo que mejora la sensibilidad LC-MS/MS. Una bala mezclador 5 de homogeneizador se utiliza en el procedimiento, aunque los resultados similares se pueden obtener con un homogeneizador Dounce. Hydroxytolue Butylatedne (BHT) y la evaporación bajo nitrógeno (N 2) de gas se utiliza para evitar la oxidación. Toda la cristalería debe ser siliconado (Sigmacote) para reducir la unión de lípidos. La extracción con disolventes orgánicos se debe realizar en una campana química.
- Pesar un tubo cónico de 50 ml de polipropileno. Transferir aproximadamente 6,0 g de gusanos congelados desde el tubo cónico de 15 ml se almacenó a -80 ° C por el corte a través del tubo con una hoja de afeitar caliente cerca de la marca de 6,5 ml. Una espátula de metanol-purificada puede usarse para eliminar el gusano de pellets congelados de la parte inferior del tubo. Al cortar a través de la pastilla para recuperar la parte inferior, las larvas de gusano menos densas y las bacterias residuales desde la parte superior de la pastilla se quedan atrás.
- Transfiera los gusanos congelados al tubo cónico de 50 ml previamente pesado. Si se están procesando muestras múltiples, utilice la misma cantidad (6,0 g) de tejido para estudios comparativos. Como los gusanos deshielo hasta formar una pasta, añadir o eliminar los gusanos con la espátula para obtener la masa deseada. Opcional: add 1,00 ng de PGF estándar 2α-d4 como un control interno para la eficiencia de la extracción.
- Añadir 12 ml de hielo-acetona fría 02:01 / solución salina con 0,005% de BHT a la suspensión gusano y mezclar bien con un vórtex. Dispensar 1,5 ml de la suspensión de gusano a cada uno de los doce tubos de plástico de 5 ml autoportantes para uso en la Batidora bala.
- Añadir 0,7-0,8 ml de 0,5 mm de diámetro ceria estabilizada perlas de óxido de circonio a cada tubo 5 ml. Cierre las tapas bien y cargar los 12 tubos en el Bullet mezclador 5 homogeneizador. Ejecutar la batidora durante 3 min a velocidad 8-9 y colocar los tubos en hielo. Asegúrese de cerrar las tapas muy bien o el contenido podría derramarse. Consulta 10 l de homogeneizado de un tubo en un portaobjetos utilizando un estereoscopio. Debe haber muy pocos gusanos intactos restantes. Repita a la misma velocidad durante un minuto, si es necesario.
- Uniformemente transferir los homogeneizados de cuatro tubos de vidrio cónico de 10 ml con un 9 "pipeta Pasteur. Evite cuentas de transferencia. Lavar las perlas de tres tubos Sequéntially con 1 ml de 1:2 de acetona / solución salina que contiene BHT. Repita el proceso para otros tubos hasta que se lavan todas las bolas. Transferir la solución restante (~ 4 ml) a los tubos de vidrio de 10 ml y se colocan en hielo.
- Centrifugar los tubos de vidrio de 10 ml a 4 ° C en una centrífuga clínica a ~ 1.000 xg durante 10 min. Transferir el sobrenadante de cada tubo a un tubo cónico de 10 ml de vidrio limpio.
- En una campana química, añadir un volumen igual de hexano a cada tubo de vidrio de 10 ml. Por ejemplo, añadir 3,5 ml de hexano a 3,5 ml de acetona / solución salina. Vortex a velocidad máxima durante 30 segundos.
- Centrifugar los tubos de vidrio de 10 ml a 4 ° C en una centrífuga clínica a ~ 1.000 xg durante 10 min. Desechar la fase superior que contiene hexano y los lípidos de carga neutra.
- Se acidifica la fase inferior a pH 3,5 con ácido fórmico al 2 M (aproximadamente 100 a 150 l). Prueba de pH con tiras de pH.
- Añadir un volumen igual de cloroformo a cada tubo. Vórtice a la máxima velocidad durante 30 segundos y centrifugar los tubos a 4 º C ina centrífuga clínica a ~ 1.000 xg durante 10 min.
- Retire y deseche la fase acuosa superior. Introduzca la punta de la pipeta a través de cualquier interfase lechosa residual de la fase inferior de cloroformo, evitando la interfase. Recoger la fase inferior de cada uno de los 4 tubos de 15 ml a un tubo cónico de vidrio limpio. Incubar a -20 ° C durante al menos 24 horas. En este punto, el extracto puede ser almacenado a -20 ° C durante hasta dos semanas.
- Tome el extracto del congelador y desechar la capa superior acuosa lechosa restante, si está presente. Transferir la fase de cloroformo a un vial de vidrio de ½ Dram marcado recubierto de teflón con una nueva pipeta Pasteur. En una campana química, se evapora la fracción soluble en cloroformo hasta sequedad bajo un flujo suave de gas N 2. El extracto seco se puede almacenar a -20 ° C durante hasta 2 semanas. Un esquema general utilizado para la extracción y el análisis de PG se muestra en la Figura 1.
3. Análisis prostaglandina
- Prepare Stocksoluciones de prostaglandinas de referencia individuales, tales como PGF 2α o PGF 2 α-d4 (1 g / ml) en metanol y diluir con metanol: agua (08:02 v / v) para obtener una solución de trabajo. Preparar una serie de diluciones (100, 10, 1, 0,1, 0,01 ng / ml) para generar una curva estándar.
- Añadir 200 l de metanol: agua (08:02 v / v) a la C. seca elegans extracto lipídico (s) y mezclar bien. Si se extrajo menos de 6 g de tejido sin fin, el extracto seco se debe resuspendió en menos volumen de metanol: solución de agua.
- Preparar la fase móvil que consta de 0,1% de ácido fórmico en agua [A] y acetonitrilo que contiene ácido fórmico al 0,1% [B].
- Configure el inyector automático a 4 ° C y colocar los viales de muestra en un 70-count 1.5 bastidor ml frasco.
- Equilibrar la Sinergia hidro columna RP-C18 con 0,1% de ácido fórmico a una velocidad de flujo de 0,2 ml / min durante aproximadamente 5 min.
- Inyectar la muestra (20-50 l) en la columna. Realizar gradiente de elución de inicioING con 10% de B y va hasta el 80% de B 0-11 min, 80-100% de B 11-14 min, y volviendo de nuevo a 10% de B en 16 min. El tiempo de ejecución total es de 20 min. Los tiempos de retención de 13 patrones auténticos se muestran en la Tabla 1 para la referencia 3.
- Introducir el efluente de la columna en el espectrómetro de masas usando una interfaz ESI operativo en el modo de iones negativos. El nitrógeno se usa como un nebulizador y gas de cortina (CUR = 10). El gas de colisión, la energía de colisión, y la temperatura se fijó en 10, -35 eV y 600 ° C, respectivamente. Desagrupación potencial (DP), la energía de colisión (CE), y el potencial de salida de la célula (CXP) se fijó en -90, -35 y -10, respectivamente.
- En las exploraciones de la encuesta (scans Q1), utilice el modo de iones negativos en el rango de masa de m / z 315 a 360 para la mayoría de PGs (Figura 2). El rango puede ser alterada, dependiendo de la masa del compuesto (s) de interés. Extraer iones de corriente de iones totales (TIC) de LC-MS cromatogramas de iones y determinar si la extracciónted iones corresponden a los iones desprotonados o aducto, o a los fragmentos de iones.
- Para los experimentos de GRM, la transición de masas m / z 355/311 se utiliza para detectar la clase F1, m / z 353/193 se utiliza para la clase F2, y m / z 351/193 o 351/191 se utiliza para la clase F3 (Figura 3). MRM también se utiliza para detectar el patrón interno (por ejemplo, m / z 357/197 para la PGF 2α-d4) y para generar la curva estándar. Ver Murphy et al. Para obtener información adicional en la página transiciones de masa 18.
- Para los experimentos de MS / MS, usar m / z 355 para la clase F1, m / z clase F2 353for, y m / z 351for F3 PGs clase. C. elegans datos de MS / MS para PGs de la serie F está disponible en la figura 4 y en la Tabla 2 3,16. Datos de MS / MS de eicosanoides mamíferos está disponible en www.lipidmaps.org .
- Procesar los datos analíticos que utilizan Analyst de software (Versión 1.4.2, Applied Biosystems).
Resultados
Preparación de la muestra se llevó a cabo por extracción líquido-líquido adaptado de Golovko y Murphy 17. Es siempre una excelente recuperación del patrón interno (PGF 2α-d4). El esquema general para la extracción de PG de C. elegans se muestra en la Figura 1. Se optimizaron las condiciones cromatográficas para proporcionar la separación inicial de> 30 normas eicosanoides (Tabla 1 muestra 13 de las normas). Una columna Hydro-RP (250 x 2,0 mm ID) con agua y acetonitrilo que contiene ácido fórmico al 0,1%, siempre que la mejor separación y la sensibilidad. Análisis de la encuesta de extractos mutantes de tipo salvaje y sin grasa 3 muestran en la Figura 2 niveles globales de documentos de iones dentro del rango de masas de 315 a 360 unidades de masa atómica. Grasa 3 (WA22) mutantes que carecen de PUFAs más de 20 carbonos. Se resalta una clase PG F3. En la Figura 3, los análisis de GRM de un extracto de tipo salvaje muestran múltiples isómeros PG de la F1 (Figura 3A ng>), (Figuras 3C y 3D) clases F2 (Figura 3B), y F3. La clase F3 puede ser detectado con cualquiera de las dos transiciones de masa, m / z 351/193 o m / z 351/191. CePGF2 está predominantemente compuesta por la PGF 2α enantiómero. CePGF1 es probable que sea PGF 1α o su enantiómero. Figura 4 muestra la descomposición inducida por colisión de CePGF2 (RT = 11,8) en comparación con el estándar de PGF2 α (RT = 11,8). Probablemente pequeñas diferencias de iones producto se deben a la baja abundancia CePGF2 y compuestos que eluyen en el extracto.

Figura 1. Diagrama esquemático de C. elegans PGs extracción y análisis LC-MS. Tenga en cuenta que la acetona / solución salina y cloroformo ambos tienen 0,005% de BHT para reducir al mínimo la oxidación de lípidos. Consulte el texto para más detalles.https://www.jove.com/files/ftp_upload/50447/50447fig1large.jpg "target =" _blank "> Haga clic aquí para ver más grande la figura.

Figura 2. Análisis de la encuesta de m / z 315-360 de extractos mutantes de tipo salvaje y sin grasa 3 (WA22). Tiempo de retención cromatografía líquida (RT) se muestran en el panel [A]. Iones extraídos a TA = 11.3 se muestran para los de tipo salvaje [B] y grasa 3 (WA22) [C] extractos. Se resalta una PG clase F3 con masa m / z 351. Cps, cuentas / segundo; amu, unidad de masa atómica.
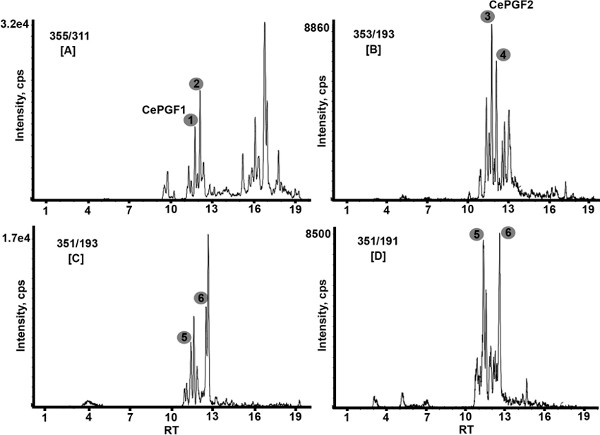
HigoUre 3. Análisis MRM de extractos de tipo salvaje. PGs clase F1 se detectan con la transición de masa m / z 355/311 [A]. Observe que también se detectan varios compuestos hidrófobos (RT> 14 min), que son poco probable que sea PGs, con esta transición. PGs clase F2 se detectan con la transición de masa m / z 353/193 [B]. PGs clase F3 se detectan, ya sea con la transición de masa m / z 351/193 [C] o m / z 351/191 [D]. Tenga en cuenta que los extractos contienen múltiples isómeros PG de cada clase. Los números corresponden a las PGs que se muestran en la Tabla 2. La concentración de CePGF2 es 1,8 ng / ml. RT, tiempo de retención; cps, cuentas / segundo.

La Figura 4. Descomposición inducida por colisión de synth químicamenteesized PGF 2α y CePGF2. Las flechas en el panel [A] indican iones producto o fragmentación compartidos entre PGF 2α y CePGF2 (RT = 11,8). Los iones producto de m / z 309 y m / z 193 se generan a partir de los sitios de escisión indicados (marcados A y B), corresponden a las estructuras que se muestran y son característicos de PGs de la serie F [B]. Cps, recuentos / seg. Haga clic aquí para ver más grande la figura .
| Estándar | RT (min) | [MH] - m / z | Iones producto clave en MS / MS |
| 20-hidroxi PGE 2 | 9.43 | 367 | 349, 331, 287, 234, 189, 129, 109 |
| PGF 3 - | 11.26 | 351 | 333, 307, 289, 271, 245, 219, 209, 193, 191, 171, 165, 111 |
| El tromboxano B 2 | 11.66 | 369 | 289, 191, 177, 169, 151 |
| PGF 2 - | 11.80 | 353 | 335, 309, 291, 273, 263, 247, 235, 209, 193, 171, 165, 111 |
| PGF 1 - | 11.79 | 355 | 337, 319,311, 301, 293, 275, 265, 237, 211, 195 |
| Lipoxina B 4 | 12.38 | 351 | 201, 191,189, 165, 155, 115, 107, 71, 59 |
| PGD 2 | 12.56 | 351 | 315, 271,203, 189 |
| 5 (S), 6 (R) - lipoxina A 4 | 12.83 | 351 | 235, 217, 189, 144, 135, 115, 99, 59 |
| PGA 2 | 14.02 | 333 | 315, 297, 271, 235, 191, 189, 175, 163, 137, 113, 109 |
| Δ12-PGJ 2 | 14.20 | 333 | 271, 189, 123 |
| Leucotrieno B4 | 14.73 | 335 | 181, 109, 93, 71, 69, 59, 57 |
| 15d-Δ 12,14-PGJ 2 | 16.80 | 315 | 297, 271, 217, 203, 158 |
| 5 (S)-HPETE | 17.88 | 335 | 97, 83, 81, 57 |
Tabla 1. Los tiempos de retención e iones de productos clave de 13 niveles de eicosanoides el método LC-MS/MS 3. Se utilizaron más de 30 normas para desarrollar el programa LC-MS/MS. Los tiempos de retención cromatográficos (RTs) son diferentes, incluso entre PGs muy similares. Una excepción es 2α 1α y PGF PGF. Sin embargo, estas PGs son distinguished por sus masas de iones padres ([MH] - m / z) y colisión inducida por espectros de descomposición (MS / MS).
| Clase de prostaglandina | No. En la Figura 3 | [MH] - m / z | Iones producto clave en MS / MS |
| F1 (CePGF1) | 1 | 355 | 319, 301, 311, 293, 275, 265, 237, 223, 211, 195, 157 |
| F1 | 2 | 355 | 311, 301, 293, 275, 265, 211, 195, 167, 157 |
| F2 (CePGF2) | 3 | 353 | 309, 291, 273, 263, 247, 209, 193, 171, 165, 127 |
| F2 | 4 | 353 | 309, 291, 273, 263, 255, 247, 219, 209, 193, 171, 113 |
| F3 | 5 | 351 | 315, 307, 289, 275, 249, 205, 193, 191, 167, 153, 139 |
| F3 | 6 | 351 | 333, 289, 271, 261, 245, 223, 193, 191, 163 |
Tabla 2. Iones producto de descomposición inducida por la colisión de varios de los principales C. elegans F1, F2, F3 y PGs muestran en la Figura 3. MS / MS de otros isómeros menos abundantes no se muestran. Estos datos provienen de múltiples análisis y no todos los iones producidos pueden ser visibles en un plazo determinado. Dada la complejidad de los extractos, algunos iones de productos menos abundantes pueden derivar de otro ion progenitor con el tiempo de retención similar o resultado de la interferencia. Pico 2 es probable que un estereoisómero de CePGF1 y el pico 4 es probable que un estereoisómero de CePGF2. Ver Edmonds, et al. (2010) para obtener datos adicionales 3.
Discusión
Se describe un procedimiento para la extracción y el análisis de los eicosanoides, centrándose en PGs de la serie F. Hay varias partes del procedimiento que puede ser problemático. En primer lugar, es fundamental que los cultivos de gusanos no mueren de hambre, como el hambre puede alterar el metabolismo PG. Para la alimentación complementaria, se recomienda NA22 bacterias en lugar de los OP50 bacterias más comúnmente utilizadas por NA22 alcanza una mayor densidad. Sin embargo, la cepa NA22 carece de resistencia a los antibióticos y es más susceptible a la contaminación. En segundo lugar, los gusanos sintetizar isómeros PG individuales en abundancia bajo en relación con los tejidos de mamíferos. Esto puede ser debido, en parte, a la redundancia entre los numerosos isómeros. Recomendamos unos 6 g de tejido para análisis completo y señales más fuertes. Menos tejido (1-2 g) se puede utilizar si el extracto seco se resuspendió en menos metanol: solución de agua para aumentar la concentración de PG. Sin embargo, se pueden realizar sólo una o dos inyecciones. El límite de detección de nuestro sistema de LC-MS/MS es de aproximadamente 10 pgPGF 2α / ml. Un ml de densas gusanos etapa mixta (aproximadamente 1 g) se obtiene más o menos 25-50 pg de CePGF2. Sistemas de espectrometría de masas más sensibles pueden reducir la cantidad de tejido necesario para el análisis del gusano. En tercer lugar, las diferencias en la eficiencia de extracción PG entre las muestras pueden provocar resultados variables. Hemos encontrado que la eficiencia de extracción es muy similar cuando los tejidos se extraen en paralelo. Para determinar la eficiencia, añadir 1,0 ng de PGF 2α-d 4 en la etapa de homogeneización como un control interno. MRM con la transición de masa m / z 357/197 se utiliza para medir la concentración de PGF 2α-d4 relación a un 1 ng / ml solución estándar. Luego se calcula el importe de PGF 2α-d4 perdido durante la extracción.
Los parámetros de cromatografía y transiciones de masa que incluimos pueden ser alterados para detectar otras PGs y eicosanoides. A pesar de considerables esfuerzos, no hemos sido capaces de identificar la serie D o E-sers PGs en los extractos 17. Por otra parte, no hemos detectado 8-iso PGF 2α y 8-iso PGE2 que son característicos de la libre peroxidación iniciada por radicales, que genera una mezcla selectiva de PG estereoisómeros 19. Ya sea que los gusanos sintetizan otros tipos PG no se conoce. Los endocannabinoides y diversos epoxi e hidroxi metabolitos de los ácidos araquidónico y eicosapentaenoico se han encontrado en C. elegans extrae 5,7,20,21. Se recomienda el uso de ambos MRM y MS / MS en comparación con patrones auténticos para la cuantificación e identificación, respectivamente. Para nuevos eicosanoides, estos análisis se deben combinar con un estudio comparativo de los mutantes de grasa, que son deficientes en la síntesis de PUFA enzimas 22, así como un ensayo funcional, si es posible. Una advertencia para el análisis de mutantes de grasa es que pequeñas cantidades de PUFAs presentes en los gusanos son suficientes para la síntesis de PG. Por ejemplo, la grasa-2 (wa17) mutantestener una pequeña cantidad de la actividad desaturasa D12 (~ 5% de tipo salvaje 22) y estos mutantes todavía producen PGs 6. grasa-3 (WA22) y grasa-4 (WA14) mutantes no pueden sintetizar las PGs derivadas de los ácidos araquidónico y eicosapentaenoico 16 . También hemos encontrado que los mutantes de grasa para compensar la pérdida de clases por AGPI hasta la regulación de la síntesis de PG de las clases restantes. Por ejemplo, grasa-3 (WA22) mutantes no pueden sintetizar la mayoría de las PGs derivadas de PUFA 20-carbono. En cambio, parece que hasta de regular PGs nuevos derivados de 18 carbonos PUFAs 16. Hasta la fecha, no hemos identificado una C. elegans cepa que es completamente deficiente en la síntesis de PG. Es posible que las PGs son esenciales para el crecimiento o el desarrollo.
Divulgaciones
Los autores no tienen ningún conflicto de intereses.
Agradecimientos
Agradecemos a los metabolómica dirigida UAB y Laboratorio de Proteómica, que ha sido apoyado en parte por el Centro de Investigación de Enfermedades UAB Skin (P30 AR050948 Elmets a C.), el Centro de Lesiones de O'Brien Renal Aguda UAB-UCSD (P30 DK079337 a A. Agarwal ) y el Centro de Salud Pulmonar UAB (HL114439 R01, R01 HL110950 de JE Blalock). Soporte para el espectrómetro de masas era de una subvención compartida Instrumentación CNRR (S10 RR19261 de S. Barnes). También queremos agradecer a Ray Moore para soporte técnico. C. elegans cepas fueron proporcionados por el Centro de Genética Caenorhabditis, que es financiado por el NIH. Este trabajo fue apoyado por el NIH (R01GM085105 al MAM, incluyendo un suplemento administrativa ARRA).
Materiales
| Name | Company | Catalog Number | Comments | ||||||||||||||
| REAGENTS | |||||||||||||||||
| X-large (16 cm) plates | Fisher Scientific | 0875714 | |||||||||||||||
| E. coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | http://www.cgc.cbs.umn.edu | ||||||||||||||
| Acetone, 399.5% | Fisher Scientific | A928-4 | |||||||||||||||
| Butylated Hydroxytoluene | MP Biomedicals | 101162 | |||||||||||||||
| Hexane, HPLC grade | Fisher Scientific | H302-1 | |||||||||||||||
| Formic acid, 399% | Acros | AC27048-0010 | Available through Fisher Scientific | ||||||||||||||
| Chloroform, HPLC grade | Acros | AC26832-0010 | Available through Fisher Scientific | ||||||||||||||
| PGF2α-d4 | Cayman Chemicals | 316010 | Cayman has a wide array of standards available for purchase | ||||||||||||||
| Sterile screw cap self-standing 5 ml tube | Fisher Scientific | 14-222-651 | For use with Bullet Blender | ||||||||||||||
| 0.5 mm zirconium oxide beads | Next >>> Advance | ZrOB05 | |||||||||||||||
| 10 ml glass conical heavy-duty graduated centrifuge tubes | Kimble Kimax | 45200-10 | Available through Fisher Scientific | ||||||||||||||
| 15 ml glass conical tubes | Corning Pyrex | 8082-15 | Available through Fisher Scientific | ||||||||||||||
| Sigmacote (Siliconizing reagent) | Sigma-Aldrich | SL2-100ML | |||||||||||||||
| Teflon lined capped 1/2 Dram glass vial | Fisher Scientific | V1235C-TFE | |||||||||||||||
| EQUIPMENT | |||||||||||||||||
| CentraSL2 Clinical Centrifuge | Thomas Scientific | 2517N92-TS | |||||||||||||||
| Bullet Blender 5 blue homogenizer | Next >>> Advance | BBY5MB | A 40 ml Dounce homogenizer can be used as an alternative | ||||||||||||||
| Synergi 4 μm Hydro-RP 80 Å LC Column 250 x 2.0 mm | Phenomenenex | 00G-4375-B0 | HPLC Column | ||||||||||||||
| SecurityGuard Cartridges AQ C18 4 x 2.0 mm | Phenomenenex | AJ0-7510 | |||||||||||||||
| SecurityGuard Guard Cartridges Kit | Phenomenenex | KJ0-4282 | |||||||||||||||
| Shimadzu Prominence HPLC with refrigerated auto sampler | Shimadzu Scientific Instruments, Inc. | Any standard HPLC system coupled to a triple quadrupole mass spectrometer should be sufficient | |||||||||||||||
| API 4000 triple quadrupole mass spectrometer | Applied Biosystems/MDS SCIEX | ||||||||||||||||
| |||||||||||||||||
Referencias
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends Endocrinol. Metab. 20, 58-65 (2009).
- Marza, E., Lesa, G. M. Polyunsaturated fatty acids and neurotransmission in Caenorhabditis elegans. Biochem. Soc. Trans. 34, 77-80 (2006).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Dev. Cell. 19, 858-871 (2010).
- Kniazeva, M., Shen, H., Euler, T., Wang, C., Han, M. Regulation of maternal phospholipid composition and IP(3)-dependent embryonic membrane dynamics by a specific fatty acid metabolic event in C. elegans. Genes Dev. 26 (3), 554-566 (2012).
- Kosel, M., et al. Eicosanoid formation by a cytochrome P450 isoform expressed in the pharynx of Caenorhabditis elegans. Biochem. J. 435, 689-700 (2011).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nat Cell Biol. 8, 1143-1148 (2006).
- Lucanic, M., et al. N-acylethanolamine signalling mediates the effect of diet on lifespan in Caenorhabditis elegans. Nature. 473, 226-229 (2011).
- Gerisch, B., et al. A bile acid-like steroid modulates Caenorhabditis elegans lifespan through nuclear receptor signaling. Proc. Natl. Acad. Sci. U.S.A. 104, 5014-5019 (2007).
- Edison, A. S. Caenorhabditis elegans pheromones regulate multiple complex behaviors. Curr. Opin. Neurobiol. 19, 378-388 (2009).
- Funk, C. D. Prostaglandins and leukotrienes: advances in eicosanoid biology. Science. 294, 1871-1875 (2001).
- Wang, D., Dubois, R. N. Eicosanoids and cancer. Nat. Rev. Cancer. 10, 181-193 (2010).
- Cha, Y. I., Solnica-Krezel, L., DuBois, R. N. Fishing for prostanoids: deciphering the developmental functions of cyclooxygenase-derived prostaglandins. Dev. Biol. 289, 263-272 (2006).
- Hata, A. N., Breyer, R. M. Pharmacology and signaling of prostaglandin receptors: multiple roles in inflammation and immune modulation. Pharmacol. Ther. 103, 147-166 (2004).
- Sugimoto, Y., Narumiya, S., Ichikawa, A. Distribution and function of prostanoid receptors: studies from knockout mice. Prog. Lipid Res. 39, 289-314 (2000).
- Basu, S. Isoprostanes: novel bioactive products of lipid peroxidation. Free Radic. Res. 38, 105-122 (2004).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogenous mixture of F-series prostaglandins promotes sperm guidance in the C. elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- Golovko, M. Y., Murphy, E. J. An improved LC-MS/MS procedure for brain prostanoid analysis using brain fixation with head-focused microwave irradiation and liquid-liquid extraction. J. Lipid Res. 49, 893-902 (2008).
- Murphy, R. C., et al. Electrospray ionization and tandem mass spectrometry of eicosanoids. Anal. Biochem. 346, 1-42 (2005).
- Milne, G. L., Yin, H., Morrow, J. D. Human biochemistry of the isoprostane pathway. J. Biol. Chem. 283, 15533-15537 (2008).
- Lehtonen, M., Reisner, K., Auriola, S., Wong, G., Callaway, J. C. Mass-spectrometric identification of anandamide and 2-arachidonoylglycerol in nematodes. Chem. Biodivers. 5, 2431-2441 (2008).
- Kulas, J., Schmidt, C., Rothe, M., Schunck, W. H., Menzel, R. Cytochrome P450-dependent metabolism of eicosapentaenoic acid in the nematode Caenorhabditis elegans. Arch. Biochem. Biophys. 472, 65-75 (2008).
- Watts, J. L., Browse, J. Genetic dissection of polyunsaturated fatty acid synthesis in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U.S.A. 99, 5854-5859 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados