Method Article
Extraction de prostaglandine et de l'analyse en
Dans cet article
Résumé
Dans cet article, nous décrivons une procédure optimisé pour l'extraction et l'analyse des prostaglandines et autres eicosanoïdes de C. elegans Par LC-MS/MS.
Résumé
Caenorhabditis elegans est en train de devenir un modèle animal puissant pour étudier la biologie des lipides 1-9. Les prostaglandines sont une classe importante d'eicosanoïdes, qui sont des signaux lipidiques dérivés des acides gras polyinsaturés (AGPI) 10-14. Ces molécules de signalisation sont difficiles à étudier en raison de leur faible abondance et la nature réactive. La caractéristique de prostaglandines est une structure de cycle cyclopentane situé dans le squelette d'acide gras. Chez les mammifères, les prostaglandines peuvent être formés par la cyclo-oxygénase voies et indépendants enzyme dépendant de 10,15. C. elegans synthétise un large éventail de prostaglandines indépendants de cyclooxygenases 6,16,17. Une grande classe des prostaglandines de la série F a été identifié, mais l'étude des eicosanoïdes est à un stade précoce avec amplement d'espace pour de nouvelles découvertes. Nous décrivons ici une méthode pour l'extraction et l'analyse des prostaglandines et autres eicosanoïdes. Lipide chargés sont extraites à partir de cultures de vers de masse à l'aide d'une technique d'extraction liquide-liquide et analysés par chromatographie en phase liquide couplée à la spectrométrie de masse en tandem d'ionisation d'électronébulisation (LC-ESI-MS/MS). L'inclusion d'analogues deutérés de prostaglandines, comme PGF 2 α-D 4 en tant que norme interne est recommandé pour l'analyse quantitative. Suivi de réactions multiples ou MRM peuvent être utilisés pour quantifier et comparer les types de prostaglandines spécifiques entre les animaux de type sauvage et mutant. Décomposition induite par collision ou MS / MS peuvent être utilisés pour obtenir des informations sur les caractéristiques structurelles importantes. Spectrométrie de masse chromatographie liquide (LC-MS) scans de l'enquête d'une gamme sélectionnée de masse, tels que m / z 315-360 peut être utilisé pour évaluer les changements globaux des niveaux de prostaglandine. Nous fournissons des exemples de ces trois analyses. Ces méthodes permettront aux chercheurs un ensemble d'outils pour la découverte de nouveaux eicosanoïdes et de délimiter leurs voies métaboliques.
Introduction
Les prostaglandines (PG) sont une classe importante d'hormones lipidiques qui ont été largement étudiés et impliqués dans la régulation de la reproduction, l'immunité et le développement dans un large éventail d'organismes 12-14. PG sont idéales pour les systèmes analyses approfondies de la biologie, car ils comprennent une série de lipides issus d'un précurseur commun (s). Le nématode C. elegans est l'un des organismes modèles les plus largement utilisés pour répondre aux questions fondamentales de la génétique et de la biologie des systèmes.
Nous avons démontré que C. elegans synthétise PG F-series qui guident spermatozoïdes mobiles des ovocytes 3,6,16. PG F-séries dérivées des AGPI 20 carbone avec trois, quatre, et cinq doubles liaisons, comprenant la F1, F2, F3 et des classes, respectivement ont été identifiés 3,16. Ces PG sont synthétisés indépendant des enzymes de cyclooxygénase, encore PGF 2α 1α stéréo et PGF sont encore getransporteur est également exonéré. Pour les analyses qualitatives et quantitatives de C. elegans PG, LC-MS/MS est une technique d'analyse puissante et sensible. Avant de procéder à cette analyse, il est important de développer une méthode d'extraction optimisé car la performance du processus d'analyse dépend fortement de la qualité de l'extrait. Chromatographie liquide et la spectrométrie de masse ne peuvent fournir de masse prévu sur charge (m / z), ainsi que la forme du pic souhaitable et temps de rétention de l'ion parent PG. Le profilage métabolique des PG en C. elegans est une tâche difficile nécessitant diverses stratégies d'acquisition MS.
Analyse complète ou une enquête balayage LC-MS (Q1 balayage) a l'avantage de garantir que les PG plus ionisables vont générer une réponse par spectrométrie de masse. Bien que l'analyse de l'enquête fournit des renseignements utiles sur le profilage total de PG par rapport au type sauvage et mutant C. elegans, la détection des PG mineurs sont compromises en raison d'une faible sensibilité. Néanmoinsmoins, l'analyse LC-MS enquête peut donner une vue globale des PG et est particulièrement utile pour l'analyse des mutants prévus pour affecter le métabolisme d'une grande population de PG.
Dans l'identification des métabolites, l'analyse CPL-SM/SM de normes de PG synthétisés par voie chimique est d'abord effectuée pour obtenir leurs spectres d'ions produit en tant que composés de référence. Ces spectres peut être comparé au spectre d'un métabolite inconnu. Mode de suivi de réactions multiples (MRM) est utilisé pour améliorer la sensibilité et la spécificité. Une expérience MRM est accomplie en spécifiant le passage de masse des ions ions / produit d'un composé parent. En connaissant la masse et de la structure des analytes cibles, il est possible de prévoir des transitions MRM théoriques pour de nombreux métabolites inconnus.
Une méthode LC-MS/MS optimisé pour le profilage PG isomères dans C. elegans n'a pas été signalée. Nous décrivons ici une extraction et une approche intégrée de la spectrométrie de masse constitué de LC-MS et LC-Méthodes MS / MS pour la détection, la quantification et l'investigation C. elegans métabolites p. Cette approche peut être appliquée à d'autres eicosanoïdes.
Protocole
Le protocole décrit ci-dessous est divisée en trois sections: la culture du ver, l'extraction de la prostaglandine et l'analyse des prostaglandines. Comme indiqué, il ya plusieurs points lorsque les échantillons peuvent être stockés temporairement à -80 ° C ou -20 ° C.
1. Worm Culture
Nous vous recommandons d'environ 6 g de vers de scène mixtes pour LC-MS/MS complets. Cela devrait fournir suffisamment de matériel pour la détection d'au moins six injections séparées. Pour la quantification des PG connus par MRM en une seule injection ou deux, 1-2 g sont suffisants. L'analyse des extraits de cultures synchronisées consistant en une étape spécifique est également possible. Jusqu'à 4 différentes souches peuvent être cultivées en même temps. Par exemple, un type sauvage de contrôle et de trois souches mutantes différentes.
- Préparez-65 X-Large (16 cm) des plaques NGM et les bactéries concentrées pour l'alimentation supplémentaire. Utilisez NA22 bactéries pour l'ensemencement. Pour rendre les bactéries concentrées pour l'alimentation supplémentaire, grow au moins quatre litres de NA22 en milieu LB pendant 16-24 h. Isoler, éliminer le surnageant, et les bactéries remettre en suspension dans 100 ml de tampon M9. 200 à 400 ml de cette solution bactérienne concentrée peut être exigée pour chaque souche du ver. Conserver à 4 ° C.
- Commencez cultures du ver sur 5 X-grandes plaques. Croître vers pour environ 3 à 4 générations jusqu'à ce que les plaques sont pleines d'adultes gravides. Bactéries concentrées doivent être ajoutés à plaques pour empêcher la famine, le cas échéant (~ 1 ml / plaque et laisser sécher complètement avant de remettre le couvercle).
- Lavez hermaphrodites gravides des assiettes avec le tampon M9 et recueillir les vers dans un tube en polypropylène conique de 50 ml.
- Permettre aux hermaphrodites gravides à se déposent au fond (habituellement environ 3-5 min). Retirer le surnageant, y compris les bactéries, les œufs et les vers de stade larvaire. Remettre en suspension dans un tampon M9 15 ml et mélanger délicatement.
- Transférer 200 ul de suspension de ver à chacun des 60 têtes de série des plaques NGM. Disperser vers à travers les plaques. Conserver la solution de ver mélangébien jusqu'à ce que toutes les plaques ont été ensemencées afin de s'assurer qu'ils reçoivent à peu près autant de vers.
- Supplément par des bactéries concentrées au besoin (~ 1 ml/plate/12 pour une période de 24 h) pour éviter la famine. Laisser les plaques sécher à l'air avant de remplacer les couvercles. Croître vers de 2-4 générations, selon le nombre initial de vers ensemencées, ou jusqu'à ce que les plaques sont pleines d'adultes gravides.
- plaques de ver de récolte d'une souche à la fois. Lavez-les vers hors les plaques avec du tampon M9 et recueillir dans des tubes de 50 ml en polypropylène (par exemple 6 tubes). Utilisez tampon M9 pour laver une assiette, puis transférer le tampon vis-remplie à la plaque suivante. Après le lavage d'un nombre (par exemple. 10 e) de plaques, de transférer le tampon vis-remplie pour le tube de 50 ml. Remplir le tube vers le haut avec un tampon M9. Répéter le lavage pour le reste des plaques.
- Comme les adultes gravides se déposent au fond à 5-6 min, retirer le surnageant (~ 35 ml) et de consolider en un ou deux tubes. Remplir les tubes de 50 ml avec frtampon M9 chair, laisser reposer pendant 3-5 min, et retirer le surnageant laissant adultes gravides. Répétez 3 fois ou jusqu'à ce que le surnageant soit transparent.
- En utilisant un grand trou pipette Pasteur, transférer autant que possible vers deux 15 ml polypropylène tubes coniques. Isoler à 1000 RCF (~ 3,500 rpm dans CentraSL2) pendant 5 min dans une centrifugeuse clinique. Retirer le surnageant et répéter jusqu'à ce que tous les vers sont transférés et granulés dans le même tube. Retirez le maximum de surnageant que possible et les vers de conserver à -80 ° C. Répétez l'opération pour toutes les souches.
2. Extraction de la prostaglandine
Les réactifs nécessaires pour l'extraction sont indiqués ci-dessous. Le procédé est modifiée par rapport à celle de Golovko Murphy et 17 et comprend extraction à l'acétone suivie d'une purification liquide-liquide, ce qui augmente la sensibilité des CPL-SM/SM. A Bullet Blender 5 homogénéisateur est utilisé dans la procédure, même si des résultats similaires peuvent être obtenus avec un homogénéisateur Dounce. Hydroxytolue Butylatedne (BHT) et évaporation sous azote (N 2) gazeux sont utilisés pour empêcher l'oxydation. Toute la verrerie doit être siliconé (Sigmacote) pour réduire la liaison de lipides. L'extraction avec des solvants organiques doit être effectuée dans une hotte chimique.
- Peser un tube conique en polypropylène 50 ml. Transférer environ 6,0 g de vers congelés du tube conique de 15 ml stockés à -80 ° C en coupant à travers le tube avec une lame de rasoir chaud près de la marque ml 6.5. Une spatule méthanol-nettoyé peut être utilisé pour supprimer le ver congelé granulés à partir du fond du tube. En coupant à travers la pastille de récupérer la partie inférieure, vers larvaires moins denses et de bactéries résiduelles à partir du dessus de la pastille sont laissés.
- Transfert vers les surgelés dans le tube conique pré-pesé 50 ml. Si plusieurs échantillons sont en cours de traitement, utiliser le même montant (6,0 g) de tissu pour des études comparatives. Comme les vers dégel dans une pâte, ajouter ou supprimer des vers avec la spatule pour obtenir la masse désirée. Facultatif: add 1,00 ng de PGF 2α norme-d4 comme contrôle interne pour l'efficacité d'extraction.
- Ajouter 12 ml de glace froide 02h01 acétone / saline avec 0,005% de BHT à la suspension de ver et bien mélanger au vortex. Distribuer 1,5 ml de la suspension de ver à chacun des douze 5 ml tubes en plastique autoportants à mettre dans le mélangeur de balle.
- Ajouter 0,7-0,8 ml de 0,5 mm de diamètre Ceria stabilisé billes d'oxyde de zirconium pour chaque tube de 5 ml. Gros bouchons hermétiquement et charger les 12 tubes dans le Bullet Blender 5 homogénéisateur. Exécutez le mixeur pendant 3 min à vitesse 8-9 et placer les tubes sur la glace. Veillez à fermer les bouchons très serré ou le contenu peut se répandre. Vérifiez 10 pi de broyat d'un tube sur une diapositive à l'aide d'un stéréoscope. Il devrait y avoir très peu de vers intactes restantes. Répétez la même vitesse pendant une minute, si nécessaire.
- Transférer régulièrement les broyats de quatre tubes de 10 ml coniques en verre à l'aide d'un "pipette Pasteur 9. Éviter de transférer des perles. Laver les billes de trois tubes Sèquentially avec 1 ml de 1:2 acétone / solution saline contenant BHT. Répéter pour les autres tubes jusqu'à ce que toutes les perles sont lavées. Transférer la solution restante (~ 4 ml) pour les tubes en verre de 10 ml et placer sur la glace.
- Centrifuger les tubes en verre de 10 ml à 4 ° C dans une centrifugeuse clinique à ~ 1 000 xg pendant 10 min. Transférer le surnageant de chaque tube dans un tube conique propre 10 ml en verre.
- Dans une hotte chimique, ajouter un volume égal d'hexane à chaque tube de verre de 10 ml. Par exemple, ajouter 3,5 ml d'hexane et 3,5 ml d'acétone / solution saline. Vortex à la vitesse maximale pendant 30 sec.
- Centrifuger les tubes en verre de 10 ml à 4 ° C dans une centrifugeuse clinique à ~ 1 000 xg pendant 10 min. Jeter la phase supérieure contenant de l'hexane et de lipides charge neutre.
- Acidifier la phase inférieure à pH 3,5 en utilisant 2 M acide formique (environ 100 - 150 pi). pH de test en utilisant des bandes de pH.
- Ajouter un volume égal de chloroforme à chaque tube. Vortex à vitesse maximale pendant 30 secondes et centrifuger les tubes à 4 ° C icentrifugeuse clinique na à ~ 1000 g pendant 10 min.
- Retirez et jetez la phase aqueuse supérieure. Insérer une pointe de pipette à travers toute l'interphase laiteux résiduelle de la phase inférieure du chloroforme, ce qui évite l'interphase. Recueillir la phase inférieure de chacun des quatre tubes d'un tube en verre de 15 ml conique propre. Incuber à -20 ° C pendant au moins 24 heures. À ce stade, l'extrait peut être conservé à -20 ° C pendant jusqu'à deux semaines.
- Prenez l'extrait du congélateur et jetez la couche supérieure aqueuse laiteuse restant, le cas échéant. Transférer la phase chloroforme dans une fiole de verre ½ Dram marqué téflon en utilisant une nouvelle pipette Pasteur. Dans une hotte chimique, évaporer la fraction soluble dans le chloroforme à sec sous un léger flux de gaz N 2. L'extrait sec peut être stocké à -20 ° C pendant 2 semaines. Un schéma global utilisé pour l'extraction et l'analyse PG est illustré à la figure 1.
3. Analyse de la prostaglandine
- Préparer Stocksolutions de prostaglandines de référence individuelles, comme PGF 2α ou PGF 2 α-d4 (1 pg / ml) dans le méthanol et le diluer avec du méthanol: eau (08:02 v / v) pour obtenir une solution de travail. Préparer une série de dilutions (100, 10, 1, 0,1, 0,01 ng / ml) afin de générer une courbe d'étalonnage.
- Ajouter 200 ul de méthanol: eau (08:02 v / v) à la C. secs extrait lipidique elegans (s) et mélanger soigneusement. Si on extrait moins de 6 g de tissu de ver, l'extrait sec doit être remis en suspension dans un volume inférieur de méthanol: solution d'eau.
- Préparer la phase mobile comprenant de l'acide formique 0,1% dans l'eau [A] et de l'acétonitrile contenant de l'acide formique 0,1% de [B].
- Mettre en place l'échantillonneur automatique à 4 ° C et placer les flacons dans un rack 1,5 flacon de 70 ml de comptage.
- Équilibrer la colonne RP-C18 Synergie hydraulique avec de l'acide formique 0,1% à un débit de 0,2 ml / minute pendant environ 5 min.
- Injecter l'échantillon (20-50 pi) dans la colonne. Effectuer un gradient d'élution débuttion avec 10% de B et allant jusqu'à 80% B 0-11 min, 80-100% B 11 à 14 min, et le retour à 10% de B à 16 min. Le temps total d'exécution est de 20 min. Les temps de rétention de 13 normes authentiques sont présentés dans le tableau 1 pour la référence 3.
- Introduire l'effluent de la colonne dans le spectromètre de masse à l'aide d'une interface ESI fonctionnement en mode ion négatif. L'azote est utilisé comme gaz de nébulisation et de rideau (CUR = 10). Le gaz de collision, l'énergie de collision, et la température sont fixées à 10, -35 eV et 600 ° C, respectivement. potentiel de Declustering (DP), les collisions d'énergie (CE), et le potentiel de sortie de la cellule (CXP) sont fixés à -90, -35 et -10, respectivement.
- Pour les analyses de l'enquête (scans Q1), utilisez le mode d'ions négatifs dans l'intervalle de masse m / z 315-360 pour la plupart des PG (Figure 2). La portée peut être modifiée, en fonction de la masse de composé (s) d'intérêt. Extrait ions de courant ionique total (CIT) de chromatogrammes LC-MS ion et de déterminer si l'extractionions ted correspondent aux ions déprotonés ou produits d'addition ou de ions fragments.
- Pour les expériences de GRM, la transition de masse m / z 355/311 est utilisé pour détecter la classe F1, m / z 353/193 est utilisé pour la classe F2, et m / z 351/193 ou 351/191 est utilisé pour la classe F3 (Figure 3). MRM est également utilisé pour détecter le standard interne (par exemple, m / z 357/197 pour PGF 2α-d4) et pour générer la courbe standard. Voir Murphy et al. Des informations supplémentaires sur PG transitions de masse 18.
- Pour les expériences MS / MS, utilisez m / z 355 pour la classe F1, m / z 353for classe F2, et m / z 351for F3 PG classe. C. données MS / MS elegans pour F-PG de la série est disponible dans la figure 4 et le tableau 2 3,16. Données MS / MS pour eicosanoïdes mammifères est disponible à www.lipidmaps.org .
- Traiter les données analytiques en utilisant Analyslogiciel t (Version 1.4.2, Applied Biosystems).
Résultats
La préparation des échantillons a été réalisée par extraction liquide-liquide adapté de Golovko et Murphy 17. Il a fourni une excellente récupération de l'étalon interne (PGF 2α-d4). Le régime général pour l'extraction du PG C. elegans est illustré à la figure 1. Conditions chromatographiques ont été optimisés pour fournir une séparation de référence> 30 normes eicosanoïdes (tableau 1 présente 13 normes). Une colonne Hydro-Rp (250 x 2.0 mm id) avec de l'eau et de l'acétonitrile contenant de l'acide formique à 0,1% a fourni la meilleure séparation et de sensibilité. analyses de l'enquête d'extraits mutants de type sauvage et de la graisse-3 montre la figure 2 niveaux globaux de documents d'ions dans la gamme de masse de 315 à 360 unités de masse atomique. gras-3 (WA22) mutants manque AGPI plus de 20 carbone. Un PG de la classe F3 est mise en évidence. Dans la figure 3, les analyses MRM d'un extrait de type sauvage montrent plusieurs isomères de PG de la F1 (figure 3A Ng>), F2 (figure 3B) et F3 (figures 3C et 3D) des classes. La classe F3 peut être détecté avec l'une des deux transitions de masse, m / z 351/193 ou m / z 351/191. CePGF2 est principalement composé de la PGF 2α énantiomère. CePGF1 est susceptible d'être PGF 1α ou son énantiomère. Figure 4 montre la décomposition induite par collision de CePGF2 (RT = 11,8) par rapport à la norme α PGF2 (RT = 11,8). Des différences mineures dans les ions produits sont probablement dues à la faible abondance CePGF2 et composés co-élution dans l'extrait.

Figure 1. Schéma de C. Les analyses LC-MS elegans PG extraction et. A noter que l'acétone / chloroforme et une solution saline à la fois l'avons 0,005% BHT pour minimiser l'oxydation des lipides. Se référer au texte pour plus de détails.https://www.jove.com/files/ftp_upload/50447/50447fig1large.jpg "target =" _blank "> Cliquez ici pour agrandir la figure.

Figure 2. analyses de l'enquête de temps m / z 315-360 d'extraits mutants de type sauvage et de la graisse-3 (WA22). rétention chromatographie en phase liquide (RT) sont présentés dans le tableau [A]. Ions extraits à TA = 11.3 sont indiquées pour type sauvage [b] et graisse 3 (WA22) [c] extraits. Un PG de la classe F3 de masse m / z 351 est mis en évidence. CPS coups / s; UMA, unité de masse atomique.
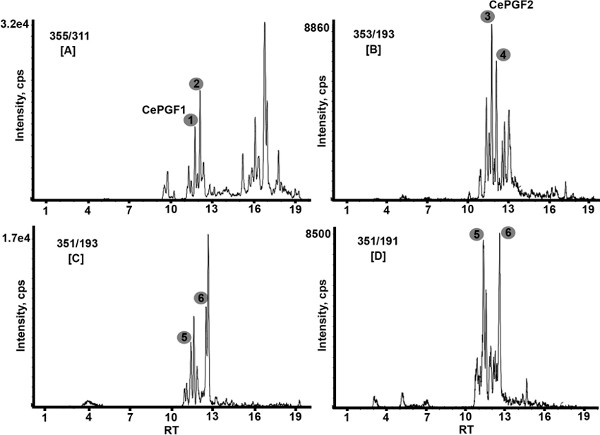
Figure 3. MRM analyses d'extraits de type sauvage. PGS classe F1 sont détectés avec une transition de masse m / z 355/311 [A]. Notez que plusieurs composés hydrophobes (RT> 14 min), qui ne sont probablement pas PG, sont également détectés avec cette transition. PG de classe F2 sont détectés avec la transition de masse m / z 353/193 [B]. PG de la classe F3 sont détectés avec soit transition de masse m / z 351/193 [C] ou m / z 351/191 [D]. Notez que les extraits contiennent plusieurs isomères PG de chaque classe. Les chiffres correspondent aux PG présentés dans le tableau 2. La concentration de CePGF2 est de 1,8 ng / ml. RT, temps de rétention; cps, coups / sec.

Figure 4. Décomposition induite par collision de synthé chimiquementesized PGF 2α et CePGF2. flèches dans le panneau [A] indiquer que le produit ou la fragmentation des ions partagés entre PGF 2α et CePGF2 (RT = 11,8). Les ions produits à m / z 309 et m / z 193 sont générés à partir des sites de clivage indiqués (mis a et b), correspondent aux structures représentées, et sont caractéristiques de la série F PG [B]. Cps, chiffres / sec. Cliquez ici pour agrandir la figure .
| Norme | RT (min) | [MH] - m / z | Ions de produits clés en MS / MS |
| 20-hydroxy PGE 2 | 9,43 | 367 | 349, 331, 287, 234, 189, 129, 109 |
| PGF 3 - | 11.26 | 351 | 333, 307, 289, 271, 245, 219, 209, 193, 191, 171, 165, 111 |
| Thromboxane B 2 | 11,66 | 369 | 289, 191, 177, 169, 151 |
| PGF 2 - | 11.80 | 353 | 335, 309, 291, 273, 263, 247, 235, 209, 193, 171, 165, 111 |
| PGF 1 - | 11.79 | 355 | 337, 319,311, 301, 293, 275, 265, 237, 211, 195 |
| Lipoxine B 4 | 12.38 | 351 | 201, 191,189, 165, 155, 115, 107, 71, 59 |
| PGD 2 | 12.56 | 351 | 315, 271 203, 189 |
| 5 (S), 6 (R) - lipoxine A 4 | 12.83 | 351 | 235, 217, 189, 144, 135, 115, 99, 59 |
| PGA 2 | 14.02 | 333 | 315, 297, 271, 235, 191, 189, 175, 163, 137, 113, 109 |
| Δ12-PGJ 2 | 14.20 | 333 | 271, 189, 123 |
| Leucotriènes B 4 | 14.73 | 335 | 181, 109, 93, 71, 69, 59, 57 |
| 15d-Δ 12,14-PGJ 2 | 16.80 | 315 | 297, 271, 217, 203, 158 |
| 5 (S)-HPETE | 17.88 | 335 | 97, 83, 81, 57 |
Tableau 1. Les temps de rétention et des ions produits clés de 13 normes eicosanoïdes de la méthode LC-MS/MS 3. Plus de 30 normes ont été utilisés pour élaborer le programme LC-MS/MS. Les temps de rétention chromatographique (RTS) diffèrent, même parmi PG très similaires. Une exception est 2α 1α et PGF PGF. Néanmoins, ces PG sont distinguished par leurs masses d'ions parents ([MH] - m / z) et induite par collision spectres de décomposition (MS / MS).
| classe des prostaglandines | No. dans la Figure 3 | [MH] - m / z | Ions de produits clés en MS / MS |
| F1 (CePGF1) | 1 | 355 | 319, 301, 311, 293, 275, 265, 237, 223, 211, 195, 157 |
| F1 | 2 | 355 | 311, 301, 293, 275, 265, 211, 195, 167, 157 |
| F2 (CePGF2) | 3 | 353 | 309, 291, 273, 263, 247, 209, 193, 171, 165, 127 |
| F2 | 4 | 353 | 309, 291, 273, 263, 255, 247, 219, 209, 193, 171, 113 |
| F3 | 5 | 351 | 315, 307, 289, 275, 249, 205, 193, 191, 167, 153, 139 |
| F3 | 6 | 351 | 333, 289, 271, 261, 245, 223, 193, 191, 163 |
Tableau 2. Ions produits décomposition induite par collision pour plusieurs grandes C. elegans F1, F2, F3 et PG présentés dans la figure 3. MS / MS d'autres isomères moins abondantes ne sont pas représentés. Ces données sont tirées des analyses multiples et tous les ions produits ne peuvent pas être visible dans une course donnée. Étant donné la complexité des extraits, certains ions produits moins abondantes peuvent provenir d'un autre ion parent avec un temps de rétention proche ou le résultat de l'ingérence. Peak 2 est probablement un stéréo de CePGF1 et le pic 4 est probablement un stéréo de CePGF2. Voir Edmonds, et al. (2010) pour des données supplémentaires 3.
Discussion
Nous décrivons une procédure d'extraction et d'analyse des eicosanoïdes, en se concentrant sur PG F-series. Il ya plusieurs parties de la procédure qui peut être problématique. Tout d'abord, il est essentiel que les cultures de vers ne meurent pas de faim, que la famine peut modifier le métabolisme PG. Pour une alimentation d'appoint, NA22 bactéries sont recommandés au lieu de les OP50 bactéries les plus couramment utilisés car NA22 atteint une densité plus élevée. Cependant, la souche NA22 manque de résistance aux antibiotiques et est plus sensible à la contamination. Deuxièmement, les vers synthétisent isomères PG individuels faible abondance relative de tissus de mammifères. Cela peut être dû en partie à la redondance parmi les nombreux isomères. Nous vous recommandons d'environ 6 g de tissu pour analyse complète et des signaux plus forts. Moins de tissu (1-2 g) peut être utilisé si l'extrait séché est remis en suspension dans moins de méthanol: solution d'eau pour augmenter la concentration PG. Toutefois, seulement une à deux injections peuvent être réalisées. La limite de détection de notre système LC-MS/MS est d'environ 10 pgPGF 2α / ml. Un ml de vers de scène mixtes denses (environ 1 g), on obtient à peu près 25-50 pg de CePGF2. Des systèmes de spectrométrie de masse plus sensibles peuvent réduire la quantité de tissu à vis sans fin utilisé pour l'analyse. Troisièmement, les différences de rendement d'extraction PG parmi les échantillons peuvent provoquer des résultats variables. Nous avons constaté que l'efficacité d'extraction est très similaire lorsque les tissus sont extraits en parallèle. Pour déterminer l'efficacité, ajoutez 1,0 ng de PGF 2α-d 4 à l'étape d'homogénéisation comme un contrôle interne. MRM aide de transition de masse m / z 357/197 est utilisé pour mesurer la concentration PGF 2α-d4 par rapport à un 1 ng / ml de solution étalon. Le montant de la PGF 2α-d4 perdu lors de l'extraction est ensuite calculée.
Les paramètres de chromatographie et les transitions de masse nous incluons peuvent être modifiés pour détecter d'autres PG et eicosanoïdes. Malgré des efforts considérables, nous n'avons pas été en mesure d'identifier la série D ou E-SERs PGS dans les extraits 17. En outre, nous n'avons pas détecté 8-iso PGF 2α et 8-iso PGE 2 qui sont caractéristiques de la libre peroxydation initiée par des radicaux, ce qui génère un mélange non sélectif de PG stéréo 19. Que ce soit vers synthétisent les autres types de PG n'est pas connue. Les endocannabinoïdes et divers époxy et hydroxy métabolites des acides arachidonique et eicosapentaénoïque ont été trouvés dans C. elegans extrait 5,7,20,21. Nous recommandons l'usage du MRM et MS / MS par rapport aux normes authentiques de quantification et d'identification, respectivement. Pour nouveaux eicosanoïdes, ces analyses devraient être combinées avec une étude comparative des mutants graisseuses, qui sont déficients en AGPI synthétiser des enzymes 22, ainsi que d'une analyse fonctionnelle, si possible. Une mise en garde à l'analyse de mutants graisse est que d'infimes quantités d'AGPI présents dans les vers sont suffisantes pour la synthèse des PG. Par exemple, les matières grasses (2 wa17) mutantsune petite quantité d'activité désaturase D12 (~ 5% de type sauvage 22) et ces mutants produisent encore PG 6. gras-3 (WA22) et de la graisse-4 (WA14) des mutants ne parviennent pas à synthétiser PG dérivés d'acides arachidonique et eicosapentaénoïque 16 . Nous avons également constaté que les mutants gras compenser la perte des classes AGPI jusqu'à réglementer la synthèse de PG de classes restantes. Par exemple, la graisse 3 (WA22) mutants ne parviennent pas à synthétiser la plupart des dérivés de PG AGPI 20-carbone. Au lieu de cela, ils semblent mettre à réguler nouveaux PG issus de 18 atomes de carbone AGPI 16. À ce jour, nous n'avons pas identifié un C. souche elegans qui est complètement déficiente dans la synthèse des PG. Il est possible que les PG sont essentiels pour la croissance ou le développement.
Déclarations de divulgation
Les auteurs n'ont aucun conflit d'intérêt.
Remerciements
Nous remercions les métabolomique ciblée UAB et de laboratoire de protéomique, qui a été financé en partie par la peau Disease Research Center UAB (P30 AR050948 à C. Elmets), le O'Brien Centre de lésions rénales aiguës UAB-UCSD (P30 DK079337 à A. Agarwal ) et l'UAB Lung Health Center (R01 HL114439, HL110950 R01 à JE Blalock). Soutien à la spectrométrie de masse était d'une NCRR partagée subvention Instrumentation (S10 RR19261 à S. Barnes). Nous remercions également Ray Moore pour le support technique. C. souches elegans ont été fournies par le Centre de génétique Caenorhabditis, qui est financé par le NIH. Ce travail a été soutenu par le NIH (R01GM085105 de MAM, y compris un supplément administratif ARRA).
matériels
| Name | Company | Catalog Number | Comments | ||||||||||||||
| REAGENTS | |||||||||||||||||
| X-large (16 cm) plates | Fisher Scientific | 0875714 | |||||||||||||||
| E. coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | http://www.cgc.cbs.umn.edu | ||||||||||||||
| Acetone, 399.5% | Fisher Scientific | A928-4 | |||||||||||||||
| Butylated Hydroxytoluene | MP Biomedicals | 101162 | |||||||||||||||
| Hexane, HPLC grade | Fisher Scientific | H302-1 | |||||||||||||||
| Formic acid, 399% | Acros | AC27048-0010 | Available through Fisher Scientific | ||||||||||||||
| Chloroform, HPLC grade | Acros | AC26832-0010 | Available through Fisher Scientific | ||||||||||||||
| PGF2α-d4 | Cayman Chemicals | 316010 | Cayman has a wide array of standards available for purchase | ||||||||||||||
| Sterile screw cap self-standing 5 ml tube | Fisher Scientific | 14-222-651 | For use with Bullet Blender | ||||||||||||||
| 0.5 mm zirconium oxide beads | Next >>> Advance | ZrOB05 | |||||||||||||||
| 10 ml glass conical heavy-duty graduated centrifuge tubes | Kimble Kimax | 45200-10 | Available through Fisher Scientific | ||||||||||||||
| 15 ml glass conical tubes | Corning Pyrex | 8082-15 | Available through Fisher Scientific | ||||||||||||||
| Sigmacote (Siliconizing reagent) | Sigma-Aldrich | SL2-100ML | |||||||||||||||
| Teflon lined capped 1/2 Dram glass vial | Fisher Scientific | V1235C-TFE | |||||||||||||||
| EQUIPMENT | |||||||||||||||||
| CentraSL2 Clinical Centrifuge | Thomas Scientific | 2517N92-TS | |||||||||||||||
| Bullet Blender 5 blue homogenizer | Next >>> Advance | BBY5MB | A 40 ml Dounce homogenizer can be used as an alternative | ||||||||||||||
| Synergi 4 μm Hydro-RP 80 Å LC Column 250 x 2.0 mm | Phenomenenex | 00G-4375-B0 | HPLC Column | ||||||||||||||
| SecurityGuard Cartridges AQ C18 4 x 2.0 mm | Phenomenenex | AJ0-7510 | |||||||||||||||
| SecurityGuard Guard Cartridges Kit | Phenomenenex | KJ0-4282 | |||||||||||||||
| Shimadzu Prominence HPLC with refrigerated auto sampler | Shimadzu Scientific Instruments, Inc. | Any standard HPLC system coupled to a triple quadrupole mass spectrometer should be sufficient | |||||||||||||||
| API 4000 triple quadrupole mass spectrometer | Applied Biosystems/MDS SCIEX | ||||||||||||||||
| |||||||||||||||||
Références
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends Endocrinol. Metab. 20, 58-65 (2009).
- Marza, E., Lesa, G. M. Polyunsaturated fatty acids and neurotransmission in Caenorhabditis elegans. Biochem. Soc. Trans. 34, 77-80 (2006).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Dev. Cell. 19, 858-871 (2010).
- Kniazeva, M., Shen, H., Euler, T., Wang, C., Han, M. Regulation of maternal phospholipid composition and IP(3)-dependent embryonic membrane dynamics by a specific fatty acid metabolic event in C. elegans. Genes Dev. 26 (3), 554-566 (2012).
- Kosel, M., et al. Eicosanoid formation by a cytochrome P450 isoform expressed in the pharynx of Caenorhabditis elegans. Biochem. J. 435, 689-700 (2011).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nat Cell Biol. 8, 1143-1148 (2006).
- Lucanic, M., et al. N-acylethanolamine signalling mediates the effect of diet on lifespan in Caenorhabditis elegans. Nature. 473, 226-229 (2011).
- Gerisch, B., et al. A bile acid-like steroid modulates Caenorhabditis elegans lifespan through nuclear receptor signaling. Proc. Natl. Acad. Sci. U.S.A. 104, 5014-5019 (2007).
- Edison, A. S. Caenorhabditis elegans pheromones regulate multiple complex behaviors. Curr. Opin. Neurobiol. 19, 378-388 (2009).
- Funk, C. D. Prostaglandins and leukotrienes: advances in eicosanoid biology. Science. 294, 1871-1875 (2001).
- Wang, D., Dubois, R. N. Eicosanoids and cancer. Nat. Rev. Cancer. 10, 181-193 (2010).
- Cha, Y. I., Solnica-Krezel, L., DuBois, R. N. Fishing for prostanoids: deciphering the developmental functions of cyclooxygenase-derived prostaglandins. Dev. Biol. 289, 263-272 (2006).
- Hata, A. N., Breyer, R. M. Pharmacology and signaling of prostaglandin receptors: multiple roles in inflammation and immune modulation. Pharmacol. Ther. 103, 147-166 (2004).
- Sugimoto, Y., Narumiya, S., Ichikawa, A. Distribution and function of prostanoid receptors: studies from knockout mice. Prog. Lipid Res. 39, 289-314 (2000).
- Basu, S. Isoprostanes: novel bioactive products of lipid peroxidation. Free Radic. Res. 38, 105-122 (2004).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogenous mixture of F-series prostaglandins promotes sperm guidance in the C. elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- Golovko, M. Y., Murphy, E. J. An improved LC-MS/MS procedure for brain prostanoid analysis using brain fixation with head-focused microwave irradiation and liquid-liquid extraction. J. Lipid Res. 49, 893-902 (2008).
- Murphy, R. C., et al. Electrospray ionization and tandem mass spectrometry of eicosanoids. Anal. Biochem. 346, 1-42 (2005).
- Milne, G. L., Yin, H., Morrow, J. D. Human biochemistry of the isoprostane pathway. J. Biol. Chem. 283, 15533-15537 (2008).
- Lehtonen, M., Reisner, K., Auriola, S., Wong, G., Callaway, J. C. Mass-spectrometric identification of anandamide and 2-arachidonoylglycerol in nematodes. Chem. Biodivers. 5, 2431-2441 (2008).
- Kulas, J., Schmidt, C., Rothe, M., Schunck, W. H., Menzel, R. Cytochrome P450-dependent metabolism of eicosapentaenoic acid in the nematode Caenorhabditis elegans. Arch. Biochem. Biophys. 472, 65-75 (2008).
- Watts, J. L., Browse, J. Genetic dissection of polyunsaturated fatty acid synthesis in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U.S.A. 99, 5854-5859 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon