Method Article
La pasivación de la superficie de Estudios sola proteína-molécula
En este artículo
Resumen
Se describe un método para la pasivación de una superficie de vidrio usando polietilenglicol (PEG). Este protocolo cubre la limpieza de superficies, funcionalización de la superficie, y el recubrimiento de PEG. Se introduce una nueva estrategia para el tratamiento de la superficie con moléculas de PEG en dos rondas, lo que produce una calidad superior de pasivación en comparación con los métodos existentes.
Resumen
La espectroscopia de fluorescencia de una sola molécula ha demostrado ser fundamental para la comprensión de una amplia gama de fenómenos biológicos a escala nanométrica. Ejemplos importantes de lo que esta técnica puede ceder a las ciencias biológicas son las ideas sobre los mecanismos de proteína-proteína y las interacciones proteína-ácido nucleico. Cuando las interacciones de proteínas se sondean a nivel de una sola molécula, las proteínas o sus sustratos a menudo se inmovilizan sobre una superficie de vidrio, lo que permite una observación a largo plazo. Este esquema de inmovilización puede introducir artefactos no deseados de la superficie. Por lo tanto, es esencial para pasivar la superficie del vidrio para que sea inerte. Recubrimiento de superficies con polietilenglicol (PEG) se destaca por su alto rendimiento en la prevención de las proteínas a partir de la interacción de forma no específica con una superficie de cristal. Sin embargo, el procedimiento de revestimiento de polímero es difícil, debido a la complicación derivada de una serie de tratamientos de superficie y el requisito estricto de que una superficie necesitaestar libre de cualquier moléculas fluorescentes al final del procedimiento. Aquí, ofrecemos un protocolo robusto, con instrucciones paso a paso. Cubre la limpieza de superficies incluyendo el grabado de pirañas, funcionalización de la superficie con grupos amino, y, finalmente, recubrimiento de PEG. Para obtener una alta densidad de una capa de PEG, se introduce una nueva estrategia de tratamiento de la superficie con moléculas de PEG más de dos rondas, lo que mejora notablemente la calidad de pasivación. Proporcionamos resultados representativos, así como consejos prácticos para cada paso crítico para que cualquiera pueda lograr la pasivación de la superficie de alta calidad.
Introducción
Al realizar un estudio de una sola molécula de proteína es esencial para lograr una alta calidad de pasivación de la superficie de manera que el experimento está libre de cualquier proteína mal funcionamiento inducida por superficie o 1,2 desnaturalización. Mientras que una superficie de vidrio tratada con agentes tensioactivos, tales como albúmina de suero bovino, se utiliza comúnmente para estudios de ácido nucleico de una sola molécula 3, el grado de su pasivación no es lo suficientemente alta como para los estudios de proteínas. Una superficie de vidrio recubierta con polímero (polietilenglicol, PEG) es superior en el rendimiento de pasivación 4-6. De esta manera, se ha convertido universalmente usado para estudios de proteínas de una sola molécula desde que se introdujo en un estudio de fluorescencia de una sola molécula de 7-10. El procedimiento de recubrimiento de polímero requiere de múltiples tratamientos superficiales 7,11,12. Por lo tanto, es difícil de seguir todo el procedimiento sin instrucciones detalladas. A menudo, el grado de pasivación de la superficie varía dependiendo de qué protocolo is siguieron. Aquí se presenta un protocolo robusto con el paso a paso las instrucciones, lo que eliminará uno de los principales cuellos de botella de los estudios de proteínas de una sola molécula. Consulte la Figura 1 para una descripción.
Protocolo
1. Deslice Preparación y limpieza
Una cámara de microfluidos se compone de un portaobjetos de cuarzo y un cubreobjetos. En tipo prisma de fluorescencia total reflexión interna (TIRF) microscopía, la superficie del portaobjetos de cuarzo se forma la imagen. Por lo tanto, es importante para limpiar un portaobjetos de cuarzo de fondo usando H 2 O, acetona, KOH, y soluciones piraña. Th es la limpieza de múltiples pasos elimina moléculas orgánicas fluorescentes en una superficie que interfiere con las mediciones de fluorescencia de una sola molécula. Adicionalmente, el grabado de la piraña hace que la superficie hidrófila de cuarzo mediante la generación de grupos hidroxilo. Los grupos hidroxilo libres son esenciales para la reacción amino-silanización en el paso 3.
- Portaobjetos de cuarzo de perforación. Haga un par de agujeros en una diapositiva de cuarzo con una broca de 3/4 milímetros de perforación de diamante (Figura 2a). Si se desean múltiples canales, perforar más paIRS de agujeros (Figura 2b). Estos agujeros se utilizan para la inyección de soluciones en una cámara de microfluidos en el Paso 7.
- Mantenga la broca húmedo en H 2 O durante la perforación. H 2 O realiza como un lubricante, lo que aumenta la vida útil de la broca.
- Ocasional limpiar la punta de la broca ayuda a los agujeros de perforación.
- Después de la perforación de agujeros, marcar un lado de la corredera para facilitar la identificación durante el proceso de PEGilación. Los marcadores se pueden usar como referencia para evitar la confusión más adelante. Para el marcado, una broca de diamante puede ser utilizado. No utilice ningún bolígrafo ya que la tinta puede ser que consiga en la superficie.
- Limpieza con H 2 O. Colocar los portaobjetos en una cubeta de tinción de vidrio. Típicamente 5 a 15 diapositivas se pueden colocar en un solo frasco. Enjuagar los portaobjetos con H2O MilliQ Repita 3 veces y sonicar las diapositivas con H2O MilliQ durante 5 minutos para eliminar la suciedad. Deseche el agua y enjuague las diapositivas de nuevo 3 veces conMilliQ H 2 O. Tenga en cuenta que 130 W es la potencia de ultrasonidos utilizado para este protocolo. Potencia de sonicación Superior podría disminuir el tiempo de vida de los portaobjetos de cuarzo.
- La limpieza con acetona. Vuelva a colocar la MilliQ H 2 O con acetona. Sonicar las diapositivas con acetona durante 20 minutos o más.
- Enjuague con H 2 O. Deseche la acetona y enjuague los portaobjetos con H2O MilliQ Repetir 3 veces con el fin de eliminar cualquier residuo de acetona.
- Limpieza con KOH. Cambie el agua con 1 M KOH y sonicar las diapositivas durante 20 minutos o más. Grabado excesivo (por ejemplo, tratamiento de KOH durante la noche) mejorará la calidad de la superficie, pero introducirá arañazos, que podrían interferir con las imágenes de fluorescencia.
- Enjuague con H 2 O. Enjuagar los portaobjetos con H2O MilliQ por 3 veces para eliminar los rastros de KOH.
- Grabado Piranha.
- Transfiera los portaobjetos a un soporte de diapositivas Duran o un soporte de teflón o hechos a medida y plas de ellos en un vaso de precipitados (1 L) que se encuentra en una campana química.
- Llene el vaso de precipitados con 450 ml de H 2 SO 4.
- Añadir 150 ml de H 2 O 2 para relación 3:1 entre H 2 SO 4 y H 2 O 2. Una vez que la solución comienza a hervir de manera espontánea, la temperatura aumenta más de 90 º C. Asegúrese de que la solución de H 2 O 2 es a temperatura ambiente antes de iniciar la reacción. De lo contrario, la temperatura de ebullición de la solución puede ser inferior a 90 ° C.
- Se agita la solución para un mezclado adecuado y dejar que el vaso de precipitados en reposo durante 20 min.
- Tome las diapositivas de la solución de pirañas, junto con el soporte de diapositivas, y los puso en un soporte de diapositivas que contiene MilliQ H 2 O. Mientras tanto, desechar la solución de pirañas en una botella de residuos designado una vez que alcance la temperatura ambiente.
- Enjuagar los portaobjetos 3 veces con H2O MilliQ Un cuidado especial se debe tomar con mayor steps para evitar cualquier posible contaminación de las diapositivas. Continuar con el paso 3. Se aconseja proceder de inmediato con los pasos siguientes.
* Precaución: La solución de pirañas es extremadamente reactivo. Al manejar esta solución precaución adicional se debe tomar. Además, cuando por error mezclado con disolventes orgánicos tales como acetona, que puede causar una explosión.
2. Limpieza Cubreobjetos
Una cámara de microfluidos se compone de un portaobjetos de cuarzo y el labio una cubierta de s. Cuando se utiliza un microscopio TIRF de tipo prisma, la superficie de un cubreobjetos no se forma la imagen. Por lo tanto, es suficiente para limpiar un cubreobjetos sólo con H 2 O y KOH. En caso de que un cubreobjetos debe ser fotografiado (por ejemplo, a través de la microscopía TIRF de tipo objetivo), se recomienda para el tratamiento de los cubreobjetos con solución de pirañas (Paso 1.7). Tenga en cuenta que si la PEGilación de la superficie cubreobjetos no es de alta calidad, que podría actuar como un sumidero para las proteínas de unad dar lugar a variaciones en la concentración de proteína.
- Enjuague con H 2 O. Coloque los cubreobjetos (24 x 30, 24 x 40, o 24 x 50 mm 2) en un frasco de vidrio de tinción. Típicamente 5 a 15 cubreobjetos se pueden colocar en un solo frasco. Enjuagar los portaobjetos 3 veces con el MilliQ H 2 O.
- Limpieza con KOH. Cambie el agua con 1 M KOH y sonicar los cubreobjetos durante 20 minutos o más.
- Enjuague con H 2 O. Enjuagar los portaobjetos 3 veces con H2O MilliQ para eliminar trazas de KOH. Continúe con el paso 3.
3. Amino-silanización de Diapositivas y Cubreobjetos
Funcionalización de la superficie de los portaobjetos de cuarzo y los cubreobjetos con grupo amina a través de la química amino-silanización. El metanol se utiliza como un disolvente y ácido acético como catalizador para la reacción de amino-silanización.
- El enjuague con metanol. Vuelva a colocar la MilliQ H 2 O en los platos de tinción (de Steps 1 y 2) con metanol. Mantenga las diapositivas y los cubreobjetos en metanol hasta el Paso 3.3. No guarde las diapositivas y los cubreobjetos en metanol durante un tiempo innecesariamente largo período de tiempo (por ejemplo, varias horas) ya que las impurezas en metanol absorberá a la superficie.
- Preparación de solución de amino-silanización.
- Enjuague un matraz de Pyrex varias veces con metanol. Sonicar el matraz con metanol durante 5 minutos o más. Se recomienda tener un frasco dedicado que se mantiene limpio.
- Verter 100 ml de metanol en el matraz.
- Añadir 5 ml de ácido acético.
- Añadir 3 ml de APTES (trimethoxysilane 3-aminopropil) y mezclar suavemente sacudiéndolo.
- Amino-silanización. Vuelva a colocar el metanol en los platos de tinción que contienen las diapositivas y los cubreobjetos con la mezcla de reacción aminosilanization.
- Incubar durante 20 a 30 min. Durante la incubación, sonicar una vez durante 1 min.
- El enjuague con metanol. Vuelva a colocar la unaminosilanization reacción con metanol. Deseche el metanol y se añade una solución de metanol fresco. Repita este procedimiento tres veces.
4. Pasivación superficial Utilizando Polymer (la primera ronda)
Pasivación de la superficie amina recubiertos de portaobjetos de cuarzo y cubreobjetos mediante la conjugación de NHS-éster de polietilenglicol (PEG). Esta reacción se lleva a cabo con la concentración de saturación de la solución de PEG a pH 8,5 durante la noche.
- Secado de diapositivas y cubreobjetos. Secar los portaobjetos y los cubreobjetos utilizando gas N2 y colocarlos en cajas de pipeta limpia de tal manera que el lado que tiene que ser pegilado quede hacia arriba. El cuadro de pipeta se llena parcialmente con H2O MilliQ Este ambiente húmedo impide solución PEGilación se seque durante la incubación durante la noche.
- Preparación de tampón de reacción. Preparar 0,1 M de tampón fresco de bicarbonato de sodio (pH 8,5) mediante la disolución de 84 mg de bicarbonato de sodio en 10 ml deMilliQ H 2 O. No hay necesidad de ajustar el pH. Esta solución puede conservarse congelado para el siguiente uso (por ejemplo, el paso 6.1).
- Preparación de solución de PEGilación.
- Preparar una mezcla de PEG de 0,2 mg de biotina NHS-éster de PEG (5.000 Da) 13 y 8 mg de éster de NHS de mPEG (5000 Da) en un tubo de 1,5 ml. Al preparar número N de diapositivas, preparar N veces mayor cantidad de la mezcla de PEG en un único tubo.
- Añadir 64 l (o N Tiempos 64 l de N número de diapositivas) del tampón recién preparado (Paso 4.2). Pipetear hacia arriba y hacia abajo con el fin de disolver completamente.
- Centrifugar con 16.100 xg durante 1 min para eliminar las burbujas de aire. No pipetear después. De lo contrario, las burbujas de aire se formarán que interfieren con la PEGilación en el Paso 4.4.
- PEGilación.
- La gota 70 l de la mezcla de PEGilación a un portaobjetos de cuarzo seca de la Etapa 4.1. Utilice 90 l en el caso de 24 x 50 mm 2 coverslip.
- Con suavidad, coloque un cubreobjetos secos del Paso 4.1 sobre la solución.
- Para tener un uniforme y de alta calidad de PEGilación, tenga cuidado de no introducir burbujas de aire. Debido a la tensión superficial, la mayoría de las burbujas de aire puede salir de forma espontánea el volumen de reacción dentro de los cinco minutos, debido a la tensión superficial.
- Incubar los portaobjetos en un ambiente oscuro y húmedo. La vida media de NHS-éster de PEG que utilizamos a pH 8 es aproximadamente una hora. Como mínimo, los incuban durante 2 horas. Incubación durante la noche conduce a la mayor calidad de PEGilación (datos no mostrados).
5. Almacenamiento a largo plazo
El almacenamiento de las diapositivas y cubreobjetos en N 2 pegilado a -20 º C.
- Secado de diapositivas y cubreobjetos. Desmontar con cuidado el portaobjetos y el cubreobjetos deslizando el cubreobjetos a un lado, enjuagarlos con MilliQ H 2 O, y secarlas con N 2.
- Almacenamiento de diapositivas y cubreobjetos. For su uso inmediato, siga el procedimiento para la segunda ronda de PEGilación (Paso 6). Con el fin de almacenar por un período largo de tiempo, siga los siguientes pasos.
- Coloque un par de la corredera y el cubreobjetos en un tubo de 50 ml de tal manera que las superficies PEGilados se enfrentan a distancia el uno del otro.
- Parcialmente cerrar el tubo de vacío del tubo, y luego llenarlo con N 2. Estos pasos ayudan a preservar la superficie PEGilada durante un largo periodo de tiempo. Atornille el tubo herméticamente y guardarlo a -20 ° C. La calidad de las diapositivas sigue siendo bueno para un máximo de 3 meses (Figura 3a, derecha).
6. Pasivación superficial Utilizando Polymer (La Segunda Ronda)
Ronda adicional de PEGilación para hacer la capa más densa PEG y también para apagar cualquier grupos amina restantes en la superficie. El uso de moléculas de éster de NHS de PEG cortos (333 Da) puede ser eficaz en la penetración en una capa de PEG existente. Es recmienda hacer esta segunda ronda de PEGilación derecha antes de usar una diapositiva.
- Preparación de tampón de reacción. Preparar 0,1 M de tampón de bicarbonato de sodio fresco (pH 8,5). La solución congelada de la Etapa 4.2 también se puede utilizar.
- Preparación de solución de PEGilación. Disolver 7 l de 250 mM de MS4-PEG en 63 l del tampón de bicarbonato de sodio.
- PEGilación. Seguir el mismo procedimiento que en el Paso 4.4. Incubar durante 30 min hasta la noche.
- Secado de diapositivas y cubreobjetos. Desmontar la par de la diapositiva y el cubreobjetos, enjuagarlos con H2O MilliQ, séquelos con N2, y mantenerlos en una caja de pipeta limpia. Proceda para el montaje de una cámara de microfluidos en el Paso 7.
7. Montaje de una cámara de microfluidos
Montaje de una cámara de microfluidos usando un par de un portaobjetos de cuarzo pegilado y un cubreobjetos. Cinta adhesiva de doble cara se utiliza como separador. La cámara se sella con pegamento de epoxy y, por loluciones se introducen a través de los agujeros en la corredera de cuarzo.
- Coloque un portaobjetos de cuarzo sobre una superficie plana con el lado pegilado arriba.
- Hacer un canal (anchura de 5 a 7 mm) en diagonal sobre la superficie pegilado poniendo cintas adhesivas de doble cara sobre la diapositiva. Asegúrese de que los orificios se colocan en el centro del canal. Tenga cuidado de no estropear la superficie pegilado durante el proceso de fabricación de una cámara. Es posible hacer un portaobjetos de multi-canal mediante la colocación y pegar las cintas adhesivas de doble cara de manera diferente (véase la Figura 2).
- Con suavidad, coloque un cubreobjetos pegilado en la parte superior para completar la Sala. El lado pegilado debe estar boca abajo.
- Sellar la cámara pulsando el cubreobjetos sobre el área donde se colocan las cintas de doble cara. Hágalo suavemente pero a fondo para que la cámara se convierte en cerrado de forma estanca el agua.
- Cierre los bordes de la cámara con pegamento epóxico.
- Inmovilizar estreptavidina o Neutravidina en lacapa biotinilado de PEG mediante la adición de 50 l de 0,1 mg / ml de solución de estreptavidina o Neutravidina en T50 (Tris-HCl 10 [pH 8,0], 50 mM de NaCl tampón) usando una pipeta P200. Después de 1 min de incubación, lavar con 100 l de tampón T50.
- Añadir moléculas biológicas con biotina para su imagen de una sola molécula.
8. Deslice Reciclaje
Reciclaje de portaobjetos de cuarzo. Diapositivas usados son reciclados por quitarse los cubreobjetos y las cintas adhesivas de doble cara.
- Después de su uso, guardar las cámaras en el agua del grifo. Incubación a largo plazo en el agua facilita el desmontaje de las cámaras.
- Hervir las cámaras en el agua del grifo usando un horno de microondas. Utilice un vaso de precipitados Pyrex. Hervir durante 10 minutos o más.
- Quítese los cubreobjetos y las cintas adhesivas de doble cara utilizando una hoja de afeitar. No presione un portaobjetos de cuarzo perpendicular a su plano. De lo contrario, se rompe. Mantenga la cuchilla de afeitar lejos de la canal. Antiguo Testamentoherwise, introduce arañazos en el canal.
- Enjuagar los portaobjetos usando un detergente doméstico frotándolos con los dedos.
- Colocar los portaobjetos en una cubeta de tinción de vidrio. Típicamente 5 a 15 diapositivas se pueden colocar en un solo frasco. Agregar 10% de detergente doméstico y sonicar las diapositivas de 20 minutos o más. Enjuagar los portaobjetos con una gran cantidad de agua del grifo.
- Vaya al paso 1.2.
Resultados
Después de que el conjunto de la cámara de microfluidos (Paso 7.1 a 7.6) y antes de llevar a cabo la Etapa 7.7, se recomienda llevar a cabo el control de calidad de la superficie pegilado.
Si la pasivación de la superficie se ha hecho con éxito, hay menos de 10 adsorbidos no específicamente proteínas por área de imagen (25 mm x 25 mm) observó cuando se añade 1-10 nM proteína marcada con fluorescencia en la cámara (Figura 3a, izquierda).
Cuando alguno de los pasos de limpieza o de reacción no se ha realizado correctamente, el número de no-específicamente adsorbido proteínas aumenta significativamente, y la pantalla CCD puede ser saturado por las señales de fluorescencia. Por ejemplo, si el grabado piraña se omite, no es 100 veces una mayor cantidad de adsorción no específica observada (Figura 3a; comparar izquierda con el centro). Cuando se omite el segundo paso PEGilación, había aproximadamente 3 vecessa mayor cantidad de adsorción observada no específica (Figura 3b). Se observa un bajo grado de PEGilación cuando se utilizan productos químicos de vencimiento (por ejemplo APTES almacenan a temperatura ambiente durante varios meses) (datos no mostrados). La calidad de la superficie también se reduce hacia abajo cuando una cantidad significativa de tiempo ha pasado desde que era PEGilado (Figura 3a; comparar izquierda con la derecha).
A nuestro leal saber y entender, es la primera vez que las dos rondas de PEGilación se introducen para los estudios de una sola molécula. Las dos rondas de PEGilación garantizan la más alta calidad de la formación de la capa de PEG (Figura 3b). La naturaleza superior de la doble PEGilación se muestra un lugar destacado en las películas (Comparar Película 1a con 1b Película). En estas películas, se observan las señales de fondo a partir de moléculas fluorescentes en solución a ser mucho más débil cuando el doble PEGilación era utilizados, lo que indica que las proteínas son repelidos más eficazmente por la capa doblemente pegilado. Aunque este proceso de dos pasos es muy recomendable, el segundo paso PEGilación puede ser omitido si su experimento es tolerable para la pasivación no óptima.
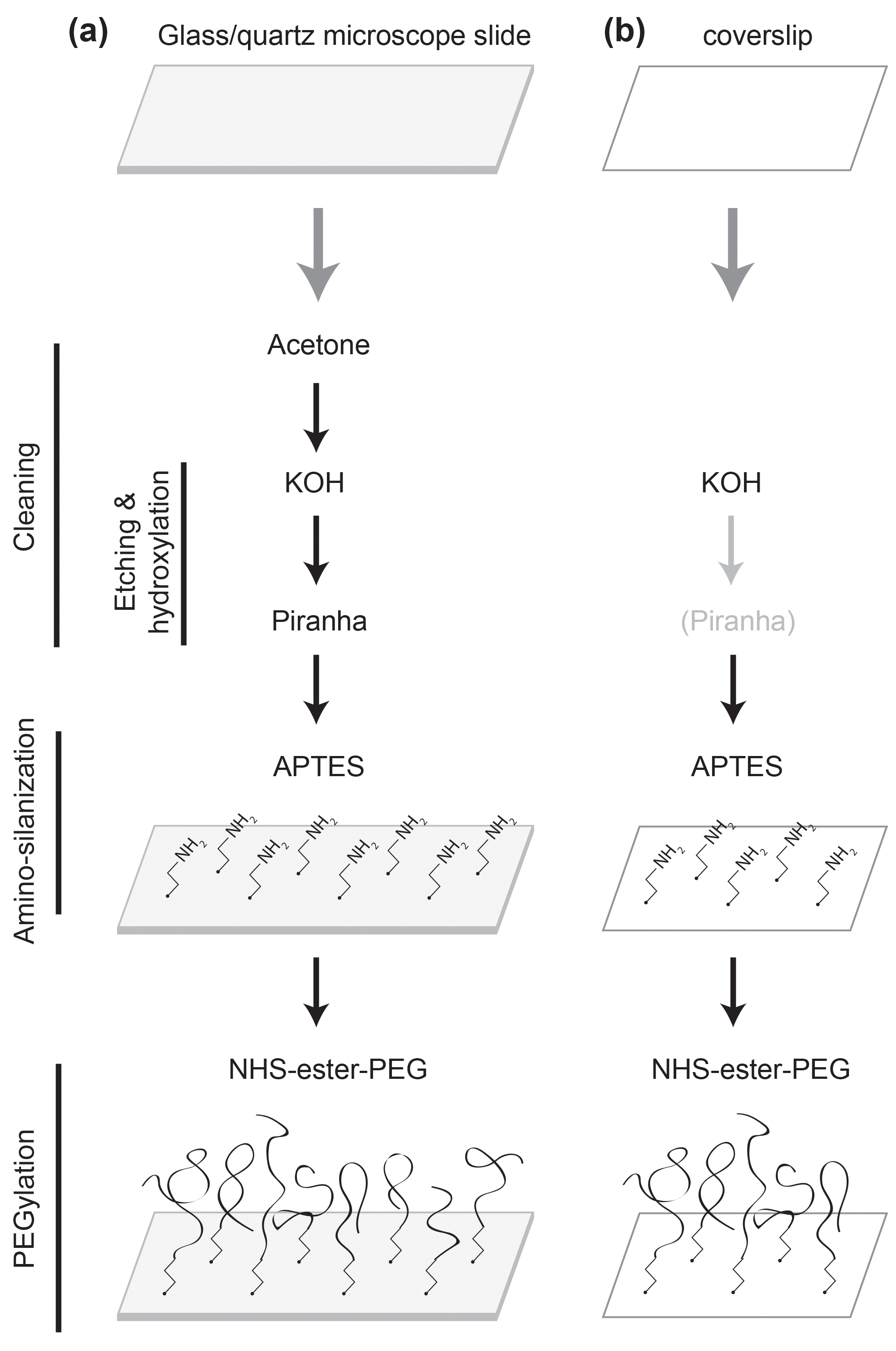
Figura 1:. Esquemática de los tratamientos de superficie (a) Un portaobjetos de microscopio se limpia con acetona, KOH, y soluciones piraña. Se funcionalizado con APTES y PEGilada con NHS-éster de PEG. (B) Un cubreobjetos se limpia con KOH, así como con la solución Piranha si es necesario. Se funcionalizado con APTES y PEGilada con NHS-éster de PEG.
fig2highres.jpg "width =" 500 "/>
Figura 2:. Cámara de microfluidos (a) una cámara de un solo canal. El portaobjetos de microscopio tiene dos agujeros perforados. Se monta con un cubreobjetos usando dos rebanadas de una cinta adhesiva de doble cara. (B) Una cámara de tres canales. El portaobjetos de microscopio tiene seis agujeros perforados. Se monta con un cubreobjetos usando cuatro rebanadas de una cinta adhesiva de doble cara.
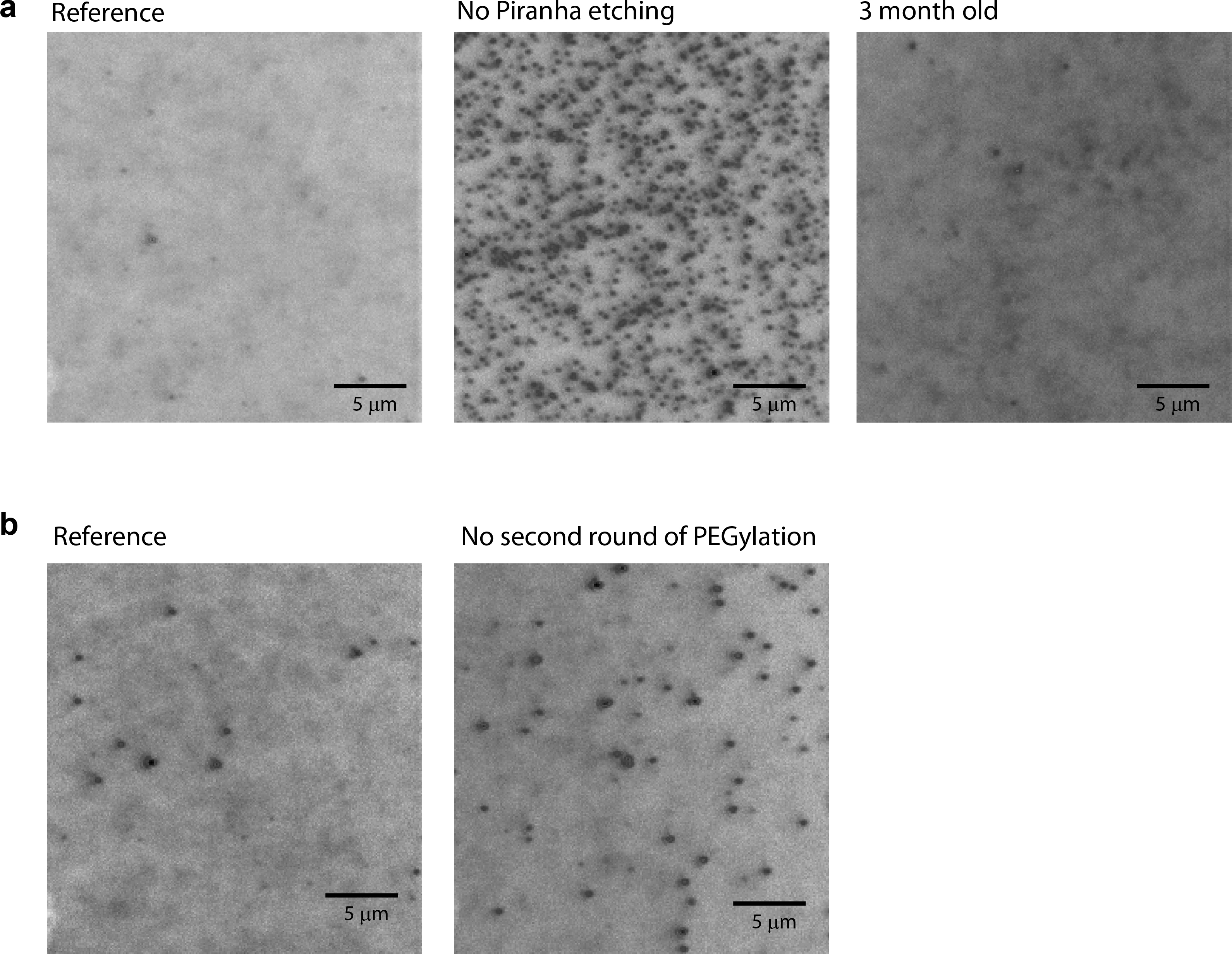
Figura 3: imágenes CCD tomadas con proteínas marcado tinte en solución. (A) las imágenes CCD fueron tomadas por tipo prisma total de fluorescencia de reflexión interna microscopía usando un lente objetivo de 60X con 10 nM Cy3-labeld Rep en solución. (Izquierda) Una superficie se preparó siguiendo el protocolo en este artículo. (Educación media) Una superficie fue preparojo siguiendo el protocolo en este artículo, pero el grabado de pirañas se omiten. (Derecha) Una superficie se preparó siguiendo el protocolo en este artículo y se almacena durante 3 meses a -20 º C en atmósfera de nitrógeno. (B) las imágenes CCD tomadas con 10 nM Cy3-labeld Rep en solución. (Izquierda) Una superficie se preparó siguiendo el protocolo en este artículo. (Derecha) Una superficie se preparó siguiendo el protocolo en este artículo, pero se omitió la segunda ronda de la PEGilación. Barra de escala = 5 micras.
Película 1: películas CCD tomadas con proteínas marcado tinte en solución. Películas CCD fueron tomadas por tipo prisma total de fluorescencia de reflexión interna microscopía usando un lente objetivo de 60X con 10 nM Cy3-labeld Rep en solución. El tiempo de resolución es de 100 ms. (A) Una superficie se preparó siguiendo el protocolo en este artículo. (B) Una superficie se preparó siguiendo el protocolo en este artículo, pero la segunda ronda de PEGylción se ha omitido. Haga clic aquí para ver la película de 1a y haga clic aquí para ver la película 1b.
Discusión
Los pasos críticos dentro de este protocolo
Es esencial para que la superficie hidrófila antes de la reacción amino-silanización. Esto se logró mediante el grabado de pirañas que genera los grupos hidroxilo libres en una superficie de vidrio / cuarzo. Se recomienda no para mantener la superficie grabada piraña expuesta en H 2 O o aire durante un largo período de tiempo desde que la hidrofilicidad de la superficie desciende gradualmente.
Las moléculas de éster de NHS de PEG son reactivos. Se aconseja hacer alícuotas y almacenarlas bajo nitrógeno en -20 º C. La vida útil de la química APTES en la temperatura ambiente es corto. Se aconseja sustituirlo por uno nuevo cada mes.
Las modificaciones de este protocolo
Cuando no se puede utilizar el grabado de pirañas y por la razón práctica, es posible grabar utilizando KOH por un largo período de tiempo (por ejemplo, overnight), que también hará que los grupos hidroxilo expuestos. La trampa de este enfoque alternativo es que la corredera se vuelve inutilizable después de unos recicla debido a arañazos graves.
A menudo se practica para quemar una superficie de vidrio / cuarzo, utilizando soplete de propano, que es eficaz en la eliminación de materiales orgánicos fluorescentes 7. Este procedimiento no se incluyó en este protocolo, ya que es redundante para el grabado de pirañas. Tenga en cuenta que este procedimiento potencialmente conducir a la oxidación de los grupos hidroxilo. Por lo tanto, este procedimiento no debería llevarse a cabo una vez a la superficie estaba grabada usando KOH o solución de pirañas.
Cuando se utiliza un tampón con pH inferior a 7 para la formación de imágenes de una sola molécula, la conformación de PEG cambia de "hongo" a "pincel", que reduce el grado de pasivación. Por lo tanto, cuando se utiliza un pH inferior a 7,0, se recomienda para pasivar aún más la superficie utilizando tartrato de disuccinimidilo 7.
Perspectivas
Este trabajo ha proporcionado un protocolo robusto para lograr la pasivación superficial de alta calidad. Este protocolo será útil para estudios de fluorescencia de una sola molécula que están involucrados con proteínas de 14, así como los complejos de proteínas dentro de extractos celulares y los inmunoprecipitados 15. Se utiliza ampliamente para otras técnicas de una sola molécula, tales como espectroscopia de fuerza y torque espectroscopía 16. Será también útil para la prevención de las células de adsorción a una superficie 17.
El protocolo previsto en este trabajo es muy exigente con sus procedimientos de varios pasos. Pasivación de superficies utilizando lípidos PEG 8 y poli-lisina PEG 9 están disponibles como un enfoque alternativo. Dado que, no requieren ningún reacciones químicas de que es fácil de implementar. Sin embargo, el grado de pasivación no sea tan alta como la que se consigue a través de modif químicaicación de una superficie.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
COSUDE, ACH, y CJ fueron apoyados por las subvenciones de inicio (ERC-STG-2012 a 309.509) a través del Consejo Europeo de Investigación. J.-MN fue apoyado por la Fundación Nacional de Investigación (NRF) (2011-0.018.198) de Corea; y el Programa del Centro de Investigación de Pioneer (2012-009586) a través de la NRF de Corea financiado por el Ministerio de Ciencia, TIC, y de Planeamiento del Futuro (MSIP). Este trabajo también fue apoyado por el Centro para la Salud BioNano-Guard financiado por MSIP de Corea como el Proyecto Global Frontier (H-GUARD_2013-M3A6B2078947). YKL y J.-HH fueron apoyados por el Programa de Becas de Ciencias de Seúl de la ciudad de Seúl, Corea. La proteína Rep marcado fue un generoso regalo del doctor Sua Myong.
Materiales
| Name | Company | Catalog Number | Comments |
| 1. Slide preparation and cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coverslips | VWR | 631-0136 631-0144 631-0147 | 24 x 32 mm2, 22 x 40 mm2, 24 x 50 mm2 (No.1½, Rectangular) |
| Diamond drill bits | MTN-Giethoorn, The Netherlands | LA-0564-00DB | 3/4 mm |
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| Glass staining dishes | Fisher Scientific | 300101 | |
| H2O2 | Boom | 6233905 | 1 L, hydrogen peroxide 30%. Opened bottles should be stored at 4 °C. |
| H2SO4 | Boom | 80900627.9010 | Sulfuric acid 95-98% |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| Quartz slides | Finkenbeiner | 1” x 3”, 1 mm thick | |
| 2. Coverslip cleaning | |||
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 3. Amino-silanization of slides and coverslips | |||
| Acetic acid | Sigma | 320099-500ML | Acetic acid, glacial |
| APTES | Sigma-Aldrich | 281778-100ML | 3-aminopropyl trimethoxysilane. Store at the room temperature under N2. Replace once in a month. |
| Flask (200 ml) | VWR | Flask (200 ml) | Pyrex flask. Have one flask dedicated for aminosilanization. |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 4. Surface passivation using polymer (the first round) | |||
| Biotin-mPEG | Laysan Bio | Biotin-PEG-SVA-5000-100mg | Biotin-PEG-SVA, MW 5,000 Da. Store aliquots of 1-2 mg (enough for 10 slides) at -20 °C under N2. |
| mPEG | Laysan Bio | MPEG-SVA-5000-1g | mPEG-succinimidyl valerate (SVA), MW 5,000 Da. Store aliquots of 80 mg (enough for 10 slides) at -20 °C under N2. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 5. Surface passivation (the second round) | |||
| DMSO | Sigma-Aldrich | D8418-100ML | Dimethyl sulfoxide BioReagent, for molecular biology, ≥99.9% |
| DST | Pierce | 20589 | Disuccinimidyl tartarate |
| MS4-PEG | Pierce | 22341 | Short NHS-ester PEG, MW 333 Da. Dissolve 100 mg MS4-PEG in 1.1 ml DMSO. Store 20 µl aliquots at -20 °C. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 6. Assembling a microfluidic chamber | |||
| Double sticky tape | Scotch | 10 mm wide | |
| Epoxy | Thorlabs | G14250 | Devcon 5 minute epoxy |
| NaCl | Sigma-Aldrich | S9888-1 KG | Sodium chloride |
| Neutravidin | Pierce | 31000 | ImmunoPure NeutrAvidin Biotin-Binding protein. Stock in 5 mg/ml in H2O at 4 °C. |
| Streptavidin | Invitrogen | S-888 | Stock 5 mg/ml in H2O or T50 at 4 °C. |
| Trizma base | Sigma-Aldrich | T1503-1 KG | Tris |
Referencias
- Rasnik, I., McKinney, S. A., Ha, T. Surfaces and orientations: much to FRET about. Acc Chem Res. 38 (7), 542-548 (2005).
- Lamichhane, R., Solem, A., Black, W., Rueda, D. Single-molecule FRET of protein-nucleic acid and protein-protein complexes: surface passivation and immobilization. Methods. 52 (2), 192-200 (2010).
- Di Fiori, N., Meller, A. Automated system for single molecule fluorescence measurements of surface-immobilized biomolecules. J Vis Exp. (33), 1542-1510 (2009).
- Kingshott, P., Griesser, H. J. Surface that resist biodegradation. Curr Opin Solid St M. 4 (4), 403-412 (1999).
- Elbert, D. L., Hubbell, J. A. Surface treatments of polymers for biocompatibility. Annu Rev Mater Sci. 26, 365-394 (1996).
- Zalipsky, S., Preface Harris, J. M. . Poly(theylene glycol). , 11-12 (1997).
- Selvin, P. R., Ha, T. . Single-Molecule Techniques: A Laboratory Manual. , (2007).
- Finkelstein, I. J., Greene, E. C. Supported lipid bilayers and DNA curtains for high-throughput single-molecule studies. Methods Mol Biol. 745, 447-461 (2011).
- Kenausis, G. L., et al. Poly(L-lysine)-g-Poly(ethylene glycol) layers on metal oxide surfaces: attachment mechanism and effects of polymer architecture on resistance to protein adsorption. J Phys Chem B. 104 (14), 3298-3309 (2000).
- Groll, J., Star Moeller, M. polymer surface passivation for single-molecule detection. Method Enzymol. 472, 1-18 (2010).
- Bahmani, B., Gupta, S., Upadhyayula, S., Vullev, V. I., Anvari, B. Effect of polyethylene glycol coatings of uptake of indocyanine green loaded nanocapsules by human spleen macrophages in vitro. J Biomed Opt. 16 (5), (2011).
- Kulczyk, A. W., Tanner, N. A., Loparo, J. J., Richardson, C. C., van Oijen, A. M. Direct observation of enzymes replicating DNA using a single-molecule DNA stretching assay. J Vis Exp. (37), e1689 (2010).
- Upadhyayula, S., et al. Coatings of polyethylene glycol for suppressing adhesion between solid microspheres and flat surfaces. Langmuir. 28 (11), 5059-5069 (2012).
- Dulin, D., Lipfert, J., Moolman, M. C., Dekker, N. H. Studying genomic processes at the single-molecule level: introducing the tools and applications. Nat Rev Genet. 14, 9-22 (2012).
- Joo, C., Fareh, M., Narry Kim, V. Bringing single-molecule spectroscopy to macromolecular protein complexes. Trends Biochem Sci. 38 (1), 30-37 (2012).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505 (2008).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318, 426-430 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados