Method Article
Passivação da superfície de Estudos de proteína única molécula
Neste Artigo
Resumo
Descreve-se um método para passivação de uma superfície de vidro, usando polietilenoglicol (PEG). Este protocolo abrange limpeza de superfícies, funcionalização de superfície e revestimento PEG. Nós introduzimos uma nova estratégia para o tratamento da superfície com moléculas de PEG mais de dois rounds, que produz qualidade superior de passivação em relação aos métodos existentes.
Resumo
Espectroscopia de fluorescência de moléculas individuais provou ser fundamental para a compreensão de uma ampla gama de fenômenos biológicos em nanoescala. Exemplos importantes do que esta técnica pode render às ciências biológicas são as idéias mecanicistas sobre proteína proteína e proteína-interações ácido nucleico. Quando as interacções de proteínas são sondadas no nível de uma única molécula, as proteínas ou os seus substratos são frequentemente imobilizado sobre uma superfície de vidro, o que permite uma observação a longo prazo. Este esquema de imobilização pode introduzir artefatos superficiais indesejáveis. Portanto, é essencial para passivar a superfície do vidro para tornar inerte. Revestimento de superfícies utilizando polietileno glicol (PEG) destaca-se por sua alta performance na prevenção de proteínas de interagir não especificamente com uma superfície de vidro. No entanto, o procedimento de revestimento de polímero é difícil, devido a uma complicação que resulte de uma série de tratamentos de superfície e a exigência rigorosa que uma superfície precisaestar isento de quaisquer moléculas fluorescentes, no final do procedimento. Aqui, nós fornecemos um protocolo robusto, com instruções passo-a-passo. Abrange limpeza de superfícies, incluindo decapagem piranha, funcionalização de superfície com grupos amina e, finalmente, revestimento PEG. Para se obter uma elevada densidade de uma camada de PEG, que introduzem uma nova estratégia para o tratamento de superfície com moléculas de PEG em duas voltas, o que melhora notavelmente a qualidade de passivação. Nós fornecemos resultados representativos, bem como conselhos práticos para cada passo crítico para que qualquer pessoa pode alcançar a superfície passivation alta qualidade.
Introdução
Ao efectuar um estudo de uma única molécula de proteína que é essencial para atingir uma elevada qualidade de passivação da superfície, de modo que a experiência é livre de qualquer mau funcionamento da proteína induzida à superfície ou a desnaturação de 1,2. Embora uma superfície de vidro tratado com surfactantes, tais como albumina do soro bovino, é vulgarmente utilizado para os estudos de ácido nucleico única molécula de 3, o seu grau de passivação não é suficientemente elevada para os estudos de proteína. A superfície de vidro revestido com polímero (polietilenoglicol, PEG) é superior no desempenho 4-6 passivação. Desse modo, tornou-se universalmente utilizado para estudos de proteína única molécula desde que foi apresentado a um estudo de fluorescência única molécula 7-10. O processo de revestimento de polímero requer vários tratamentos de superfície 7,11,12. Portanto, é difícil para acompanhar todo o processo sem instruções detalhadas. Muitas vezes, o grau de passivação da superfície varia de acordo com o protocolo is seguidas. Aqui apresentamos um protocolo robusto, com instruções passo-a-passo, que irá remover um dos principais gargalos de estudos de proteína única molécula. Veja a Figura 1 para uma descrição.
Protocolo
1. Deslize Preparação e Limpeza
Uma câmara de microfluidos é composta por uma lâmina de quartzo e uma lamela. No tipo de prisma de reflexão interna total microscopia de fluorescência (TIRF), a superfície da lâmina de quartzo é fotografada. Portanto, é importante limpar uma lâmina de quartzo, cuidadosamente, com H 2 O, acetona, KOH, e soluções piranha. Th é de limpeza de multi-passo elimina moléculas orgânicas fluorescentes sobre uma superfície, que interferem com as medições de fluorescência de moléculas isoladas. Além disso, a gravura piranha torna a superfície hidrófila de quartzo através da geração de grupos hidroxilo. Os grupos hidroxilo livres são essenciais para a reacção de amino-silanização no Passo 3.
- Lâminas de perfuração de quartzo. Faça um par de buracos em um slide de quartzo com um bit 3/4 mm de perfuração de diamante (Figura 2a). Se vários canais são desejados, perfurar mais pairs dos orifícios (Figura 2b). Estes orifícios são usados para a injecção de soluções para uma câmara de microfluidos no Passo 7.
- Manter a broca molhado em H2O durante a perfuração. H 2 O funciona como um lubrificante, o que aumenta o tempo de vida da broca.
- Ocasionais limpando a ponta da broca ajuda a abertura de furos.
- Após a abertura de furos, marque um lado da lâmina para facilitar a identificação durante o processo PEGylation. Os marcadores podem ser utilizados como referência, para evitar confusão mais tarde. Para a marcação, uma broca de diamante pode ser usado. Não utilize qualquer caneta desde que a tinta pode ficar na superfície.
- Limpeza com H 2 O. Colocar as lâminas em um frasco de vidro para coloração. Tipicamente, de 5 a 15 as lâminas podem ser colocadas num recipiente. Lavar as lâminas com MilliQ H 2 O. Repita 3 vezes e sonicate os slides com MilliQ H2O por 5 min para remover a sujeira. Descarte a água e lave os slides de novo 3 vezes comMilliQ H 2 O. Note-se que 130 W é a energia de ultra-sons utilizado para este protocolo. Poder sonicação Superior pode diminuir a vida útil das lâminas de quartzo.
- A limpeza com acetona. Substitua o MilliQ H2O com acetona. Sonicar as lâminas com acetona durante 20 minutos ou mais.
- A lavagem com H 2 O. Descarte a acetona e enxaguar as lâminas com MilliQ H 2 O. Repita isso por três vezes, a fim de remover qualquer resíduo de acetona.
- Limpeza com KOH. Substitua a água com 1 M KOH e sonicate os slides para 20 minutos ou mais. Corrosão excessiva (por exemplo, tratamento KOH overnight) irá melhorar a qualidade da superfície, mas vai apresentar arranhões, o que pode interferir com imagens de fluorescência.
- A lavagem com H 2 O. Lavar as lâminas com MilliQ H2O por 3 vezes para remover vestígios de KOH.
- Gravura Piranha.
- Transferir as lâminas para um suporte de slides Duran ou um titular de Teflon feito por encomenda e place-los num copo (1 L), que está localizada numa chaminé de química.
- Encher o recipiente com 450 ml de H 2 SO 4.
- Adicionar 150 ml de H 2 O 2 para relação de 3:1 entre H 2 SO 4 e H 2 O 2. Uma vez que a solução começa a ferver espontaneamente, a temperatura aumenta acima de 90 ° C. Certifique-se de que a solução de H 2 O 2 está à temperatura ambiente antes de iniciar a reacção. Caso contrário, a temperatura de ebulição da solução pode ser inferior a 90 ° C.
- Agita-se a solução para uma mistura apropriada e permitir que o recipiente em repouso por 20 minutos.
- Tome as lâminas da solução piranha, juntamente com o titular do slide, e colocá-los no porta-lâminas contendo MilliQ H 2 O. Enquanto isso, descartar a solução piranha em um frasco de resíduos designada uma vez que atinge a temperatura ambiente.
- Lavar as lâminas três vezes com H 2 O. MilliQ Cuidado extra deve ser tomado em mais steps para evitar qualquer possível contaminação de slides. Continue na Etapa 3. Aconselha-se a proceder de imediato com os seguintes passos.
* Atenção: A solução piranha é extremamente reativo. Ao manusear esta solução cuidado extra deve ser tomado. Além disso, quando por engano misturados com solventes orgânicos, tais como acetona, que pode provocar uma explosão.
2. Limpeza Coverslip
Uma câmara de microfluidos é composta por uma lâmina de quartzo e um lábio de cobertura s. Quando um TIRF microscópio do tipo prisma é utilizada, a superfície de uma lamela não é visualizada. Portanto, é suficiente para limpar uma lamela apenas com H 2 O e KOH. No caso de uma lamela deve ser trabalhada (por exemplo, através da microscopia TIRF tipo objectivo), recomenda-se a tratar as lamelas com solução piranha (Passo 1.7). Note que se PEGylation da superfície da lamela não é de alta qualidade, ele pode atuar como um dissipador de proteínas umad dar origem a variações na concentração de proteína.
- A lavagem com H 2 O. Colocar lamelas (24 x 30, 24 x 40, ou 24 x 50 mm 2) em um frasco de vidro para coloração. Tipicamente, de 5 a 15 lamelas podem ser colocados num único frasco. Lavar as lamelas 3 vezes com o MilliQ H 2 O.
- Limpeza com KOH. Substitua a água com KOH 1M e sonicate as lamelas de 20 min ou mais.
- A lavagem com H 2 O. Lavar as lamelas 3 vezes com MilliQ H 2 O para remover os vestígios de KOH. Continue na Etapa 3.
3. Amino-silanização de Slides e Lamelas
Funcionalização da superfície das lâminas de quartzo e as lamelas com o grupo amina por meio da química amino-silanização. O metanol é usado como solvente e ácido acético como catalisador para a reacção de amino-silanização.
- A lavagem com metanol. Substitua o MilliQ H2O nos pratos de coloração (a partir de SPTE 1 e 2) com metanol. Mantenha os slides e as lamelas em metanol até Passo 3.3. Não armazenar as lâminas e as lamelas em metanol durante um tempo desnecessariamente longo período de tempo (por exemplo, várias horas) desde que as impurezas em metanol irá adsorver à superfície.
- Preparar solução de amino-silanização.
- Lavar um balão de pirex várias vezes com metanol. Sonicar o frasco com metanol durante 5 minutos ou mais. É aconselhável ter um frasco dedicado que é mantido limpo.
- Verter 100 mL de metanol, para o balão.
- Adicionar 5 ml de ácido acético.
- Adicionar 3 ml de APTES (3-aminopropil trimetoxissilano) e misture delicadamente por sacudi-la.
- Amino-silanização. Substituir o metanol nos pratos de coloração que contêm as lâminas e as lamelas de cobertura com a mistura de reacção aminosilanization.
- Incubar por 20-30 min. Durante a incubação, sonicar uma vez durante 1 min.
- A lavagem com metanol. Substitua a umminosilanization reacção com metanol. Descartar o metanol e adicionar uma solução de metanol fresco. Repita este procedimento três vezes.
4. Passivation superfície usando Polymer (A Primeira Rodada)
Passivação da superfície revestida de amina de lâminas e lamelas de quartzo através da conjugação de NHS-éster de polietileno glicol (PEG). Esta reacção é levada a cabo com a concentração de saturação da solução de PEG a um pH de 8,5 durante a noite.
- Secagem lâminas e lamínulas. Secam-se as lâminas e as lamelas utilizando gás N2 e colocá-los em caixas de pipetas limpo, de tal maneira que o lado que não tem de ser tratado com PEG está virada para cima. A caixa de pipeta é parcialmente preenchido com MilliQ H 2 O. Esse ambiente úmido impede solução PEGylation sequem durante a incubação durante a noite.
- Preparar tampão de reacção. Prepare a 0,1 M de tampão de fresco de bicarbonato de sódio (pH 8,5) por dissolução de 84 mg de bicarbonato de sódio em 10 ml deMilliQ H 2 O. Não há necessidade de ajustar o pH. Esta solução pode ser armazenado congelado para a próxima utilização (por exemplo, Passo 6.1).
- Preparar solução PEGylation.
- Prepara-se uma mistura de PEG de 0,2 mg biotiniladas NHS-éster de PEG (5000 Da) e 13 8 mg de NHS-éster de mPEG (5000 Da), em um tubo de 1,5 ml. Quando se prepara o número N de lâminas, preparar N vezes maior quantidade da mistura de PEG num único tubo.
- Adicionar 64 mL (ou N vezes 64 mL de N número de lâminas) do buffer recém-preparado (Passo 4.2). Pipetar para cima e para baixo a fim de dissolvê-los completamente.
- Centrifugar com 16.100 xg por 1 min para remover as bolhas de ar. Não pipete depois. De outro modo, as bolhas de ar se formam, que interferem com a PEGilação no passo 4.4.
- PEGylation.
- Queda de 70 uL da mistura de PEGilação para uma lâmina de quartzo seca do Passo 4.1. Utilizar 90 mL, no caso de 24 x 50 mm 2 coverslip.
- Delicadamente, coloque uma lamela seco a partir do Passo 4.1 sobre a solução.
- Para se ter uma alta qualidade uniforme e de PEGylation, tome cuidado para não introduzir bolhas de ar. Devido à tensão de superfície, a maior parte das bolhas de ar podem sair espontaneamente o volume de reacção dentro de cinco minutos, devido à tensão superficial.
- Incubar as lâminas em um ambiente escuro e úmido. A meia-vida de NHS-éster de PEG que usamos a pH 8 é de cerca de uma hora. No mínimo, a incubar durante 2 horas. Incubação durante a noite conduz a uma maior qualidade de PEGilação (dados não mostrados).
5. Armazenamento de longo prazo
Armazenar as lâminas e lamínulas em N 2 PEGilados a -20 º C.
- Secagem lâminas e lamínulas. Desmontar cuidadosamente a lâmina ea lamínula, deslizando a lamela para um lado, lavá-los com MilliQ H 2 O, e seque-as com N 2.
- Armazenar lâminas e lamínulas. For uso imediato, siga o procedimento para a segunda rodada de PEGylation (Passo 6). Para armazenar por um longo período de tempo, siga os seguintes passos.
- Coloque um par de lâmina e lamela em um tubo de 50 ml de tal forma que as superfícies estão PEGilados virada para fora um do outro.
- Parcialmente fechar o tubo, o tubo de vácuo, em seguida, preenchê-lo com N 2. Estes passos ajudar a preservação da superfície PEGuilado por um longo período de tempo. Aperte o tubo bem e armazená-lo a -20 ° C. A qualidade das lâminas permanece bom por até 3 meses (Figura 3A, à direita).
6. Passivation superfície usando Polymer (o segundo turno)
Ronda adicional de PEGilação para tornar a camada mais densa de PEG e também para matar todos os restantes grupos amina sobre a superfície. O uso de moléculas de PEG de NHS de éster de curta duração (333 Da) pode ser eficaz no que penetra uma camada de PEG existente. É recommended fazer esta segunda rodada de PEGylation direita antes de usar um slide.
- Preparar tampão de reacção. Prepare a 0,1 M de tampão de bicarbonato de sódio fresco (pH 8,5). A solução congelada a partir do Passo 4.2, também podem ser usados.
- Preparar solução PEGylation. Dissolve-se 7 ul de 250 mM MS4-PEG em 63 ul de tampão bicarbonato de sódio a.
- PEGylation. Seguem o mesmo procedimento como no passo 4.4. Incubar por 30 min até durante a noite.
- Secagem lâminas e lamínulas. Desmonte a par da lâmina ea lamínula, lavá-los com MilliQ H 2 O, seque-os com N 2, e mantê-los em uma caixa de pipeta limpa. Prossiga para a montagem de uma câmara microfluídicos no Passo 7.
7. Montar uma Câmara Microfluidic
Montar uma câmara microfluídicos usando um par de um quartzo de slides peguilado e uma lamela. Fita adesiva dupla face é usado como um espaçador. A câmara é selada com cola epóxi e, assimluções são introduzidos através dos orifícios da corrediça de quartzo.
- Coloque uma lâmina de quartzo sobre uma superfície plana com a face voltada para cima da PEGuilado.
- Fazer um canal (largura 5-7 mm) na diagonal na superfície de PEGuilado colocando fitas adesivas de dupla face sobre a lâmina. Certifique-se de que os orifícios estão posicionados no centro do canal. Tome cuidado para não estragar a superfície da PEGylated durante o processo de fabricação de uma câmara. É possível fazer um slide de multi-canal, colocando e aderindo as fitas adesivas de dupla face de forma diferente (ver Figura 2).
- Delicadamente, coloque uma lamela PEGylated em cima para completar a câmara. O lado PEGylated deve estar voltado para baixo.
- Selar a câmara pressionando a lamela sobre a área onde as fitas dupla face são colocados. Fazê-lo suavemente, mas cuidadosamente para que a câmara se torna água hermeticamente fechado.
- Fechar as extremidades da câmara de cola epóxi.
- Imobilizar estreptavidina ou neutravidina nabiotinilado camada de PEG pela adição de 50 ul de 0,1 mg / ml de solução de estreptavidina ou neutravidina em T50 (10 mM Tris-HCl [pH 8,0], tampão de NaCl 50 mM) usando uma pipeta de p200. Após 1 min de incubação, lavar com 100 mL de tampão T50.
- Adicionar moléculas biológicas biotinilados para sua única molécula de imagem.
8. Deslize Reciclagem
Reciclagem de lâminas de quartzo. Slides utilizados são reciclados por tirar as lamelas e as fitas adesivas de dupla face.
- Após o uso, guarde as câmaras na água da torneira. Incubação longo prazo na água facilita a desmontagem das câmaras.
- Ferva as câmaras na água da torneira usando um microondas. Use uma proveta de Pyrex. Ferva por 10 minutos ou mais.
- Tire as lamelas e as fitas adesivas de dupla face, usando uma lâmina de barbear. Não pressione um slide quartzo perpendicular ao seu plano. Caso contrário, ele quebra. Manter a lâmina de barbear para longe do canal. Otherwise, introduz riscos no canal.
- Lavar as lâminas usando um detergente doméstico, esfregando-os com os dedos.
- Colocar as lâminas em um frasco de vidro para coloração. Tipicamente, de 5 a 15 as lâminas podem ser colocadas num recipiente. Adicionar 10% de detergente doméstico e sonicate os slides para 20 minutos ou mais. Lavar as lâminas com uma grande quantidade de água da torneira.
- Vá para o Passo 1.2.
Resultados
Após a montagem de câmara de microfluídica (Passo 7,1-7,6) e antes da realização de Passo 7.7, é aconselhável realizar o controle da superfície PEGylated qualidade.
Se a passivação da superfície foi feita com sucesso, existem menos do que 10 não especificamente proteínas adsorvidas por área de imagem (25 mm x 25 mm) quando observada 1-10 nM de proteína marcada por fluorescência é adicionado para dentro da câmara (Figura 3a, à esquerda).
Quando qualquer uma das etapas de limpeza ou de reação não foi devidamente realizado, o número de não especificamente adsorvido proteínas aumenta significativamente, ea tela do CCD pode ser saturada por sinais de fluorescência. Por exemplo, se o condicionamento piranha é ignorada, não é 100 vezes maior quantidade de adsorção não-específica observada (Figura 3a; comparar deixou com meio). Quando o segundo passo de PEGuilação é ignorada, houve cerca de 3 horasa maior quantidade de adsorção não-específica observada (Figura 3b). Um baixo grau de PEGilação é observada quando os produtos químicos no fim (por exemplo, APTES armazenado à temperatura ambiente durante vários meses) são utilizadas (dados não apresentados). A qualidade da superfície também cai quando uma quantidade significativa de tempo já passou por uma vez que foi PEGuilado (figura 3a, comparar esquerda com direita).
Para o nosso melhor conhecimento, é a primeira vez que as duas rodadas de PEGylation são introduzidos para estudos de moléculas individuais. As duas rodadas de PEGylation garantir a mais alta qualidade de formação da camada PEG (Figura 3b). A natureza superior da dupla PEGylation está proeminentemente mostrado nos filmes (Compare 1a filme com 1b Filme). Nestes filmes, os sinais de fundo de moléculas fluorescentes em solução são observados para ser muito mais fraco do que o dobro PEGilação utilizado, o que indica que as proteínas são repelidos mais eficazmente pela camada duplamente peguilado. Embora este processo de duas etapas é altamente recomendável, a segunda etapa PEGylation pode ser ignorada se a experiência é tolerável para passivação não ideal.
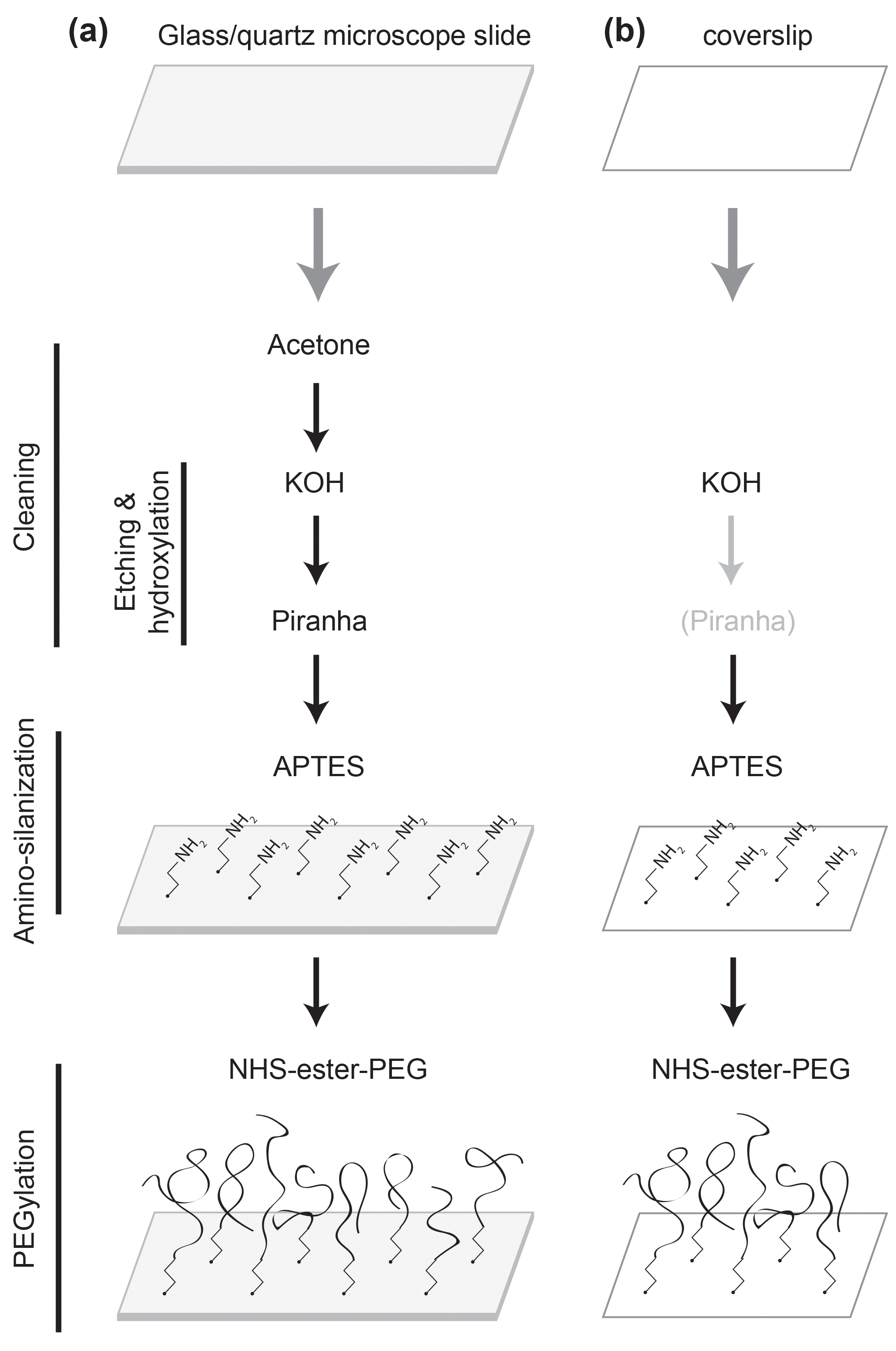
Figura 1:. Esquemática dos tratamentos de superfície (a) uma lâmina de microscópio é limpa com acetona, KOH, e soluções piranha. Ele é funcionalizado com APTES e PEGuilado com NHS-éster de PEG. (B) Uma lamela são limpas com KOH, bem como com a solução piranha se necessário. Ele é funcionalizado com APTES e PEGuilado com NHS-éster de PEG.
"width =" 500 fig2highres.jpg "/>
Figura 2:. Câmara microfluídicos (a) A câmara de canal único. A lâmina de microscópio tem dois furos. É montado com uma lamela usando duas fatias de uma fita adesiva dupla face. (B) Uma câmara de três canais. A lâmina de microscópio tem seis furos. É montado com uma lamela usando quatro fatias de uma fita adesiva dupla face.
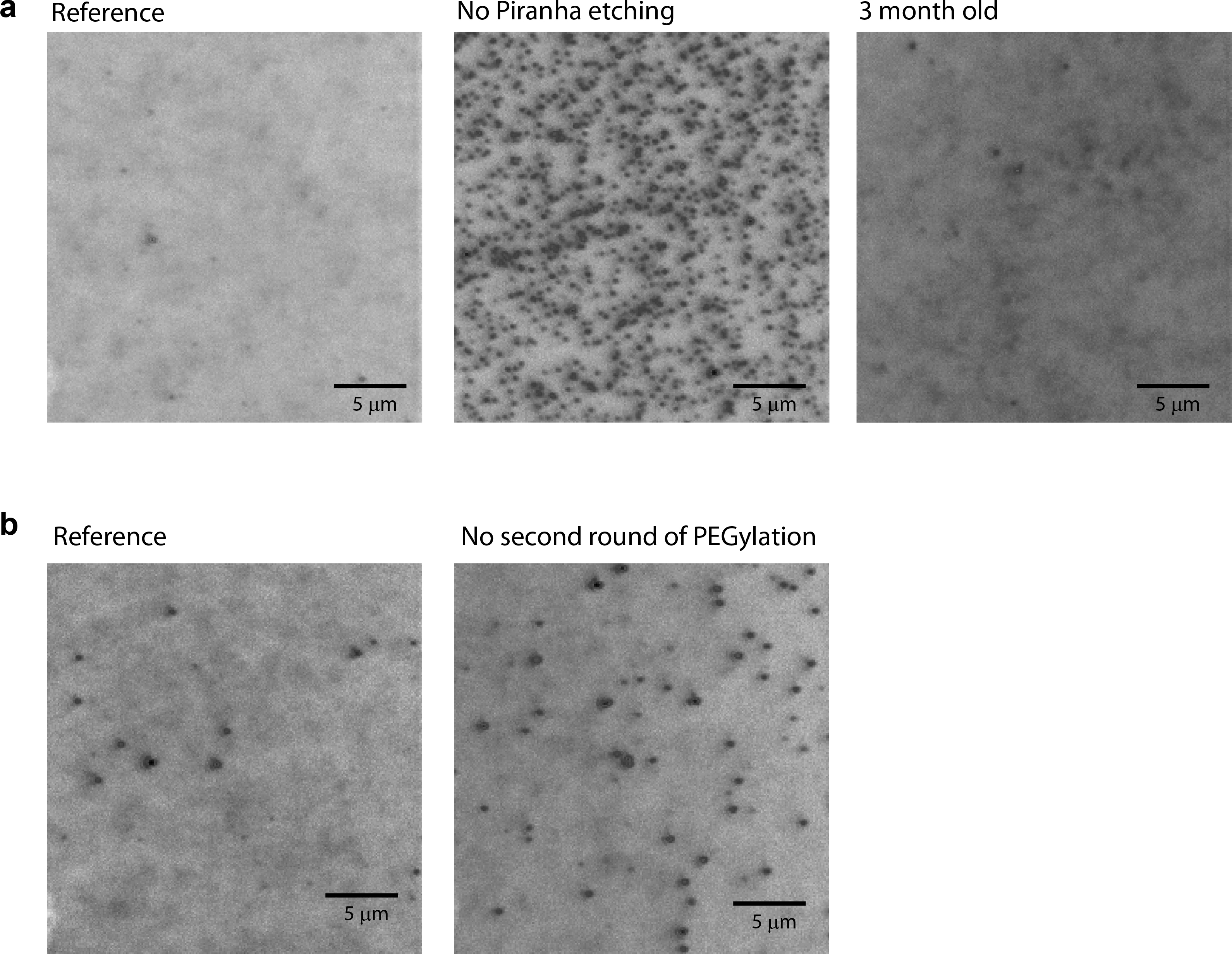
Figura 3: imagens CCD tiradas com as proteínas marcadas com corante em solução. (A) imagens CCD foram tiradas por microscopia de fluorescência total de reflexão interna do tipo prisma usando uma lente objetiva de 60X com 10 nM Cy3-labeld Rep em solução. (Esquerda) A superfície foi preparado seguindo o protocolo neste artigo. (Média) A superfície foi prepaseguindo o protocolo neste artigo vermelho, mas piranha gravura foi ignorada. (Direita) A superfície foi preparado seguindo o protocolo neste artigo e armazenados durante 3 meses a -20 ° C sob azoto. (B) imagens CCD tiradas com 10 nM Cy3-labeld Rep em solução. (Esquerda) A superfície foi preparado seguindo o protocolo neste artigo. (Direita) A superfície foi preparada seguindo o protocolo neste artigo, mas a segunda rodada de PEGylation foi ignorada. Barra de escala = 5 um.
Filme 1: filmes CCD tiradas com as proteínas marcadas com corante em solução. Filmes CCD foram tiradas por microscopia de fluorescência total de reflexão interna do tipo prisma usando uma lente objetiva de 60X com 10 nM Cy3-labeld Rep em solução. O tempo de resolução é de 100 ms. (A) A superfície foi preparado seguindo o protocolo neste artigo. (B) A superfície foi preparada seguindo o protocolo neste artigo, mas a segunda rodada de PEGylção foi ignorada. Clique aqui para ver 1a filme e clique aqui para ver 1b Filme.
Discussão
As etapas críticas dentro deste protocolo
É essencial para fazer a superfície hidrófila antes da reação amino-silanização. Isto foi conseguido através da gravura piranha que gera os grupos hidroxilo livres em uma superfície de vidro / quartzo. Recomenda-se não para manter a superfície atacada piranha expostas quer a H2O ou a ar durante um longo período de tempo desde que a hidrofilicidade da superfície diminui gradualmente.
As moléculas de éster de NHS-PEG são reactivos. Aconselha-se a fazer alíquotas e armazená-los sob azoto, em -20 º C. O prazo de validade do produto químico APTES na temperatura ambiente é curto. Aconselha-se a substituí-lo por um novo a cada mês.
Modificações deste protocolo
Quando você não pode usar a gravura piranha por qualquer motivo prático, você pode gravar usando KOH por um longo período de tempo (por exemplo, overnight), o que também vai fazer grupos hidroxilo expostos. A armadilha de esta abordagem alternativa é a de que a lâmina torna-se inutilizável depois de algumas reciclagens devido a arranhões severos.
Ele é muitas vezes praticada para queimar uma superfície de vidro / quartzo usando maçarico a gás, o qual é eficaz na eliminação de materiais orgânicos fluorescentes 7. Este procedimento não foi incluído neste protocolo, pois é redundante para o condicionamento piranha. Note-se que este procedimento irá potencialmente conduzir a oxidação dos grupos hidroxilo. Portanto, este procedimento não deve ser realizado uma vez por superfície foi gravado usando KOH ou solução piranha.
Quando um tampão com pH inferior a 7 é usado para uma única molécula de imagem, a conformação de PEG muda de "cogumelos" a "escova", o que reduz o grau de passivação. Portanto, quando o pH inferior a 7,0 é usado, é recomendável para passivar a superfície posterior utilizando tartarato de dissuccinimidilo 7.
Perspectivas
Este trabalho tem proporcionado um protocolo robusto para atingir alta qualidade de superfície de passivação. Este protocolo irá ser útil para estudos de fluorescência de moléculas individuais que estão envolvidos com as proteínas de 14, bem como complexos de proteína dentro de extractos de células e imunoprecipitados 15. Será amplamente utilizado para outras técnicas de molécula única, como a espectroscopia de força e espectroscopia de binário 16. Será também útil para prevenir a adsorção de células a partir de uma superfície 17.
O protocolo fornecido neste trabalho é exigente para os seus procedimentos de várias etapas. Passivação superficial utilizando lípido PEG-8 e de poli-lisina PEG 9 estão disponíveis como uma abordagem alternativa. Desde então, eles não precisam de qualquer reação química é fácil de implementar. No entanto, o grau de passivação não é tão elevada como a conseguida através modif químicacação de uma superfície.
Divulgações
Não temos nada a divulgar.
Agradecimentos
SDC, ACH, e CJ foram apoiados por Começando Grants (ERC-STG-2012-309509), através do Conselho Europeu de Investigação. J.-MN foi apoiado pela Fundação Nacional de Pesquisa (NRF) (2011-0018198) da Coreia; e do Programa Centro de Pesquisa Pioneer (2012-009586) através do NRF da Coréia financiado pelo Ministério da Ciência, TIC, e Planejamento Futuro (MSIP). Este trabalho também foi apoiado pelo Centro de Saúde BioNano-Guard financiado pela MSIP da Coréia como o Projeto Frontier Global (H-GUARD_2013-M3A6B2078947). YKL e J.-HH foram apoiados pelo Programa de Ciência da cidade de Seul, Coréia do Fellowship Seul. A proteína Rep rotulado foi uma generosa oferta do Dr. Suá Myong.
Materiais
| Name | Company | Catalog Number | Comments |
| 1. Slide preparation and cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coverslips | VWR | 631-0136 631-0144 631-0147 | 24 x 32 mm2, 22 x 40 mm2, 24 x 50 mm2 (No.1½, Rectangular) |
| Diamond drill bits | MTN-Giethoorn, The Netherlands | LA-0564-00DB | 3/4 mm |
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| Glass staining dishes | Fisher Scientific | 300101 | |
| H2O2 | Boom | 6233905 | 1 L, hydrogen peroxide 30%. Opened bottles should be stored at 4 °C. |
| H2SO4 | Boom | 80900627.9010 | Sulfuric acid 95-98% |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| Quartz slides | Finkenbeiner | 1” x 3”, 1 mm thick | |
| 2. Coverslip cleaning | |||
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 3. Amino-silanization of slides and coverslips | |||
| Acetic acid | Sigma | 320099-500ML | Acetic acid, glacial |
| APTES | Sigma-Aldrich | 281778-100ML | 3-aminopropyl trimethoxysilane. Store at the room temperature under N2. Replace once in a month. |
| Flask (200 ml) | VWR | Flask (200 ml) | Pyrex flask. Have one flask dedicated for aminosilanization. |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 4. Surface passivation using polymer (the first round) | |||
| Biotin-mPEG | Laysan Bio | Biotin-PEG-SVA-5000-100mg | Biotin-PEG-SVA, MW 5,000 Da. Store aliquots of 1-2 mg (enough for 10 slides) at -20 °C under N2. |
| mPEG | Laysan Bio | MPEG-SVA-5000-1g | mPEG-succinimidyl valerate (SVA), MW 5,000 Da. Store aliquots of 80 mg (enough for 10 slides) at -20 °C under N2. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 5. Surface passivation (the second round) | |||
| DMSO | Sigma-Aldrich | D8418-100ML | Dimethyl sulfoxide BioReagent, for molecular biology, ≥99.9% |
| DST | Pierce | 20589 | Disuccinimidyl tartarate |
| MS4-PEG | Pierce | 22341 | Short NHS-ester PEG, MW 333 Da. Dissolve 100 mg MS4-PEG in 1.1 ml DMSO. Store 20 µl aliquots at -20 °C. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 6. Assembling a microfluidic chamber | |||
| Double sticky tape | Scotch | 10 mm wide | |
| Epoxy | Thorlabs | G14250 | Devcon 5 minute epoxy |
| NaCl | Sigma-Aldrich | S9888-1 KG | Sodium chloride |
| Neutravidin | Pierce | 31000 | ImmunoPure NeutrAvidin Biotin-Binding protein. Stock in 5 mg/ml in H2O at 4 °C. |
| Streptavidin | Invitrogen | S-888 | Stock 5 mg/ml in H2O or T50 at 4 °C. |
| Trizma base | Sigma-Aldrich | T1503-1 KG | Tris |
Referências
- Rasnik, I., McKinney, S. A., Ha, T. Surfaces and orientations: much to FRET about. Acc Chem Res. 38 (7), 542-548 (2005).
- Lamichhane, R., Solem, A., Black, W., Rueda, D. Single-molecule FRET of protein-nucleic acid and protein-protein complexes: surface passivation and immobilization. Methods. 52 (2), 192-200 (2010).
- Di Fiori, N., Meller, A. Automated system for single molecule fluorescence measurements of surface-immobilized biomolecules. J Vis Exp. (33), 1542-1510 (2009).
- Kingshott, P., Griesser, H. J. Surface that resist biodegradation. Curr Opin Solid St M. 4 (4), 403-412 (1999).
- Elbert, D. L., Hubbell, J. A. Surface treatments of polymers for biocompatibility. Annu Rev Mater Sci. 26, 365-394 (1996).
- Zalipsky, S., Preface Harris, J. M. . Poly(theylene glycol). , 11-12 (1997).
- Selvin, P. R., Ha, T. . Single-Molecule Techniques: A Laboratory Manual. , (2007).
- Finkelstein, I. J., Greene, E. C. Supported lipid bilayers and DNA curtains for high-throughput single-molecule studies. Methods Mol Biol. 745, 447-461 (2011).
- Kenausis, G. L., et al. Poly(L-lysine)-g-Poly(ethylene glycol) layers on metal oxide surfaces: attachment mechanism and effects of polymer architecture on resistance to protein adsorption. J Phys Chem B. 104 (14), 3298-3309 (2000).
- Groll, J., Star Moeller, M. polymer surface passivation for single-molecule detection. Method Enzymol. 472, 1-18 (2010).
- Bahmani, B., Gupta, S., Upadhyayula, S., Vullev, V. I., Anvari, B. Effect of polyethylene glycol coatings of uptake of indocyanine green loaded nanocapsules by human spleen macrophages in vitro. J Biomed Opt. 16 (5), (2011).
- Kulczyk, A. W., Tanner, N. A., Loparo, J. J., Richardson, C. C., van Oijen, A. M. Direct observation of enzymes replicating DNA using a single-molecule DNA stretching assay. J Vis Exp. (37), e1689 (2010).
- Upadhyayula, S., et al. Coatings of polyethylene glycol for suppressing adhesion between solid microspheres and flat surfaces. Langmuir. 28 (11), 5059-5069 (2012).
- Dulin, D., Lipfert, J., Moolman, M. C., Dekker, N. H. Studying genomic processes at the single-molecule level: introducing the tools and applications. Nat Rev Genet. 14, 9-22 (2012).
- Joo, C., Fareh, M., Narry Kim, V. Bringing single-molecule spectroscopy to macromolecular protein complexes. Trends Biochem Sci. 38 (1), 30-37 (2012).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505 (2008).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318, 426-430 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados