Method Article
Passivazione della superficie per singola molecola proteica Studi
In questo articolo
Riepilogo
Noi descriviamo un metodo per la passivazione una superficie di vetro con polietilenglicole (PEG). Questo protocollo copre pulizia delle superfici, funzionalizzazione superficiale, e rivestimento PEG. Introduciamo una nuova strategia per il trattamento della superficie con molecole di PEG su due turni, che produce una qualità superiore di passivazione rispetto ai metodi esistenti.
Abstract
Spettroscopia di fluorescenza singola molecola ha dimostrato di essere determinante nella comprensione di una vasta gamma di fenomeni biologici su scala nanometrica. Importanti esempi di ciò che questa tecnica può cedere alle scienze biologiche sono gli approfondimenti meccanicistici sulla proteina-proteina e le interazioni proteina-acido nucleico. Quando interazioni di proteine vengono sondati a livello di singola molecola, le proteine oi loro substrati sono spesso immobilizzate su una superficie di vetro, che consente una osservazione a lungo termine. Questo schema immobilizzazione può introdurre artefatti indesiderati di superficie. Pertanto, è essenziale passivazione della superficie di vetro per renderlo inerte. Rivestimento di superficie utilizzando polietilene glicole (PEG) si distingue per le sue alte prestazioni nella prevenzione proteine da non specificamente interagendo con una superficie di vetro. Tuttavia, la procedura di rivestimento polimerico è difficile, a causa della complicazione derivante da una serie di trattamenti superficiali e il requisito stringente che una superficie deveessere esente da qualsiasi molecole fluorescenti alla fine della procedura. Qui, forniamo un protocollo robusto con passo-passo le istruzioni. Si estende la pulizia di superfici tra cui piranha incisione, funzionalizzazione superficiale con gruppi amminici, e infine il rivestimento PEG. Per ottenere una elevata densità di uno strato PEG, si introduce una nuova strategia di trattamento della superficie con molecole di PEG su due turni, che migliora notevolmente la qualità di passivazione. Forniamo risultati rappresentativi, nonché consigli pratici per ogni fase critica in modo che chiunque possa raggiungere la passivazione della superficie di alta qualità.
Introduzione
Quando si esegue uno studio proteina a singola molecola è essenziale per ottenere una elevata qualità di passivazione della superficie in modo che l'esperimento è libero da qualsiasi malfunzionamento proteina-superficie indotta o denaturazione 1,2. Mentre una superficie di vetro trattata con tensioattivi, come albumina di siero bovino, è comunemente utilizzato per studi di acido nucleico a singola molecola 3, il suo grado di passivazione non è sufficientemente elevata per gli studi di proteine. Una superficie di vetro rivestito con polimero (polietilene glicole, PEG) è superiore al 4-6 prestazioni passivazione. In tal modo, è diventato universalmente usato per gli studi di proteine singola molecola da quando è stato introdotto in uno studio di fluorescenza singola molecola 7-10. La procedura di rivestimento in polimero richiede più trattamenti superficiali 7,11,12. Pertanto, è difficile seguire l'intera procedura senza istruzioni dettagliate. Spesso il grado di passivazione superficiale varia a seconda del protocollo Is seguirono. Qui vi presentiamo un protocollo robusto con passo-passo le istruzioni, che rimuovere uno dei principali colli di bottiglia degli studi di proteine singola molecola. Vedere la Figura 1 per una panoramica.
Protocollo
1. Scorrere Preparazione e pulizia
Una camera di microfluidica è composto di una diapositiva quarzo e un coprioggetto. In prisma di tipo a riflessione totale interna fluorescenza (TIRF) microscopia, la superficie del vetrino di quarzo viene esposta. Pertanto, è importante pulire una diapositiva quarzo accuratamente con H 2 O, acetone, KOH, e soluzioni Piranha. Th è pulizia multi-step elimina molecole organiche fluorescenti su una superficie che interferiscono con le singole misure di fluorescenza della molecola. Inoltre, l'attacco piranha rende la superficie idrofila quarzo generando gruppi idrossilici. I gruppi idrossilici liberi sono essenziali per la reazione ammino-silanizzazione nel passaggio 3.
- Diapositive quarzo Drilling. Praticare un paio di fori in una diapositiva quarzo con un bit 3/4 mm punta di diamante (Figura 2a). Se si desiderano più canali, forare più pairs di fori (Figura 2b). Questi fori servono per iniettare soluzioni in una camera microfluidica nel passaggio 7.
- Mantenere la punta bagnata in H 2 O durante la perforazione. H 2 O esegue come lubrificante, che aumenta la durata della punta.
- Occasionali asciugandosi la punta del trapano aiuta fori.
- Dopo fori, segnare un lato del vetrino per una facile identificazione durante il processo di PEGylation. I marcatori possono essere utilizzati come riferimento per evitare confusione in seguito. Per la marcatura, una punta di diamante può essere utilizzato. Non utilizzare la penna in quanto l'inchiostro potrebbe ottenere sulla superficie.
- Pulizia con H 2 O. Porre i vetrini in una vaschetta di colorazione di vetro. Tipicamente 5 a 15 vetrini possono essere collocati in un singolo barattolo. Sciacquare i vetrini con MilliQ H 2 O. Ripetere 3 volte e sonicare i vetrini con MilliQ H 2 O per 5 minuti per rimuovere lo sporco. Smaltire l'acqua e sciacquare gli scivoli di nuovo 3 volte conMilliQ H 2 O. Si noti che 130 W è la potenza sonicazione utilizzato per questo protocollo. Potenza sonicazione superiore potrebbe diminuire la durata delle diapositive di quarzo.
- Pulizia con acetone. Sostituire il MilliQ H 2 O con acetone. Sonicare i vetrini con acetone per 20 minuti o più.
- Risciacquo con H 2 O. Eliminare il acetone e lavare i vetrini con MilliQ H 2 O. Ripetere per 3 volte per rimuovere eventuali residui di acetone.
- Pulizia con KOH. Sostituire l'acqua con 1 M KOH e sonicare le diapositive per 20 minuti o più a lungo. Incisione eccessivo (ad esempio di notte trattamento KOH) migliorerà la qualità della superficie, ma introdurrà graffi, che potrebbero interferire con fluorescenza.
- Risciacquo con H 2 O. Risciacquare i vetrini con MilliQ H 2 O per 3 volte per rimuovere tracce di KOH.
- Piranha incisione.
- Trasferire i vetrini in un portavetrini Duran o un titolare di Teflon misura e plli ace in un becher (1 L) che si trova in una cappa chimica.
- Riempire il bicchiere con 450 ml di H 2 SO 4.
- Aggiungere 150 ml di H 2 O 2 in rapporto 3:1 tra H 2 SO 4 e H 2 O 2. Una volta che la soluzione inizia a bollire spontaneamente, la temperatura aumenta oltre 90 ° C. Assicurarsi che la soluzione di H 2 O 2 è a temperatura ambiente prima di iniziare la reazione. In caso contrario, la temperatura di ebollizione della soluzione può essere inferiore a 90 ° C.
- Agitare la soluzione per una corretta miscelazione e lasciare il becher indisturbato per 20 min.
- Prendete le diapositive dalla soluzione piranha insieme con il supporto per diapositive, e metterli in un supporto diapositiva contenente MilliQ H 2 O. Nel frattempo, scartare la soluzione piranha in una bottiglia di scarico designata, una volta raggiunta la temperatura ambiente.
- Risciacquare i vetrini 3 volte con MilliQ H 2 O. La cura supplementare dovrebbe essere presa in ulteriore steps per evitare ogni possibile contaminazione dei vetrini. Continua al punto 3. Si consiglia di procedere immediatamente con le seguenti operazioni.
* Attenzione: La soluzione piranha è estremamente reattivo. Quando si maneggia questa soluzione estrema cautela dovrebbe essere presa. Inoltre, quando per errore miscelato con solventi organici come acetone, può causare esplosioni.
2. Pulizia Coverslip
Una camera di microfluidica è composto di una diapositiva quarzo e un labbro coperchio s. Quando viene usato un microscopio TIRF prisma-tipo, la superficie di un vetrino non viene esposta. Pertanto, è sufficiente pulire un coprioggetto solo con H 2 O e KOH. Nel caso un coprioggetto deve essere ripreso (ad esempio attraverso l'obiettivo di tipo microscopia TIRF), si raccomanda di trattare i coprioggetti con soluzione Piranha (Passo 1.7). Si noti che se PEGylation della superficie coprioggetto non è di alta qualità, potrebbe agire come un dissipatore di proteine per und dar luogo a variazioni della concentrazione proteica.
- Risciacquo con H 2 O. Inserire coprioggetto (24 x 30, 24 x 40 o 24 x 50 mm 2) in una vaschetta di colorazione vetro. Tipicamente 5 a 15 coprioggetto può essere collocato in un vaso singolo. Lavare i coprioggetti 3 volte con il MilliQ H 2 O.
- Pulizia con KOH. Sostituire l'acqua con KOH 1M e sonicare le lamelle per 20 minuti o più a lungo.
- Risciacquo con H 2 O. Lavare i coprioggetti 3 volte con MilliQ H 2 O per rimuovere tracce di KOH. Passare alla fase 3.
3. Amino-silanizzazione di diapositive e Coprivetrini
Funzionalizzazione della superficie dei vetrini quarzo e il coprioggetto con gruppo amminico tramite la chimica ammino-silanizzazione. Il metanolo viene usato come solvente e acido acetico come catalizzatore per la reazione ammino-silanizzazione.
- Risciacquo con metanolo. Sostituire il MilliQ H 2 O nei piatti di colorazione (da SPTO 1 e 2) con metanolo. Mantenere le diapositive e le coprioggetto in metanolo fino al punto 3.3. Non conservare i vetrini e coprioggetto in metanolo per un inutilmente lungo periodo di tempo (ad esempio alcune ore) da impurezze in metanolo adsorbire alla superficie.
- Preparare una soluzione amino-silanizzazione.
- Risciacquare una beuta Pyrex più volte con metanolo. Sonicare il pallone con metanolo per 5 minuti o più. Si consiglia di avere un pallone dedicato che viene mantenuta pulita.
- Versare 100 ml di metanolo nel pallone.
- Aggiungere 5 ml di acido acetico.
- Aggiungere 3 ml di APTES (3 amminopropil trimetossisilano) e mescolare delicatamente agitandolo.
- Amino-silanizzazione. Sostituire il metanolo nei piatti di colorazione che contengono le diapositive e il coprioggetto con la miscela di reazione aminosilanization.
- Incubare per 20-30 min. Durante l'incubazione, sonicare volta per 1 min.
- Risciacquo con metanolo. Sostituire l'unareazione minosilanization con metanolo. Eliminare il metanolo e aggiungere una soluzione di metanolo fresco. Ripetere questa procedura per tre volte.
4. Passivazione della superficie Uso Polymer (al primo turno)
Passivazione della superficie ammina rivestita di diapositive di quarzo e coprioggetto coniugando NHS-estere polietilene glicole (PEG). Questa reazione viene condotta con la concentrazione di saturazione della soluzione di PEG a pH 8.5 notte.
- Asciugatura diapositive e lamelle. Asciugare le diapositive e le coprioggetti con N 2 gas e metterli in scatole pipetta puliti in modo tale che il lato che deve essere PEGylated è rivolto verso l'alto. La scatola pipetta è parzialmente riempita con MilliQ H 2 O. Questo ambiente umido impedisce soluzione PEGylation si secchi durante la notte di incubazione.
- Preparazione del tampone di reazione. Preparare 0,1 M di tampone fresco bicarbonato di sodio (pH 8,5) sciogliendo 84 mg di bicarbonato di sodio in 10 ml diMilliQ H 2 O. Non c'è bisogno di regolazione del pH. Questa soluzione può essere conservata congelata per l'uso successivo (ad es Fase 6.1).
- Preparazione soluzione PEGylation.
- Preparare una miscela di 0,2 mg PEG biotinilato NHS-estere PEG (5.000 Da) 13 e 8 mg di NHS-estere mPEG (5.000 Da) in una provetta da 1,5 ml. Nel preparare numero N di diapositive, preparare N volte più grande quantità della miscela PEG in un unico tubo.
- Aggiungere 64 ml (o N volte 64 microlitri per numero N di diapositive) del buffer appena preparato (punto 4.2). Pipettare su e giù per sciogliere completamente.
- Centrifuga con 16.100 xg per 1 minuto per eliminare le bolle d'aria. Non pipettare dopo. In caso contrario, le bolle d'aria si formano che interferiscono con PEGylation al punto 4.4.
- PEGylation.
- Goccia 70 ml di miscela PEGylation a una diapositiva quarzo essiccata dal punto 4.1. Utilizzare 90 ml nel caso di 24 x 50 mm 2 coverslip.
- Inserire delicatamente un vetrino asciugato dal punto 4.1 sopra la soluzione.
- Per avere un uniforme e di alta qualità di PEGylation, fare attenzione a non introdurre bolle d'aria. A causa di tensione superficiale, la maggior parte delle bolle d'aria possono spontaneamente lasciare il volume di reazione entro cinque minuti a causa della tensione superficiale.
- Incubare i vetrini in un ambiente buio e umido. L'emivita di NHS-estere PEG che usiamo a pH 8 è circa un'ora. Come minimo, li incubare per 2 ore. Notte di incubazione porta alla più elevata qualità di PEGylation (dati non mostrati).
5. Conservazione a lungo termine
Memorizzazione delle diapositive pegilato e coprioggetto in N 2 a -20 ° C.
- Asciugatura diapositive e lamelle. Disassemblare con cura il vetrino ed il coprioggetto facendo scorrere il vetrino ad un lato, sciacquare con MilliQ H 2 O, e asciugarle con N 2.
- Memorizzazione di diapositive e lamelle. For uso immediato, seguire la procedura per il secondo turno di PEGylation (punto 6). Al fine di conservare per un periodo di tempo più lungo, seguire i passi successivi.
- Posizionare una coppia del vetrino e coprioggetto in un tubo da 50 ml tale che le superfici siano rivolti PEGilate distanti.
- Parzialmente chiudere il tubo, aspirare il tubo, e poi riempirlo con N 2. Questi passaggi aiutano preservare la superficie PEGylated per un lungo periodo di tempo. Avvitare il tubo ermeticamente e conservarlo a -20 ° C. La qualità delle diapositive rimane buona per 3 mesi (Figura 3a, destra).
6. Passivazione della superficie Uso Polymer (secondo turno)
Ulteriori giro di PEGylation per rendere lo strato più denso PEG e anche per estinguere eventuali gruppi amminici rimanenti sulla superficie. L'uso di brevi molecole NHS-estere PEG (333 Da) può essere efficace a penetrare in uno strato PEG esistente. E 'recmanda di fare questo secondo round di PEGylation destra prima di utilizzare una diapositiva.
- Preparazione del tampone di reazione. Preparare 0,1 M di tampone fresco bicarbonato di sodio (pH 8,5). La soluzione congelata dal punto 4.2 può anche essere usato.
- Preparazione soluzione PEGylation. Sciogliere 7 ml di 250 mM MS4-PEG in 63 ml di tampone bicarbonato di sodio.
- PEGylation. Seguire la stessa procedura della Fase 4.4. Incubare per 30 min fino a tutta la notte.
- Asciugatura diapositive e lamelle. Smontare la coppia di slitta e il vetrino, sciacquare con MilliQ H 2 O, asciugarle con N 2, e tenerli in una scatola pipetta pulita. Procedere per l'assemblaggio di una camera di microfluidica al punto 7.
7. Assemblare una sezione Microfluidic
Assemblare una camera microfluidica utilizzando una coppia di quarzo diapositiva PEGylated e un copri. Nastro biadesivo appiccicoso viene utilizzato come spaziatore. La camera è sigillata con colla epossidica e, cosìluzioni vengono introdotte attraverso i fori della diapositiva quarzo.
- Posizionare un vetrino di quarzo su una superficie piana con il lato PEGylated rivolto verso l'alto.
- Effettuare un canale (larghezza 5 a 7 mm) in diagonale sulla superficie PEGylated mettendo nastri biadesivi appiccicose sul vetrino. Assicurarsi che i fori sono posizionati al centro del canale. Fare attenzione a non rovinare la superficie PEGylated durante il processo di creazione di una camera. E 'possibile effettuare una diapositiva multi-canale, inserendo e attaccare i nastri biadesivi appiccicose diverso (vedere Figura 2).
- Posizionare delicatamente un coprioggetto PEGylated sulla parte superiore per completare la stanza. Il lato PEGylated deve essere rivolto verso il basso.
- Sigillare la camera premendo il vetrino sopra la zona dove si trovano i nastri su due lati. Fatelo delicatamente, ma accuratamente in modo che la camera diventa acqua ermeticamente chiusi.
- Chiudere i bordi della camera con colla epossidica.
- Immobilizzare Streptavidina o neutravidina sulPEG biotinilato strato aggiungendo 50 ml di 0,1 mg / ml di soluzione di streptavidina o NeutrAvidin a T50 (10 mM Tris-HCl [pH8.0], 50 mM tampone NaCl) usando una pipetta p200. Dopo 1 min di incubazione, lavare con 100 microlitri di tampone T50.
- Aggiungi molecole biologiche biotinilati per la vostra rappresentazione singola molecola.
8. Scorrere Recycling
Riciclaggio diapositive quarzo. Vetrini usati sono riciclati togliendo i coprioggetti e nastri a doppia faccia appiccicoso.
- Dopo l'uso, conservare le camere in acqua di rubinetto. Incubazione lungo termine in acqua facilita lo smontaggio delle camere.
- Lessare le camere in acqua di rubinetto utilizzando un forno a microonde. Utilizzare un bicchiere Pyrex. Bollire per 10 minuti o più.
- Togliere i coprioggetti e nastri a doppia faccia appiccicose con una lama di rasoio. Non premere una diapositiva quarzo perpendicolare al suo piano. In caso contrario, si rompe. Mantenere la lametta dal canale. Otherwise, introduce graffi sul canale.
- Sciacquare i vetrini utilizzando un detergente per uso domestico da sfregamento con le dita.
- Porre i vetrini in una vaschetta di colorazione di vetro. Tipicamente 5 a 15 vetrini possono essere collocati in un singolo barattolo. Aggiungere 10% detergenti per la casa e sonicare le diapositive per 20 minuti o più a lungo. Sciacquare i vetrini con una grande quantità di acqua tab.
- Passare al punto 1.2.
Risultati
Dopo il montaggio della camera microfluidica (Passo 7,1-7,6) e prima di effettuare Passo 7.7, si consiglia di effettuare il controllo di qualità della superficie PEGylated.
Se la passivazione della superficie è stato fatto con successo, ci sono meno di 10 non specificamente adsorbite proteine per area di esposizione (25 mm x 25 mm) osservata quando 1-10 nM proteina fluorescente viene aggiunto nella camera (figura 3a, sinistra).
Quando una qualsiasi delle fasi di pulizia o di reazione non è stata correttamente effettuata, il numero di non-specifico proteine assorbito aumenta in modo significativo, e lo schermo CCD può essere saturo di segnali di fluorescenza. Ad esempio, se l'incisione piranha viene saltato, vi è 100 volte maggiore quantità di adsorbimento non specifico osservato (Figura 3a; confronta sinistra con mezzo). Quando il secondo passo PEGylation viene saltato, c'era circa 3 temposa grande quantità di adsorbimento non specifico osservato (Figura 3b). Un basso grado di PEGylation si osserva quando vengono utilizzati prodotti chimici scaduti (ad esempio APTES conservati a temperatura ambiente per diversi mesi) (dati non riportati). La qualità della superficie scende giù quando anche una notevole quantità di tempo è passato da quando era PEGylated (Figura 3a; confronta sinistra con destra).
Per la nostra migliore conoscenza, è la prima volta che vengono introdotti i due turni di PEGylation per gli studi di singola molecola. I due turni di PEGylation garantiscono la più alta qualità di PEG strato formazione (Figura 3b). La natura superiore del doppio PEGylation è ben visibile mostrato nei film (Confronta Movie 1a con Movie 1b). In questi film, i segnali di fondo da molecole fluorescenti in soluzione sono osservate per essere molto più debole quando il doppio PEGylation era utilizzati, il che indica che le proteine sono respinti più efficacemente dallo strato doppiamente pegilato. Anche se questo processo in due fasi è fortemente consigliata, la seconda fase PEGylation potrebbe essere saltato se l'esperimento è tollerabile di passivazione non ottimale.
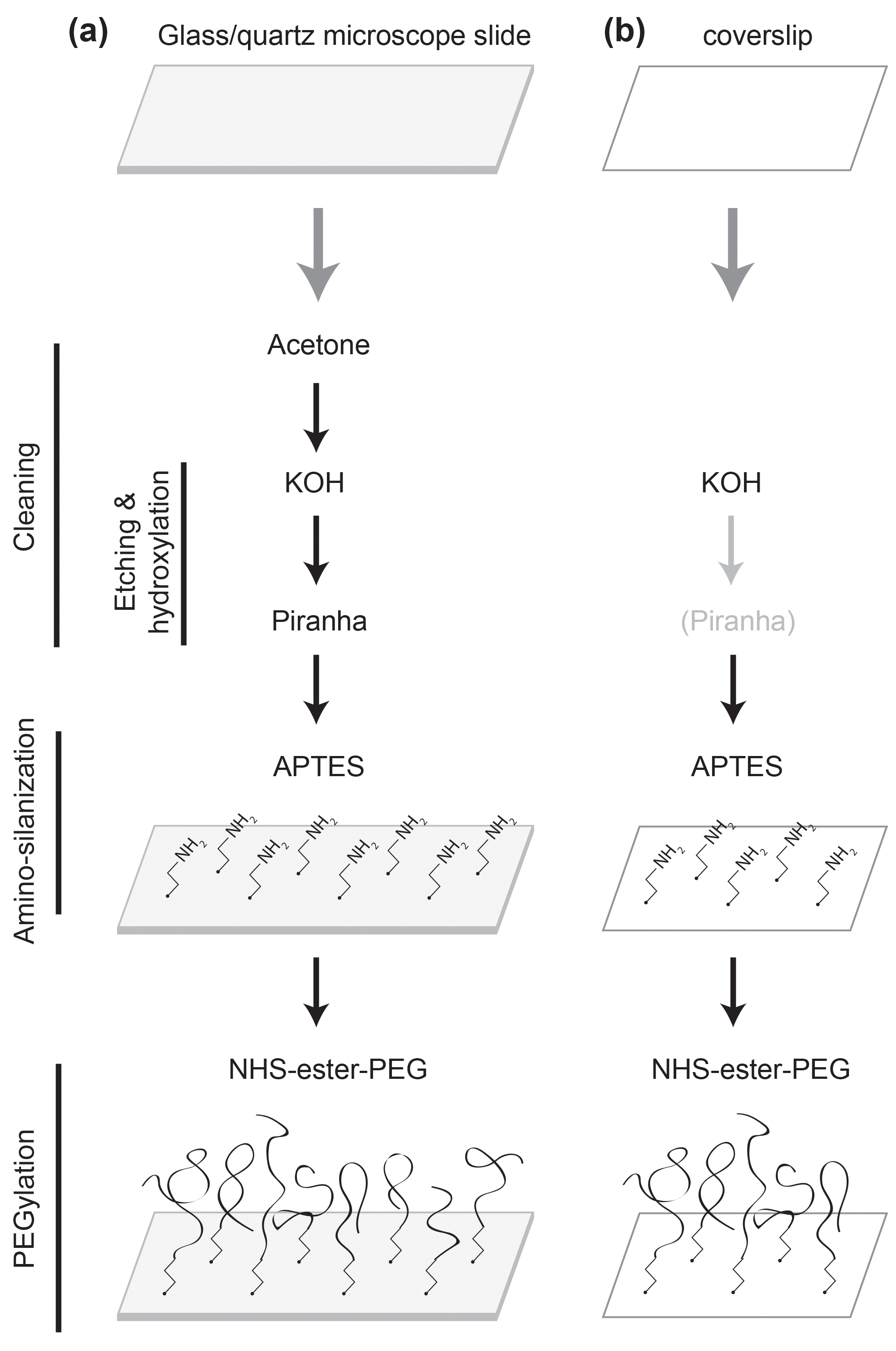
Figura 1:. Schematica dei trattamenti superficiali (a) Un vetrino viene pulita con acetone, KOH, e soluzioni Piranha. Si è funzionalizzato con APTES e PEGylated con NHS-estere PEG. (B) Un vetrino viene pulita con KOH, nonché con la soluzione Piranha se necessario. Si è funzionalizzato con APTES e PEGylated con NHS-estere PEG.
fig2highres.jpg "width =" 500 "/>
Figura 2:. Camera microfluidica (a) Una camera monocanale. Il vetrino da microscopio ha due fori. Si è assemblato con un vetrino coprioggetto utilizzando due fette di un nastro adesivo a doppia faccia. (B) Una camera a tre canali. Il vetrino da microscopio ha sei fori. Si è assemblato con un vetrino coprioggetto utilizzando quattro fette di un nastro adesivo a doppia faccia.
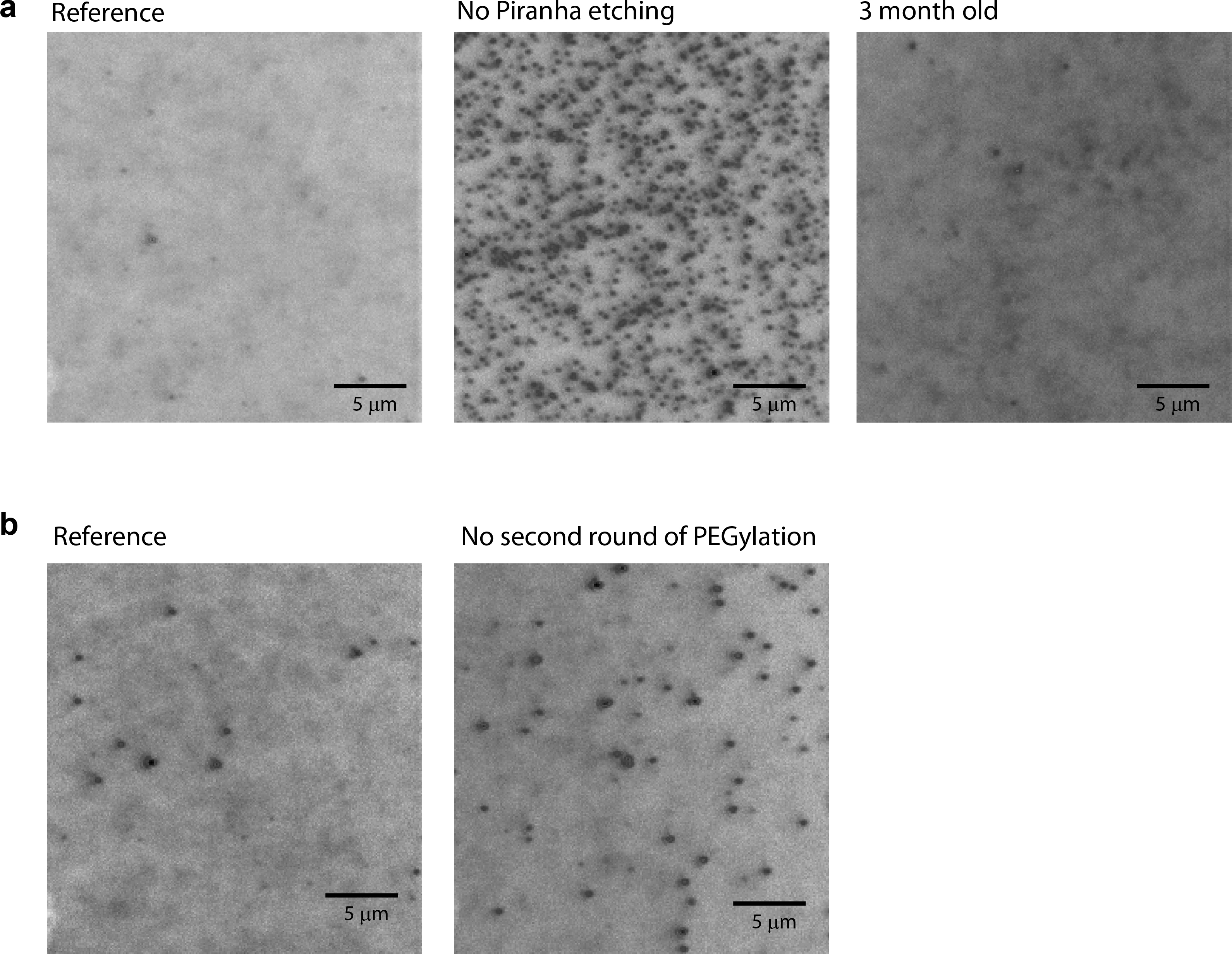
Figura 3: immagini CCD prese con le proteine dye-marcato in soluzione. (A) immagini CCD sono stati presi dai prisma-tipo microscopia riflessione interna totale fluorescenza utilizzando una lente obiettivo 60X con 10 nM Cy3-labeld Rep in soluzione. (Sinistra) Una superficie è stata preparata seguendo il protocollo in questo articolo. (Middle) Una superficie era preparazionerosso secondo il protocollo in questo articolo, ma piranha attacco è stato ignorato. (A destra) Una superficie è stata preparata seguendo il protocollo in questo articolo e conservato per 3 mesi a -20 ° C sotto azoto. (B) immagini CCD scattate con 10 nM Cy3-labeld Rep in soluzione. (Sinistra) Una superficie è stata preparata seguendo il protocollo in questo articolo. (A destra) Una superficie è stata preparata seguendo il protocollo in questo articolo, ma il secondo turno di PEGylation stato saltato. Barra della scala = 5 micron.
Movie 1: film CCD prese con le proteine dye-marcato in soluzione. Film CCD sono state prese da prisma-tipo microscopia a riflessione interna totale in fluorescenza utilizzando una lente obiettivo 60X con 10 nM Cy3-labeld Rep in soluzione. La risoluzione temporale è di 100 msec. (A) Una superficie è stata preparata seguendo il protocollo in questo articolo. (B) Una superficie è stata preparata seguendo il protocollo in questo articolo, ma il secondo turno di PEGylzione è stato saltato. Clicca qui per vedere un film 1a e clicca qui per vedere un film 1b.
Discussione
Passaggi critici all'interno di questo protocollo
È essenziale per rendere idrofila la superficie prima della reazione ammino-silanizzazione. Ciò è stato ottenuto attraverso l'incisione piranha che genera i gruppi idrossilici liberi su una superficie di vetro / quarzo. Si raccomanda di non tenere la superficie incisa Piranha esposti sia H 2 O o aria per un lungo periodo di tempo da quando l'idrofilia della superficie scende gradualmente.
Le molecole NHS-estere PEG sono reattivi. Si consiglia di effettuare aliquote e memorizzarli sotto azoto a -20 º C. La durata della sostanza chimica APTES a temperatura ambiente è breve. Si consiglia di sostituirlo con uno nuovo ogni mese.
Modifiche di questo protocollo
Quando non è possibile utilizzare l'attacco piranha per qualsiasi ragione pratica, si può incidere con KOH per un lungo periodo di tempo (ad esempio, overnight), che farà anche gruppi ossidrile esposti. L'insidia di questo approccio alternativo è che la diapositiva diventa inutilizzabile dopo un paio di ricicli a causa di gravi graffi.
Essa è spesso praticata per bruciare una superficie di vetro / quarzo utilizzando propano torcia, che è efficace per eliminare materiali organici fluorescenti 7. Questa procedura non è stata inclusa in questo protocollo perché è ridondante l'incisione piranha. Si noti che questa procedura potenzialmente causare l'ossidazione dei gruppi ossidrilici. Pertanto, questa procedura non deve essere eseguita una volta una superficie è stato inciso con KOH o soluzione Piranha.
Quando un tampone con pH inferiore a 7 è utilizzata per l'imaging singola molecola, la conformazione di PEG cambia da "fungo" a "pennello", che riduce il grado di passivazione. Pertanto, quando si utilizza pH inferiore a 7,0, si raccomanda di passivazione ulteriormente la superficie usando Disuccinimidil tartrato 7.
Prospettive
Questo lavoro ha fornito un protocollo robusto per ottenere un'elevata qualità passivazione della superficie. Questo protocollo sarà utile per studi di fluorescenza singola molecola che sono coinvolti con le proteine 14, nonché i complessi proteici all'interno di estratti cellulari e immunoprecipita 15. Sarà ampiamente utilizzato per altre tecniche di singola molecola come la spettroscopia di forza e spettroscopia di coppia 16. Sarà utile anche per evitare cellule da adsorbire ad una superficie 17.
Il protocollo previsto in questo lavoro è impegnativo per le procedure multi-step. Passivazione della superficie utilizzando lipidi PEG-8 e poli-lisina PEG 9 è disponibile come un approccio alternativo. Dal momento che, non richiedono reazioni chimiche è facile da implementare. Tuttavia, il grado di passivazione non è così elevata come quella conseguita attraverso modif chimicaicazione di una superficie.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
SDC, ACH, e CJ sono stati sostenuti da Starting Grants (ERC-STG-2012-309509) attraverso il Consiglio europeo della ricerca. J.-MN è stato sostenuto dal National Research Foundation (NRF) (2011-0018198) della Corea; e il Programma Pioneer Research Center (2012-009586) attraverso la NRF della Corea finanziato dal Ministero della Scienza, ICT e futuro Planning (MSIP). Questo lavoro è stato supportato anche dal Centro per BioNano Salute-Guard finanziato dalla MSIP della Corea come Frontier Global Project (H-GUARD_2013-M3A6B2078947). YKL e J.-HH sono stati sostenuti dal Seoul Science Fellowship Program della città di Seoul, Corea. La proteina Rep etichettato era un dono generoso del Dr. Sua Myong.
Materiali
| Name | Company | Catalog Number | Comments |
| 1. Slide preparation and cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coverslips | VWR | 631-0136 631-0144 631-0147 | 24 x 32 mm2, 22 x 40 mm2, 24 x 50 mm2 (No.1½, Rectangular) |
| Diamond drill bits | MTN-Giethoorn, The Netherlands | LA-0564-00DB | 3/4 mm |
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| Glass staining dishes | Fisher Scientific | 300101 | |
| H2O2 | Boom | 6233905 | 1 L, hydrogen peroxide 30%. Opened bottles should be stored at 4 °C. |
| H2SO4 | Boom | 80900627.9010 | Sulfuric acid 95-98% |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| Quartz slides | Finkenbeiner | 1” x 3”, 1 mm thick | |
| 2. Coverslip cleaning | |||
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 3. Amino-silanization of slides and coverslips | |||
| Acetic acid | Sigma | 320099-500ML | Acetic acid, glacial |
| APTES | Sigma-Aldrich | 281778-100ML | 3-aminopropyl trimethoxysilane. Store at the room temperature under N2. Replace once in a month. |
| Flask (200 ml) | VWR | Flask (200 ml) | Pyrex flask. Have one flask dedicated for aminosilanization. |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 4. Surface passivation using polymer (the first round) | |||
| Biotin-mPEG | Laysan Bio | Biotin-PEG-SVA-5000-100mg | Biotin-PEG-SVA, MW 5,000 Da. Store aliquots of 1-2 mg (enough for 10 slides) at -20 °C under N2. |
| mPEG | Laysan Bio | MPEG-SVA-5000-1g | mPEG-succinimidyl valerate (SVA), MW 5,000 Da. Store aliquots of 80 mg (enough for 10 slides) at -20 °C under N2. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 5. Surface passivation (the second round) | |||
| DMSO | Sigma-Aldrich | D8418-100ML | Dimethyl sulfoxide BioReagent, for molecular biology, ≥99.9% |
| DST | Pierce | 20589 | Disuccinimidyl tartarate |
| MS4-PEG | Pierce | 22341 | Short NHS-ester PEG, MW 333 Da. Dissolve 100 mg MS4-PEG in 1.1 ml DMSO. Store 20 µl aliquots at -20 °C. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 6. Assembling a microfluidic chamber | |||
| Double sticky tape | Scotch | 10 mm wide | |
| Epoxy | Thorlabs | G14250 | Devcon 5 minute epoxy |
| NaCl | Sigma-Aldrich | S9888-1 KG | Sodium chloride |
| Neutravidin | Pierce | 31000 | ImmunoPure NeutrAvidin Biotin-Binding protein. Stock in 5 mg/ml in H2O at 4 °C. |
| Streptavidin | Invitrogen | S-888 | Stock 5 mg/ml in H2O or T50 at 4 °C. |
| Trizma base | Sigma-Aldrich | T1503-1 KG | Tris |
Riferimenti
- Rasnik, I., McKinney, S. A., Ha, T. Surfaces and orientations: much to FRET about. Acc Chem Res. 38 (7), 542-548 (2005).
- Lamichhane, R., Solem, A., Black, W., Rueda, D. Single-molecule FRET of protein-nucleic acid and protein-protein complexes: surface passivation and immobilization. Methods. 52 (2), 192-200 (2010).
- Di Fiori, N., Meller, A. Automated system for single molecule fluorescence measurements of surface-immobilized biomolecules. J Vis Exp. (33), 1542-1510 (2009).
- Kingshott, P., Griesser, H. J. Surface that resist biodegradation. Curr Opin Solid St M. 4 (4), 403-412 (1999).
- Elbert, D. L., Hubbell, J. A. Surface treatments of polymers for biocompatibility. Annu Rev Mater Sci. 26, 365-394 (1996).
- Zalipsky, S., Preface Harris, J. M. . Poly(theylene glycol). , 11-12 (1997).
- Selvin, P. R., Ha, T. . Single-Molecule Techniques: A Laboratory Manual. , (2007).
- Finkelstein, I. J., Greene, E. C. Supported lipid bilayers and DNA curtains for high-throughput single-molecule studies. Methods Mol Biol. 745, 447-461 (2011).
- Kenausis, G. L., et al. Poly(L-lysine)-g-Poly(ethylene glycol) layers on metal oxide surfaces: attachment mechanism and effects of polymer architecture on resistance to protein adsorption. J Phys Chem B. 104 (14), 3298-3309 (2000).
- Groll, J., Star Moeller, M. polymer surface passivation for single-molecule detection. Method Enzymol. 472, 1-18 (2010).
- Bahmani, B., Gupta, S., Upadhyayula, S., Vullev, V. I., Anvari, B. Effect of polyethylene glycol coatings of uptake of indocyanine green loaded nanocapsules by human spleen macrophages in vitro. J Biomed Opt. 16 (5), (2011).
- Kulczyk, A. W., Tanner, N. A., Loparo, J. J., Richardson, C. C., van Oijen, A. M. Direct observation of enzymes replicating DNA using a single-molecule DNA stretching assay. J Vis Exp. (37), e1689 (2010).
- Upadhyayula, S., et al. Coatings of polyethylene glycol for suppressing adhesion between solid microspheres and flat surfaces. Langmuir. 28 (11), 5059-5069 (2012).
- Dulin, D., Lipfert, J., Moolman, M. C., Dekker, N. H. Studying genomic processes at the single-molecule level: introducing the tools and applications. Nat Rev Genet. 14, 9-22 (2012).
- Joo, C., Fareh, M., Narry Kim, V. Bringing single-molecule spectroscopy to macromolecular protein complexes. Trends Biochem Sci. 38 (1), 30-37 (2012).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505 (2008).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318, 426-430 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon