Method Article
פסיבציה משטח ללימודי חלבון מולקולה בודדת
In This Article
Summary
אנו מתארים שיטה לpassivating משטח זכוכית באמצעות פוליאתילן גליקול (PEG). פרוטוקול זה מכסה ניקוי פני השטח, functionalization פני השטח, וציפוי PEG. אנחנו מציגים את האסטרטגיה חדשה לטיפול במשטח עם מולקולות PEG יותר משני סיבובים, אשר מניב איכות מעולה של פסיבציה בהשוואה לשיטות קיימות.
Abstract
ספקטרוסקופיה הקרינה המולקולה בודדת הוכיחה להיות אינסטרומנטלי בהבנת מגוון רחב של תופעות ביולוגיות בקנה המידה ננומטרי. דוגמאות חשובות של מה שטכניקה זו יכולה להניב למדעי ביולוגיה הן התובנות מכניסטית על חלבונים ואינטראקציות חומצת חלבון גרעין. כאשר אינטראקציות של חלבונים נחקר ברמת המולקולה בודדת, החלבונים או מצעים שלהם לעתים קרובות משותקים על משטח זכוכית, המאפשר תצפית לטווח ארוך. ערכת קיבוע זה עשויה להציג את ממצאי משטח לא רצויים. לכן, זה הכרחי כדי passivate משטח הזכוכית כדי להפוך אותו אדיש. ציפוי פני השטח באמצעות פוליאתילן גליקול (PEG) בולט לביצועים גבוהים שלה במניעת חלבונים מהלא ספציפי באינטראקציה עם משטח זכוכית. עם זאת, הליך ציפוי הפולימר הוא קשה, בשל הסיבוך הנובע מסדרה של טיפולי שטח והדרישות המחמירות שמשטח צריךלהיות חופשי של כל מולקולות ניאון בסוף ההליך. כאן, אנו מספקים פרוטוקול חזק עם הוראות צעד אחר צעד. היא משתרעת על ניקוי שטח, כולל תחריט פיראניה, functionalization שטח עם קבוצות האמינים, ולבסוף ציפוי PEG. כדי להשיג צפיפות גבוהה של שכבת PEG, אנחנו מציגים אסטרטגיה חדשה לטיפול במשטח עם מולקולות PEG יותר משני סיבובים, שלהפליא משפר את איכות פסיבציה. אנו מספקים תוצאות נציג, כמו גם עצות מעשיות לכל שלב קריטי כל כך שכל אחד יכול להשיג את פסיבציה פני השטח באיכות הגבוהה.
Introduction
בעת ביצוע מחקר חלבון מולקולה בודדת זה חיוני כדי להשיג איכות גבוהה של פסיבציה פני השטח, כך שהניסוי הוא חופשי מכל תקלה חלבון מושרה משטח או 1,2 denaturation. בעוד משטח זכוכית שטופלו בשטח, כגון אלבומין בסרום שור, משמש בדרך כלל למחקרי חומצות גרעין מולקולה בודדת 3, מידת פסיבציה אינה גבוהה מספיק ללימודי חלבון. משטח זכוכית מצופה בפולימר (פוליאתילן גליקול, PEG) הוא מעולה ב4-6 ביצועי פסיבציה. וכך, זה הפך להיות אוניברסלי המשמש למחקרי חלבון מולקולה בודדת מאז שהוצג למחקר הקרינה מולקולה בודדת 7-10. הליך ציפוי הפולימר דורש טיפולי שטח מרובים 7,11,12. לכן, קשה לעקוב אחרי כל ההליך ללא הוראות מפורטות. לעתים קרובות את מידת פסיבציה פני השטח משתנה בהתאם לפרוטוקול שבו אנישל אחריו. כאן אנו מציגים פרוטוקול חזק עם הוראות צעד אחר צעד, אשר תסיר אחד מצווארי הבקבוק העיקריים של מחקרי חלבון מולקולה בודדת. ראה איור 1 עבור סקירה.
Protocol
1. החלק הכנה וניקוי
תא microfluidic מורכב משקופית קוורץ וcoverslip. בקרינת השתקפות הפנימית מוחלטת פריזמה הסוג מיקרוסקופית (TIRF), את פני השטח של שקופית קוורץ הוא הדמיה. לכן, חשוב לנקות את שקופיות ביסודיות באמצעות קוורץ H 2 O, אצטון, KOH, ופתרונות פיראניה. ה היא ניקוי רב שלבים מבטל מולקולות אורגניות ניאון על משטח אשר מפריע למדידות הקרינה מולקולה בודדות. בנוסף, תחריט פיראניה עושה הידרופילי משטח קוורץ על ידי יצירת קבוצות הידרוקסיל. הקבוצות הידרוקסיל חופשיות הן חיוניות לתגובת האמין silanization בשלב 3.
- שקופיות קוורץ הקידוח. מקדחה זוג החורים לתוך שקופית קוורץ עם קצת 3/4 מקדח יהלום מ"מ (איור 2 א). אם מספר רב של ערוצים הם רצויים, לקדוח יותר הרשותמס ההכנסה של חורים (איור 2b). חורים אלה משמשים להזרקת פתרונות לתוך תא microfluidic בשלב 7.
- שמור על המקדח רטוב בH 2 O במהלך הקידוח. H 2 O מבצע כחומר סיכה, המגדיל את אורך החיים של המקדח.
- מדי פעם לנגב את קצה המקדח עוזר קידוח חורים.
- לאחר קידוח חורים, לסמן צד אחד של השקופיות לזיהוי קל במהלך תהליך PEGylation. הסמנים יכולים לשמש כנקודת התייחסות כדי למנוע בלבול בשלב מאוחר יותר. לסימון, ניתן להשתמש במקדח יהלום. אין להשתמש בכל עט מאז הדיו עלול לעלות על פני השטח.
- ניקוי עם H 2 O. מניחים את השקופיות בצנצנת מכתים זכוכית. יכולות להיות ממוקמות בדרך כלל 5-15 שקופיות בצנצנת אחת. יש לשטוף את השקופיות עם MilliQ H 2 O. חזור על זה 3 פעמים וsonicate השקופיות עם MilliQ H 2 O למשך 5 דקות כדי להסיר לכלוך. השלך את המים ולשטוף את השקופיות שוב 3 פעמים עםH 2 O. הערה MilliQ ש130 W הוא כוח sonication משמש לפרוטוקול זה. כוח sonication גבוה עשוי להקטין את משך החיים של שקופיות קוורץ.
- ניקוי עם אצטון. החלף את MilliQ H 2 O עם אצטון. Sonicate השקופיות עם אצטון עבור 20 דקות או יותר.
- שטיפה עם H 2 O. מחק את אצטון ולשטוף את השקופיות עם MilliQ H 2 O. חזור על זה במשך 3 פעמים כדי להסיר שאריות אצטון.
- ניקוי עם KOH. החלף את המים עם 1 M KOH וsonicate השקופיות עבור 20 דקות או יותר. תחריט מוגזם (למשל טיפול KOH לילה) ישפר את האיכות של פני השטח, אבל יציג סריטות, שעלול להפריע לדימות פלואורסצנטי.
- שטיפה עם H 2 O. יש לשטוף את השקופיות עם MilliQ H 2 O ל3 פעמים כדי להסיר עקבות של KOH.
- תחריט פיראנה.
- העברת השקופיות להחזיק שקופיות דוראן או בעל טפלון מחוייט וplאס בכוס (1 ליטר) שממוקמת במנדף כימי.
- למלא את הכוס עם 450 מיליליטר של H 2 SO 4.
- הוסף 150 מיליליטר של H 2 O 2 ל3:01 יחס בין H 2 SO 4 ו-H 2 O 2. ברגע שהפתרון מתחיל לרתוח באופן ספונטני, הטמפרטורה מגבירה מעל 90 ° C. ודא כי פתרון H 2 O 2 הוא בטמפרטורת חדר לפני שמתחיל את התגובה. אחרת, את הטמפרטורה של הפתרון הרותח עשויה להיות נמוך מ90 ° C.
- מערבבים את הפתרון לערבוב נכון ולתת את הכוס באין מפריעה ל20 דקות.
- קח את השקופיות מפתרון Piranha יחד עם מחזיק השקופיות, ולשים אותם בהחזיק שקופיות המכיל MilliQ H 2 O. בינתיים, לבטל את פתרון Piranha לתוך בקבוק פסולת מיועד ברגע שהוא מגיע לטמפרטורת חדר.
- יש לשטוף את השקופיות 3 פעמים עם MilliQ H 2 O. טיפול נוסף צריך להילקח בSTE נוסףנ.ב. כדי למנוע כל זיהום אפשרי של שקופיות. המשך לשלב 3. זה מומלץ להמשיך מייד בשלבים הבאים.
* זהירות: פתרון Piranha הוא מאוד תגובתי. בעת הטיפול בפתרון זה יש לנקוט במשנה זהירה. בנוסף, כאשר בטעות מעורבבת עם ממסים אורגניים כגון אצטון, זה עלול לגרום לפיצוץ.
2. ניקוי Coverslip
תא microfluidic מורכב משקופית קוורץ ושפות של כיסוי. כאשר מיקרוסקופ TIRF פריזמה סוג משמש, את פני השטח של coverslip לא צילם. לכן, זה מספיק כדי לנקות coverslip רק עם H 2 O ו KOH. במקרה coverslip צריך להיות צילם (למשל באמצעות מיקרוסקופיה TIRF האובייקטיבי מהסוג), מומלץ לטיפול בcoverslips עם פתרון Piranha (שלב 1.7). שימו לב שאם PEGylation של פני השטח coverslip הוא לא באיכות גבוהה, זה יכול לפעול ככיור לחלבוניםd להצמיח וריאציות בריכוז החלבון.
- שטיפה עם H 2 O. coverslips מקום (24 x 30, 24 x 40, או 24 x 50 2 מ"מ) בצנצנת מכתים זכוכית. יכול להיות ממוקם בדרך כלל 5-15 coverslips בצנצנת אחת. שטוף את coverslips 3 פעמים עם H 2 O. MilliQ
- ניקוי עם KOH. החלף את המים עם 1M KOH וsonicate coverslips עבור 20 דקות או יותר.
- שטיפה עם H 2 O. שטוף את coverslips 3 פעמים עם MilliQ H 2 O כדי להסיר עקבות של KOH. המשך לשלב 3.
3. אמינו-silanization של שקופיות וCoverslips
Functionalizing את פני השטח של שקופיות קוורץ וcoverslips עם קבוצה אמין באמצעות הכימיה האמין silanization. מתנול משמש כממס וחומצה אצטית כזרז לתגובת האמין silanization.
- שטיפה עם מתנול. החלף את 2 O MilliQ H במנות מכתים (מSteps 1 ו -2) עם מתנול. שמור את השקופיות וcoverslips במתנול עד שלב 3.3. אין לאחסן את השקופיות וcoverslips במתנול לתקופה ארוכה שלא לצורך זמן (כמה שעות לדוגמא) מאז זיהומים במתנול יהיה לספוג אל פני השטח.
- הכנת פתרון האמין silanization.
- יש לשטוף את בקבוק פיירקס מספר פעמים עם מתנול. Sonicate הבקבוק עם מתנול במשך 5 דקות או יותר. מומלץ לי בקבוק ייעודי שנשמר נקי.
- יוצקים של מתנול 100 מיליליטר לתוך הבקבוק.
- הוסף 5 מיליליטר של חומצה אצטית.
- הוסף 3 מיליליטר של APTES (trimethoxysilane 3-aminopropyl) ולערבב בעדינות על ידי טלטולו.
- אמינו-silanization. החלף את מתנול במנות הצביעה המכילות את השקופיות וcoverslips עם תערובת תגובת aminosilanization.
- דגירה של 20-30 דקות. במהלך דגירה, sonicate פעם דקות 1.
- שטיפה עם מתנול. החלף אתתגובת minosilanization עם מתנול. מחק את מתנול ולהוסיף פתרון מתנול טרי. חזור על תהליך זה שלוש פעמים.
4. פסיבציה פני השטח באמצעות פולימרים (סיבוב הראשון)
Passivating המשטח מצופה האמין של שקופיות קוורץ וcoverslips ידי conjugating פוליאתילן גליקול NHS-אסטר (PEG). תגובה זו מתבצעת עם הריכוז להרוות של פתרון PEG ב-pH 8.5 הלילה.
- ייבוש שקופיות וcoverslips. ייבש את השקופיות וcoverslips באמצעות גז N 2 ולמקם אותם בקופסות פיפטה נקיות באופן כזה שהצד שבו יש להיות PEGylated הוא פונה כלפי מעלה. תיבת פיפטה מתמלאת באופן חלקי עם MilliQ H 2 O. סביבה לחה זה מונעת פתרון PEGylation מהתייבשות במהלך הדגירה הלילה.
- הכנת מאגר תגובה. הכן 0.1 M של חיץ סודיום ביקרבונט הטרי (pH 8.5) על ידי המסת 84 מ"ג של סודה לשתייה ב10 מיליליטר שלMilliQ H 2 O. אין צורך בהתאמת ה-pH. פתרון זה עשוי להיות מאוחסן קפוא לשימוש הבא (לדוגמא שלב 6.1).
- הכנת פתרון PEGylation.
- הכן תערובת PEG של 0.2 מ"ג biotinylated NHS-אסתר PEG (5,000 דא) 13 ו8 מ"ג של NHS-אסתר MPEG (5,000 דא) בצינור 1.5 מיליליטר. בעת הכנת מספר N של שקופיות, להכין כמות גדולה יותר פעמים N של תערובת PEG בצינור יחיד.
- הוספת 64 μl (או N פעמים 64 μl עבור מספר N של שקופיות) של החיץ מוכן הטרי (שלב 4.2). פיפטה אותו למעלה ולמטה על מנת לפזר אותם לחלוטין.
- צנטריפוגה עם 16,100 XG דקות 1 כדי להסיר בועות אוויר. אל פיפטה לאחר מכן. אחרת, בועות אוויר יהוו אשר מפריעות PEGylation בשלב 4.4.
- PEGylation.
- זרוק 70 μl של תערובת PEGylation לשקופית קוורץ יבשה משלב 4.1. השתמש 90 μl במקרה של 24 x 50 מ"מ 2 coverslip.
- מניח בעדינות coverslip מיובש משלב 4.1 על הפתרון.
- להיות אחידה ואיכותי של PEGylation, לדאוג שלא להכניס בועות אוויר. בשל מתח פנים, רוב בועות האוויר יכול באופן ספונטני לעזוב את נפח התגובה תוך חמש דקות בשל שטח מתח.
- דגירה השקופיות בסביבה חשוכה ולחה. זמן מחצית החיים של NHS-אסתר PEG שאנו משתמשים ב-pH 8 הוא כשעה. לכל הפחות, דגירה אותם במשך שעה 2. דגירה הלילה מובילה לאיכות גבוהה יותר של PEGylation (מידע לא מוצג).
5. אחסון לטווח ארוך
אחסון שקופיות PEGylated וcoverslips בN 2 ב -20 º C.
- ייבוש שקופיות וcoverslips. לפרק בזהירות את השקף וcoverslip על ידי הזזה את coverslip לצד, יש לשטוף אותם עם MilliQ H 2 O, ולייבש אותם עם N 2.
- אחסון שקופיות וcoverslips. עבורr שימוש מיידי, בצע את ההליך לסיבוב של PEGylation (שלב 6) השני. על מנת לאחסן לתקופה ארוכה יותר של זמן, בצע את השלבים הבאים.
- הנח זוג השקופיות וcoverslip בצינור 50 מיליליטר כך שמשטחי PEGylated עומדים בפני אחד מהשני.
- חלקית לסגור את צינור ואקום הצינור, ולאחר מכן למלא אותו עם N 2. צעדים אלה יסייעו לשמר את משטח PEGylated לתקופה ארוכה של זמן. הברג את הצינור בחוזקה ולאחסן אותו ב -20 ° C. האיכות של השקופיות נותרת טובה לעד 3 חודשים (איור 3 א, מימין).
6. פסיבציה פני השטח באמצעות פולימרים (סיבוב השני)
סבב נוסף של PEGylation לעשות צפוף שכבת PEG וגם כדי להרוות את כל קבוצות האמינים שנותרו על פני השטח. השימוש במולקולות קצרות NHS-אסתר PEG (333 דא) עשויות להיות יעילות בחודר לתוך שכבת PEG קיים. זה recommended לעשות סיבוב שני זה של PEGylation תקין לפני השימוש בשקופית.
- הכנת מאגר תגובה. הכן 0.1 M של חיץ סודיום ביקרבונט הטרי (pH 8.5). יכול לשמש גם הפתרון הקפוא משלב 4.2.
- הכנת פתרון PEGylation. ממיסים 7 μl של 250 מ"מ MS4-PEG ב63 μl של חיץ סודיום ביקרבונט.
- PEGylation. בצע את אותו התהליך כמו בשלב 4.4. דגירה במשך 30 דקות עד הלילה.
- ייבוש שקופיות וcoverslips. לפרק את הזוג של השקופית וcoverslip, יש לשטוף אותם עם MilliQ H 2 O, לייבש אותם עם N 2, ולשמור אותם בקופסא פיפטה נקייה. המשך להרכבת תא microfluidic בשלב 7.
7. הרכבה קאמרית Microfluidic
הרכבת תא microfluidic באמצעות זוג שקופית קוורץ PEGylated וcoverslip. סרט דביק דו צדדי משמש כשומר רווח. החדר אטום עם דבק אפוקסי ו, כךlutions הם הציגו דרך החורים בשקופית קוורץ.
- מקום שקופית קוורץ על משטח שטוח עם צד PEGylated פונה כלפי מעלה.
- הפוך ערוץ (רוחב 5 עד 7 מ"מ) באלכסון על פני PEGylated ידי הצבת קלטות דו צדדיות דביקות על השקופית. ודא כי החורים ממוקמים במרכזו של הערוץ. יש להיזהר שלא לקלקל את משטח PEGylated במהלך התהליך של הפיכת תא. אפשר להפוך את שקופיות רב ערוצית על ידי הצבת ודבק הקלטות דו צדדיות דביקות באופן שונה (ראה איור 2).
- מניח בעדינות coverslip PEGylated על גבי כדי להשלים את החדר. צד PEGylated צריך להיות כלפי מטה.
- לאטום את החדר על ידי לחיצה על coverslip מעל האזור שבו קלטות דו צדדיות ממוקמות. לעשות את זה בעדינות אך ביסודיות, כך שהתא הופך למים בחוזקה אטום.
- סגור את הקצוות של החדר עם דבק אפוקסי.
- לשתק Streptavidin או Neutravidin עלbiotinylated PEG שכבה על ידי הוספת 50 μl של 0.1 מ"ג / מיליליטר של תמיסת Streptavidin או Neutravidin בT50 (, 50 חיץ mM NaCl [pH8.0] 10 מ"מ טריס-HCl) באמצעות פיפטה p200. לאחר 1 דקות של דגירה, לשטוף עם חיץ של T50 100 μl.
- הוספת מולקולות ביולוגיות biotinylated הדמיה המולקולה בודדת שלך.
8. Slide מחזור
מחזור שקופיות קוורץ. שקופיות משומשות ממוחזרות על ידי לקיחה את coverslips והקלטות דו צדדיות דביקות.
- לאחר שימוש, לאחסן את התאים במים ברז. דגירה ארוך טווח במים מקלה על פירוק של התאים.
- מרתיחים את התאים במים ברז באמצעות מיקרוגל. השתמש בכוס פיירקס. מרתיחים במשך 10 דקות או יותר.
- תוריד את coverslips וקלטות דו צדדיות דביקות באמצעות סכין גילוח. אל תלחץ שקופית קוורץ בניצב למישור שלה. אחרת, הוא נשבר. שמור את סכין הגילוח מהערוץ. Otherwise, היא מציגה סריטות על הערוץ.
- יש לשטוף את השקופיות באמצעות חומרי ניקוי ביתי על ידי שפשוף אותם עם אצבעות.
- מניחים את השקופיות בצנצנת מכתים זכוכית. יכולות להיות ממוקמות בדרך כלל 5-15 שקופיות בצנצנת אחת. הוסף 10% חומר ניקוי ביתי וsonicate השקופיות עבור 20 דקות או יותר. יש לשטוף את השקופיות עם כמות גדולה של מים כרטיסייה.
- עבור לשלב 1.2.
תוצאות
לאחר ההרכבה תא microfluidic (שלב 7.1-7.6) ולפני ביצוע שלב 7.7, מומלץ לבצע את בקרת האיכות של פני השטח PEGylated.
אם פסיבציה פני השטח כבר נעשתה בהצלחה, יש פחות מ -10 הלא ספציפי adsorbed חלבונים לאזור הדמיה (25 מ"מ x 25 מ"מ) נצפו כאשר 1-10 חלבון שכותרתו fluorescently ננומטר מתווסף לתוך התא (איור 3 א, משמאל).
כאשר כל אחד משלבי הניקוי או תגובה לא בוצע כראוי, מספר הלא ספציפי adsorbed חלבונים מגביר באופן משמעותי, ומסך CCD עשוי להיות רווי ידי אותות הקרינה. לדוגמא, אם תחריט פיראניה מדלג, יש 100 פעמים כמות גדולה יותר של ספיחה הלא ספציפית שנצפתה (איור 3 א; להשוות נשאר עם באמצע). כאשר צעד PEGylation השני הוא דילג, היה כ 3 זמןsa כמות גדולה יותר של ספיחה ציינה שאינו ספציפי (איור 3 ב). מידה נמוכה של PEGylation הוא ציין כאשר כימיקלים פגו (למשל APTES לאחסן בטמפרטורת חדר במשך כמה חודשים) משמשים (מידע לא מוצג). האיכות של פני השטח גם יורדת למטה כאשר כמות משמעותית של זמן עבר מאז שזה היה PEGylated (איור 3 א; להשוות נשאר עם ימין).
למיטב ידיעתנו, זה הפעם הראשונה ששני הסיבובים של PEGylation הם הציגו ללימודי מולקולה בודדת. שני סיבובים של PEGylation להבטיח את האיכות הגבוהה ביותר של היווצרות שכבת PEG (3 ב איור). הטבע מעולה של PEGylation הכפול מוצג בהבלטה בסרטים (השווה 1a סרט עם 1b סרט). בסרטים אלה, אותות רקע ממולקולות ניאון בפתרון הם נצפו להיות הרבה יותר חלשים כשPEGylation הכפול היה בשימוש, אשר מציין כי חלבונים הם הדפו בצורה יעילה יותר על ידי שכבת pegylated כפליים. למרות שתהליך בן שני שלבים זה מומלץ בחום, צעד PEGylation השני עשוי להיות דילוג אם הניסוי שלך הוא נסבל לפסיבציה שאינה אופטימלית.
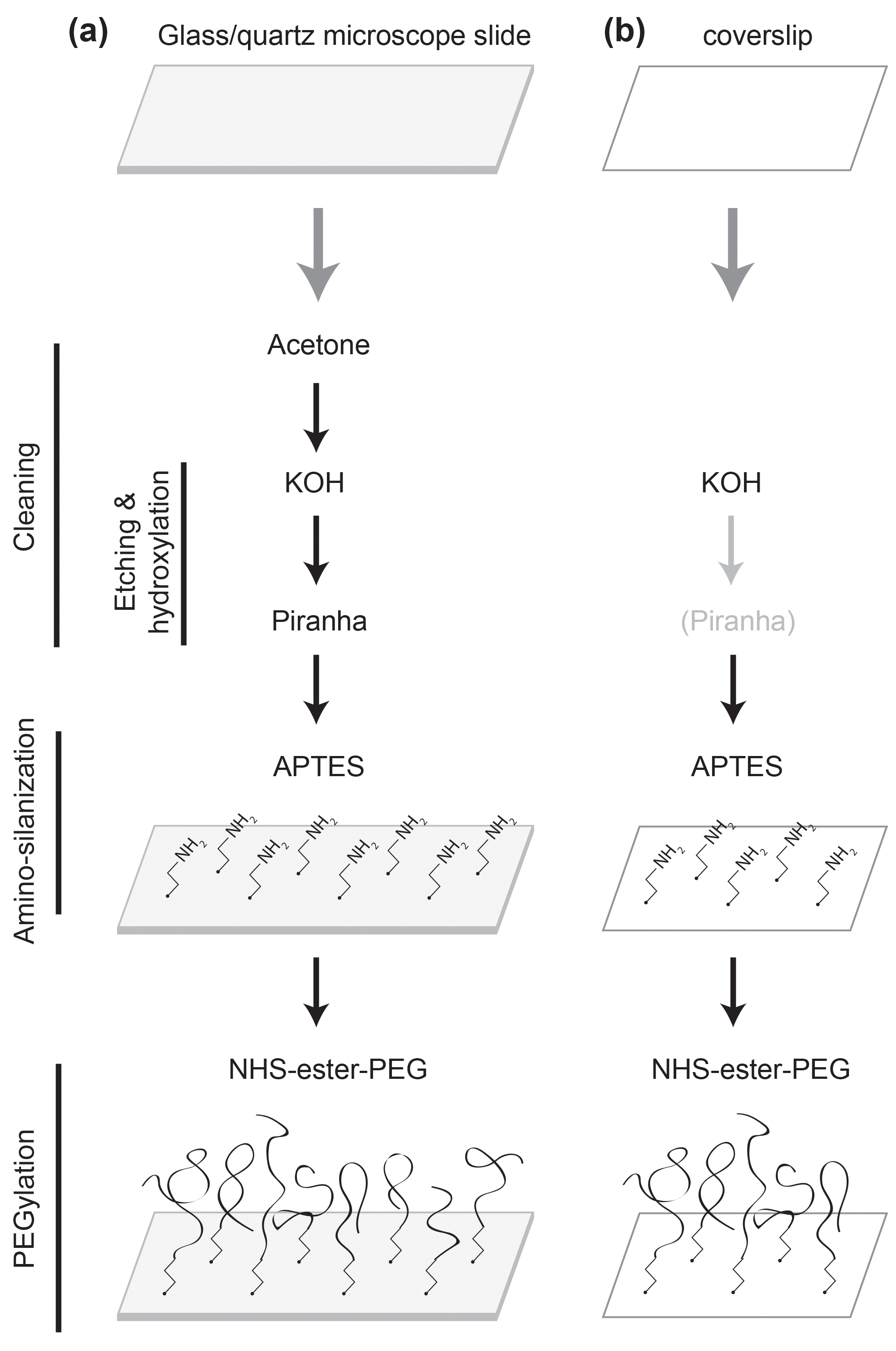
איור 1:. סכמטי של טיפולי שטח () שקופית מיקרוסקופ הוא ניקה עם אצטון, KOH, ופתרונות פיראניה. הוא פונקציונליות עם APTES וPEGylated עם NHS-אסתר PEG. (ב) coverslip הוא ניקה עם KOH, כמו גם עם פתרון Piranha במידת צורך. הוא פונקציונליות עם APTES וPEGylated עם NHS-אסתר PEG.
"Width =" fig2highres.jpg 500 "/>
איור 2:. תא microfluidic (א) קאמרי ערוץ אחד. יש שקופיות מיקרוסקופ שני חורים שנקדחו. זה מורכב עם coverslip באמצעות שתי פרוסות קלטת דו צדדית דביקה. (ב) חדר שלושה ערוצים. יש שקופיות מיקרוסקופ שישה חורים שנקדחו. זה מורכב עם coverslip באמצעות ארבע פרוסות של קלטת דו צדדית דביקה.
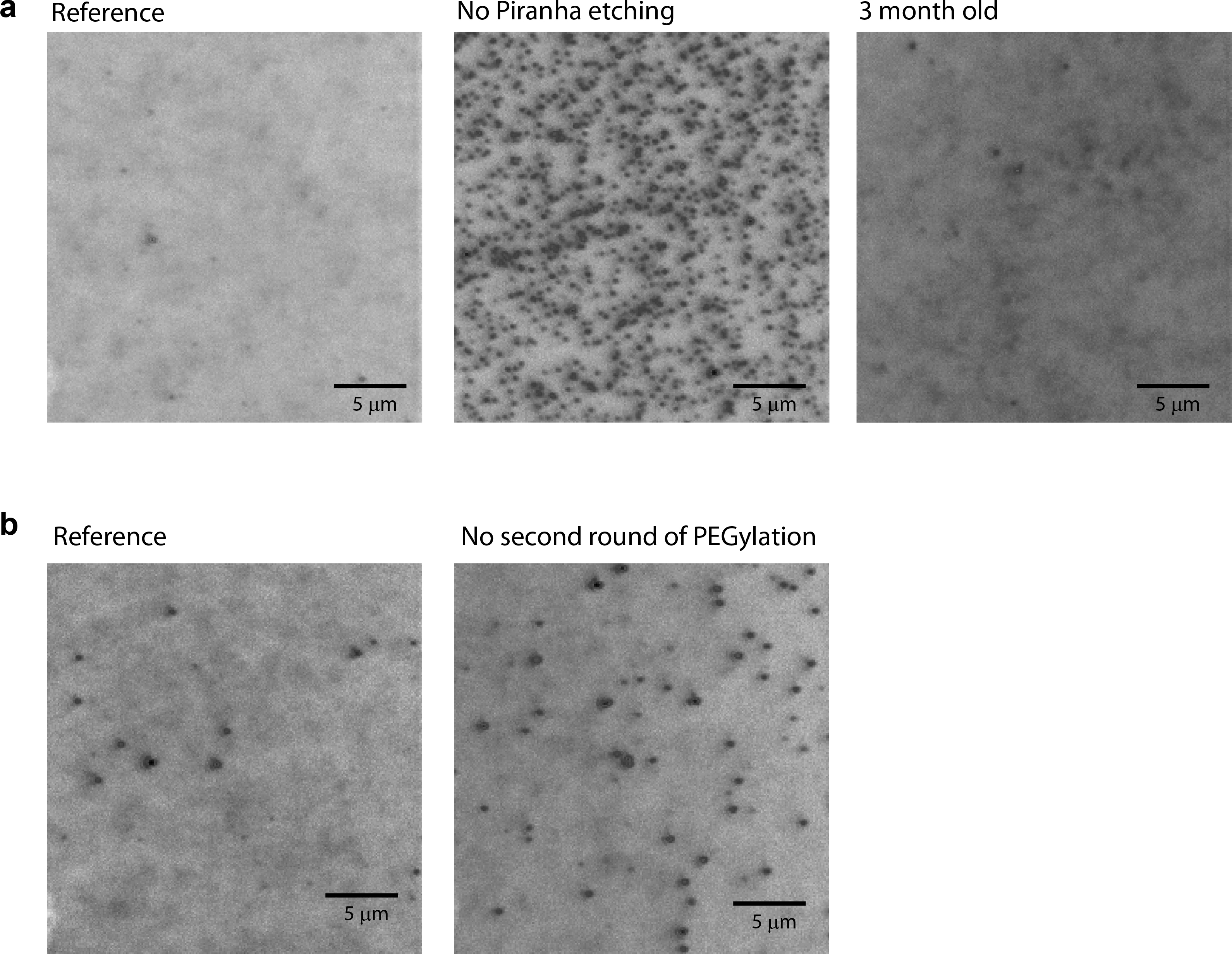
איור 3: תמונות CCD נלקחו עם חלבונים שכותרתו צבע בתמיסה. (א) תמונות CCD נלקחו על ידי מיקרוסקופ פלואורסצנטי סך הכל ההשתקפות הפנימית פריזמה הסוג באמצעות עדשה אובייקטיבית 60x עם 10 ננומטר Cy3-labeld נציג בתמיסה. (משמאל) משטח הוכן בעקבות הפרוטוקול במאמר זה. (תיכון) פני השטח היה תכשיריםאדום בעקבות הפרוטוקול במאמר זה, אבל תחריט פיראניה היה לדלג עליו. (מימין) משטח הוכן בעקבות הפרוטוקול במאמר זה ומאוחסן במשך 3 חודשים ב -20 מעלות צלזיוס תחת חנקן. (ב) תמונות שצולמו עם CCD 10 ננומטר Cy3-labeld נציג בתמיסה. (משמאל) משטח הוכן בעקבות הפרוטוקול במאמר זה. (מימין) משטח הוכן בעקבות הפרוטוקול במאמר זה, אבל הסיבוב של PEGylation השני לדלג עליו. סרגל קנה מידה = 5 מיקרומטר.
סרט 1: סרטי CCD נלקחו עם חלבונים שכותרתו צבע בתמיסה. סרטי CCD נלקחו על ידי מיקרוסקופ פלואורסצנטי סך הכל ההשתקפות הפנימית פריזמה הסוג באמצעות עדשה אובייקטיבית 60x עם 10 ננומטר Cy3-labeld נציג בתמיסה. הרזולוציה הזמן היא 100 אלפיות שנייה. (א) משטח הוכן בעקבות הפרוטוקול במאמר זה. (ב) משטח הוכן בעקבות הפרוטוקול במאמר זה, אבל את הסיבוב השני PEGylation היה לדלג עליו. לחץ כאן לצפייה בסרט ו1a לחץ כאן לצפייה בסרט 1b.
Discussion
שלבים קריטיים בפרוטוקול זה
זה חיוני כדי להפוך את הידרופילי השטח לפני תגובת האמין silanization. זו הושגה באמצעות תחריט פיראניה אשר יוצר קבוצות הידרוקסיל חופשיות על משטח הזכוכית / קוורץ. מומלץ לא לשמור את פני השטח חרוטים פיראניה נחשף לאו H 2 O או באוויר במשך תקופה ארוכה של זמן מאז hydrophilicity של פני השטח יורד בהדרגה.
מולקולות NHS-אסתר PEG הן תגובתי. מומלץ לעשות aliquots ולאחסן אותם תחת חנקן ב-20 º C. חיי המדף של החומר הכימי APTES בטמפרטורת החדר הוא קצרים. מומלץ להחליף אותו עם אחד חדש בכל חודש.
שינויים של פרוטוקול זה
כאשר אתה לא יכול להשתמש בתחריט פיראניה מכל סיבה מעשית, ייתכן שלחרוט באמצעות KOH לתקופה ארוכה של זמן (למשל overnight), שגם יאפשר לקבוצות הידרוקסיל חשופות. המלכודת של גישה חלופית זו היא שהשקופיות הופכת להיות שמישים אחרי כמה ממחזרת בשל סריטות קשות.
זה לעתים קרובות נהוג לשרוף משטח הזכוכית / קוורץ באמצעות לפיד פרופאן, שהוא יעיל בחיסול חומרים אורגניים ניאון 7. הליך זה לא נכלל בפרוטוקול זה כי זה מיותר לתחריט פיראניה. שים לב שהליך זה יהיה פוטנציאל לגרום לחמצון של הקבוצות הידרוקסיל. לפיכך, הליך זה לא צריך להתבצע פעם אחת משטח היה חרוט באמצעות KOH או פתרון Piranha.
כאשר חיץ עם pH הנמוך מ -7 משמש להדמית מולקולה בודדת, קונפורמציה של PEG משתנה מ" פטרייה "ל" מברשת", אשר מפחיתה את מידת פסיבציה. לכן, כאשר הוא משמש pH נמוך מ7.0, מומלץ לpassivate המשטח באמצעות disuccinimidyl tartarate <נוסףsup> 7.
פרספקטיבות
עבודה זו סיפקה פרוטוקול חזק להשגת פסיבציה פני השטח באיכות גבוהה. פרוטוקול זה יהיה שימושי עבור מחקרי הקרינה מולקולה בודדת כי הם מעורבים עם חלבונים 14 כמו גם קומפלקסי חלבונים בתוך תא ותמציות immunoprecipitates 15. זה יהיה בשימוש נרחב לטכניקות מולקולה בודדת אחרות כגון ספקטרוסקופיה הכוח וספקטרוסקופיה מומנט 16. זה יהיה שימושי גם למניעת תאים מadsorbing למשטח 17.
הפרוטוקול האמור בעבודה זו דורש לנהלים רב שלביה. פסיבציה פני השטח באמצעות השומנים PEG 8 ופולי-ליזין PEG 9 זמינות כגישה חלופית. מאז, הם אינם דורשים כל תגובות כימיות היא קל ליישום. עם זאת, מידת פסיבציה היא לא גבוהה כמו שמושג באמצעות modif הכימיication של פני השטח.
Disclosures
יש לנו מה למסור.
Acknowledgements
SDC, ACH, וCJ נתמכו על ידי החל מענקים (ERC-STG-2012-309,509) באמצעות המועצה האירופית למחקר. J.-MN נתמכה על ידי הקרן הלאומית למחקר (NRF) (2011-0,018,198) של קוריאה; ותכנית פיוניר מרכז המחקר (2012-009586) דרך NRF של קוריאה ממומנת על ידי משרד המדע, טכנולוגיות המידע והתקשורת, ותכנון עתידי (MSIP). עבודה זו נתמכה גם על ידי מרכז לבריאות bionano-Guard ממומן על ידי MSIP של קוריאה כגלובל פרונטיר הפרויקט (H-GUARD_2013-M3A6B2078947). YKL וי-HH נתמכו על ידי מדע תכנית העמיתים של סיאול סיאול עיר, קוריאה. חלבון הנציג שכותרתו היה מתנה נדיבה של ד"ר סוא מיונג.
Materials
| Name | Company | Catalog Number | Comments |
| 1. Slide preparation and cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coverslips | VWR | 631-0136 631-0144 631-0147 | 24 x 32 mm2, 22 x 40 mm2, 24 x 50 mm2 (No.1½, Rectangular) |
| Diamond drill bits | MTN-Giethoorn, The Netherlands | LA-0564-00DB | 3/4 mm |
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| Glass staining dishes | Fisher Scientific | 300101 | |
| H2O2 | Boom | 6233905 | 1 L, hydrogen peroxide 30%. Opened bottles should be stored at 4 °C. |
| H2SO4 | Boom | 80900627.9010 | Sulfuric acid 95-98% |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| Quartz slides | Finkenbeiner | 1” x 3”, 1 mm thick | |
| 2. Coverslip cleaning | |||
| Duran slide holder | LGS, The Netherlands | 213170003 | |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 3. Amino-silanization of slides and coverslips | |||
| Acetic acid | Sigma | 320099-500ML | Acetic acid, glacial |
| APTES | Sigma-Aldrich | 281778-100ML | 3-aminopropyl trimethoxysilane. Store at the room temperature under N2. Replace once in a month. |
| Flask (200 ml) | VWR | Flask (200 ml) | Pyrex flask. Have one flask dedicated for aminosilanization. |
| Methanol | Sigma | 32213 | 1 L |
| Sonicator | Branson | Tabletop ultrasonic cleaner, 3510 | |
| 4. Surface passivation using polymer (the first round) | |||
| Biotin-mPEG | Laysan Bio | Biotin-PEG-SVA-5000-100mg | Biotin-PEG-SVA, MW 5,000 Da. Store aliquots of 1-2 mg (enough for 10 slides) at -20 °C under N2. |
| mPEG | Laysan Bio | MPEG-SVA-5000-1g | mPEG-succinimidyl valerate (SVA), MW 5,000 Da. Store aliquots of 80 mg (enough for 10 slides) at -20 °C under N2. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 5. Surface passivation (the second round) | |||
| DMSO | Sigma-Aldrich | D8418-100ML | Dimethyl sulfoxide BioReagent, for molecular biology, ≥99.9% |
| DST | Pierce | 20589 | Disuccinimidyl tartarate |
| MS4-PEG | Pierce | 22341 | Short NHS-ester PEG, MW 333 Da. Dissolve 100 mg MS4-PEG in 1.1 ml DMSO. Store 20 µl aliquots at -20 °C. |
| Sodium bicarbonate | Sigma | S6014-500G | |
| 6. Assembling a microfluidic chamber | |||
| Double sticky tape | Scotch | 10 mm wide | |
| Epoxy | Thorlabs | G14250 | Devcon 5 minute epoxy |
| NaCl | Sigma-Aldrich | S9888-1 KG | Sodium chloride |
| Neutravidin | Pierce | 31000 | ImmunoPure NeutrAvidin Biotin-Binding protein. Stock in 5 mg/ml in H2O at 4 °C. |
| Streptavidin | Invitrogen | S-888 | Stock 5 mg/ml in H2O or T50 at 4 °C. |
| Trizma base | Sigma-Aldrich | T1503-1 KG | Tris |
References
- Rasnik, I., McKinney, S. A., Ha, T. Surfaces and orientations: much to FRET about. Acc Chem Res. 38 (7), 542-548 (2005).
- Lamichhane, R., Solem, A., Black, W., Rueda, D. Single-molecule FRET of protein-nucleic acid and protein-protein complexes: surface passivation and immobilization. Methods. 52 (2), 192-200 (2010).
- Di Fiori, N., Meller, A. Automated system for single molecule fluorescence measurements of surface-immobilized biomolecules. J Vis Exp. (33), 1542-1510 (2009).
- Kingshott, P., Griesser, H. J. Surface that resist biodegradation. Curr Opin Solid St M. 4 (4), 403-412 (1999).
- Elbert, D. L., Hubbell, J. A. Surface treatments of polymers for biocompatibility. Annu Rev Mater Sci. 26, 365-394 (1996).
- Zalipsky, S., Preface Harris, J. M. . Poly(theylene glycol). , 11-12 (1997).
- Selvin, P. R., Ha, T. . Single-Molecule Techniques: A Laboratory Manual. , (2007).
- Finkelstein, I. J., Greene, E. C. Supported lipid bilayers and DNA curtains for high-throughput single-molecule studies. Methods Mol Biol. 745, 447-461 (2011).
- Kenausis, G. L., et al. Poly(L-lysine)-g-Poly(ethylene glycol) layers on metal oxide surfaces: attachment mechanism and effects of polymer architecture on resistance to protein adsorption. J Phys Chem B. 104 (14), 3298-3309 (2000).
- Groll, J., Star Moeller, M. polymer surface passivation for single-molecule detection. Method Enzymol. 472, 1-18 (2010).
- Bahmani, B., Gupta, S., Upadhyayula, S., Vullev, V. I., Anvari, B. Effect of polyethylene glycol coatings of uptake of indocyanine green loaded nanocapsules by human spleen macrophages in vitro. J Biomed Opt. 16 (5), (2011).
- Kulczyk, A. W., Tanner, N. A., Loparo, J. J., Richardson, C. C., van Oijen, A. M. Direct observation of enzymes replicating DNA using a single-molecule DNA stretching assay. J Vis Exp. (37), e1689 (2010).
- Upadhyayula, S., et al. Coatings of polyethylene glycol for suppressing adhesion between solid microspheres and flat surfaces. Langmuir. 28 (11), 5059-5069 (2012).
- Dulin, D., Lipfert, J., Moolman, M. C., Dekker, N. H. Studying genomic processes at the single-molecule level: introducing the tools and applications. Nat Rev Genet. 14, 9-22 (2012).
- Joo, C., Fareh, M., Narry Kim, V. Bringing single-molecule spectroscopy to macromolecular protein complexes. Trends Biochem Sci. 38 (1), 30-37 (2012).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505 (2008).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318, 426-430 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved