Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La
En este artículo
Resumen
El enfoque de BPA vaselina de corte abierto se utiliza para obtener bajos grabaciones de ruido de corrientes iónicas y conmutación de canales iónicos dependientes de voltaje expresados en oocitos de Xenopus con alta resolución de la cinética de canal rápido. Con modificaciones menores, fluorometría de fijación de voltaje puede estar acoplado con el protocolo de ovocitos de corte abierto.
Resumen
La brecha vaselina ovocito a cielo abierto (COVG) técnica de fijación de voltaje permite el análisis de las propiedades electrofisiológicas y cinéticos de los canales iónicos heterólogos en ovocitos. Las grabaciones de la instalación a cielo abierto son particularmente útiles para la resolución de bajas corrientes de compuerta magnitud, la rápida activación de corriente iónica y desactivación. Los principales beneficios más de la fijación de voltaje de dos electrodos técnica (TEVC) incluyen el aumento de velocidad de la abrazadera, la mejora de la relación señal-ruido, y la capacidad de modular la intracelular y el medio extracelular.
Aquí, utilizamos el canal de sodio cardíaco humano (HNA V 1.5), expresado en ovocitos de Xenopus, para demostrar la disposición a cielo abierto y el protocolo, así como las modificaciones que se requieren para agregar la capacidad de fluorometría de fijación de voltaje.
Las propiedades de los canales iónicos de activación rápida, tales como HNA V 1.5, no se pueden resolver por completo cerca de la temperatura ambiente usando TEVC, en which la totalidad de la membrana del ovocito se sujeta, haciendo difícil el control de tensión. Sin embargo, en la técnica de cielo abierto, el aislamiento de sólo una pequeña parte de la membrana celular permite la rápida de sujeción requerida para registrar con precisión cinética rápida, mientras que la prevención de canal de carrera hacia abajo asociada con las técnicas de patch clamp.
En conjunción con la técnica COVG, la cinética de los canales iónicos y propiedades electrofisiológicas pueden ensayarse adicionalmente utilizando fluorometría de fijación de voltaje, donde el movimiento de proteínas se realiza un seguimiento a través de cisteína conjugación de fluoróforos aplicadas extracelularmente, la inserción de las proteínas fluorescentes codificadas genéticamente, o la incorporación de aminoácidos no naturales en la región de interés 1. Estos datos adicionales se obtiene información sobre cinética reordenamientos conformacionales dependientes de voltaje de la proteína a través de cambios en el microambiente que rodea la molécula fluorescente.
Introducción
Técnicas de fijación de voltaje especializados permiten la grabación de corrientes iónicas en los potenciales de membrana controlados. Ampliamente utilizado de fijación de voltaje de dos electrodos (TEVC) y las técnicas de patch clamp proporcionan información electrofisiológica fiable sobre las propiedades de muchos canales iónicos. Sin embargo, ambos de estos métodos tienen inconvenientes que impiden la adquisición de datos fiables para los canales de sodio dependientes de voltaje rápidos y otros canales de activación rápida en membranas tales como las de los oocitos de Xenopus. Los laboratorios Bezanilla y Stefani consecuencia desarrollaron la técnica de fijación de voltaje brecha vaselina a cielo abierto (COVG) de ovocitos 2. La técnica se ha aplicado ampliamente para grabar, Na +, K + y Ca 2 + canales 3-8.
Durante la grabación COVG, una membrana del oocito que expresa la proteína heteróloga se divide en tres regiones. Los datos de corriente iónica se graba desde la región superior de la ovocito como labaño que rodea la región de la parte superior se sujeta a un potencial de comando, que se puede cambiar fácil y rápidamente. Los guardias región de Oriente contra corrientes de fuga al ser sujetado al mismo potencial que la región superior 9. La región inferior es que la apertura de los ovocitos (cut-open) se produce mediante el uso de una solución de saponina o una cánula. Químico o la apertura manual de la membrana en la zona del fondo permite el control del potencial interno, que está fijado a tierra, y hace que el interior de la célula contigua con la solución de cámara inferior. La perfusión de soluciones en la cámara inferior puede ajustar las propiedades del medio interno, mientras que el intercambio de solución en la cámara superior altera el entorno externo. 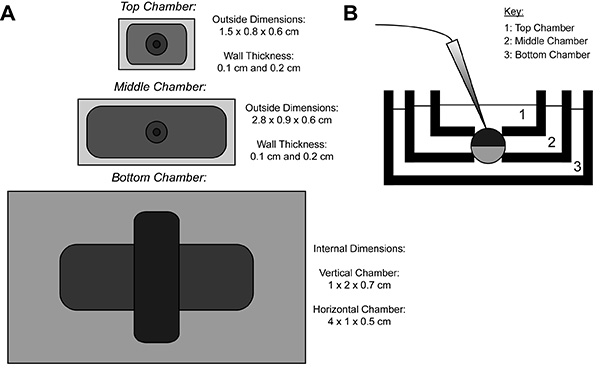
Figura 1. Ovocitos-Cut abierto Voltaje-Clamp Bath esquema de instalación. (A) Topabajo de la vista de los tres cuartos de baño separados el uno del otro. Las dimensiones de las cámaras para COVG se muestran en la figura. (B) Vista lateral de la configuración de los baños en posición de prueba. Haga clic aquí para ver la imagen más grande .
Las ventajas de la técnica de COVG incluyen bajo ruido de corriente (nA 1 a 3 kHz), el control de la composición iónica de los medios de comunicación externos, la capacidad de modular los medios de comunicación interna, el tiempo de resolución rápida (20-100 microsegundos constante de tiempo de decaimiento de la capacidad transitoria), y grabaciones estable durante varias horas 9. Las desventajas son que requiere un equipo especializado y es más difícil de realizar en comparación con dos de fijación de tensión de electrodos (TEVC) 10.
Si bien el enfoque COVG requiere un equipo altamente especializado y elementos de procedimiento intrincados, puede permitir la adquisición de valiosadatos electrofisiológicos capaces. Estos datos, como conmutar corrientes con cinética rápida y corrientes de cola 4, se puede grabar sin algunos de los problemas asociados con otros protocolos de fijación de voltaje, incluyendo canal de decadencia. Pequeñas modificaciones en la configuración COVG pueden permitir el uso de controladores de temperatura y fluorometría fijación de voltaje (VCF). La inclusión de elementos de sujeción de fluorometría de tensión dentro del conjunto COVG puede aumentar la salida de datos por conferir la capacidad de monitorizar los cambios conformacionales de la proteína mientras que al mismo tiempo la grabación actual 11-13.
Protocolo
1. Configuración del equipo inicial
- Coloque la etapa y el manipulador microelectrodo en un sistema de vibración-el aislamiento (por ejemplo, una mesa de aire) con una jaula de Faraday circundante para evitar el ruido eléctrico y mecánico.
- Suelde seis bolitas de Ag / AgCl para longitudes de seis pulgadas de 24 AWG. Para una de estas longitudes (para ser conectado a P1), de corte y empalme en un segundo alambre para formar una "Y". En los extremos de cada cable de soldar un pin BNC de oro, que se incluye con el amplificador.
- Conecte los cinco bolitas de Ag / AgCl soldados a 24 AWG al headstage Baño / Guardia (P1, P2, CC, GS1 y GS2). Conecte el "yo" Ag / AgCl pellet a la "I" headstage y el segundo cable que sale de la P1 a la headstage V2.
- Conecte el amplificador a la unidad de adquisición de datos de acuerdo con las instrucciones de los manuales del equipo.
- Coloque y epoxi los termistores del controlador de temperatura. Pase el termistor bloque a través de un agujero en el Scaffol metálicad directamente sobre el centro del elemento de calefacción / refrigeración. Coloque y epoxi el termistor baño en un agujero perforado en el cuerpo de la cámara inferior de temperatura-la realización de muy cerca, pero no en contacto la solución.
2. Ovocitos y Preparación Preliminar
- Para grabar un canal de forma heteróloga expresada como HNA V 1.5, sintetizar ARNm (derivado de hSCN5a) y se inyecta en un ovocito de Xenopus alrededor de 4-5 días antes de realizar el Protocolo n º 4. Para hSCN5a, pico de expresión se obtiene después de la incubación durante 4-5 días a 19 ° C. Consulte Richards y Dempski 14 y Cohen et al. 15 para obtener instrucciones detalladas acerca de los ovocitos, la preparación de ARNm, y la inyección de ovocitos.
- Cloruro de alambre AgCl y pellets de AgCl antes de comenzar el Protocolo 4. Para hacer esto, colocar un extremo del alambre y los pellets en lejía durante al menos 20 min y el tiempo como O / N. Una vez que los pellets se han Cloruroed, péguelas en el colector utilizando adhesivo.
Nota: conducción de corriente a través de los cables también se puede utilizar para el cloruro de alambre y gránulos. Esta técnica se incrementará la velocidad de cloración pero también requieren más equipo. Vea Técnicas para cloruración alambres de plata para la instrucción adicional 16.
3. Agar Preparación Puente
- Hacer al menos seis puentes de agar mediante el calentamiento de un extremo de un tubo capilar de borosilicato en un medio de llama. Asegúrese de que el extremo del tubo capilar está en la parte superior de la llama azul. Hacer puentes extraordinarios en caso de daños a los originales.
- Una vez que el tubo capilar se ha calentado, el uso de fórceps para hacer un ángulo de plegado 90 ° en el tubo. Aspirar a una curva con una curvatura suave en lugar de una esquina abrupta o puede reducir significativamente el diámetro interno del vaso, lo que hace más difícil el llenado y aumenta la resistencia del puente.
- Haga una segunda curva de 90 °en la misma dirección 25 mm hacia abajo del tubo capilar de la primera curva utilizando los mismos pasos.
Nota: La longitud exacta del puente no importa siempre y cuando el tamaño de puente es consistente, pero en última instancia las longitudes debe ser adecuado para el equipo de perforación que se utilizarán en. Tenga en cuenta que la resistencia del puente es proporcional a su longitud y debe reducirse al mínimo. - Una vez que los tubos capilares se hayan enfriado, use un cortador de vidrio con punta de diamante para cortar las "patas" del puente de aproximadamente 5 mm.
- Inserte longitudes de alambre de platino en los tubos capilares de los tres puentes "actual" con el suministro para mejorar el rendimiento mediante la reducción de la resistencia en el agar 17. Corte cualquier exceso de alambre de platino de manera que no hay ningún cable expuesto al exterior del tubo.
Nota: Debido al alto costo de platino, recuperar y reutilizar cualquier cable desde los puentes rotos. - Empuje el alambre de platino más en el tubo capilar con una punta fina implementar como una micropipeta tIP para que el alambre es 1 mm más corto que el vidrio en ambos extremos del tubo capilar.
- Hacer 100 ml de 1 M NMDG tamponadas con 1,2 g de HEPES. Utilice un medidor de pH y añadir polvo de hidrato de MES hasta que se alcanza un pH de 7,4 (~ 10 g). Una vez que se ha alcanzado un pH de 7,4, eliminar el electrodo de pH. Ponga a un lado 40 ml de la solución para mantener como una solución de almacenamiento.
- Añadir agar granulado para producir una mezcla de agar 2-3%. Agitar y calentar hasta que la solución de agar se disuelve y claro. No sobrecaliente o hierva la solución, ya que llegar a ser excesivamente viscosa y llenando los puentes serán difíciles.
- Mueva la solución de agar a un nuevo vaso y añadir una pequeña barra de agitación. Continuar calentando y agitando a una velocidad moderada.
- Añadir los puentes capilares uno a la vez con las piernas hacia arriba. Con el tiempo los puentes se llenarán de agar. Como alternativa, llena los puentes empujando solución de agar a través de una jeringa conectada a una pequeña punta de la pipeta.
- Una vez que no haya burbujas en el bridges, recuperar los puentes de la solución de agar y colocar los puentes en una toalla de papel para secarse. Cualquier puentes con burbujas residuales se pueden agitar con pinzas para facilitar la salida de burbujas.
Nota: agar fundada con burbujas se puede extirpar completamente mediante la inmersión de los puentes en el agua hirviendo. Una vez que se retira el agar, utilizar una línea de vacío para eliminar el agua residual. Los puentes pueden luego ser reutilizados para el tratamiento de agar. - Retire el exceso de agar de los puentes de la ropa seca. Añadir 60 ml de agua a la solución de reserva de 40 ml y colocar los puentes en la solución de almacenamiento.
4. -Cut abierta Rig Preparación
- Encienda la fuente de agua para el controlador de temperatura y luego el interruptor de alimentación en el controlador de temperatura. Espere hasta que la temperatura del baño alcanza la temperatura especificada (19 ° C).
- Tire de microelectrodos de borosilicato tubo capilar con un extractor de microelectrodos para una resistencia de 0,2-0,5 MΩ.
Nota: La reducción de pipresistencia ette mejora la velocidad de fijación. Sin embargo, las pipetas de resistencia más bajos son más propensos a dañar el ovocito. Se requiere experimentación para determinar el mejor valor de la resistencia de la pipeta para cada aplicación. - Preparar la solución de saponina mediante la mezcla de 0,125 g de saponina seco con 50 ml de solución interna. Esto conducirá a una solución de 0,25%. Invierta suavemente para mezclar.
- Bajo un microscopio de disección aplicar una pequeña cantidad de vaselina alrededor del borde del orificio en el lado superior de la cámara intermedia y la parte inferior de la cámara superior con un objeto con punta muy fina-.
Nota: El "rosquilla" de vaselina ayudará a mantener el ovocito en su lugar sobre el agujero y ayudará en la formación de la junta. Sin embargo, demasiado vaselina atrapar burbujas y prevenir las soluciones de llegar a la superficie del ovocito. - Añadir solución 3 M de KCl en las ranuras múltiples que sostienen pellets de Ag / AgCl de manera que no hay desbordamiento de las ranuras, pero los pellets y extremos de las patas del puente son Coverojo. Limpie las gotas adicionales de KCl para evitar conexiones eléctricas no deseadas entre las ranuras.
- Añadir solución externa a las cámaras de baño bajas y medias.
- Coloque los puentes de agar en las ranuras en el colector de pellets AgCl de manera que una pierna por puente es en cada ranura. La otra pata de los puentes más tarde será colocado en las cámaras respectivas (P1, P2, los mejores CC; GS1, GS2 media (guardia), yo inferior). Asegúrese de que los puentes de alambre de platino se encuentran en la GS2, P2 y ranuras de E.
Nota: Asegúrese de puentes se lavan con agua destilada y secar completamente antes de insertarlo en la cámara de baño. - Encienda el sistema de adquisición de datos y el PC. Inicie el software de grabación.
5. Procedimiento a cielo abierto
- Instale los altos y medios cámaras de ovocitos sin un ovocito. Deslizar la cámara superior fuera del centro de manera que los agujeros en las dos cámaras no se superponen. Rellene todas las cámaras con una solución externa y colocar todos los electrodos en sus respectivas cámaras.
Nota: No presione la cámara de la parte superior hasta el fondo en la instalación de las cámaras. Asegúrese de que una pequeña brecha entre las dos cámaras. La disposición fuera del centro aumenta la resistencia del sistema de cámara para simular mejor la presencia de una célula. Este proceso, llamado "el equilibrio de los puentes", compensa el potencial de compensación que pueden derivarse de la falta de homogeneidad entre los puentes de agar.- Apague el comando externo y las dos abrazaderas. Compruebe la lectura de la corriente en el amplificador. Ajuste con un destornillador pequeño el P de desplazamiento en la parte posterior de la cabeza-etapa baño / guardia a la corriente nula.
- Apague el interruptor de baño / guardia en el amplificador para activar y ajustar la compensación para obtener la corriente cero GS.
- Repita entre "activo" y "pasivo" hasta que ambos son razonablemente cercana a cero (<100 nA).
- Retire la cámara de la parte superior y la transferencia de un ovocito en la cámara de baño de media usando una bomba de pipeta. Asegúrese de que el oocyTE se coloca sobre el agujero en el centro del baño.
Nota: Cuando se prepara un ovocito para VCF, coloque la celda marcada en la cámara con el polo animal (lado oscuro) hacia arriba. Orientación celular no importa si VCF no se está realizando. - Eliminar el exceso de solución externa de la parte inferior del baño utilizando un aspirador para crear un sello entre el ovocito y superficie del baño.
- Coloque la cámara de baño de la parte superior sobre el ovocito de modo que el agujero en la cámara se centra en la parte superior del ovocito. El uso de un dedo pulgar y el dedo medio, se aplica lentamente la presión hacia abajo en la cámara hasta que se presiona firmemente contra el ovocito para exponer sólo una pequeña parte de la membrana para el baño superior a través del agujero.
Nota: El ovocito puede sobresalir bajo la presión de la cámara superior. No aplique una fuerza excesiva a la cámara superior, ya que esto hará que el ovocito se rompa. Pinzas puntas colocadas en las esquinas diagonales de la cámara superior se puede utilizar como una alternativa a los dedos a Aplpresión a la baja y. - Añadir solución externa a los baños de arriba y abajo hasta que están casi llenos.
- Colocar las patas libres de los puentes de agar en la solución externa de cada baño, como se ve en la Figura 2 (la colocación de puente). Asegúrese de que cada puente está descansando en su ubicación correcta del baño. (I Puente en baño de abajo, GS1 y GS2 puentes en baño de media, y P1, P2 y puentes de CC en el baño superior). Apague el interruptor de baño / guardia en el amplificador a activo.
Nota: Asegúrese de que no hay conexiones de 3 M KCl entre los puentes, sus pozos, y las cámaras de grabación. Además, asegúrese de que los puentes se forman de manera que se elevan por encima de las soluciones de cámara de registro.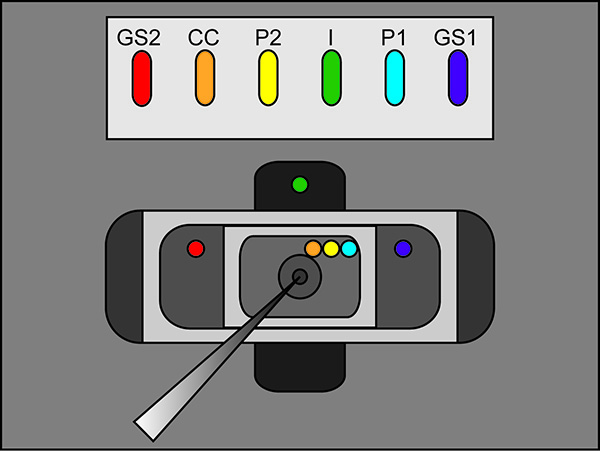
Figura 2. Ubicaciones Puente Agar Configuración Ubicación Diagrama. Colocación de los extremos libres de los puentes de agaren los distintos baños. Haz clic aquí para ver la imagen más grande . - Inicie un protocolo de prueba del software de grabación. Si el pulso muestra el desplazamiento vertical de la sección horizontal entre los dos picos al aplicar un pulso de 100 mV que es mayor que 100 nA (correspondiente a 0,3 MΩ con el baño / guardia en pasiva) a continuación, aumentar la estanqueidad de la tapa del baño. Ver Figura 3 para un ejemplo de un impulso de prueba ideal.
Nota: El protocolo de pruebas emite un pulso de tensión para ver si la tapa del baño es lo suficientemente apretado y todos los componentes se han montado correctamente. Alternativamente, la función de prueba del amplificador se puede utilizar.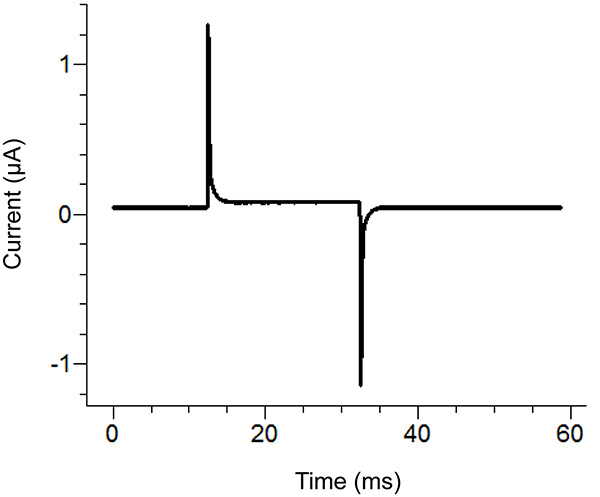
Figura 3. Ideal Impulso del ensayo del software de grabación. El impulso de pruebadebe ser similar a la del pulso anteriormente, dependiendo del protocolo aplicado. La corriente de mantenimiento (centro de referencia) debe estar cerca de cero. Haz clic aquí para ver la imagen más grande . - Retire la solución externa en el baño de abajo y reemplazarlo con una solución de saponina. Tenga cuidado de evitar la creación de burbujas mientras añade la saponina. Para asegurar la máxima reemplazo, aplicar succión en el extremo opuesto de la parte inferior de baño, mientras que la adición de la solución.
- Después de la solución de saponina se ha añadido, observar el impulso de prueba se repite. Si el pico del protocolo de pruebas reduce o desaparece, entonces es una señal de que hay una burbuja situado debajo del ovocito. En este caso, retire por completo y la solución de saponina entonces reemplazarlo.
Nota: La permeabilización típicamente se completa dentro de 30 segundos con solución de saponina fresco. Las soluciones pueden tener dificultades para llegar a la celda si hay burbujas atrapadaso si la capa folicular permanece en un oocito mal digeridos. El ovocito ha sido permeabilizadas (abierto) cuando la pendiente de la punta de voltaje disminuye (aumento de la constante de tiempo de decaimiento).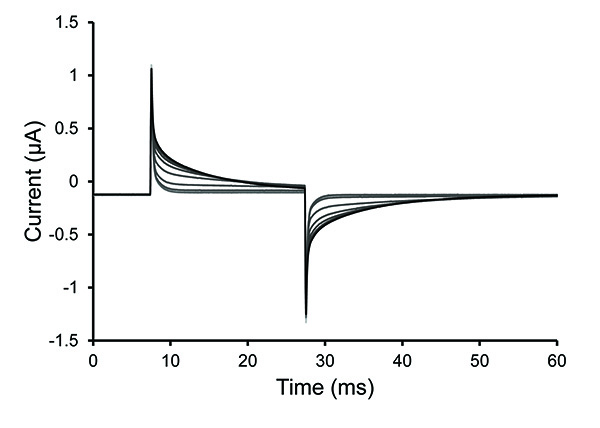
Figura 4. Impulso del ensayo Traces Durante ovocitos permeabilización. Trazas seleccionadas desde el protocolo de impulsos de prueba después de una solución de saponina 0,25% se introdujo en la cámara de ovocitos parte inferior. El aumento de la constante de tiempo de la decadencia observada en los trazos demuestra un aumento de la permeabilización de los ovocitos. Haga clic aquí para ver la imagen más grande . - Una vez que la célula se permeabilized, eliminar la solución de saponina y llenar la bañera con una solución interna. Detenga el protocolo de prueba.
Nota: A pesar de que la saponina permite el acceso a lainterior de la célula por permeabilización de la membrana, la equilibración de las concentraciones de iones entre el baño inferior y el citoplasma del ovocito por difusión es un proceso muy lento. Este proceso puede requerir decenas de minutos dependiendo de las condiciones (Figura 5). - Verifique que no haya un alto nivel de solución en los baños y se cristaliza KCl entre los pozos del colector, ya que pueden provocar cortocircuitos y un comportamiento errático.
- Utilice la jeringa modificada para inyectar 3 M KCl en un microelectrodo. Flick el microelectrodo varias veces con un dedo mientras sostiene con los otros dedos.
Nota: Este paso es necesario para eliminar las burbujas de aire atrapadas en el microelectrodo. - Monte el electrodo de relleno de KCl en el brazo micromanipulador insertando el filamento de alambre en el extremo de microelectrodos abierto. Empuje el extremo del microelectrodo en el soporte de filamento y asegúrese de que el electrodo no está suelto. Apretar el sujetador del electrodo.
Nota: Make asegurarse de que el alambre tiene un revestimiento uniforme AgCl para el electrodo para funcionar normalmente. - Gire el brazo en su posición sobre los baños de ovocitos y apriete las abrazaderas para evitar un mayor movimiento del brazo.
- Usando los botones de manipulador, caminar el electrodo hacia abajo en la bañera. Asegúrese de que no se aplica ningún impulso de prueba y que la función de prueba de la membrana no se activa en este punto.
Nota: Antes de la punta del electrodo se inserta en el líquido, V1-V2 en la tensión de la abrazadera leerá un voltaje positivo. Una vez que la punta del electrodo se inserta en el líquido, el medidor de tensión en la tensión de la abrazadera debe cambiar a un valor cercano a cero. Para grabaciones VCF, el electrodo necesita acercarse a la celda en un ángulo poco profundo para dejar espacio para el objetivo. Empalar la célula con el electrodo fuera del centro, más cerca del borde del parche de membrana aislada también ayuda a evitar la colisión del objetivo con el electrodo. - Deje de caminar el electrodo hacia abajo. Establezca la desviación del electrodopotencial a cero presionando el botón V1 y luego la reducción de la tensión V1 a cero mediante el ajuste del desplazamiento V1. Además, realizar el mismo ajuste para V2. La diferencia de potencial V1-V2 debe decir 000 mV.
- Cambie de nuevo a V1 y gire Z-test para medir la resistencia de los electrodos. El valor se reducirá gradualmente y acercarse a la resistencia real. Trate de mantener un valor de resistencia de 0,2-0,5 MΩ.
- Continúe caminando el electrodo hacia el parche visible del ovocito en el baño de arriba. Una vez que el microelectrodo es muy cerca del ovocito, ver la lectura V1-V2 para ver cuando el electrodo entra en el ovocito; la tensión V1-V2 se convertirá en negativo cuando el microelectrodo entra en la célula.
Nota: El valor que se muestra en este punto es el potencial de membrana de la célula y se verá afectado por los canales expresadas y las soluciones utilizadas. Inserción del microelectrodo demasiado puede dañar la membrana celular. - Abra el protocolo de recogida de datos en elsoftware de grabación.
- Mover sobre el cambio de bloqueo de la abrazadera de tensión y ajuste el potencial para que coincida con el comando (por ejemplo, -100 mV) ajustando la perilla ubicada en la "I" headstage.
- Voltear el interruptor de la capacitancia y la compensación de la resistencia.
- Da la vuelta al "Test" encender en la región "comandos" de la abrazadera de tensión. Utilice el osciloscopio para visualizar la señal. Ajuste las perillas de compensación Cm en el segmento de acondicionamiento de señal para reducir los transitorios capacitivos en el osciloscopio. No sobre-compensar los picos hasta el punto donde se producen picos inverso adicional o los picos comienzan a desarrollar una curvatura sigmoidea, que puede introducir artefacto en la grabación.
- Una vez que la capacidad se ha reducido de forma manual a un nivel satisfactorio, apague el interruptor de prueba.
- Comenzar el protocolo de registro de datos en el software de grabación.
6. Limpieza
- Cuando las grabaciones han de abejan finalizado, apague todos los diferentes interruptores en la fijación de voltaje, incluyendo la pinza y baño / interruptores de guardia.
- Use unas pinzas para quitar los puentes de agar a partir de los diversos baños.
- Retirar el baño de arriba y aspirar todas las soluciones y los ovocitos de todos los baños.
- Utilice una botella de agua desionizada para enjuagar todos los baños y luego aspirar los baños con una aspiradora. Repita este paso 3 a 5 veces.
- Limpie cristalizado KCl de los puentes y colocar los puentes en la solución de almacenamiento. Los puentes pueden ser reutilizados por varias semanas, siempre y cuando se almacenan correctamente.
- Aspirar la solución de KCl a partir de los pozos múltiples y enjuagar el colector con agua desionizada varias veces.
- Apague todos los diferentes equipos, incluyendo el control de la temperatura y el software de grabación.
7. La adición de la abrazadera de voltaje Fluorometría
- Siga los pasos indicados en la sección 1 a la 6 en un protocolo previamente publicado JoVE 16 Examining la Dinámica conformacional de proteínas de membrana in situ con fluorescencia Sitio dirigido Etiquetado: Haga clic aquí para ver la página.
- Lleve a cabo los pasos de la Sección 4 a 5.22 del protocolo COVG solicitado utilizando un microscopio VCF puesta a 4X enfoque.
Nota: Las grabaciones VCF requieren grandes cámaras de baño de los ovocitos de los necesarios en las mediciones COVG. (Las dimensiones de las cámaras VCF de encargo se encuentran en la lista de materiales.) Esta cámara de VCF más grande debe ser capaz de acomodar simultáneamente la lente del objetivo, microelectrodo, y puentes de agar. Además, el polo animal (lado oscuro del ovocito) necesita ser orientada hacia arriba en la cámara de bajo fondo grabaciones VCF. - Traer la parte superior del ovocito en el foco usando un objetivo de inmersión en agua 40X.
Nota: El cambio de la 4X con el objetivo de 40X requiere un ge específicametría de los componentes a cielo abierto y una cuidadosa atención a fin de no golpear el electrodo, puentes, o cámaras al bajar el objetivo de 40X. Por otra parte, debido al aumento del volumen de la protección superior, asegúrese de que el volumen del baño de la guardia de la parte superior no está conectado con el guardia de media, cuando el objetivo de 40X se fija en su lugar. - Centrarse en un anillo alrededor del perímetro de la superficie de los ovocitos expuestos, de manera que la parte superior del ovocito está ligeramente por encima del plano de enfoque.
Nota: El ajuste en el plano xy puede ser necesario para que el campo de visión está todo lleno de membrana y no la cámara. Traducción XY se logra más fácilmente mediante la colocación de un microscopio en una etapa de traducción. - Mueva el cubo de filtro en la trayectoria óptica y cambiar la trayectoria de la luz desde el ocular para el detector (diodo).
- Encienda la fuente de luz VCF.
- Apague las luces del techo, el iluminador de luz de fibra, y otras fuentes de luz.
Nota: Lo ideal sería que VCFgrabaciones deben realizarse en una habitación completamente a oscuras. - Ejecute un protocolo de fluorescencia en el software de grabación.
Resultados
La Figura 4 muestra el cambio en la permeabilidad de los ovocitos como una solución de saponina se aplica a la sección inferior del ovocito. Figura 5 demuestra la tasa de intercambio solución intracelular por difusión siguiente permeabilización de saponina. 20-40 min se requieren para llegar a un estado de equilibrio 2,18.
Figura 6A presenten trazas generadas desde el protocolo de grabación. La figura muestra las corrientes ...
Discusión
La vaselina ovocito técnica de fijación de voltaje brecha de corte abierto permite una rápida resolución de los datos, de poco ruido, aumenta el control sobre la solución interna y composición de la solución externa y grabaciones estables a través de protocolos relativamente largos 19. Estas ventajas establecen esta técnica, aparte de la fijación de voltaje de dos electrodos estándar y técnicas de patch clamp. Aunque se requiere equipo especializado y el protocolo es relativamente difícil, muy po...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Todos los miembros de la Universidad de Washington en St. Louis cardiaca Molecular Laboratorio de Ingeniería. A Burroughs Welcome Premio Fondo Carrera en la interfaz de la Ciencia - 1010299 (JS).
Materiales
| Name | Company | Catalog Number | Comments |
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Referencias
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados