Method Article
Un ratón, dos culturas: Aislamiento y cultivo de adultos Neural las células madre de las dos zonas neurogénicos de ratones individuales
En este artículo
Erratum Notice
Resumen
Aquí se describe un protocolo detallado para la generación simultánea de cultivos de células precursoras neurales, ya sea como monocapas o neuroesferas adherentes, de la zona subventricular y giro dentado de ratones adultos individuales.
Resumen
El ensayo de neuroesferas y el sistema de cultivo en monocapa adherente son herramientas valiosas para determinar el potencial (la proliferación o diferenciación) de las células madre neurales adultas in vitro. Estos ensayos se pueden usar para comparar el potencial de precursor de células aisladas de diferentes genéticamente o tratados diferencialmente animales para determinar los efectos de los factores exógenos sobre la proliferación de células precursoras neurales y diferenciación y para generar líneas de células neuronales precursoras que pueden ensayarse más de pasajes continuos. El ensayo de neuroesfera se utiliza tradicionalmente para la identificación post-hoc de las células madre, principalmente debido a la falta de marcadores definitivos con la que pueden ser aisladas a partir de tejido primario y tiene la gran ventaja de dar una estimación rápida de los números de células precursoras en el tejido cerebral derivados de animales individuales. Cultivos monocapa adherentes, en cambio, no se utilizan tradicionalmente para comparar la proliferación entre animales individuales, Como cada cultivo se inicia generalmente a partir del tejido combinado de entre 5-8 animales. Sin embargo, tienen la importante ventaja de que, a diferencia de neuroesferas, que consisten en una población en su mayoría homogénea de células precursoras y son útiles para seguir el proceso de diferenciación en células individuales. Aquí se describe, en detalle, la generación de los cultivos de neuroesferas y, por primera vez, cultivos adherentes de animales individuales. Esto tiene muchas implicaciones importantes, incluyendo el análisis pareado de la proliferación y / o diferenciación potencial tanto en la zona subventricular (SVZ) y giro dentado (DG) de líneas de ratones tratados o genéticamente diferentes, así como una reducción significativa en el uso de animales.
Introducción
El ensayo neuroesfera 1,2 y el cultivo en monocapa adherente 3,4, desarrollados a principios de 1990, siguen siendo el estándar de oro en los ensayos de células madre neurales in vitro. En estos ensayos, tejido primario se micro disecado de una región particular del cerebro, disocia en una única suspensión de células y se cultivaron en presencia de mitógenos el factor de crecimiento epidérmico (EGF) y factor de crecimiento de fibroblastos-2 (FGF2) para formar ya sea de libre flotación clusters (neuroesferas) o monocapas adherentes. Ambos sistemas tienen una serie de ventajas y desventajas y la consideración cuidadosa se debe dar a la cuestión que ha de abordarse antes de que se elija uno u otro sistema.
Neuroesferas permiten una fácil lectura de las diferencias en el número de células precursoras y potencial. Además, neuroesferas también son una herramienta útil para estudiar la especificación intrínseca de las células cuando se extraen de su ambiente externo normal. Extrínsecasic señales pueden ser estudiados por la simple adición del factor de interés para el medio de crecimiento y cuantificar el número y tamaño de las neuroesferas generadas. El principal inconveniente de neuroesferas sin embargo, es que forman su propio nicho, con las células en el centro de las neuroesferas (particularmente grandes neuroesferas) siendo más diferenciado que los de la superficie 5. Neuroesferas contienen una mezcla de células madre, los progenitores comprometidos, y células diferenciadas y las interacciones célula-célula dentro de las neuroesferas contrarrestar el mantenimiento de las células madre. Esta es la razón por neuroesferas contienen sólo un pequeño número de células madre verdaderos 6-8.
Cultivos monocapa adherentes también proporcionan un buen sistema in vitro para modelar en la proliferación in vivo. Cultivos adherentes, en el que las células se mantienen más aislados y homogéneos, pueden eliminar el carácter heterogéneo de la neuroesfera. Bajo estas condiciones de crecimiento de las células precursoras proliferan rapiDivino y casi todas las células se están dividiendo y expresan los marcadores precursoras neurales característicos Nestin, Sox2 y BLBP. La principal desventaja del sistema de cultivo monocapa en comparación con el ensayo de neuroesferas es que los clones derivados de precursores individuales no pueden ser controlados y cuantificados.
Un inconveniente de la mayoría de los protocolos para ambos tipos de cultivos ha sido la necesidad de utilizar un número relativamente grande de animales, debido a que el rendimiento de las estrategias de aislamiento a menudo ha sido pobre. Al mismo tiempo, se ha hecho evidente que la neurogénesis adulta contribuye a la individualización del cerebro 9, lo que resulta en la necesidad de modelos individualizados ex vivo también. Estas necesidades pueden ser satisfechas por los protocolos de "un ratón de un solo cultivo", tal como se describe en el presente informe.
El siguiente protocolo visual describe la generación simultánea de culturas precursoras neurales tanto de la ZVS y la DG de animales individuales, ya sea m como adherenteonolayers o como neuroesferas. La generación de las culturas de los animales individuales es particularmente útil cuando se requieren comparaciones entre animales tratados individualmente o varios transgénico individuo o ratones de tipo salvaje. Este protocolo incluye instrucciones detalladas para la microdisección simultánea de las regiones ZVS y la DG de ratones adultos, su disociación en una suspensión de células, cultivo in vitro, ya sea como cultivos monocapa adherentes o neuroesferas y análisis de pluripotencialidad y potencial a largo plazo, los dos cardinal propiedades de una célula madre de buena hueso.
Protocolo
1. Configuración básica y preparación del medio de cultivo
- Al menos dos días antes de comenzar el experimento, la preparación de poli-D-lisina (PDL) / laminina revestida de placas de cultivos monocapa adherentes. Para preparar pozo / frascos añadir suficiente PDL (10 mg / ml en dH 2 O) para cubrir la superficie e incubar durante la noche a temperatura ambiente. Eliminar la solución de la antena y lavar el plato tres veces con dH 2 O. Deje que se seque al aire. Añadir laminina (5 mg / ml en DMEM frío: F12) y se incuba a 37 ° C durante la noche. Retire la laminina y, o bien utilizar las placas de inmediato o guarde con la laminina a -20 ° C hasta su utilización.
- Preparar pipetas pulido fuego con agujeros "pequeños" "medio" y girando pipetas Pasteur de vidrio en una llama hasta que los bordes se redondean. Esterilizar en autoclave para esterilizar.
- En el día de la disección, preparar la cantidad apropiada de medio de cultivo por mezcla de los nervios medio basal con 2% B27, 1x GlutaMAX, 2 mg / ml de heparina, 50 unidades / ml de penicilina / estreptomicina, 20 ng / ml de factor de crecimiento epidérmico receptor purificado grado de ratón (EGF), y 20 ng / factor de crecimiento de fibroblastos bovina recombinante ml (FGF-2). Calentar el medio de cultivo a 37 ° C en un baño de agua.
- Para la disociación ZVS, preparar 0,05% de tripsina-EDTA y 0,125 mg / ml de inhibidor de la tripsina que contiene 0,01 mg / ml de ADNasa I. Equilibrar estas soluciones a 37 ° C.
- Establecer un microscopio de disección y preparar las herramientas necesarias para extraer el cerebro (tijeras y espátula pequeña) y para ZVS y la Dirección General de disecciones (bisturí, 27 G aguja unida a una jeringa de 1 ml, 1 x # 7 pinzas, 1 x # 5/45 fórceps) por inmersión en etanol al 70%.
2. La recolección de los cerebros de ratones adultos y SVZ / DG microdisecciones
- Anestesie adulto soltero (8 semanas de edad) los ratones de acuerdo con las directrices institucionales apropiados. Realice dislocación cervical.
- Pulverizar la cabeza con etanol al 70% para esterilizar el área y para reducir al mínimo la cantidad de piel que unadHères a las tijeras y el cerebro. Utilizando unas tijeras afiladas decapitar al animal en la base del tronco cerebral.
- Sostener la cabeza en la base del cráneo, cortar el cráneo entre los dos bulbos olfatorios colocando una hoja de un pequeño par de tijeras en cada cavidad de los ojos y el corte coronal. A continuación, hacer dos cortes laterales en la base del cráneo, seguido de un corte longitudinal a través del cráneo largo de la sutura sagital Precaución:. Aseguran el ángulo de la tijera es lo más planas posible para evitar daños en el cerebro subyacente.
- Exponer el cerebro, quitando el cráneo, ya sea con la hoja de la tijera o un par de pinzas curvas. Libere el cerebro del cráneo siguiendo una pequeña espátula y el lugar en PBS frío.
- Enjuague cerebros con PBS para eliminar la sangre y la piel.
- Transferencia cerebros para una placa de Petri de 10 cm de plástico que contenía PBS
- Coloque el plato de Petri que contiene el cerebro con un microscopio de disección a bajo aumento y posicionar el brain en su superficie ventral. Usando pinzas curvas finas eliminar los bulbos olfativos mientras mantiene el cerebro en posición por el cerebelo.
- Girar el cerebro en la cara dorsal y el uso de un bisturí hacer un corte coronal a través del cerebro a nivel del quiasma óptico
- Para microdissect la ZVS (para obtener instrucciones más detalladas, consulta Azari et al. 10), colocar la porción rostral del cerebro de manera que la superficie coronal cortar quede hacia arriba y enfocar el microscopio en un aumento mayor. Retire y deseche el tabique usando pinzas curvas finas.
- Diseccionar la SVZ (la capa delgada de tejido que rodea el ventrículo) mediante la colocación de la punta de una hoja de un par de pinzas curvas finas en la esquina lateral del ventrículo lateral inmediatamente debajo del cuerpo calloso y los otros aproximadamente 1 mm en el tejido inmediatamente adyacente al ventrículo. Presione hacia abajo la pinza hacia la base del plato y hacia la cara ventral del ventrArticulo para quitar una pequeña pieza triangular de tejido. Coloque la SVZ disecado en una placa de Petri en hielo.
- Para microdissect la DG (para obtener instrucciones más detalladas, consulta Hagihara et al. 11), colocar la porción caudal del cerebro en la placa de Petri y cortar a lo largo de la fisura longitudinal con un bisturí.
- Bajo un microscopio de disección, retire el cerebelo y el diencéfalo uso de fórceps.
- Reorientar el microscopio para que los bordes alrededor de la DG son ahora visibles. Para quitar el giro dentado, introduzca la punta de una aguja 27 G y se deslizan a lo largo de la frontera entre el Director General y el cuerno de Ammon. Usando las pinzas finas, liberar a la Dirección General de los tejidos circundantes.
3. La disociación de tejidos SVZ
- Picar el tejido usando una hoja de bisturí durante aproximadamente 1 min hasta que no hay piezas grandes permanecen.
- Transferir el tejido picado a un tubo de 15 ml usando 1 ml de precalentado 0,05% de tripsina-EDTA y se incuba durante 7 min enun baño de agua ajustado a 37 ° C.
- Para detener la reacción enzimática, añadir 1 ml de inhibidor de tripsina que contiene DNaseI y mezclar el contenido colocando el tubo.
- Pellet la suspensión por centrifugación a 300 xg durante 5 min y descartar el sobrenadante
- Resuspender el precipitado en 1 ml de medio de cultivo y se disocian pipeteando suavemente hacia arriba y hacia abajo de aproximadamente 7 a 10 veces con una pipeta P1000 Precaución:. Sobre trituración puede conducir a un aumento de la muerte celular y tendrá un impacto negativo sobre el crecimiento celular subsiguiente.
- Añadir medio de crecimiento a un volumen total de 5 ml y pasar la suspensión celular a través de un tamiz de 40 mm para eliminar los residuos y grumos de tejido no disociadas.
- Centrifugar a 300 xg durante 5 min, descartar el sobrenadante y resuspender el sedimento resultante en 200 ml de medio de crecimiento.
4. DG Tissue Disociación
- Picar el tejido usando una hoja de bisturí durante aproximadamente 1 min hasta que no hay piezas grandes permanecen y la transferenciaen precalentado mezcla de enzimas PDD (Papaína 2,5 U / ml de dispasa, 1 U / ml de ADNasa I, 250 U / ml). Incubar durante 20 min a 37 ° C, la mezcla invirtiendo el tubo cada 3-5 minutos.
- Disociar el tejido mecánicamente usando un calibre medio, el fuego pulido pipeta Pasteur de la pipeta hacia arriba y hacia abajo suavemente 10 veces.
- Incubar durante otros 10 min a 37 ° C, la mezcla invirtiendo el tubo cada 3-5 minutos.
- Además disociar el tejido mecánicamente usando un pequeño orificio, fuego pulido pipeta Pasteur de la pipeta hacia arriba y hacia abajo suavemente 10 veces.
- Se centrifuga a 130 × g durante 5 min.
- Eliminar el sobrenadante y resuspender el sedimento en 1 ml de solución tampón (1x HBSS, 30 mM de glucosa, 2 mM de HEPES (pH 7,4), 26 mM NaHCO 3). Completar hasta 10 ml con solución tampón.
- Se centrifuga a 130 × g durante 5 min.
- Aspirar el sobrenadante y resuspender el precipitado en 5 ml de 20% de Percoll. (Para preparar 90% de Percoll, añadir 4,5 ml de 100% de Percoll a 0,5 ml de 10x de PBS y después se diluye aún más esta a 20%mediante la adición de 1,1 ml de 90% de Percoll a 3,9 ml de 1x PBS).
- Centrifugar 450 xg durante 15 min.
- Eliminar el sobrenadante y resuspender el precipitado en 10 ml de tampón.
- Se centrifuga a 130 × g durante 5 min.
- Resuspender el sedimento en 200 l medio de crecimiento.
5. Generación de cultivos adherentes monocapa
- Placa de la ZVS disociada o tejido DG en un único PDL / laminina revestida pocillo de una placa de 96 pocillos y se incuba a 37 ° C con 5% de CO 2.
- Aproximadamente 24 horas después de la siembra, una vez que las células se han adherido a la superficie revestida, intercambiar el medio de crecimiento para eliminar adicionalmente el exceso de desechos.
- Cada posteriores 3-4 días, el intercambio de medio del medio de cultivo con medio fresco para reponer los factores de crecimiento.
- Repita hasta que las células alcanzan aproximadamente el 80% de confluencia y están listos para ser pasados Nota:. El tiempo entre las planchas y el primer paso puede tomar hasta 2-3 semanas.
- Cuando los cultivos alcanzan aproximadamente el 80% de confluencia eliminar el medio del pozo y lavar con PBS.
Nota: No permita que las células se exceden 90% de confluencia, ya que esto puede conducir a la separación de las células y la formación de neuroesfera y, además, el aumento de los niveles de muerte celular. - Añadir 50 ml Accutase y se incuba a 37 ° C durante 2-3 min (comprobación para ver si las células son redondas y distante).
- Retire las células a un tubo de 15 ml y lavar el bien una vez con PBS y transferir al mismo tubo.
- Diluir las células a 5 ml con PBS y centrifugar 300 xg durante 5 min.
- Para el primer pasaje, diluir las células a 1 ml y la placa en una PDL / laminina recubierto pocillo de una placa de 24 pocillos.
- Para pasos subsiguientes, volver a suspender las células en 200 ml de medio de crecimiento y el recuento utilizando un hemocitómetro. Placa a 1 x 10 4 células / cm 2 en el que esté bien cubierto de tamaño apropiado o frasco. i>
7. La diferenciación de cultivos adherentes monocapa
- Para diferenciar los cultivos monocapa adherentes, la placa de la proliferación de células en PDL / cubreobjetos recubiertos de laminina a una densidad de 1 x 10 4 células / cm 2 en medio de crecimiento que contiene 20 ng / ml de EGF y 10 ng ml de bFGF /.
- Cuando las células alcanzan aproximadamente el 80% de confluencia (generalmente 2 días), sustituir el medio de cultivo con medio que contiene 5 ng / ml de bFGF y 0 ng / ml de EGF.
- Después de 2 días en 5 ng / ml de bFGF, sustituir el medio con medio de crecimiento en ausencia de ambos mitógenos durante otros 3 días Nota:. Durante este período se produzca una cantidad significativa de la muerte celular.
- Después de un total de 5 días, se lavan las células diferenciadas con PBS para eliminar cualquier célula muerta luego fijar con 4% de paraformaldehído (PFA) durante 20 min a temperatura ambiente.
- Lavar a continuación con PBS para eliminar cualquier cubreobjetos PFA y almacenar en pozos en 1 ml de PBS a 4 ° C.
- Diluir la SVZ disociada o tejido DG de un animal en 20 ml de medio de cultivo y la placa 200 ml / pocillo en una placa de 96 pocillos usando una pipeta de 10 ml multidoser.
- Se incuba a 37 ° C con 5% de CO 2 durante 6-7 días para neuroesferas derivadas de SVZ y 10-12 días para neuroesferas derivadas de la DG.
Nota: el crecimiento durante más de estos tiempos de incubación recomendados resultará en el crecimiento excesivo y dará lugar a la muerte celular en el centro de las neuroesferas y / o, apego espontáneo y la diferenciación. - Contar y medir el diámetro de las neuroesferas usando una retícula ocular montado en un microscopio de luz en posición vertical
9. Pasar las neuroesferas
Después de las neuroesferas primarias han sido contados y su tamaño grabado que se puede ampliar a través de varios pasajes que comienzan con un único neuroesfera o un cultivo en masa.
- Bulk expansión cultura neuroesfera
- Para paso neuroesferas combinados como un cultivo en masa, retire el medio que contiene las neuroesferas de la placa, transferir a un tubo de 15 ml y centrifugar a 300 xg durante 5 min.
- Desechar el sobrenadante y resuspender las neuroesferas en 1 ml de precalentado 0,05% de tripsina-EDTA y se incuba a temperatura ambiente durante 3 min.
- Añadir un volumen igual de inhibidor de tripsina que contiene DNaseI y mezclar bien.
- Centrifugar durante 5 min a 300 xg, eliminar el sobrenadante y añadir 1 ml de medio de crecimiento.
- Triturar arriba y hacia abajo aproximadamente 10 veces con una pipeta P1000 para disociar las neuroesferas.
- Eliminar 10 ml de la suspensión celular y se mezclan con un volumen igual de azul de tripano y realizar un recuento de células vivas utilizando un hemocitómetro.
- Resiembre las células a una densidad de 1 x 10 4 células / cm 2 en el cultivo de células de tamaño adecuado o bien matraz.
- Incubar a 37 ° Ccon 5% de CO 2 hasta que se formen neuroesferas secundarias.
- Expansión individual neuroesfera
- Para pasaje neuroesferas individuales eligen pozos que contienen un único neuroesfera y retirar con cuidado y descartan aproximadamente 160 l de medio de crecimiento de cada pocillo sin alterar la neuroesfera.
- Añadir 100 ml de 0,05% de tripsina-EDTA a cada pocillo para ser pasado y se incuba a temperatura ambiente durante 3 min.
- Añadir 100 l de inhibidor de la tripsina que contiene DNAseI para detener la reacción.
- Triturar aproximadamente 10 veces arriba y abajo con una pipeta P200 para romper el neuroesfera.
- Transferir los 200 ml que contiene la neuroesfera disociada a un nuevo pocillo de una placa de 24 pocillos que contenía 1,5 ml de medio de crecimiento. Se incuba a 37 ° C con 5% de CO 2 hasta que se formen neuroesferas secundarias.
Nota: para determinar el potencial a largo plazo, una de las propiedades cardinales de un verdadero s neuronalescélula TEM, neuroesferas debe ser pasado por lo menos 5 a 10 pasajes. Véase también la bibliografía sobre el controvertido papel en la interpretación de estos resultados 12-14.
10. La diferenciación de las Culturas Neurosphere
Neuroesferas primarias o con pases pueden ser diferenciados para determinar multipotencialidad.
- Retire neuroesferas en la suspensión de su placa de cultivo o frasco y transferirlos a un 10 cm placa Petri de plástico.
- Bajo un microscopio de disección eliminar aproximadamente 15-20 neuroesferas a partir del medio utilizando una pipeta P20 y transferir a una placa de 24 pocillos que contenía medio de cultivo sin factores de crecimiento y un cubreobjetos recubiertos PDL / laminina.
- Diferenciar por aproximadamente 7 días a 37 ° C con 5% de CO 2.
- Lavar las neuroesferas diferenciados con PBS para eliminar cualquier célula muerta luego fijar con PFA al 4% durante 20 min a temperatura ambiente.
- Lavar a continuación con PBS para rquítelo cualquier cubreobjetos PFA y almacenar en pozos en 1 ml de PBS a 4 ° C
11. La inmunotinción de Neurosphere y cultivos adherentes
Nota: Para la tinción con el anticuerpo O4 omitir el Tritón de las etapas de bloqueo y de tinción y recuerde usar un anticuerpo secundario IgM apropiado.
- Incubar los cubreobjetos que contienen las neuroesferas diferenciados o cultivos monocapa adherentes en solución de bloqueo (10% de suero normal de burro en PBS que contenía 0,2% de Triton X-100) durante 60 min a temperatura ambiente.
- Incubar en solución de bloqueo fresco que contiene bIII-tubulina primaria, Map2a + B, la proteína ácida fibrilar glial (GFAP) o anticuerpos O4 para 60min a temperatura ambiente.
- Lavar 3 veces con PBS.
- Incubar en solución de bloqueo fresco que contiene de fluorescencia anticuerpos secundarios conjugados apropiados y 4,6-diamino-2-fenilindol (DAPI; 1:5.000) durante 30 min a temperatura ambiente en la oscuridad.
- lavar tres veces con PBS.
- Montar los cubreobjetos en portaobjetos de microscopio de fluorescencia utilizando el montaje mediano y aire seco en la oscuridad durante la noche
- Ver e imagen usando un microscopio de fluorescencia.
Resultados
Aunque las dos regiones neurogénicas del cerebro adulto de ratón contienen tanto células precursoras neurales, estas células pueden comportarse de manera muy diferente cuando se cultivan in vitro. Los cultivos monocapa adherentes generados a partir de ambas regiones parecen morfológicamente indistinguibles (Figura 1A), sin embargo, los cultivos adherentes derivadas de SVZ proliferan más rápidamente y necesitan ser passaged, en promedio, 1-2 días antes de los derivados de la DG. Como neuroesferas, las células precursoras derivadas de SVZ también proliferan más rápidamente y formar neuroesferas más grandes (Figura 1B) que las células precursoras derivadas de la DG (Figura 1C). Mientras neuroesferas derivadas de SVZ suelen contarse después de 6-7 días de cultivo, neuroesferas derivadas-DG se suelen cuantificarse después de 10-12 días. Además, un número mucho mayor de células precursoras neurales residen en la SVZ en comparación con la DG, como lo demuestra el casi 10 veces mayor número de neuroesferas que pueden ser génerosTed de esta región (ZVS: 1173 ± 74,9 vs DG: 145,3 ± 26,4, p = <0,0001, n = 10 animales por grupo; Figura 2A).
Los estudios han demostrado que las células precursoras dentro de la SVZ y la DG responden a diferentes estímulos. Las células precursoras en la DG se activan por tipos específicos de aprendizaje espacial y por estímulos tales como el enriquecimiento ambiental y la actividad física, mientras que las células precursoras SVZ se activan por el aprendizaje olfativo y el enriquecimiento olfativa. Consistente con esto, uno de nosotros (TLW) previamente demostrado que la DG contiene una población de vástago latente y células progenitoras que se puede activar por la excitación de los nervios 15-18. En contraste, encontramos que las células precursoras SVZ responden de manera muy diferente a este estímulo, con una disminución en el número de neuroesferas en respuesta a la despolarización de los niveles de KCl 17. Aquí, hemos repetido este experimento, plateando la mitad de las células aisladas derivadas de la ZVS y la DG de individual animales en despolarizar niveles de KCl y la otra mitad en control de los niveles de KCl. Se demuestra, como anteriormente, que mientras que las células precursoras DG se activan por la despolarización (101,2 ± 17,4 vs 184,8 ± 12,5, p = 0,005, n = 5 animales), la proliferación de las células derivadas de la SVZ es, de hecho, disminuyó significativamente ( 368,0 ± 62,9 vs 266,6 ± 41,6, p = 0,02, n = 5 animales; Figura 2B).
Para confirmar el potencial a largo plazo, una de las características cardinales de una célula madre verdadera, neuroesferas individuales o cultivos monocapa adherentes debe ser capaz de expansión extendida es decir, sobre al menos 10 pasajes. En cada paso, después de la preparación de una suspensión de una sola célula, el número de células se cuenta y la expansión de plegado se calcula. El total de células teórica se calcula entonces multiplicando la expansión veces durante ese paso por el total teórico del paso anterior. Este es DISP retardada en forma de gráfico de línea con el número de pases conspirado contra el log10 del número total de células teórico (ver ejemplo Figura 3). Para confirmar multipotencialidad, ambos cultivos en monocapa y neuroesferas se pueden diferenciar por la retirada por mitógenos y aparecen para dar lugar a las neuronas y la glía (Figura 4).
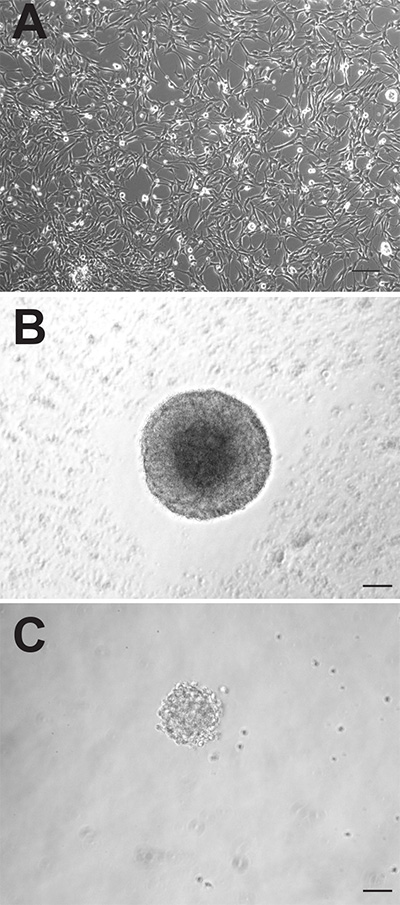
. Figura 1 las células precursoras de ratones adultos pueden ser cultivadas como cultivos monocapa adherentes (A) o como neuroesferas (B: SVZ, C: DG).. Barra de escala es 50 mm Haz clic aquí para ver la imagen más grande.
load/51225/51225fig2highres.jpg "src =" / files/ftp_upload/51225/51225fig2.jpg "/>
Figura 2. Significativamente más neuroesferas se generan a partir de la SVZ en comparación con la DG de ratones sola (A). Las células precursoras SVZ y DG responden de manera diferente a la despolarización in vitro (B).

Figura 3. Para confirmar la potenciación a largo plazo, neuroesferas se expandió por más de 10 pasajes.

Figura 4. Neuroesferas pueden diferenciarse en bIII-tubuneuronas lin + (A: rojo), astrocitos GFAP + (A: verde), O4 + oligodendrocitos (B: rojo) y MAP2ab + neuronas (C: rojo). Haz click aquí para ver la imagen más grande.
Discusión
Este artículo presenta un protocolo detallado para la iniciación de las culturas precursoras neurales, tanto como monocapas adherentes y neuroesferas, desde las dos principales regiones neurogénicos del cerebro del ratón adulto. Hay una serie de puntos importantes que se deben tener en cuenta a la hora de intentar cualquiera de estos sistemas de cultivo in vitro en. En primer lugar, la elección del método de disociación es muy importante y es dependiente de tejido. En nuestras manos, 0,05% de tripsina-EDTA es muy eficaz para la disociación de tejido ZVS, y resulta en un mayor número de neuroesferas que cuando se utiliza una técnica de disociación basada en la papaína. Para la disociación del tejido DG sin embargo, se recomienda encarecidamente un enfoque basado en la disociación papaína. Al comparar directamente los dos métodos de disociación en el tejido DG, se observó un rendimiento significativamente menor de células viables y aproximadamente 10 veces menos neuroesferas utilizando tripsina. Esta diferencia en la disociación podría ser debido a la diferencia en el tejido COMPOSICIOn entre las dos regiones. El tejido compacto de la DG está rodeado por un extenso neuropil y grandes daños de los procesos celulares puede ocurrir durante la disociación.
Un segundo punto importante a destacar es que, mientras que el ensayo neuroesfera puede ser útil para hacer declaraciones cuantitativos sobre el número de células precursoras presentes en una muestra de tejido dado, cierta precaución debe, sin embargo, ser empleado en la interpretación de estas cifras absolutas. Fusión de neuroesferas puede ser un factor de confusión importante. Varios estudios han demostrado que las neuronas son muy móviles y se pueden fundir, incluso bajo qué condiciones son supuestamente 'clonales' 7,19. La frecuencia de neuroesferas resultante puede ser muy dependiente de factores, incluyendo los componentes del medio, el procedimiento de disección y el proceso de disociación. Incluso entre los manipuladores experimentados alguna variación en el número de neuroesferas generadas a partir de muestras supuestamente idénticos es evidente (ver Figura 1A.) Más útil, es una comparación directa de la frecuencia de precursores entre dos muestras dadas (es decir, control vs tratada o de tipo salvaje vs ronda) manipulados por la misma persona dentro de un solo experimento, en lugar de una declaración cuantitativa del total número de células precursoras.
Al decidir cuál de los dos métodos de cultivo es el más adecuado para un experimento particular, es importante tener en cuenta que estos dos sistemas de cultivo difieren en la homogeneidad de los tipos de células generadas. En comparación con la proliferación de cultivos de células adherentes, que muestran una piscina célula precursora bastante homogénea (~ 98% de las células son Sox2 +) 20, neuroesferas son más heterogéneas y contienen, así como la proliferación de células precursoras, las neuronas diferenciadas, y astrocitos 21,22. Es importante que las neuroesferas no se cultivan durante largos períodos de tiempo entre pasajes como el más grande de la neuroesfera convertido en el más probable es encontrar tipos de células diferenciadas en su núcleo.
Tradicionalmente Iniciamos monocapa culturas precursoras neurales adherentes del tejido DG de entre 5-8 ratones. Por lo tanto, cuando se trata de establecer los cultivos en monocapa adherentes de la DG o SVZ de un solo ratón, el mayor cuidado debe ser tomado durante el procedimiento de disociación de tejidos con el fin de evitar la excesiva muerte celular causada por más de trituración del tejido, o tomar extendió períodos de tiempo entre la disección y etapas de cultivo finales. Este protocolo describe, por primera vez, la generación de cultivos monocapa adherentes precursores tanto de la SVZ y la DG de animales individuales. Hay muchos casos en que la comparación de la proliferación y diferenciación de precursores necesita ser hecho en una sola base animal. Estas incluyen la habilidad para comparar directamente la DG y SVZ de los animales individuales utilizando estadísticas pareadas y para vincular los datos de cultivo con datos conductuales o fisiológicas individuales 9. Culturas individuales animales también albajo el uso de animales raros transgénicos, en los que no es posible una reserva de 8.5 donantes por la cultura de coincidencia de edad, así como los animales únicos (por ejemplo, cruces F2 o animales criados fuera) para estudios de asociación genética.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
TLW fue apoyado por una Marie Curie Fellowship Internacional entrante. Este trabajo también se financió con fondos institucionales básicos, Bundesministerium für Bildung y Forschung (BMBF) de financiación y en parte con el apoyo de la prioridad del Programa de Investigación (SFB) 655 a GK. Los autores desean agradecer a Anne Karasinsky para el cuidado y mantenimiento de todos los animales utilizados en este estudio y Odette Leiter, Susann Ruhwald, Fanny Boehme, y Richard Wetzel para el cultivo celular y la asistencia de microscopía.
Materiales
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P7280-5MG | |
| Laminin | Roche | 11243217001 | |
| Glass Pastuer pipettes | Volac | BS5732 | |
| DMEM:F12 (1:1) 1x | Life Technologies | 21331-020 | |
| Neural Basal Medium (1x) | Life Technologies | 21103-049 | |
| B27 supplements (50x) | Life Technologies | 17504-044 | |
| GlutaMAX | Life Technologies | 35050-038 | |
| Heparin | Sigma | H3393 | |
| Penacillin/Streptomycin | Life Technologies | 15140-122 | |
| EGF | PeproTech | AF-100-15 | |
| bFGF | PeproTech | 100-18B | |
| 0.05% Trypsin-EDTA | Life Technologies | 25300-054 | |
| Trypsin inhibitor | Sigma | T6522 | |
| DNaseI | Roche | 10104159001 | |
| Accutase | PAA | L11-007 | |
| Papain | Worthington | LS003120 | |
| Dispase | Life Technologies | 17105-041 | |
| Percoll | GE Healthcare | 17-0891-02 | |
| HBSS (with Calcium and Magnesium) | Life Technologies | 14025-050 | |
| Glucose | Roth | X997.2 | |
| HEPES | Sigma | H3375-500G | |
| NaHCO3 | Merck | K39347429847 | |
| 1 ml Syringes | Braun | 2016-10 | |
| 27 G Needles | Braun | 4657705 | |
| Scalpels (#22 disposable) | Braun | BA222 | |
| Dumont #7 forceps | FST | 11271-30 | |
| Dumont 5/45 forceps | FST | 11251-35 | |
| Scissors | FST | 14060-10 | |
| Iris spatula | FST | 10093-13 | |
| 70% Ethanol | |||
| PBS | Life Technologies | 14040-091 | |
| flasks/well plates | TPP | 92696 | |
| PFA (4%) | Sigma | P6148 | |
| Hemocytometer | Marienfeld | 650010 | |
| Trypan blue (0.4%) | Sigma | T8154 | |
| NDS | Millipore | 530 | |
| TritonX-100 | Sigma | T9284 | |
| Mouse monoclonal bIII-tubulin antibody | Promega | G712A | |
| Rabbit polyclonal glial fibrillary acidic protein antibody | Dako | 20334 | |
| O4 | R&D Systems | MAB1326 | |
| Map2a+b | Sigma | M1406 | |
| Donkey anti-mouse Cy3 antibody | Jackson ImmunoResearch | 715-505-151 | |
| Donkey anti-rabbit Alexa488 | Dianova | 711-545-152 | |
| 4,6-Diamidino-2-phenylindole (DAPI) | Invitrogen | 861405 | |
| Aqua Polymount | Polysciences Inc | 18606 | |
| 10 ml Combi tips | Eppendorf | 30089677 | |
| Plastic 10 ml and 25 ml serological pipettes | Corning | 4488/4489 | |
| EQUIPMENT | |||
| Pipetboy | Integra Biosciences | 521942 | |
| Multidoser pipette | Eppendorf | ||
| 37 °C waterbath | |||
| Dissecting microscope | |||
| 37 °C:5% CO2 incubator | |||
| Centrifuge | Eppendorf | 5810R |
Referencias
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1-13 (1996).
- Palmer, T. D., Ray, J., Gage, F. H. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol. Cell. Neurosci. 6, 474-486 (1995).
- Ray, J., Raymon, H. K., Gage, F. H. Generation and culturing of precursor cells and neuroblasts from embryonic and adult central nervous system. Methods Enzymol. 254, 20-37 (1995).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993, 18-29 (2003).
- Babu, H., Cheung, G., Kettenmann, H., Palmer, T. D., Kempermann, G. Enriched monolayer precursor cell cultures from micro-dissected adult mouse dentate gyrus yield functional granule cell-like neurons. PLoS One. 2, (2007).
- Jessberger, S., Clemenson, G. D., Gage, F. H. Spontaneous fusion and nonclonal growth of adult neural stem cells. Stem Cells. 25, 871-874 (2007).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565-4574 (1992).
- Freund, J., et al. Emergence of individuality in genetically identical mice. Science. 340, 756-759 (2013).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J. Vis. Exp. , (2010).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. J. Vis. Exp. , (2009).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol. Neurobiol. 34, 153-161 (2006).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell. Stem Cell. 8, 486-498 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres- re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Walker, T. L., Turnbull, G. W., Mackay, E. W., Hannan, A. J., Bartlett, P. F. The latent stem cell population is retained in the hippocampus of transgenic Huntington's disease mice but not wild-type mice. PLoS One. 6, (2011).
- Walker, T. L., et al. Prolactin stimulates precursor cells in the adult mouse hippocampus. PLoS One. 7, (2012).
- Walker, T. L., et al. Latent stem and progenitor cells in the hippocampus are activated by neural excitation. J. Neurosci. 28, 5240-5247 (2008).
- Walker, T. L., et al. Prominin-1 allows prospective isolation of neural stem cells from the adult murine hippocampus. J. Neurosci. 33, (2013).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Front. Neurosci. 5, 89 (2011).
- Parmar, M., Sjoberg, A., Bjorklund, A., Kokaia, Z. Phenotypic and molecular identity of cells in the adult subventricular zone in vivo and after expansion in vitro. Mol. Cell Neurosci. 24, 741-752 (2003).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99, 14506-14511 (2002).
Erratum
Formal Correction: Erratum: One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice
Posted by JoVE Editors on 11/26/2014. Citeable Link.
A correction was made to One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Many micro symbols were changed into milli symbols by accident: In the Protocols, sections 1.1, 1.3, 3.6, 3.7, 6.2, 6.6, 8.1, 9.1.6, 9.2.2, and 9.2.5 need to be fixed, as does Figure 1 description in the Results section.
Protocol section 1.1 was changed from:
At least two days prior to commencing the experiment, prepare Poly-D-lysine (PDL)/Laminin coated plates for adherent monolayer cultures. To prepare wells/flasks add enough PDL (10 mg/ml in dH2O) to coat the surface and incubate overnight at room temperature. Remove the solution from the dish and wash the dish three times with dH2O. Allow to air dry. Add Laminin (5 mg/ml in cold DMEM:F12) and incubate at 37 °C overnight. Remove the Laminin and either use the plates immediately or store with the Laminin at -20 °C until required.
to:
At least two days prior to commencing the experiment, prepare Poly-D-lysine (PDL)/Laminin coated plates for adherent monolayer cultures. To prepare wells/flasks add enough PDL (10 µg/ml in dH2O) to coat the surface and incubate overnight at room temperature. Remove the solution from the dish and wash the dish three times with dH2O. Allow to air dry. Add Laminin (5 µg/ml in cold DMEM:F12) and incubate at 37 °C overnight. Remove the Laminin and either use the plates immediately or store with the Laminin at -20 °C until required.
Protocol section 1.3 was changed from:
On the day of dissection, prepare the appropriate amount of culture medium by mixing Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 µg/ml heparin, 50 units/ml Penicillin/Streptomycin, 20 ng/ml purified mouse receptor-grade epidermal growth factor (EGF), and 20 ng/ml recombinant bovine fibroblast growth factor (FGF-2). Warm the culture medium to 37 °C in a water bath.
to:
On the day of dissection, prepare the appropriate amount of culture medium by mixing Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 mg/ml heparin, 50 units/ml Penicillin/Streptomycin, 20 ng/ml purified mouse receptor-grade epidermal growth factor (EGF), and 20 ng/ml recombinant bovine fibroblast growth factor (FGF-2). Warm the culture medium to 37 °C in a water bath.
Protocol section 3.6 was changed from:
Add growth medium to a total volume of 5 ml and pass the cell suspension through a 40 mm sieve to remove debris and undissociated tissue clumps.
to:
Add growth medium to a total volume of 5 ml and pass the cell suspension through a 40 µm sieve to remove debris and undissociated tissue clumps.
Protocol section 3.7 was changed from:
Centrifuge at 300 x g for 5 min, discard the supernatant and resuspend the resulting pellet in 200 ml growth medium.
to:
Centrifuge at 300 x g for 5 min, discard the supernatant and resuspend the resulting pellet in 200 µl growth medium.
Protocol section 6.2 was changed from:
Add 50 ml Accutase and incubate at 37 °C for 2-3 min (checking to see if the cells are rounded and detached).
to:
Add 50 µl Accutase and incubate at 37 °C for 2-3 min (checking to see if the cells are rounded and detached).
Protocol section 6.6 was changed from:
For subsequent passages, resuspend cells in 200 ml growth medium and count using a hemocytometer. Plate at 1 x 104 cells/cm2 in the appropriate sized coated well or flask.
to:
For subsequent passages, resuspend cells in 200 µl growth medium and count using a hemocytometer. Plate at 1 x 104 cells/cm2 in the appropriate sized coated well or flask.
Protocol section 8.1 was changed from:
Dilute the dissociated SVZ or DG tissue from one animal in 20 ml of culture medium and plate 200 ml/well across a 96-well plate using a 10 ml multidoser pipette.
to:
Dilute the dissociated SVZ or DG tissue from one animal in 20 ml of culture medium and plate 200 µl/well across a 96-well plate using a 10 ml multidoser pipette.
Protocol section 9.1.6 was changed from:
Remove 10 ml of the cell suspension and mix with an equal volume of trypan blue and perform a live cell count using a hemocytometer.
to:
Remove 10 µl of the cell suspension and mix with an equal volume of trypan blue and perform a live cell count using a hemocytometer.
Protocol section 9.2.2 was changed from:
Add 100 ml of 0.05% Trypsin-EDTA to each well to be passaged and incubate at room temperature for 3 min.
to:
Add 100 µl of 0.05% Trypsin-EDTA to each well to be passaged and incubate at room temperature for 3 min.
Protocol section 9.2.5 was changed from:
Transfer the 200 ml containing the dissociated neurosphere to a new well of a 24-well plate containing 1.5 ml of growth medium. Incubate at 37 °C with 5% CO2 until secondary neurospheres form.
to:
Transfer the 200 µl containing the dissociated neurosphere to a new well of a 24-well plate containing 1.5 ml of growth medium. Incubate at 37 °C with 5% CO2 until secondary neurospheres form.
Figure 1 description was updated from:
Figure 1. Adult mouse precursor cells can be cultured as adherent monolayer cultures (A) or as neurospheres (B: SVZ, C: DG). Scale bar is 50 mm.
to:
Figure 1. Adult mouse precursor cells can be cultured as adherent monolayer cultures (A) or as neurospheres (B: SVZ, C: DG). Scale bar is 50 µm.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados