Method Article
Un mouse, due culture: isolamento e la coltura di Adult Neural Stem Cells dalle due zone neurogena Mice individuale
In questo articolo
Erratum Notice
Riepilogo
Qui si descrive un protocollo dettagliato per la generazione simultanea di colture di cellule precursore neuronali, sia come monostrati aderenti o neurosfere, dalla zona subventricolare e giro dentato di singoli topi adulti.
Abstract
Il saggio neurosfere e il sistema di coltura monostrato aderente sono strumenti utili per determinare il potenziale (proliferazione o differenziazione) di cellule staminali neurali adulte in vitro. Questi saggi possono essere utilizzati per confrontare il potenziale precursore di cellule isolate da animali geneticamente differenti o differenzialmente trattati per determinare gli effetti dei fattori esogeni sulla proliferazione cellulare precursore neurale e la differenziazione e per generare linee cellulari precursori neurali che possono essere dosati sopra continui passaggi. Il saggio neurosfere è tradizionalmente utilizzato per l'identificazione post-hoc di cellule staminali, principalmente a causa della mancanza di marcatori definitivi con cui possono essere isolate dal tessuto primario e ha il grande vantaggio di fornire una rapida stima del numero di cellule precursore nel tessuto cerebrale derivati da singoli animali. Colture monostrato aderenti, al contrario, non sono tradizionalmente utilizzati per confrontare proliferazione tra i singoli animali, Come ogni cultura è generalmente iniziata dal tessuto combinato di tra 5-8 animali. Tuttavia, essi hanno il grosso vantaggio che, a differenza neurosfere, sono costituiti da una popolazione prevalentemente omogenea di cellule precursori e sono utili per seguire il processo di differenziazione in cellule singole. Qui, descriviamo, in particolare, la generazione di colture di neurosfere e, per la prima volta, colture aderenti da singoli animali. Questo ha molte implicazioni importanti compresa l'analisi abbinato della proliferazione e / o potenziale di differenziazione sia nella zona subventricolare (SVZ) e giro dentato (DG) delle linee topo trattato o geneticamente diversi, così come una riduzione significativa dell'uso di animali.
Introduzione
Il test neurosfere 1,2 e la cultura monostrato aderente 3,4, entrambi sviluppati nei primi anni 1990, rimangono ancora il gold standard in vitro di cellule staminali neurali. In questi saggi, il tessuto primario è micro sezionato da una particolare regione del cervello, dissociato in una sospensione di cellule singole e coltivate in presenza del fattore mitogeni crescita epidermico (EGF) e fattore di crescita dei fibroblasti-2 (FGF2) per formare sia liberamente fluttuante cluster (neurosfere) o monostrati aderenti. Entrambi i sistemi hanno una serie di vantaggi e svantaggi e attenta deve considerare la questione che deve essere affrontata prima viene scelto uno o l'altro sistema.
Neurosfere consentono una semplice lettura di differenze nel numero di cellule precursori e le potenzialità. Inoltre, neurosfere sono anche uno strumento utile per studiare specifica intrinseca delle cellule ritirati dalle loro ambiente esterno normale. Extrinspunti sic possono essere studiate semplicemente aggiungendo il fattore di interesse al mezzo di crescita e quantificare il numero e la dimensione delle neurosfere generati. Il principale inconveniente di neurosfere tuttavia, è che essi formano la propria nicchia, alle cellule al centro delle neurosfere (particolarmente grandi neurosfere) essendo più differenziato rispetto a quelli sulla superficie 5. Neurosfere contengono una miscela di cellule staminali, progenitori commessi, e le cellule differenziate e le interazioni cellula-cellula all'interno delle neurosfere contrastare il mantenimento delle cellule staminali. Questo è il motivo neurospheres contengono solo un piccolo numero di cellule staminali vere 6-8.
Colture monostrato aderenti forniscono anche un buon sistema in vitro per modellare nella proliferazione vivo. Colture aderenti, in cui le cellule rimangono più isolato ed omogeneo, in grado di eliminare l'eterogeneità del neurosfere. In queste condizioni di crescita delle cellule precursori proliferano rapiRIT E quasi tutte le cellule si dividono ed esprimono le caratteristiche marcatori precursori neurali Nestin, Sox2, e BLBP. Il principale svantaggio del sistema di coltura monostrato rispetto al saggio neurosfere è che i singoli cloni derivati da precursori sono in grado di monitorare e quantificato.
Un inconveniente di molti protocolli per entrambi i tipi di colture è stata la necessità di utilizzare un numero relativamente alto di animali, poiché il rendimento delle strategie di isolamento è stato spesso scarsa. Allo stesso tempo, è diventato chiaro che neurogenesi adulta contribuisce all'individuazione del cervello 9, con la conseguente necessità di ex vivo di modelli individualizzati pure. Queste esigenze possono essere soddisfatte dai protocolli "one-topo-one-cultura", come descritto nella presente relazione.
Il seguente protocollo visivo descrive la generazione simultanea di culture precursori neurali sia dal SVZ e DG di singoli animali sia m come aderenteonolayers o come neurosfere. La generazione delle culture dei singoli animali è particolarmente utile quando è necessario il confronto tra gli animali trattati individualmente o varie transgenico individuali o topi wild-type. Questo protocollo include istruzioni dettagliate per la microdissezione simultanea delle regioni SVZ e DG di topi adulti, la loro dissociazione in una sospensione singola cella, coltura in vitro sia come colture monostrato aderenti o neurosfere e analisi di multipotenzialità e potenziale a lungo termine, i due cardinali proprietà di una cellula staminale fide dell'osso.
Protocollo
1. Impostazioni di base e preparazione della Cultura Media
- Almeno due giorni prima di iniziare l'esperimento, preparare Poly-D-lisina (PDL) / laminina rivestito piastre per colture monostrato aderenti. Per preparare pozzetti / boccette voglio abbastanza PDL (10 mg / ml in dH 2 O) per rivestire la superficie e incubare una notte a temperatura ambiente. Rimuovere la soluzione dal piatto e lavare il piatto tre volte con dH 2 O. Lasciare asciugare all'aria. Aggiungere laminina (5 mg / ml in DMEM freddo: F12) e incubare a 37 ° C per una notte. Rimuovere la laminina e utilizzare le piastre immediatamente o conservare con la laminina a -20 ° C fino all'utilizzo.
- Preparare fuoco pipette lucido con "medium" e "piccoli" fori da pipette Pasteur in vetro rotante in una fiamma finché i bordi si arrotondano. Autoclave per sterilizzare.
- Il giorno della dissezione, preparare la giusta quantità di terreno di coltura miscelando Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 mg / ml di eparina, 50 unità / ml di penicillina / streptomicina, 20 ng / ml purificato topo fattore di crescita epidermico-grade (EGF), e 20 ng / ml di fattore di crescita dei fibroblasti ricombinante bovina (FGF-2). Riscaldare il terreno di coltura a 37 ° C in un bagno d'acqua.
- Per la dissociazione SVZ, preparare 0,05% tripsina-EDTA e 0,125 mg / ml inibitore della tripsina contenente 0,01 mg / ml DNaseI. Equilibrare queste soluzioni a 37 ° C.
- Impostare un microscopio dissezione e preparare gli strumenti necessari per rimuovere il cervello (forbici e piccola spatola) e SVZ e DG dissezioni (bisturi, 27 ago G attaccato alla siringa da 1 ml, 1 x # 7 pinze, 1 x # 5/45 forcipe) per immersione in etanolo al 70%.
2. La raccolta dei cervelli di topo adulto e SVZ / DG Microdissections
- Anestetizzare (8 settimane di età) topi adulti non sposati secondo le linee guida istituzionali appropriati. Eseguire dislocazione cervicale.
- Spruzzare la testa con etanolo al 70% per sterilizzare l'area e di minimizzare la quantità di pelo che undHères le forbici e il cervello. Utilizzando forbici affilate decapitano l'animale alla base del tronco cerebrale.
- Tenendo la testa alla base del cranio, tagliare il cranio tra le due bulbi olfattivi mettendo una lama di un piccolo paio di forbici in ciascuna cavità occhio e taglio coronale. Quindi, fare due tagli laterali alla base del cranio, seguito da un taglio longitudinale attraverso il cranio lungo la sutura sagittale Attenzione:. Garantiscano l'angolo delle forbici è profonda possibile per evitare di danneggiare il cervello sottostante.
- Esporre il cervello peeling indietro il cranio sia con la lama delle forbici o un paio di pinze curve. Liberare il cervello dal cranio con una piccola spatola e il luogo in PBS freddo.
- Risciacquare cervelli con PBS per rimuovere il sangue e la pelliccia.
- Trasferire cervello per una piastra di Petri 10 centimetri di plastica contenente PBS
- Porre capsula di Petri contenente il cervello sotto un microscopio da dissezione a basso ingrandimento e posizionare il brain sulla sua superficie ventrale. Utilizzando pinze curve sottili togliere i bulbi olfattivi mentre si tiene il cervello in posizione dal cervelletto.
- Ruotare il cervello sul dorso e con un bisturi fare un taglio coronale attraverso il cervello a livello del chiasma ottico
- Per microdissect SVZ (per informazioni più dettagliate, si veda anche Azari et al. 10), posizionare la porzione rostrale del cervello in modo che la superficie coronale tagliata rivolta verso l'alto e mettere a fuoco il microscopio su un ingrandimento maggiore. Rimuovere e gettare il setto con pinze curve sottili.
- Sezionare il SVZ (il sottile strato di tessuto circostante ventricolo) posizionando immediatamente la punta di una lama di una coppia di pinze curve sottili nell'angolo laterale del ventricolo laterale immediatamente sotto il corpo calloso e le altre di circa 1 mm nel tessuto adiacente al ventricolo. Premere la pinza verso la base del piatto e verso l'aspetto ventrale del VentRicolo per rimuovere un piccolo pezzo triangolare di tessuto. Posizionare la SVZ sezionato in una capsula di Petri sul ghiaccio.
- Per microdissect DG (per informazioni più dettagliate, si veda anche Hagihara et al. 11), posizionare la porzione caudale del cervello nella scatola di Petri e tagliare lungo la fessura longitudinale con un bisturi.
- Sotto un microscopio dissezione, rimuovere il cervelletto e il diencefalo con pinze.
- Ridefinire il microscopio in modo che i bordi intorno DG sono ora visibili. Per rimuovere il giro dentato, inserire la punta di un ago 27 G e scorrono lungo il confine tra la DG e corno di Ammon. Utilizzando le belle pinze, liberare il DG dal tessuto circostante.
3. SVZ Tissue Dissociazione
- Tritare il tessuto con una lama da bisturi per circa 1 minuto fino a quando non rimangono pezzi di grandi dimensioni.
- Trasferire il tessuto tritato in una provetta da 15 ml usando 1 ml di preriscaldata 0,05% tripsina-EDTA e incubare per 7 min inbagnomaria a 37 ° C.
- Per fermare la reazione enzimatica, aggiungere 1 ml di inibitore della tripsina contenenti DNaseI e mescolare il contenuto muovendo il tubo.
- Pellet la sospensione per centrifugazione a 300 xg per 5 minuti e scartare il surnatante
- Risospendere il pellet in 1 ml di mezzo di crescita e di dissociare pipettando gentilmente su e giù per circa 7-10x con una pipetta P1000. Attenzione: nel corso di triturazione può portare ad un aumento della morte cellulare e avrà un impatto negativo sulla crescita delle cellule successive.
- Aggiungere mezzo di crescita per un volume totale di 5 ml e passare la sospensione cellulare attraverso un setaccio da 40 mm a rimuovere i detriti e grumi di tessuto indissociate.
- Centrifugare a 300 xg per 5 minuti, scartare il surnatante e risospendere il pellet con conseguente 200 ml mezzo di crescita.
4. DG Tissue Dissociazione
- Tritare il tessuto con una lama da bisturi per circa 1 minuto fino a quando non pezzi di grandi dimensioni rimangono e trasferimentoin preriscaldata PDD enzima papaina mix (2,5 U / ml, dispasi 1 U / ml, DNaseI 250 U / ml). Incubare per 20 min a 37 ° C, mescolando per inversione ogni 3-5 minuti.
- Dissociare il tessuto meccanicamente con un foro medio, fuoco lucido, pipetta Pasteur pipettando su e giù delicatamente 10x.
- Incubare per altri 10 min a 37 ° C, mescolando per inversione ogni 3-5 minuti.
- Ulteriori dissociare il tessuto meccanicamente con un piccolo foro, incendio lucidato pipetta Pasteur pipettando su e giù delicatamente 10x.
- Centrifugare a 130 xg per 5 min.
- Rimuovere il surnatante e risospendere il pellet in 1 ml di soluzione tampone (1x HBSS, glucosio 30 mM, 2 HEPES mM (pH 7.4), 26 NaHCO mm 3). Portare a 10 ml con soluzione tampone.
- Centrifugare a 130 xg per 5 min.
- Rimuovere il surnatante e risospendere il pellet in 5 ml di 20% Percoll. (Per preparare Percoll 90%, aggiungere 4,5 ml di 100% Percoll a 0,5 ml di PBS 10x diluire ulteriormente questo al 20%aggiungendo 1,1 ml di Percoll 90% a 3,9 ml 1x PBS).
- Centrifugare a 450 xg per 15 min.
- Rimuovere il surnatante e risospendere il pellet in 10 ml di tampone.
- Centrifugare a 130 xg per 5 min.
- Risospendere il pellet in 200 microlitri mezzo di crescita.
5. Generazione di culture Aderente monostrato
- Piatto SVZ dissociato o DG tessuto in un unico PDL / laminina rivestito pozzetto di una piastra a 96 pozzetti ed incubare a 37 ° C con 5% di CO 2.
- Circa 24 ore dopo la placcatura, una volta che le cellule hanno aderito alla superficie rivestita, scambiare il mezzo di crescita per rimuovere ulteriori detriti in eccesso.
- Ogni successivi 3-4 giorni, scambio metà del terreno di coltura con terreno fresco per reintegrare i fattori di crescita.
- Ripetere finché le cellule raggiungono circa l'80% di confluenza e sono pronti per essere diversi passaggi. Nota: il tempo tra la placcatura e il primo passaggio può richiedere fino a 2-3 settimane.
- Quando le colture raggiungono circa l'80% di confluenza rimuovere il mezzo dal pozzo e lavare con PBS.
Nota: Non permettere alle cellule di superare il 90% di confluenza in quanto questo può portare al distacco delle cellule e la formazione di neurosfere e, inoltre, un aumento dei livelli di morte cellulare. - Aggiungere 50 ml Accutase e incubare a 37 ° C per 2-3 minuti (controllare per vedere se le cellule sono arrotondate e distaccato).
- Rimuovere le cellule in una provetta da 15 ml e lavare il bene una volta con PBS e trasferimento al tubo stesso.
- Diluire le cellule a 5 ml con PBS e centrifugare a 300 xg per 5 min.
- Per il primo passaggio, diluire cellule per 1 ml e piastra in un PDL / laminina rivestite pozzetto di una piastra a 24 pozzetti.
- Per passaggi successivi, risospendere le cellule in 200 ml di mezzo di crescita e conteggio con un emocitometro. Piastra a 1 x 10 4 cellule / cm 2 nel pozzetto rivestito dimensioni appropriate o matraccio. i>
7. Differenziazione delle Culture Aderente monostrato
- Per differenziare le colture monostrato aderenti, cellule piastra proliferanti su vetrini rivestiti PDL / laminina ad una densità di 1 x 10 4 cellule / cm 2 in terreno di coltura contenente 20 ng / ml EGF e 10 ng / ml bFGF.
- Quando le cellule raggiungono circa il 80% di confluenza (solitamente 2 giorni), sostituire il mezzo di crescita su terreno contenente 5 ng / ml bFGF e 0 ng / ml EGF.
- A seguito di 2 giorni in 5 ng / ml bFGF, sostituire il mezzo con mezzo di coltura in assenza di entrambi i mitogeni per altri 3 giorni Nota:. Durante questo periodo si verifica una notevole quantità di cellule morte.
- Dopo un totale di 5 giorni, lavare le cellule differenziate con PBS per rimuovere eventuali cellule morte poi fissare con 4% paraformaldeide (PFA) per 20 min a temperatura ambiente.
- Lavare nuovamente con PBS per rimuovere eventuali vetrini PFA e conservare in pozzi in 1 ml di PBS a 4 ° C.
- Diluire il SVZ dissociato o DG tessuto da un animale in 20 ml di terreno di coltura e piastra 200 ml / pozzetto in una piastra a 96 pozzetti utilizzando un multidoser pipetta 10 ml.
- Incubare a 37 ° C con 5% di CO 2 per 6-7 giorni per neurosfere SVZ-derivati e 10-12 giorni per neurosfere DG-derivati.
Nota: crescita per più di questi tempi di incubazione raccomandati comporterà crescita eccessiva e porterà alla morte delle cellule al centro delle neurosfere e / o, attacco spontaneo e differenziazione. - Contare e misurare il diametro delle neurosfere usando un reticolo oculare montato su un microscopio ottico verticale
9. Passaging le Neurosfere
Dopo le neurosfere primarie sono stati contati e la loro dimensione registrate possono essere espanse su diversi passaggi che iniziano con un singolo neurosfere o di una cultura di massa.
- Bulk espansione cultura neurosfere
- Per passaggio neurosfere combinati come una cultura di massa, rimuovere il terreno contenente le neurosfere dalla piastra, trasferire in un tubo da 15 ml e centrifugare a 300 xg per 5 min.
- Eliminare il supernatante e risospendere le neurosfere in 1 ml di preriscaldata 0,05% tripsina-EDTA e incubare a temperatura ambiente per 3 min.
- Aggiungere un uguale volume di inibitore della tripsina contenente DNaseI e mescolare bene.
- Centrifugare per 5 minuti a 300 xg, rimuovere il supernatante e aggiungere 1 ml di terreno di coltura.
- Triturare su e giù circa 10x con una pipetta P1000 dissociare le neurosfere.
- Rimuovere 10 ml della sospensione di cellule e mescolare con un volume uguale di blu tripano ed eseguire un conteggio di cellule in vivo con un emocitometro.
- Reinizializzare le cellule ad una densità di 1 x 10 4 cellule / cm 2 in coltura appropriato cella dimensioni pozzetto o bottiglia.
- Incubare a 37 ° Ccon il 5% di CO 2 fino a forma neurosfere secondarie.
- Espansione neurosfere singolo
- Per il passaggio singoli neurosfere scegliete pozzetti che contengono un singolo neurosfere e rimuovere con attenzione e scartare circa 160 ml di terreno di coltura di ogni bene senza disturbare il neurosfere.
- Aggiungere 100 ml di 0,05% tripsina-EDTA a ciascun pozzetto per essere diversi passaggi e incubare a temperatura ambiente per 3 min.
- Aggiungere 100 ml di inibitore della tripsina contenente DNAseI per arrestare la reazione.
- Triturare circa 10 volte su e giù con una pipetta P200 di spezzare il neurosfere.
- Trasferire 200 ml contenenti il neurosfere dissociato in un pozzetto di una piastra da 24 pozzetti contenente 1,5 ml di mezzo di crescita. Incubare a 37 ° C con 5% di CO 2 fino a forma neurosfere secondarie.
Nota: per determinare il potenziale a lungo termine, una delle proprietà cardinali di un vero s neuralecellula TEM, neurosfere dovrebbe essere diversi passaggi per almeno 5-10 passaggi. Vedere anche la letteratura sulla parte nella controversa interpretazione dei risultati 12-14.
10. Differenziazione delle Culture neurosfere
Neurosfere primarie o diversi passaggi possono essere differenziati per determinare multipotenzialità.
- Rimuovere neurosfere in sospensione dalla loro piastra di coltura o di pallone e trasferirli su una piastra di Petri 10 centimetri di plastica.
- Sotto un microscopio dissezione rimuovere circa 15-20 neurosfere dal mezzo con una pipetta P20 e trasferire ad una piastra a 24 pozzetti contenenti il terreno di coltura senza fattori di crescita e un vetrino rivestito PDL / laminina.
- Differenziare per circa 7 giorni a 37 ° C con 5% di CO 2.
- Lavare le neurosfere differenziati con PBS per rimuovere tutte le cellule morte poi fissare con PFA 4% per 20 minuti a temperatura ambiente.
- Lavare nuovamente con PBS per rTogliete eventuali coprioggetto PFA e conservare in pozzi in 1 ml di PBS a 4 ° C
11. Immunostaining di neurosfere e culture aderenti
Nota: Per la colorazione con l'anticorpo O4 omettere il Triton dai gradini di blocco e di colorazione e ricordarsi di utilizzare un anticorpo secondario IgM appropriato.
- Incubare i vetrini contenenti i neurosfere dissociati o colture monostrato aderenti in soluzione (10% siero normale Donkey in PBS contenente 0,2% Triton X-100) di blocco per 60 min a temperatura ambiente.
- Incubare in soluzione bloccante fresco contenente primario bIII-tubulina, Map2a + b, gliale fibrillare proteina acida (GFAP) o anticorpi O4 per 60min a temperatura ambiente.
- Lavare 3x con PBS.
- Incubare in soluzione bloccante fresco contenente appropriati anticorpi secondari coniugati fluorescenza e 4,6-diamidino-2-fenilindolo (DAPI; 1/5.000) per 30 minuti a temperatura ambiente al buio.
- lavare tre volte con PBS.
- Montare i coprioggetti su vetrini da microscopio utilizzando il montaggio fluorescenza medie e aria secca nella notte scura
- Vista e immagine utilizzando un microscopio a fluorescenza.
Risultati
Anche se le due regioni neurogenici del cervello di topo adulto entrambi contengono cellule precursori neurali, queste cellule possono comportarsi in modo diverso quando coltivate in vitro. Le colture monostrato aderenti generati da due regioni appaiono morfologicamente indistinguibili (Figura 1A), tuttavia, le colture aderenti SVZ-derivati proliferano più velocemente e devono essere diversi passaggi, in media, 1-2 giorni prima di quelli derivati dalla DG. Come neurosfere, le cellule precursori SVZ derivate anche proliferano velocemente e formare neurosfere più grandi (Figura 1B) rispetto alle cellule precursori DG-derivati (Figura 1C). Mentre neurosfere SVZ-derivati in genere vengono contati dopo 6-7 giorni di coltura, neurosfere DG-derivati sono di solito quantificati dopo 10-12 giorni. Inoltre, un numero molto maggiore di cellule precursori neurali risiedono nella SVZ rispetto al DG, come dimostra la quasi 10 volte maggiore numero di neurosfere che possono essere generited da questa regione (SVZ: 1.173 ± 74,9 vs DG: 145.3 ± 26.4, p = <0,0001; n = 10 animali per gruppo; Figura 2A).
Studi hanno dimostrato che le cellule precursori entro la DG SVZ e rispondono a differenti stimoli. Le cellule precursori del DG sono attivati da tipi specifici di apprendimento spaziale e stimoli come l'arricchimento ambientale e l'attività fisica, mentre le cellule precursori SVZ sono attivati da apprendimento olfattivo e l'arricchimento olfattivo. Coerentemente con questo, uno di noi (TLW) precedentemente dimostrato che la DG contiene una popolazione di cellule staminali latente e cellule progenitrici che può essere attivato da eccitazione neurale 15-18. Al contrario, abbiamo scoperto che le cellule precursori SVZ rispondono in modo diverso a questo stimolo, con una diminuzione del numero neurosfere in risposta a depolarizzazione livelli di KCl 17. Qui, abbiamo ripetuto questo esperimento, placcatura metà delle cellule isolate derivate dalla SVZ e DG di individual animali in depolarizzanti livelli di KCl e l'altra metà in livelli KCl controllo. Abbiamo dimostrato, come in precedenza, che mentre le cellule precursori DG sono attivati da depolarizzazione (101,2 ± 17,4 vs 184,8 ± 12,5, p = 0,005, n = 5 animali), la proliferazione delle cellule SVZ-derivati è infatti significativamente diminuita ( 368,0 ± 62,9 vs 266,6 ± 41,6, p = 0.02, n = 5 animali; Figura 2B).
Per confermare potenziale a lungo termine, una delle caratteristiche cardinali di una cellula staminale vero, singoli neurosfere o colture monostrato aderente deve essere in grado di espansione estesa cioè su almeno 10 passaggi. Ad ogni passaggio, dopo la preparazione di una cella singola sospensione, il numero di cellule viene contato e l'espansione piega viene calcolato. Il totale ipotetica cella viene calcolato moltiplicando l'espansione piega durante tale passaggio dalla totale teorico dal passaggio precedente. Questo è disp posato come un grafico lineare con il numero di passaggio tramato contro il log10 del numero totale di cellule teorica (vedi esempio figura 3). Per confermare multipotenzialità, sia colture monostrato e le neurosfere possono essere differenziati con il ritiro mitogen e verranno mostrate dar luogo a entrambi i neuroni e glia (Figura 4).
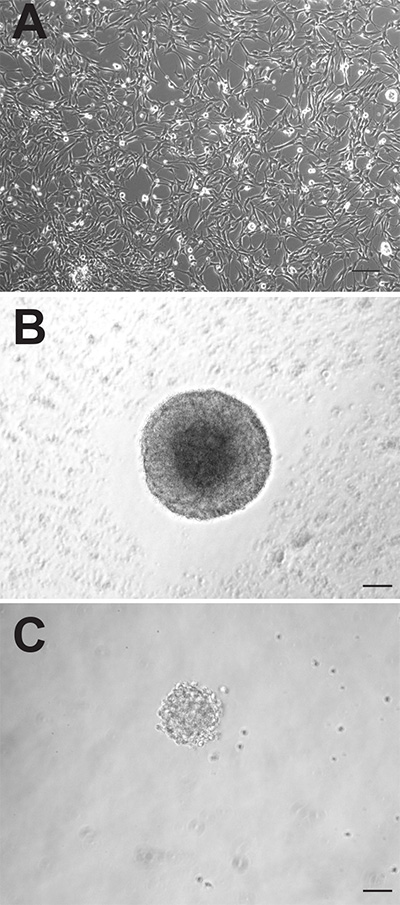
. Adulti cellule precursori Figura 1 mouse possono essere coltivate in colture monostrato aderenti (A) o come neurosfere (B: SVZ, C: DG).. Bar scala è di 50 millimetri Clicca qui per vedere l'immagine ingrandita.
load/51225/51225fig2highres.jpg "src =" / files/ftp_upload/51225/51225fig2.jpg "/>
Figura 2. Significativamente maggiore di neurosfere sono generati dalla SVZ rispetto al DG di singolo topi (A). Le cellule precursori SVZ e DG rispondono in modo diverso alla depolarizzazione in vitro (B).

Figura 3. Per confermare potenziamento a lungo termine, neurosfere sono espanse per oltre 10 passaggi.

Figura 4. Neurosfere possono essere differenziati in bIII-Tubulin + neuroni (A: rosso), GFAP + astrociti (A: verde), O4 + oligodendrociti (B: rosso) e Map2ab + neuroni (C: rosso). Clicca qui per vedere l'immagine ingrandita.
Discussione
Questo articolo presenta un protocollo dettagliato per l'avvio di culture precursori neurali, sia monostrati come aderenti e neurosfere, dalle due grandi regioni neurogena del cervello di topo adulto. Ci sono una serie di punti importanti che devono essere tenuti a mente quando si cerca uno di questi sistemi di coltura in vitro in. In primo luogo, la scelta del metodo di dissociazione è molto importante ed è tessuto dipendente. Nelle nostre mani, 0,05% tripsina-EDTA è molto efficace per la dissociazione di tessuto SVZ, e si traduce in un maggior numero di neurosfere rispetto a quando si utilizza una tecnica basata dissociazione papaina. Per la dissociazione della DG tessuto tuttavia, si consiglia vivamente un approccio dissociazione a base di papaina. Quando si confrontano direttamente i due metodi di dissociazione di DG tessuto, abbiamo osservato un rendimento significativamente inferiore di cellule vitali e circa 10 volte meno neurosfere quando si utilizza tripsina. Questa differenza di dissociazione potrebbe essere dovuto alla differenza di COMPOSIZIO tessuton tra le due regioni. Il tessuto compatta della DG è circondato da un ampio neuropil e può verificarsi danni estesi di processi cellulari durante la dissociazione.
Un secondo punto importante da notare è che, mentre il saggio neurosfere può essere utile per rendere dichiarazioni quantitativi sul numero di cellule presenti in un dato campione di tessuto precursori, cautela deve tuttavia essere impiegato nell'interpretazione di questi numeri assoluti. Fusione di neurosfere può essere un importante fattore confondente. Diversi studi hanno dimostrato che i neuroni sono molto mobili e possono fondere, anche in quelle che sono presumibilmente condizioni "cloni" 7,19. La frequenza neurosfere risultante può essere molto dipendente da fattori tra i componenti del mezzo, la procedura di dissezione e il processo di dissociazione. Anche tra i gestori esperti qualche variazione nel numero di neurosfere generati da campioni apparentemente identici è evidente (si veda la Figura 1A.) Più utile, è un confronto diretto della frequenza precursore tra due campioni indicati (cioè il controllo vs trattata o wild-type vs knock-out) gestite dalla stessa persona in un unico esperimento, piuttosto che una dichiarazione quantitativa del totale numero di cellule precursore.
Nel decidere quale dei due metodi di coltura è più adatto per un particolare esperimento è importante notare che questi due sistemi di coltura differenziano l'omogeneità dei tipi cellulari generati. Rispetto al proliferare colture cellulari aderenti, che mostrano un pool di cellule precursore abbastanza omogenea (~ 98% delle cellule sono Sox2 +) 20, neurosfere sono più eterogenei e contengono, nonché proliferanti cellule precursori, neuroni differenziati e astrociti 21,22. È importante che le neurosfere non sono coltivate per prolungati periodi tra i passi come maggiore è la neurosfere diventare il più probabile è di trovare tipi di cellule differenziate nel loro nucleo.
Abbiamo tradizionalmente Avviamo aderenti monostrato neurali culture precursori della DG tessuto tra 5-8 topi. Pertanto, quando si tenta di stabilire le colture monostrato aderenti dalla DG o SVZ di un singolo mouse, la massima cura deve essere presa durante la procedura di dissociazione dei tessuti al fine di evitare un'eccessiva morte cellulare causata da sopra triturazione del tessuto, o prendendo esteso periodi di tempo tra la dissezione e gradini in coltura finali. Questo protocollo descrive, per la prima volta, la generazione di colture monostrato precursori aderenti sia dalla SVZ e DG di singoli animali. Ci sono molti casi in cui il confronto della proliferazione e differenziazione precursore deve essere effettuato su base singolo animale. Queste includono la possibilità di confrontare direttamente il DG e SVZ di animali individuali basati sulle statistiche appaiati e per associare i dati di cultura con i singoli dati comportamentali e fisiologici 9. Culture di origine animale singole anche albasso l'uso di animali rari transgenici, in cui non è possibile in età corrispondente a un pool di 5-8 donatori per la cultura, così come gli animali unici (ad esempio croci F2 o animali allevati fuori) per studi di associazione genetica.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
TLW stato supportato da una Marie Curie internazionale Incoming Fellowship. Questo lavoro è stato finanziato anche dal finanziamento istituzionale di base, Bundesministerium für Bildung e Forschung (BMBF) finanziamento e in parte con il sostegno prioritario Research Program (SFB) 655 a Gk. Gli autori desiderano ringraziare Anne Karasinsky per la cura e la manutenzione di tutti gli animali utilizzati in questo studio e Odette Leiter, Susann Ruhwald, Fanny Boehme, e Richard Wetzel per la coltura cellulare e assistenza microscopia.
Materiali
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P7280-5MG | |
| Laminin | Roche | 11243217001 | |
| Glass Pastuer pipettes | Volac | BS5732 | |
| DMEM:F12 (1:1) 1x | Life Technologies | 21331-020 | |
| Neural Basal Medium (1x) | Life Technologies | 21103-049 | |
| B27 supplements (50x) | Life Technologies | 17504-044 | |
| GlutaMAX | Life Technologies | 35050-038 | |
| Heparin | Sigma | H3393 | |
| Penacillin/Streptomycin | Life Technologies | 15140-122 | |
| EGF | PeproTech | AF-100-15 | |
| bFGF | PeproTech | 100-18B | |
| 0.05% Trypsin-EDTA | Life Technologies | 25300-054 | |
| Trypsin inhibitor | Sigma | T6522 | |
| DNaseI | Roche | 10104159001 | |
| Accutase | PAA | L11-007 | |
| Papain | Worthington | LS003120 | |
| Dispase | Life Technologies | 17105-041 | |
| Percoll | GE Healthcare | 17-0891-02 | |
| HBSS (with Calcium and Magnesium) | Life Technologies | 14025-050 | |
| Glucose | Roth | X997.2 | |
| HEPES | Sigma | H3375-500G | |
| NaHCO3 | Merck | K39347429847 | |
| 1 ml Syringes | Braun | 2016-10 | |
| 27 G Needles | Braun | 4657705 | |
| Scalpels (#22 disposable) | Braun | BA222 | |
| Dumont #7 forceps | FST | 11271-30 | |
| Dumont 5/45 forceps | FST | 11251-35 | |
| Scissors | FST | 14060-10 | |
| Iris spatula | FST | 10093-13 | |
| 70% Ethanol | |||
| PBS | Life Technologies | 14040-091 | |
| flasks/well plates | TPP | 92696 | |
| PFA (4%) | Sigma | P6148 | |
| Hemocytometer | Marienfeld | 650010 | |
| Trypan blue (0.4%) | Sigma | T8154 | |
| NDS | Millipore | 530 | |
| TritonX-100 | Sigma | T9284 | |
| Mouse monoclonal bIII-tubulin antibody | Promega | G712A | |
| Rabbit polyclonal glial fibrillary acidic protein antibody | Dako | 20334 | |
| O4 | R&D Systems | MAB1326 | |
| Map2a+b | Sigma | M1406 | |
| Donkey anti-mouse Cy3 antibody | Jackson ImmunoResearch | 715-505-151 | |
| Donkey anti-rabbit Alexa488 | Dianova | 711-545-152 | |
| 4,6-Diamidino-2-phenylindole (DAPI) | Invitrogen | 861405 | |
| Aqua Polymount | Polysciences Inc | 18606 | |
| 10 ml Combi tips | Eppendorf | 30089677 | |
| Plastic 10 ml and 25 ml serological pipettes | Corning | 4488/4489 | |
| EQUIPMENT | |||
| Pipetboy | Integra Biosciences | 521942 | |
| Multidoser pipette | Eppendorf | ||
| 37 °C waterbath | |||
| Dissecting microscope | |||
| 37 °C:5% CO2 incubator | |||
| Centrifuge | Eppendorf | 5810R |
Riferimenti
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1-13 (1996).
- Palmer, T. D., Ray, J., Gage, F. H. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol. Cell. Neurosci. 6, 474-486 (1995).
- Ray, J., Raymon, H. K., Gage, F. H. Generation and culturing of precursor cells and neuroblasts from embryonic and adult central nervous system. Methods Enzymol. 254, 20-37 (1995).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993, 18-29 (2003).
- Babu, H., Cheung, G., Kettenmann, H., Palmer, T. D., Kempermann, G. Enriched monolayer precursor cell cultures from micro-dissected adult mouse dentate gyrus yield functional granule cell-like neurons. PLoS One. 2, (2007).
- Jessberger, S., Clemenson, G. D., Gage, F. H. Spontaneous fusion and nonclonal growth of adult neural stem cells. Stem Cells. 25, 871-874 (2007).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565-4574 (1992).
- Freund, J., et al. Emergence of individuality in genetically identical mice. Science. 340, 756-759 (2013).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J. Vis. Exp. , (2010).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. J. Vis. Exp. , (2009).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol. Neurobiol. 34, 153-161 (2006).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell. Stem Cell. 8, 486-498 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres- re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Walker, T. L., Turnbull, G. W., Mackay, E. W., Hannan, A. J., Bartlett, P. F. The latent stem cell population is retained in the hippocampus of transgenic Huntington's disease mice but not wild-type mice. PLoS One. 6, (2011).
- Walker, T. L., et al. Prolactin stimulates precursor cells in the adult mouse hippocampus. PLoS One. 7, (2012).
- Walker, T. L., et al. Latent stem and progenitor cells in the hippocampus are activated by neural excitation. J. Neurosci. 28, 5240-5247 (2008).
- Walker, T. L., et al. Prominin-1 allows prospective isolation of neural stem cells from the adult murine hippocampus. J. Neurosci. 33, (2013).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Front. Neurosci. 5, 89 (2011).
- Parmar, M., Sjoberg, A., Bjorklund, A., Kokaia, Z. Phenotypic and molecular identity of cells in the adult subventricular zone in vivo and after expansion in vitro. Mol. Cell Neurosci. 24, 741-752 (2003).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99, 14506-14511 (2002).
Erratum
Formal Correction: Erratum: One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice
Posted by JoVE Editors on 11/26/2014. Citeable Link.
A correction was made to One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Many micro symbols were changed into milli symbols by accident: In the Protocols, sections 1.1, 1.3, 3.6, 3.7, 6.2, 6.6, 8.1, 9.1.6, 9.2.2, and 9.2.5 need to be fixed, as does Figure 1 description in the Results section.
Protocol section 1.1 was changed from:
At least two days prior to commencing the experiment, prepare Poly-D-lysine (PDL)/Laminin coated plates for adherent monolayer cultures. To prepare wells/flasks add enough PDL (10 mg/ml in dH2O) to coat the surface and incubate overnight at room temperature. Remove the solution from the dish and wash the dish three times with dH2O. Allow to air dry. Add Laminin (5 mg/ml in cold DMEM:F12) and incubate at 37 °C overnight. Remove the Laminin and either use the plates immediately or store with the Laminin at -20 °C until required.
to:
At least two days prior to commencing the experiment, prepare Poly-D-lysine (PDL)/Laminin coated plates for adherent monolayer cultures. To prepare wells/flasks add enough PDL (10 µg/ml in dH2O) to coat the surface and incubate overnight at room temperature. Remove the solution from the dish and wash the dish three times with dH2O. Allow to air dry. Add Laminin (5 µg/ml in cold DMEM:F12) and incubate at 37 °C overnight. Remove the Laminin and either use the plates immediately or store with the Laminin at -20 °C until required.
Protocol section 1.3 was changed from:
On the day of dissection, prepare the appropriate amount of culture medium by mixing Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 µg/ml heparin, 50 units/ml Penicillin/Streptomycin, 20 ng/ml purified mouse receptor-grade epidermal growth factor (EGF), and 20 ng/ml recombinant bovine fibroblast growth factor (FGF-2). Warm the culture medium to 37 °C in a water bath.
to:
On the day of dissection, prepare the appropriate amount of culture medium by mixing Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 mg/ml heparin, 50 units/ml Penicillin/Streptomycin, 20 ng/ml purified mouse receptor-grade epidermal growth factor (EGF), and 20 ng/ml recombinant bovine fibroblast growth factor (FGF-2). Warm the culture medium to 37 °C in a water bath.
Protocol section 3.6 was changed from:
Add growth medium to a total volume of 5 ml and pass the cell suspension through a 40 mm sieve to remove debris and undissociated tissue clumps.
to:
Add growth medium to a total volume of 5 ml and pass the cell suspension through a 40 µm sieve to remove debris and undissociated tissue clumps.
Protocol section 3.7 was changed from:
Centrifuge at 300 x g for 5 min, discard the supernatant and resuspend the resulting pellet in 200 ml growth medium.
to:
Centrifuge at 300 x g for 5 min, discard the supernatant and resuspend the resulting pellet in 200 µl growth medium.
Protocol section 6.2 was changed from:
Add 50 ml Accutase and incubate at 37 °C for 2-3 min (checking to see if the cells are rounded and detached).
to:
Add 50 µl Accutase and incubate at 37 °C for 2-3 min (checking to see if the cells are rounded and detached).
Protocol section 6.6 was changed from:
For subsequent passages, resuspend cells in 200 ml growth medium and count using a hemocytometer. Plate at 1 x 104 cells/cm2 in the appropriate sized coated well or flask.
to:
For subsequent passages, resuspend cells in 200 µl growth medium and count using a hemocytometer. Plate at 1 x 104 cells/cm2 in the appropriate sized coated well or flask.
Protocol section 8.1 was changed from:
Dilute the dissociated SVZ or DG tissue from one animal in 20 ml of culture medium and plate 200 ml/well across a 96-well plate using a 10 ml multidoser pipette.
to:
Dilute the dissociated SVZ or DG tissue from one animal in 20 ml of culture medium and plate 200 µl/well across a 96-well plate using a 10 ml multidoser pipette.
Protocol section 9.1.6 was changed from:
Remove 10 ml of the cell suspension and mix with an equal volume of trypan blue and perform a live cell count using a hemocytometer.
to:
Remove 10 µl of the cell suspension and mix with an equal volume of trypan blue and perform a live cell count using a hemocytometer.
Protocol section 9.2.2 was changed from:
Add 100 ml of 0.05% Trypsin-EDTA to each well to be passaged and incubate at room temperature for 3 min.
to:
Add 100 µl of 0.05% Trypsin-EDTA to each well to be passaged and incubate at room temperature for 3 min.
Protocol section 9.2.5 was changed from:
Transfer the 200 ml containing the dissociated neurosphere to a new well of a 24-well plate containing 1.5 ml of growth medium. Incubate at 37 °C with 5% CO2 until secondary neurospheres form.
to:
Transfer the 200 µl containing the dissociated neurosphere to a new well of a 24-well plate containing 1.5 ml of growth medium. Incubate at 37 °C with 5% CO2 until secondary neurospheres form.
Figure 1 description was updated from:
Figure 1. Adult mouse precursor cells can be cultured as adherent monolayer cultures (A) or as neurospheres (B: SVZ, C: DG). Scale bar is 50 mm.
to:
Figure 1. Adult mouse precursor cells can be cultured as adherent monolayer cultures (A) or as neurospheres (B: SVZ, C: DG). Scale bar is 50 µm.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon