Method Article
Une souris, deux cultures: Isolement et culture des cellules souches adultes de neurones à partir des deux Neurogenic Zones de souris individuelle
Dans cet article
Erratum Notice
Résumé
Nous décrivons ici un protocole détaillé pour la production simultanée de cultures de cellules de précurseur de neurones, soit comme des monocouches ou des neurosphères adhérentes, à partir de la zone sous-ventriculaire et le gyrus denté de souris individuels adultes.
Résumé
Le dosage de neurosphères et le système de culture en monocouche adhérente sont des outils précieux pour déterminer le potentiel (prolifération ou la différenciation) des cellules souches neurales adultes in vitro. Ces dosages peuvent être utilisés pour comparer le potentiel de précurseur de cellules isolées à partir d'animaux génétiquement différents ou de manière différentielle traités afin de déterminer les effets des facteurs exogènes sur la prolifération de cellules précurseurs neurales et de la différenciation et de générer des lignées de cellules précurseurs neurales qui peuvent être dosés au cours des passages continus. Le dosage de neurosphère est traditionnellement utilisé pour l'identification post-hoc de cellules souches, principalement en raison de l'absence de marqueurs définitifs avec laquelle ils peuvent être isolés à partir de tissu primaire et a le grand avantage de donner une estimation rapide du nombre de cellules de précurseur dans le tissu cérébral provenant d'animaux individuels. Cultures monocouches adhérentes, en revanche, ne sont pas traditionnellement utilisés pour comparer la prolifération entre les animaux individuels, Étant donné que chaque culture est généralement initiée à partir du tissu combinée comprise entre 5-8 animaux. Cependant, ils présentent l'avantage majeur que, à la différence des neurosphères, ils sont constitués d'une population essentiellement homogène de cellules précurseurs et sont utiles pour la suite du processus de différenciation dans des cellules individuelles. Ici, nous décrivons en détail la production de cultures de neurosphères et, pour la première fois, les cultures adhérentes provenant d'animaux individuels. Cela a de nombreuses implications importantes, y compris l'analyse appariée de la prolifération et / ou le potentiel de différenciation à la fois dans la zone sous-ventriculaire (SVZ) et gyrus denté (DG) des lignées de souris traitées ou génétiquement différentes, ainsi qu'une réduction significative de l'utilisation des animaux.
Introduction
Le dosage de neurosphère 1,2 et la culture monocouche adhérente 3,4, développés au début des années 1990, restent encore l'étalon-or dans des essais de cellules souches neurales in vitro. Dans ces essais, le tissu primaire est micro disséquée à partir d'une région particulière du cerveau, dissocié en une suspension de cellules isolées et mises en culture en présence du facteur mitogenes de croissance épidermique (EGF) et le facteur de croissance fibroblastique 2 (FGF2) pour former une ou l'autre flottant librement clusters (neurosphères) ou monocouches adhérentes. Les deux systèmes ont un certain nombre d'avantages et d'inconvénients et une attention particulière doit être accordée à la question qui doit être traitée avant l'un ou l'autre système est choisi.
Neurosphères permettent une lecture directe du nombre des différences de précurseur et le potentiel cellulaire. En outre, les neurosphères sont aussi un outil utile pour étudier la spécification intrinsèque des cellules lorsqu'ils sont retirés de leur environnement externe normal. Extrinsic indices peuvent être étudiés en ajoutant simplement le facteur d'intérêt pour le milieu de croissance et de quantifier le nombre et la taille des neurosphères générées. Cependant, l'inconvénient majeur de neurosphères, c'est qu'ils forment leur propre créneau, avec les cellules au centre des neurosphères (en particulier les grandes neurosphères) étant plus différenciée que ceux sur la surface 5. Neurosphères contiennent un mélange de cellules souches, progéniteurs engagés et des cellules différenciées et les interactions cellule-cellule dans les neurosphères contrer le maintien des cellules souches. C'est pourquoi neurosphères contiennent seulement un petit nombre de véritables cellules souches 6-8.
Cultures monocouches adhérentes fournissent également un bon système in vitro pour modéliser la prolifération in vivo. Cultures adhérentes, dans lequel les cellules restent plus homogènes et isolées, peuvent éliminer le caractère hétérogène de la neurosphère. Dans ces conditions de croissance des cellules précurseurs prolifèrent rapidement et presque toutes les cellules se divisent et expriment les marqueurs caractéristiques précurseurs neurales Nestin, Sox2, et BLBP. L'inconvénient majeur du système de culture en monocouche par rapport à l'essai de neurosphères est que les clones dérivés de précurseurs individuels ne peuvent pas être surveillée et quantifiée.
Un inconvénient de la plupart des protocoles pour les deux types de cultures a été la nécessité d'utiliser un nombre relativement important d'animaux, parce que le rendement des stratégies d'isolement a souvent été médiocre. Dans le même temps, il est devenu clair que la neurogenèse adulte contribue à l'individualisation du cerveau 9, d'où la nécessité pour les anciens modèles in vivo individualisés ainsi. Ces besoins peuvent être satisfaits par des protocoles "d'une souris une culture" comme décrit dans le présent rapport.
Le protocole visuel ci-dessous décrit la production simultanée de cultures de précurseurs neurales à la fois de la SVZ et DG de chaque animal soit m comme adhérentonolayers ou comme neurosphères. La génération des cultures de chaque animal est particulièrement utile lorsque des comparaisons entre les animaux traités individuellement ou divers transgénique individu ou souris de type sauvage sont nécessaires. Ce protocole contient des instructions détaillées pour la microdissection simultanée des régions SVZ et DG de souris adultes, leur dissociation dans une suspension cellulaire unique, la culture in vitro, soit des cultures monocouches adhérentes ou neurosphères et analyse de multipotentialité et le potentiel à long terme, les deux cardinal propriétés d'une cellule souche fide osseuse.
Protocole
Une. Configuration de base et la préparation de milieu de culture
- Au moins deux jours avant le début de l'expérience, la préparation de poly-D-lysine (PDL) / laminine plaques revêtues de cultures monocouches adhérentes. Pour préparer les puits / flacons ajouter assez PDL (10 mg / ml en DH 2 O) pour revêtir la surface et incuber pendant une nuit à température ambiante. Retirer la solution de l'antenne et laver la capsule trois fois avec dH 2 O. Laisser sécher à l'air. Ajouter laminine (5 mg / ml dans du DMEM froid: F12) et incuber à 37 ° C pendant une nuit. Retirez la laminine et soit utiliser les plaques immédiatement ou conserver la laminine à -20 ° C jusqu'à utilisation.
- Préparer feu pipettes polies avec "moyen" et "petits" trous en tournant pipettes Pasteur en verre dans une flamme jusqu'à ce que les bords s'arrondissent. Autoclave pour stériliser.
- Le jour de la dissection, de préparer la quantité appropriée de milieu de culture en mélangeant Neural Milieu de base avec 2% de B27, 1x GlutaMAX, 2 mg / ml d'héparine, 50 unités / ml de pénicilline / streptomycine, 20 ng / ml de facteur purifié de croissance épidermique récepteur teneur souris (EGF), et 20 ng / facteur de croissance de fibroblaste bovine recombinée ml (FGF-2). Chauffer le milieu de culture à 37 ° C dans un bain d'eau.
- Pour la dissociation SVZ, préparer à 0,05% de trypsine-EDTA et 0,125 mg / ml inhibiteur de trypsine contenant 0,01 mg / ml de DNase I. Équilibrer ces solutions à 37 ° C.
- Mettre en place un microscope de dissection et de préparer les outils nécessaires pour enlever le cerveau (ciseaux et petite spatule) et pour SVZ et DG dissections (scalpel, 27 G aiguille fixée à seringue de 1 ml, 1 x # 7 forceps, 1 x # 5/45 forceps) par trempage dans l'éthanol à 70%.
2. La récolte des cerveaux de souris adultes et SVZ / DG Microdissections
- Anesthésier adulte seul (8 semaines d'âge) chez la souris selon les directives institutionnelles appropriées. Effectuer dislocation cervicale.
- Pulvériser la tête avec 70% d'éthanol pour stériliser la zone et de réduire au minimum la quantité de poils qui adHères les ciseaux et le cerveau. À l'aide de ciseaux décapitent l'animal à la base du tronc cérébral.
- Tenant la tête à la base du crâne, couper le crâne entre les deux bulbes olfactifs en plaçant une lame d'une petite paire de ciseaux dans chaque cavité de l'œil et de coupe coronaire. Ensuite, faire deux coupes latérales à la base du crâne, suivie par une coupe longitudinale à travers le crâne le long de la suture sagittale Attention:. Assurent l'angle des ciseaux est aussi faible que possible pour éviter d'endommager le cerveau sous-jacent.
- Exposer le cerveau en enlevant le crâne soit avec la lame de ciseaux ou une paire de pinces courbes. Libérer le cerveau du crâne à l'aide d'une petite spatule et le lieu dans PBS froid.
- Rincer cerveau avec du PBS pour éliminer le sang et de la fourrure.
- Transfert cerveau à une boîte de Pétri de 10 cm en plastique contenant du PBS
- Placez boîte de Pétri contenant le cerveau sous un microscope de dissection à faible grossissement et positionner le brain sur sa face ventrale. Utilisation de fines pinces courbes enlever les bulbes olfactifs tout en maintenant le cerveau en position par le cervelet.
- Tourner le cerveau sur la face dorsale et l'aide d'un scalpel faire une coupe coronale par le cerveau au niveau du chiasma optique
- Pour microdissect la SVZ (pour des instructions plus détaillées, voir aussi Azari et al. 10), placer la partie rostrale du cerveau de sorte que la surface coronale couper tourné vers le haut et de se concentrer le microscope sur un plus fort grossissement. Retirer et jeter le septum à l'aide de fines pinces courbes.
- Disséquer la SVZ (la fine couche de tissu entourant le ventricule) en plaçant l'extrémité d'une pale d'une paire de fines pinces incurvées dans l'angle latéral du ventricule latéral immédiatement sous le corps calleux et les autres d'environ 1 mm immédiatement dans le tissu adjacent au ventricule. Presser vers le bas la pince vers la base de la capsule et vers la face ventrale de la VentRicle pour enlever un petit morceau de tissu triangulaire. Placez le SVZ disséqué dans une boîte de Pétri sur de la glace.
- Pour microdissect la DG (pour des instructions plus détaillées, voir aussi Hagihara et al. 11), placer la partie caudale du cerveau dans la boîte de Pétri et couper le long de la fissure longitudinale à l'aide d'un scalpel.
- Sous un microscope de dissection, retirez le cervelet et le diencéphale l'aide de pinces.
- Recentrer le microscope de sorte que les frontières autour de la DG sont maintenant visibles. Pour supprimer le gyrus denté, insérez la pointe d'une aiguille 27 G et glissent le long de la frontière entre la DG et la corne d'Ammon. En utilisant les pince fine, libérer le DG du tissu environnant.
3. La dissociation des tissus SVZ
- Hacher le tissu en utilisant une lame de scalpel pendant environ 1 minute jusqu'à ce que aucun gros morceaux restent.
- Transférer le tissu haché à un tube de 15 ml en utilisant 1 ml d'préchauffé 0,05% de trypsine-EDTA et laisser incuber pendant 7 min àun bain-marie réglé à 37 ° C.
- Pour arrêter la réaction enzymatique, ajouter 1 ml d'inhibiteur de trypsine contenant DNaseI et mélanger le contenu en feuilletant le tube.
- Pellet la suspension par centrifugation à 300 g pendant 5 min et jeter le surnageant
- Reprendre le culot dans 1 ml de milieu de croissance et dissocier par pipetage de haut en bas environ 7 à 10 fois à l'aide d'une pipette P1000 Attention:. Sur trituration peut conduire à la mort cellulaire accrue et aura un impact négatif sur la croissance cellulaire ultérieure.
- Ajouter milieu de croissance pour un volume total de 5 ml et passer la suspension de cellules à travers un tamis de 40 mm pour enlever les débris et amas de tissus non dissociés.
- Centrifugeuse à 300 g pendant 5 min, jeter le surnageant et remettre en suspension le culot obtenu dans 200 ml de milieu de croissance.
4. DG dissociation tissulaire
- Hacher le tissu en utilisant une lame de scalpel pendant environ 1 minute jusqu'à ce que aucun gros morceaux restent transfert eten mélange préchauffé PDD enzyme papaïne (2,5 U / ml de dispase, 1 U / ml, la DNase I 250 U / ml). Incuber pendant 20 min à 37 ° C, le mélange en inversant le tube tout 3-5 min.
- Dissocier le tissu mécaniquement à l'aide d'un alésage moyen, feu poli, pipette Pasteur par aspiration et doucement 10x.
- Incuber pendant 10 minutes supplémentaires à 37 ° C, le mélange en inversant le tube tout 3-5 min.
- Dissocier davantage le tissu mécaniquement à l'aide d'un petit trou, le feu poli pipette Pasteur par aspiration et doucement 10x.
- Centrifuger à 130 g pendant 5 min.
- Eliminer le surnageant et remettre en suspension le culot dans une solution de tampon ml (1 x HBSS, 30 mM de glucose, 2 mM de HEPES (pH 7,4), 26 mM NaHCO 3). Compléter à 10 ml avec la solution tampon.
- Centrifuger à 130 g pendant 5 min.
- Retirer le surnageant et remettre le culot dans 5 ml de 20% de Percoll. (Pour la préparation de Percoll à 90%, ajouter 4,5 ml de 100% de Percoll à 0,5 ml de PBS puis diluer 10 fois plus loin à 20%en ajoutant 1,1 ml de Percoll 90% à 3,9 ml 1x PBS).
- Centrifuger 450 g pendant 15 min.
- Enlever le surnageant et remettre en suspension le culot dans 10 ml de tampon.
- Centrifuger à 130 g pendant 5 min.
- Remettre en suspension le culot dans du milieu de croissance de 200 ul.
5. Génération des cultures monocouches adhérentes
- Plaque la SVZ dissocié ou DG tissu en un seul PDL / laminine ainsi revêtu d'une plaque de 96 puits et incuber à 37 ° C avec 5% de CO 2.
- Environ 24 heures après l'étalement, une fois que les cellules ont adhéré à la surface revêtue, échanger le milieu de culture pour éliminer encore des débris en excès.
- Tous les 3-4 jours suivants, l'échange de la moitié du milieu de culture par du milieu frais pour reconstituer les facteurs de croissance.
- Répétez jusqu'à ce que les cellules atteignent environ 80% de confluence et sont prêts à être repiquées. Remarque: le temps entre le placage et le premier passage peut prendre jusqu'à 2-3 semaines.
- Lorsque les cultures atteignent environ 80% de confluence éliminer le milieu du puits et laver avec du PBS.
Note: Ne pas laisser les cellules dépassent 90% de confluence, car cela peut conduire à un détachement des cellules et la formation de neurosphères et en plus, l'augmentation des niveaux de la mort cellulaire. - Ajouter 50 ml Accutase et incuber à 37 ° C pendant 2-3 min (vérifier si les cellules sont arrondis et détaché).
- Éliminer les cellules à un tube de 15 ml et on lave le puits une fois avec du PBS et transférer dans le même tube.
- Diluer les cellules à 5 ml avec du PBS et centrifuger à 300 g pendant 5 min.
- Pour le premier passage, diluer les cellules à 1 ml et de la plaque dans un PDL / laminine bien revêtue d'une plaque à 24 puits.
- Pour les passages ultérieurs, remettre les cellules dans 200 ml de milieu de croissance et de comptage en utilisant un hémocytomètre. Plaque à 1 x 10 4 cellules / cm 2 dans le puits revêtu de taille appropriée ou le flacon. i>
7. Différenciation des cultures monocouches adhérentes
- Pour différencier les cultures monocouches adhérentes, des cellules proliférantes de la plaque sur PDL / laminine lamelles couvre-objet enduites à une densité de 1 x 10 4 cellules / cm 2 dans un milieu de croissance contenant 20 ng / ml d'EGF et 10 ng ml de bFGF /.
- Lorsque les cellules atteignent une confluence d'environ 80% (généralement de 2 jours), remplacer le milieu de croissance avec du milieu contenant 5 ng / ml de bFGF et 0 ng / ml d'EGF.
- Après 2 jours de 5 ng / ml de bFGF, remplacer le milieu par du milieu de croissance en l'absence des deux mitogènes pendant encore 3 jours. Remarque: au cours de cette période une quantité significative de la mort cellulaire se produit.
- Après un total de 5 jours, laver les cellules différenciées avec du PBS pour éliminer toutes les cellules mortes puis fixer avec du paraformaldéhyde 4% (PFA) pendant 20 min à température ambiante.
- Laver ensuite avec PBS pour enlever les lamelles PFA et magasins dans les puits dans 1 ml de PBS à 4 ° C.
- Diluer la SVZ dissocié ou DG tissus d'un animal dans 20 ml de milieu de culture et de la plaque 200 ml / puits dans une plaque à 96 puits en utilisant une pipette Multidoser 10 ml.
- Incuber à 37 ° C avec 5% de CO 2 pendant 6-7 jours pour neurosphères dérivées SVZ et de 10 à 12 jours pour les neurosphères dérivées DG.
Remarque: la croissance pendant plus de ces temps d'incubation recommandées va entraîner la prolifération et va conduire à la mort cellulaire dans le centre de neurosphères et / ou de fixation, et la différenciation spontanée. - Compter et mesurer le diamètre des neurosphères l'aide d'un réticule de l'oculaire monté sur un microscope optique verticale
9. Repiquer les Neurosphères
Après les neurosphères primaires ont été comptés et leur taille enregistrée ils peuvent être étendus sur plusieurs passages commençant par soit un seul neurosphère ou une culture en masse.
- L'expansion de la culture de neurosphères en vrac
- Pour passage neurosphères combinés comme une culture en masse, retirez le support contenant les neurosphères de la plaque, transférer à un tube de 15 ml et centrifuger à 300 g pendant 5 min.
- Jeter le surnageant et remettre en suspension les neurosphères dans 1 ml d'préchauffé 0,05% de trypsine-EDTA et incuber à température ambiante pendant 3 min.
- Ajouter un volume égal d'inhibiteur de trypsine contenant DNaseI et bien mélanger.
- Centrifugeuse pendant 5 min à 300 g, éliminer le surnageant et ajouter 1 ml de milieu de croissance.
- Triturer et une baisse d'environ 10x avec une pipette P1000 de dissocier les neurosphères.
- Retirer 10 ml de la suspension cellulaire et de mélange avec un volume égal de bleu trypan et effectuer un comptage des cellules vivantes l'aide d'un hématimètre.
- Réensemencer les cellules à une densité de 1 x 10 4 cellules / cm 2 dans la culture de cellules de taille appropriée ou bien ballon.
- Incuber à 37 ° Cavec 5% de CO 2 jusqu'à neurosphères secondaires forme.
- L'expansion de neurosphère unique
- Pour le passage des neurosphères individuelles choisir les puits qui contiennent une seule neurosphères et soigneusement retirer et jeter environ 160 ul de milieu de croissance de chaque puits, sans perturber le neurosphères.
- Ajouter 100 ml de 0,05% de trypsine-EDTA à chaque puits pour être repiquées et incuber à température ambiante pendant 3 min.
- Ajouter 100 ul d'inhibiteur de trypsine contenant ADNase I pour arrêter la réaction.
- Triturer environ 10 fois haut et bas avec une pipette P200 pour briser la neurosphère.
- Transférer les 200 ml contenant le neurosphères dissocié à un nouveau puits d'une plaque à 24 puits contenant 1,5 ml de milieu de croissance. Incuber à 37 ° C avec 5% de CO 2 jusqu'à neurosphères secondaires forme.
Remarque: pour déterminer le potentiel à long terme, l'une des propriétés cardinales d'un vrai s neuronauxcellule TEM, neurosphères doivent être repiquées pendant au moins 5 à 10 passages. Voir aussi la littérature sur la partie interprétation controversée de ces résultats 12-14.
10. Différenciation des cultures neurosphère
Neurosphères primaires ou à des passages peuvent être différenciées pour déterminer multipotentialité.
- Retirer neurosphères en suspension de leur plaque de culture ou ballon et de les transférer à une boîte de Pétri de 10 cm en plastique.
- Sous un microscope de dissection supprimer environ 15-20 neurosphères à partir du milieu à l'aide d'une pipette P20 et transférer sur une plaque de 24 puits contenant le milieu de culture sans facteurs de croissance et une lamelle enduit PDL / laminine.
- Différencier pendant environ 7 jours à 37 ° C avec 5% de CO 2.
- Laver les neurosphères différenciés avec du PBS pour éliminer les cellules mortes, puis fixer avec 4% de PFA pendant 20 min à température ambiante.
- Laver ensuite avec PBS à rEDéplacez des lamelles PFA et magasins dans les puits dans 1 ml de PBS à 4 ° C
11. Immunomarquage de Neurosphère et cultures adhérentes
Remarque: Pour la coloration avec l'anticorps O4 omettre le Triton du blocage et de coloration étapes et n'oubliez pas d'utiliser un anticorps IgM secondaire approprié.
- Incuber les lamelles contenant les neurosphères différenciées ou des cultures monocouches adhérentes en solution (10% de sérum d'âne normal dans du PBS contenant 0,2% de Triton X-100) de blocage pendant 60 min à température ambiante.
- Incuber dans une solution de blocage frais contenant primaire bIII-tubuline, MAP2a + b, protéine acide fibrillaire gliale (GFAP) ou des anticorps O4 pour 60min à température ambiante.
- Laver 3 fois avec PBS.
- Incuber dans une solution de blocage frais contenant fluorescence des anticorps secondaires conjugués appropriés et 4,6-diamidino-2-phénylindole (DAPI; 1:5000) pendant 30 min à température ambiante dans l'obscurité.
- Laver trois fois avec du PBS.
- Monter les lamelles sur des lames de microscope utilisant la fluorescence milieu de montage et de l'air sec dans l'obscurité pendant une nuit
- Voir et de l'image en utilisant un microscope à fluorescence.
Résultats
Bien que les deux régions neurogènes du cerveau de souris adulte contiennent à la fois des cellules précurseurs neurales, ces cellules peuvent se comporter très différemment lorsqu'elles sont cultivées in vitro. Les cultures monocouches adhérentes générés à partir des deux régions apparaissent morphologiquement indiscernables (figure 1A), cependant, les cultures adhérentes SVZ dérivés prolifèrent plus rapidement et doivent être repiquées, en moyenne, 1 à 2 jours plus tôt que ceux dérivés de la DG. Comme neurosphères, les cellules précurseurs dérivées de SVZ prolifèrent plus rapidement et forment également des neurosphères plus grandes (Figure 1B) que les cellules précurseurs dérivées de DG (Figure 1C). Alors que neurosphères dérivées SVZ sont généralement comptées après 6-7 jours de culture, les neurosphères dérivées DG sont généralement quantifiés après 10 à 12 jours. En outre, un plus grand nombre de cellules précurseurs neurales résident dans la SVZ par rapport à la direction générale, comme en témoigne la presque dix fois plus grand nombre de neurosphères qui peuvent être genrested de cette région (SVZ: 1173 ± 74,9 vs DG: 145,3 ± 26,4, p = <0,0001, n = 10 animaux par groupe; figure 2A).
Des études ont montré que les cellules précurseurs au sein de la SVZ et DG répondent à différents stimuli. Les cellules précurseurs dans le DG sont activés par des types spécifiques de l'apprentissage spatial et par des stimuli tels que l'enrichissement du milieu et l'activité physique, tandis que les cellules précurseur sont activées par SVZ apprentissage olfactif et enrichissement olfactif. Conformément à cela, l'un de nous (BLT) précédemment démontré que la DG contient une population de souches latente et les cellules progénitrices qui peut être activé par l'excitation neuronale 15-18. En revanche, nous avons trouvé que les cellules précurseurs SVZ répondent tout à fait différemment de ce stimulus, avec une diminution du nombre de neurosphères en réponse à des niveaux de dépolarisation de KCl 17. Ici, nous avons répété cette expérience, le placage de la moitié des cellules isolées provenant de la SVZ et DG d'individual animaux dans les niveaux de dépolarisation de KCl et l'autre moitié à des niveaux de contrôle de KCl. Nous démontrons, comme précédemment, que tandis que les cellules précurseurs DG sont activés par la dépolarisation (101,2 ± 17,4 vs 184,8 ± 12,5, p = 0,005, n = 5 animaux), la prolifération des cellules SVZ dérivés est en fait diminué de manière significative ( 368,0 ± 62,9 vs 266,6 ± 41,6, p = 0,02, n = 5 animaux; Figure 2B).
Pour confirmer le potentiel à long terme, l'un des traits essentiels d'une véritable cellule souche, neurosphères simples ou des cultures monocouches adhérentes doit être capable d'expansion prolongée dire sur au moins 10 passages. A chaque passage, suite à la préparation d'une suspension à cellule unique, le nombre de cellules est compté et l'expansion de pliage est calculée. Le total théorique de la cellule est alors calculé en multipliant le pli pendant l'expansion de ce passage par le total théorique du passage précédent. C'est disp étaient posées comme un graphique linéaire avec le nombre de passage comploté contre le log10 du nombre total de cellules théorique (voir par exemple la figure 3). Pour confirmer multipotentialité, deux cultures et neurosphères monocouches peuvent être différenciés par le retrait de mitogène et seront affichés pour donner naissance à deux neurones, les cellules gliales et (figure 4).
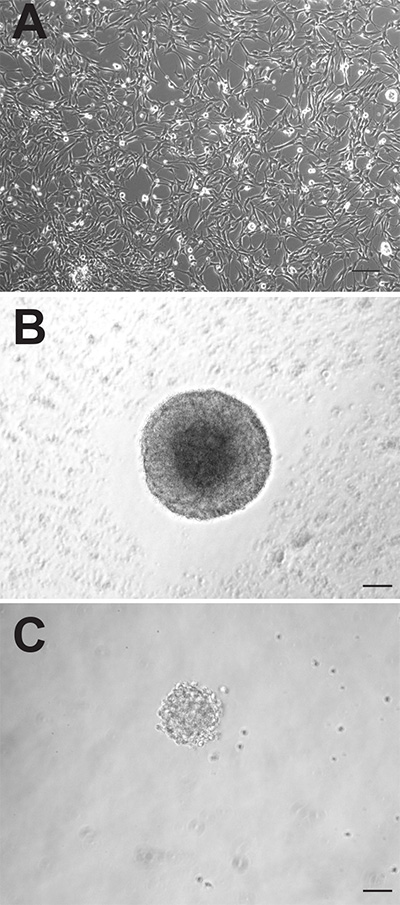
. Cellules précurseurs de souris Figure 1 adultes peuvent être cultivées comme cultures monocouches adhérentes (A) ou (B neurosphères: SVZ, C: DG).. Barre d'échelle est de 50 mm Cliquez ici pour agrandir l'image.
load/51225/51225fig2highres.jpg "src =" / files/ftp_upload/51225/51225fig2.jpg "/>
Figure 2. Significativement plus neurosphères sont générés à partir de la SVZ par rapport à la DG de souris unique (A). Les cellules précurseurs SVZ et DG répondent différemment à la dépolarisation in vitro (B).

Figure 3. Pour confirmer la potentialisation à long terme, neurosphères sont étendues depuis plus de 10 passages.

Figure 4. Neurosphères peuvent être différenciées en bIII-tubuneurones lin + (A: rouge), GFAP + astrocytes (A: vert), O4 + oligodendrocytes (B: rouge) et Map2ab + neurones (C: rouge). Cliquez ici pour agrandir l'image.
Discussion
Cet article présente un protocole détaillé pour l'initiation des cultures de précurseurs neurales, les deux monocouches et neurosphères comme adhérentes, des deux grandes régions neurogènes du cerveau de souris adulte. Il ya un certain nombre de points importants qui doivent être gardés à l'esprit lorsque l'on tente un de ces systèmes de culture in vitro en. Tout d'abord, le choix de la méthode de dissociation est très important et est dépendante du tissu. En nos mains, 0,05% de trypsine-EDTA est très efficace pour la dissociation du tissu SVZ, et se traduit par un plus grand nombre de neurosphères que lors de l'utilisation d'une technique de dissociation à base de papaïne. Pour la dissociation de la DG tissu Cependant, nous recommandons fortement une approche de dissociation en fonction de la papaïne. Lorsque l'on compare directement les deux méthodes de dissociation sur DG tissu, nous avons observé un rendement significativement plus faible de cellules viables et environ 10 fois moins de neurosphères lors de l'utilisation de la trypsine. Cette différence de dissociation peut être dû à la différence de compositio tissulairen entre les deux régions. Le tissu compact de la DG est entouré d'un vaste neuropil et des dégâts de processus cellulaires peut se produire lors de la dissociation.
Un deuxième point important à noter est que, tandis que le dosage de neurosphère peut être utile de faire des déclarations quantitatives sur le nombre de cellules précurseurs présents dans un échantillon de tissu donné, une certaine prudence doit cependant être utilisé dans l'interprétation de ces chiffres absolus. Fusion de neurosphères peut être un facteur confondant important. Plusieurs études ont montré que les neurones sont très mobiles et peuvent fusionner, même dans ce soi-disant conditions sont «clones» 7,19. La fréquence de neurosphères en résulte peut être très dépendantes de facteurs, y compris les composants du milieu, la procédure de dissection et le processus de dissociation. Même entre gestionnaires expérimentés certaine variation dans le nombre de neurosphères générées à partir d'échantillons supposés identiques est évidente (voir la figure 1A.) Plus utile, est une comparaison directe de la fréquence de précurseur entre deux échantillons donnés (par exemple le contrôle vs traité ou de type sauvage contre knock-out) traités par la même personne au sein d'une seule expérience, plutôt que d'une déclaration quantitative du total nombre de cellules précurseurs.
Au moment de décider lequel des deux procédés de culture est le plus adapté pour un essai particulier, il est important de noter que ces deux systèmes de culture diffèrent dans l'homogénéité des types de cellules produites. En comparaison avec la prolifération des cultures de cellules adhérentes, qui montrent un pool de cellules précurseurs assez homogènes (~ 98% des cellules sont Sox2 +) 20, neurosphères sont plus hétérogènes et contiennent, ainsi que la prolifération des cellules précurseurs, les neurones différenciés, et les astrocytes 21,22. Il est important que les neurosphères sont pas cultivées pendant de longues périodes entre les passages que plus la neurosphère devenir le plus il est probable de trouver des types de cellules différenciées dans leur noyau.
Nous initions traditionnellement monocouches adhérentes neurones cultures de précurseurs de la DG tissu entre 5-8 souris. Par conséquent, lorsque l'on tente d'établir les cultures monocouches adhérentes de la DG ou SVZ d'un simple clic de souris, le plus grand soin doit être pris lors de la procédure de dissociation des tissus afin d'éviter la mort cellulaire excessive causée par la trituration du tissu, ou prenant étendu périodes de temps entre la dissection et les étapes finales de culture. Ce protocole décrit, pour la première fois, la production de cultures adhérentes de précurseur de la monocouche à partir de à la fois la SVZ et DG des animaux individuels. Il existe de nombreux cas où la comparaison de la prolifération et de la différenciation des précurseurs doit être faite sur la base d'un seul animal. Il s'agit notamment de la possibilité de comparer directement le DG et SVZ des animaux individuels en utilisant statistiques par paires et de coupler les données de culture avec des données comportementales ou physiologiques individuelles 9. Cultures animales simples aussi albas l'utilisation d'animaux transgéniques rares, où l'âge correspondant à un bassin de donneurs par 5-8 culture n'est pas possible, ainsi que des animaux uniques (par exemple croix F2 ou d'animaux élevés sur) pour les études d'association génétique.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
BLT a été soutenu par une Marie Curie international entrant bourse. Ce travail a également été financé par un financement institutionnel de base, Bundesministerium für Bildung et Forschung (BMBF) et le financement en partie avec l'appui du Programme de recherche prioritaire (SFB) 655 à GK. Les auteurs tiennent à remercier Anne Karasinsky pour les soins et l'entretien de tous les animaux utilisés dans cette étude et Odette Leiter, Susann Ruhwald, Fanny Boehme, et Richard Wetzel pour la culture cellulaire et l'aide de la microscopie.
matériels
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P7280-5MG | |
| Laminin | Roche | 11243217001 | |
| Glass Pastuer pipettes | Volac | BS5732 | |
| DMEM:F12 (1:1) 1x | Life Technologies | 21331-020 | |
| Neural Basal Medium (1x) | Life Technologies | 21103-049 | |
| B27 supplements (50x) | Life Technologies | 17504-044 | |
| GlutaMAX | Life Technologies | 35050-038 | |
| Heparin | Sigma | H3393 | |
| Penacillin/Streptomycin | Life Technologies | 15140-122 | |
| EGF | PeproTech | AF-100-15 | |
| bFGF | PeproTech | 100-18B | |
| 0.05% Trypsin-EDTA | Life Technologies | 25300-054 | |
| Trypsin inhibitor | Sigma | T6522 | |
| DNaseI | Roche | 10104159001 | |
| Accutase | PAA | L11-007 | |
| Papain | Worthington | LS003120 | |
| Dispase | Life Technologies | 17105-041 | |
| Percoll | GE Healthcare | 17-0891-02 | |
| HBSS (with Calcium and Magnesium) | Life Technologies | 14025-050 | |
| Glucose | Roth | X997.2 | |
| HEPES | Sigma | H3375-500G | |
| NaHCO3 | Merck | K39347429847 | |
| 1 ml Syringes | Braun | 2016-10 | |
| 27 G Needles | Braun | 4657705 | |
| Scalpels (#22 disposable) | Braun | BA222 | |
| Dumont #7 forceps | FST | 11271-30 | |
| Dumont 5/45 forceps | FST | 11251-35 | |
| Scissors | FST | 14060-10 | |
| Iris spatula | FST | 10093-13 | |
| 70% Ethanol | |||
| PBS | Life Technologies | 14040-091 | |
| flasks/well plates | TPP | 92696 | |
| PFA (4%) | Sigma | P6148 | |
| Hemocytometer | Marienfeld | 650010 | |
| Trypan blue (0.4%) | Sigma | T8154 | |
| NDS | Millipore | 530 | |
| TritonX-100 | Sigma | T9284 | |
| Mouse monoclonal bIII-tubulin antibody | Promega | G712A | |
| Rabbit polyclonal glial fibrillary acidic protein antibody | Dako | 20334 | |
| O4 | R&D Systems | MAB1326 | |
| Map2a+b | Sigma | M1406 | |
| Donkey anti-mouse Cy3 antibody | Jackson ImmunoResearch | 715-505-151 | |
| Donkey anti-rabbit Alexa488 | Dianova | 711-545-152 | |
| 4,6-Diamidino-2-phenylindole (DAPI) | Invitrogen | 861405 | |
| Aqua Polymount | Polysciences Inc | 18606 | |
| 10 ml Combi tips | Eppendorf | 30089677 | |
| Plastic 10 ml and 25 ml serological pipettes | Corning | 4488/4489 | |
| EQUIPMENT | |||
| Pipetboy | Integra Biosciences | 521942 | |
| Multidoser pipette | Eppendorf | ||
| 37 °C waterbath | |||
| Dissecting microscope | |||
| 37 °C:5% CO2 incubator | |||
| Centrifuge | Eppendorf | 5810R |
Références
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1-13 (1996).
- Palmer, T. D., Ray, J., Gage, F. H. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol. Cell. Neurosci. 6, 474-486 (1995).
- Ray, J., Raymon, H. K., Gage, F. H. Generation and culturing of precursor cells and neuroblasts from embryonic and adult central nervous system. Methods Enzymol. 254, 20-37 (1995).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993, 18-29 (2003).
- Babu, H., Cheung, G., Kettenmann, H., Palmer, T. D., Kempermann, G. Enriched monolayer precursor cell cultures from micro-dissected adult mouse dentate gyrus yield functional granule cell-like neurons. PLoS One. 2, (2007).
- Jessberger, S., Clemenson, G. D., Gage, F. H. Spontaneous fusion and nonclonal growth of adult neural stem cells. Stem Cells. 25, 871-874 (2007).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565-4574 (1992).
- Freund, J., et al. Emergence of individuality in genetically identical mice. Science. 340, 756-759 (2013).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J. Vis. Exp. , (2010).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. J. Vis. Exp. , (2009).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol. Neurobiol. 34, 153-161 (2006).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell. Stem Cell. 8, 486-498 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres- re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Walker, T. L., Turnbull, G. W., Mackay, E. W., Hannan, A. J., Bartlett, P. F. The latent stem cell population is retained in the hippocampus of transgenic Huntington's disease mice but not wild-type mice. PLoS One. 6, (2011).
- Walker, T. L., et al. Prolactin stimulates precursor cells in the adult mouse hippocampus. PLoS One. 7, (2012).
- Walker, T. L., et al. Latent stem and progenitor cells in the hippocampus are activated by neural excitation. J. Neurosci. 28, 5240-5247 (2008).
- Walker, T. L., et al. Prominin-1 allows prospective isolation of neural stem cells from the adult murine hippocampus. J. Neurosci. 33, (2013).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Front. Neurosci. 5, 89 (2011).
- Parmar, M., Sjoberg, A., Bjorklund, A., Kokaia, Z. Phenotypic and molecular identity of cells in the adult subventricular zone in vivo and after expansion in vitro. Mol. Cell Neurosci. 24, 741-752 (2003).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99, 14506-14511 (2002).
Erratum
Formal Correction: Erratum: One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice
Posted by JoVE Editors on 11/26/2014. Citeable Link.
A correction was made to One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Many micro symbols were changed into milli symbols by accident: In the Protocols, sections 1.1, 1.3, 3.6, 3.7, 6.2, 6.6, 8.1, 9.1.6, 9.2.2, and 9.2.5 need to be fixed, as does Figure 1 description in the Results section.
Protocol section 1.1 was changed from:
At least two days prior to commencing the experiment, prepare Poly-D-lysine (PDL)/Laminin coated plates for adherent monolayer cultures. To prepare wells/flasks add enough PDL (10 mg/ml in dH2O) to coat the surface and incubate overnight at room temperature. Remove the solution from the dish and wash the dish three times with dH2O. Allow to air dry. Add Laminin (5 mg/ml in cold DMEM:F12) and incubate at 37 °C overnight. Remove the Laminin and either use the plates immediately or store with the Laminin at -20 °C until required.
to:
At least two days prior to commencing the experiment, prepare Poly-D-lysine (PDL)/Laminin coated plates for adherent monolayer cultures. To prepare wells/flasks add enough PDL (10 µg/ml in dH2O) to coat the surface and incubate overnight at room temperature. Remove the solution from the dish and wash the dish three times with dH2O. Allow to air dry. Add Laminin (5 µg/ml in cold DMEM:F12) and incubate at 37 °C overnight. Remove the Laminin and either use the plates immediately or store with the Laminin at -20 °C until required.
Protocol section 1.3 was changed from:
On the day of dissection, prepare the appropriate amount of culture medium by mixing Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 µg/ml heparin, 50 units/ml Penicillin/Streptomycin, 20 ng/ml purified mouse receptor-grade epidermal growth factor (EGF), and 20 ng/ml recombinant bovine fibroblast growth factor (FGF-2). Warm the culture medium to 37 °C in a water bath.
to:
On the day of dissection, prepare the appropriate amount of culture medium by mixing Neural Basal Medium with 2% B27, 1x GlutaMAX, 2 mg/ml heparin, 50 units/ml Penicillin/Streptomycin, 20 ng/ml purified mouse receptor-grade epidermal growth factor (EGF), and 20 ng/ml recombinant bovine fibroblast growth factor (FGF-2). Warm the culture medium to 37 °C in a water bath.
Protocol section 3.6 was changed from:
Add growth medium to a total volume of 5 ml and pass the cell suspension through a 40 mm sieve to remove debris and undissociated tissue clumps.
to:
Add growth medium to a total volume of 5 ml and pass the cell suspension through a 40 µm sieve to remove debris and undissociated tissue clumps.
Protocol section 3.7 was changed from:
Centrifuge at 300 x g for 5 min, discard the supernatant and resuspend the resulting pellet in 200 ml growth medium.
to:
Centrifuge at 300 x g for 5 min, discard the supernatant and resuspend the resulting pellet in 200 µl growth medium.
Protocol section 6.2 was changed from:
Add 50 ml Accutase and incubate at 37 °C for 2-3 min (checking to see if the cells are rounded and detached).
to:
Add 50 µl Accutase and incubate at 37 °C for 2-3 min (checking to see if the cells are rounded and detached).
Protocol section 6.6 was changed from:
For subsequent passages, resuspend cells in 200 ml growth medium and count using a hemocytometer. Plate at 1 x 104 cells/cm2 in the appropriate sized coated well or flask.
to:
For subsequent passages, resuspend cells in 200 µl growth medium and count using a hemocytometer. Plate at 1 x 104 cells/cm2 in the appropriate sized coated well or flask.
Protocol section 8.1 was changed from:
Dilute the dissociated SVZ or DG tissue from one animal in 20 ml of culture medium and plate 200 ml/well across a 96-well plate using a 10 ml multidoser pipette.
to:
Dilute the dissociated SVZ or DG tissue from one animal in 20 ml of culture medium and plate 200 µl/well across a 96-well plate using a 10 ml multidoser pipette.
Protocol section 9.1.6 was changed from:
Remove 10 ml of the cell suspension and mix with an equal volume of trypan blue and perform a live cell count using a hemocytometer.
to:
Remove 10 µl of the cell suspension and mix with an equal volume of trypan blue and perform a live cell count using a hemocytometer.
Protocol section 9.2.2 was changed from:
Add 100 ml of 0.05% Trypsin-EDTA to each well to be passaged and incubate at room temperature for 3 min.
to:
Add 100 µl of 0.05% Trypsin-EDTA to each well to be passaged and incubate at room temperature for 3 min.
Protocol section 9.2.5 was changed from:
Transfer the 200 ml containing the dissociated neurosphere to a new well of a 24-well plate containing 1.5 ml of growth medium. Incubate at 37 °C with 5% CO2 until secondary neurospheres form.
to:
Transfer the 200 µl containing the dissociated neurosphere to a new well of a 24-well plate containing 1.5 ml of growth medium. Incubate at 37 °C with 5% CO2 until secondary neurospheres form.
Figure 1 description was updated from:
Figure 1. Adult mouse precursor cells can be cultured as adherent monolayer cultures (A) or as neurospheres (B: SVZ, C: DG). Scale bar is 50 mm.
to:
Figure 1. Adult mouse precursor cells can be cultured as adherent monolayer cultures (A) or as neurospheres (B: SVZ, C: DG). Scale bar is 50 µm.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon