Method Article
La infección bacteriana sistémica y Defensa Inmune fenotipos en
En este artículo
Resumen
Drosophila melanogaster is an outstanding model organism for studying innate immune systems and the physiological consequences of infection and disease. This protocol describes how to deliver robust and quantitatively repeatable bacterial infections to D. melanogaster, and how to subsequently measure infection severity and quantify the host immune response.
Resumen
La mosca de la fruta Drosophila melanogaster es uno de los organismos modelo de primera clase para el estudio de la función y la evolución de la defensa inmune. Muchos aspectos de la inmunidad innata se conservan entre insectos y mamíferos, y desde Drosophila puede ser fácilmente manipulado genéticamente y experimentalmente, que son de gran alcance para el estudio de la función del sistema inmune y las consecuencias fisiológicas de la enfermedad. El procedimiento ha demostrado aquí permite la infección de las moscas por la introducción de bacterias directamente en la cavidad del cuerpo, por encima de las barreras epiteliales y formas más pasivas de defensa y permitiendo enfoque en la infección sistémica. El procedimiento incluye protocolos para las tasas de mortalidad de medición anfitrión, la carga de patógenos sistémica, y el grado de inducción del sistema inmune del huésped. Este procedimiento de infección es barato, robusto y cuantitativamente repetible, y se puede utilizar en estudios de genética funcional, la historia evolutiva, la vida y la fisiología.
Introducción
La mosca de la fruta Drosophila melanogaster es uno de los organismos modelo de primera clase para el estudio de la función y la evolución de la defensa inmune. Drosophila son baratos y fáciles de criar, son altamente susceptibles a la manipulación experimental, y están respaldados por una amplia comunidad científica que ha desarrollado una amplia variedad de herramientas de investigación. Muchos aspectos de la inmunidad innata se conservan entre los insectos y mamíferos, incluyendo la transducción de señales mediada por los receptores Toll-like y NF-kB factores de transcripción de la familia, de señalización JAK / STAT, y las respuestas de la vía JNK. 1,2 La función de estos genes y vías lata ser consultados en el D. melanogaster mediante mutaciones o RNAi caídas que aumentan o vía disminución actividades. 3 - 6 Además, Drosophila se puede utilizar para estudiar las consecuencias fisiológicas de la infección y la enfermedad, incluso en el contexto de la teoría evolutiva historia de vida 7.- 9 Todos estos estudios, sin embargo, dependen de la capacidad de infectar de forma fiable moscas experimentales bajo condiciones de tratamiento definidos. El procedimiento descrito aquí presenta un marco metodológico para la entrega de infecciones bacterianas robustos y repetibles a Drosophila melanogaster y posteriormente medir la gravedad de la infección y la cuantificación de la respuesta inmune del huésped.
Drosophila puede ser natural y experimentalmente infectado por una amplia variedad de parásitos y agentes patógenos, incluyendo bacterias, hongos, virus, nematodos y avispas parasitoides. El protocolo actual se centra en la entrega de la infección bacteriana sistémica. Muchas bacterias diferentes se pueden utilizar para infectar las moscas, y la elección del experimentador deben basarse en las cuestiones científicas precisas que nos pidieron. Por ejemplo, los aislados clínicos humanos se pueden emplear para estudiar los mecanismos de virulencia bacteriana 10, o ecológicamente cepas pertinentes pueden ser preferred para el estudio de la evolución. 11 Algunas bacterias son patógenos competentes de D. melanogaster, la proliferación tras la infección y causar la enfermedad de host o la muerte. Otras bacterias se administran eficazmente por el sistema inmune del huésped y borran dentro de unos pocos días. En esta demostración, Providencia rettgeri será utilizado como un patógeno proliferativa que puede causar la mortalidad de acogida y persiste en huéspedes supervivientes. Escherichia coli se utilizará como un no patógeno que se elimina por el sistema inmune del huésped.
La infección se estableció mediante la introducción de bacterias directamente en la cavidad del cuerpo de la mosca. Este enfoque evita las barreras epiteliales y comportamientos de protección, lo que permite la investigación de la infección sistémica con independencia del modo natural de transmisión. Hay dos métodos principales para establecer experimentalmente la infección sistémica. En el primero, un nanoinjector y capilares de vidrio tirado agujas se utilizan para inyectar un número preciso debacterias en la marcha. Este método tiene las ventajas de permitir un gran rango dinámico de dosis de infección y de ser cuantitativamente altamente repetible. El segundo enfoque es entregar la infección con un pinchazo séptico. Este enfoque tiene las ventajas de ser rápido y no requiere equipo especial. Una vez establecidas las infecciones, se hace posible medir la carga sistémica patógeno, la mortalidad de acogida, y la actividad inducible sistema inmunológico. Por supuesto, cualquier número de fenotipos adicionales posiblemente podría medirse en D. infectada melanogaster, incluyendo post-infección fecundidad 12, la capacidad de aprendizaje 13, estado metabólico 14, o prácticamente cualquier otro rasgo que se puede imaginar.
Protocolo
1. Recoger y preparar moscas
- Posterior D. melanogaster bajo las condiciones experimentales deseados. Tenga cuidado de no saturar las moscas durante la crianza y asegúrese de que las densidades de larvas son consistentes a través de los tratamientos, ya que las condiciones ambientales durante la etapa larval pueden afectar profundamente fenotipos de defensa inmune durante la etapa adulta. 15
- Recoger moscas experimentales 0-3 días después de la eclosión de la caja de pupa y transferirlos a un medio fresco.
- Casa de las moscas recolectadas a una temperatura deseada (temperaturas entre 22 ° C y 28 ° C son generalmente adecuados) hasta que tengan 5 - 7 días después de la eclosión.
NOTA: Esto da tiempo suficiente para que las moscas para completar la metamorfosis y convertirse en adultos maduros, pero es así antes de que comience la senescencia. - Ordena el número deseado de moscas en un vial separado antes de la infección, de nuevo teniendo cuidado de evitar el hacinamiento.
NOTA: Sólo males están infectados en esta demostración, pero es igualmente posible infectar hembras utilizando el procedimiento descrito.
2. Preparar cultura y bacterias
- Preparar un plato principal de las bacterias elegidas al menos 2 días antes de la infección. Racha de las bacterias de un glicerol 15% almacenados indefinidamente a -80 ° C. Guarde la placa maestra a 4 ° C durante un máximo de 2 semanas. Siempre racha de las placas maestras directamente desde el glicerol congelado. Evite el paso en serie de las bacterias de la placa a la placa, como paso repetido en la cultura puede hacer que las bacterias evolucionan virulencia atenuada.
NOTA: En este ejemplo se hace uso de Providencia rettgeri y Escherichia coli. - Utilice el siguiente procedimiento para preparar una suspensión bacteriana para inyección.
- Crecer una cultura 2 ml de bacterias mediante la inoculación de medio estéril con una sola colonia aislada de la placa maestra. Crecer las bacterias a la fase estacionaria (por ejemplo, O / N de crecimiento a 37 ° C).
NOTA: Tanto P. rettgeri y E. coli crecen bien en Luria Broth a temperaturas desde 20 hasta 37 ° C con agitación suave. - Una vez que la cultura ha llegado a la fase estacionaria, sedimentar suavemente las células a partir de aprox. 600 l de la cultura en una centrífuga de mesa (3 min a 5.000 xg), descartar el sobrenadante y resuspender las bacterias en aprox. 1000 l de solución salina estéril tamponada con fosfato (PBS; NaCl 137 mM, 2,7 mM de KCl, 10 mM Na 2 PO 4, 1,8 mM KH 2 PO 4, pH = 7,4).
- Diluir las células se resuspendieron en PBS estéril para alcanzar una densidad óptica (OD) apropiado para la bacteria que se utiliza, medido con un espectrofotómetro como la absorbancia a 600 nm. Utilice esta suspensión para infectar las moscas.
NOTA: A 600 = 0,1 o 1,0 corresponde, respectivamente, a aproximadamente 10 8 y 10 9 Providencia rettgeri o E. coli por ml. Debido a que ambos viven unand bacterias muertas contribuyen a la densidad óptica, es importante para cosechar cultivos en fase estacionaria temprana antes de cadáveres bacterianas se acumulan y distorsionar la relación entre densidad óptica y el número de bacterias viables introducidas durante la infección.
- Crecer una cultura 2 ml de bacterias mediante la inoculación de medio estéril con una sola colonia aislada de la placa maestra. Crecer las bacterias a la fase estacionaria (por ejemplo, O / N de crecimiento a 37 ° C).
3. Infectar las Moscas
NOTA: Como Drosophila inmunidad se ve influenciado por el ritmo circadiano, es importante llevar a cabo las infecciones a la misma hora del día a través de repeticiones experimentales 16.
3.1) El uso de un Nanoinjector
- Preparar las agujas de vidrio para la infección.
- Preparar una aguja de vidrio tirando de un capilar de vidrio de borosilicato con un extractor micropipeta.
- El uso de pinzas, rompa la punta de la aguja para crear una abertura de aproximadamente 50 m de diámetro para permitir la eyección de líquido.
- Montar el inyector.
- Coloque el sellado de la junta tórica y luego el sp blancoacer (grande hoyuelo hacia afuera) sobre el émbolo de metal.
- Llene la aguja de vidrio con aceite mineral usando una jeringa con una aguja 30 G.
- Ponga la aguja de vidrio lleno a través de la pinza y coloque la junta tórica grande alrededor de su base, alrededor de 1 mm desde el extremo romo de la aguja.
- Deslice la aguja sobre el émbolo de metal y el tornillo suavemente en la pinza hasta que quede firme.
- Expulsar la mayor parte del aceite mineral desde el inyector, pero asegúrese de que todavía hay un pequeño volumen de aceite en la aguja para actuar como una barrera entre el inyector y la suspensión bacteriana. Asegúrese de que no haya burbujas de aire en el aceite mineral o suspensión bacteriana, o entre los dos líquidos.
- Ajuste el inyector hasta el volumen deseado para inyección (entre 9 y 50 nl nl).
- Generar hiriendo controles.
- Llene la aguja del inyector con PBS estéril cuidadosamente mediante la inserción de la punta de la aguja capilar en un tubo de los medios de comunicación y pressing en el botón "llenar" en el inyector.
NOTA: Estéril medios de crecimiento bacteriano también se puede utilizar un control hiriendo si el experimento requiere la inyección de bacterias suspendidas en su medio de crecimiento. Sin embargo, debido a los medios de crecimiento bacteriano contiene componentes que pueden estimular el sistema inmune o tener otros efectos en el huésped, un vehículo inerte tal como PBS es preferible. - Anestesiar el número deseado de moscas bajo un ligero flujo de CO 2.
- Inyectar las moscas en el abdomen anterior en la superficie ventrolateral con el PBS estéril.
NOTA: También es posible inyectar moscas en otros sitios, como la placa de sternopleural del tórax, pero es importante para mantener el sitio de inyección consistente dentro de cada experimento 17. - Coloque las moscas inyectadas en viales frescos con nuevo medio, por la que se los viales de su lado hasta que todas las moscas se han recuperado de la anestesia para evitar que las moscas se convierta pegado a la comida.
NOTA: Se recomienda para inyectar las moscas de control PBS antes de la inyección de bacterias a las moscas experimentales por lo que la misma aguja se puede utilizar para ambos tratamientos. No siempre será posible usar la misma aguja para todo un experimento. En ese caso, puede ser deseable para registrar que la aguja se utilizó con el que las moscas y que incluya la identidad de la aguja como un factor experimental en el análisis estadístico.
- Llene la aguja del inyector con PBS estéril cuidadosamente mediante la inserción de la punta de la aguja capilar en un tubo de los medios de comunicación y pressing en el botón "llenar" en el inyector.
- Inyectar el patógeno bacteriano.
- Expulsar los medios estéril restante del inyector y vuelva a llenar la misma aguja con la suspensión bacteriana.
- Repita el procedimiento anterior (3.1.3), ahora la inyección de las moscas con la suspensión bacteriana preparada en el procedimiento 2.2.
3.2) Con séptico Pinprick
- Preparar la aguja para pinchar.
- Derretir el final de una punta de la micropipeta 200 l e inserte un 0,15 mm pin minutien insectos en el plástico fundido. Deje que el plástico se solidifique Doch que el pasador se mantiene en su lugar con aproximadamente 0,5 cm de pasador que se extienden desde el plástico.
- Generar hiriendo controles.
- Anestesiar el número deseado de moscas bajo un ligero flujo de CO 2.
- Pinchar las moscas en la placa sternopleural del tórax con la aguja, evitando los sitios de unión de las alas y las patas. Si es necesario, retire con cuidado las moscas de la clavija minutien utilizando pinzas suaves.
NOTA:. También es posible para pinchar las moscas en otros sitios, como el abdomen anterior en la superficie ventrolateral, pero es importante para mantener el sitio de inyección consistente dentro de cada experimento 17 Pinchazo través de la cutícula del abdomen tiende a ser más difícil que pinchar del tórax y por lo tanto menos común es. - Coloque las moscas se pincha en un vial fresco con nuevo medio mosca, por el que el vial en su lado hasta que todas las moscas se han recuperado de la anestesia para evitar que las moscas de bevenida pegado a la comida.
- Introducir la infección bacteriana.
- Anestesiar el número deseado de moscas bajo un ligero flujo de CO 2.
- Pinchar cada vuelan en la misma ubicación que los controles de medios, sumergiendo la punta del alfiler en la suspensión bacteriana preparada en el procedimiento 2.2 antes de pincharse cada marcha.
- Coloque las moscas se pincha en un vial fresco con nuevo medio mosca, por el que el vial en su lado hasta que todas las moscas se han recuperado de la anestesia para evitar que las moscas se convierta pegado a la comida.
3.3) Evaluar la dosis infecciosa Delivered
- Infectar a un conjunto de moscas como se describe anteriormente en cualquiera de los procedimientos 3.1 o 3.2, sólo que en lugar de volver a las moscas a vial alimentos para recuperarse de la anestesia, coloque cada una mosca en un tubo de microcentrífuga en hielo.
- Añadir 250 l de PBS a cada tubo y homogeneizar las moscas, ya sea usando una mano de mortero o un batidor de perlas.
- Placa del homogeneizado en una placa de agar LB, ya sea usando un dispensador en espiral o una dilución en serie.
- Para la placa utilizando dilución en serie, transferir cada homogeneizado mosca a la primera fila de una placa de 96 pocillos.
- Llene cada pocillo de las filas restantes con 90 l de PBS.
- Con una pipeta multicanal, tome 10 l de la primera fila que contiene vuela homogeneizado y dispensar en la segunda fila.
- Pipeta de arriba abajo al menos 10 veces para mezclar bien, y luego tomar 10 l y traslado a la tercera fila. Repita este procedimiento usando las filas restantes.
- A partir de la fila inferior (más diluida suspensión de bacterias), utilice la pipeta multicanal para tomar 10 l de cada pocillo y se depositan sobre una placa de LB, teniendo cuidado de que las muestras se dispensan como puntos discretos que no se tocan entre sí. Repita hasta que todos los pozos han sido muestreados de cada fila, dispensación en orden descendente de la dilución en la placa LB.
- Deja la placa a temperatura ambiente hasta que las manchas han completamente empapado en la placa LB.
NOTA: El secado de la placa de LB durante unos días a temperatura ambiente antes de su uso se recomienda para asegurar que el líquido se absorbe fácilmente, reduciendo al mínimo las posibilidades de contacto accidental entre los puntos de muestra.
- Incubar las placas O / N, teniendo cuidado de no crecer demasiado las placas de modo colonias siguen siendo pequeños y discretos.
NOTA: En función del medio de cultivo y la incubación de temperatura bacteriana utilizada, colonias derivadas de la microbiota intestinal endógena de la mosca pueden llegar a aparecer en la placa. Sin embargo, la mayoría de las bacterias utilizadas para la infección patógena crecen mucho más rápido que la microbiota intestinal en agar LB a 37 ° C. - Retire las placas de la incubadora cuando las bacterias experimentales han crecido colonias visibles (típicamente 8-12 horas), pero antes de Drosophila colonias microbiota intestinal aparecen (aproximadamente 36 horas). Para las bacterias experimentales de crecimiento lento, use un selectivaantibiótico en el agar LB para eliminar cualquier colonia de la microbiota intestinal.
- Contar el número de colonias por cada homogeneizado.
- Para placas espirales, contar las colonias que crecen utilizando un contador de colonias automatizado que puede estimar la carga bacteriana por ml de homogeneizado basado en el número y posición de las colonias en la placa.
NOTA: los recuentos de espirales son más precisa cuando la concentración bacteriana está en el intervalo de 5 x 10 02 al 05 x 10 4 bacterias por ml. - Para placas de punto, contar manualmente las colonias para cada mosca desde cualquier dilución contiene 30 a 300 colonias y calcular el número de bacterias por ml de homogeneizado inicial.
- Para placas espirales, contar las colonias que crecen utilizando un contador de colonias automatizado que puede estimar la carga bacteriana por ml de homogeneizado basado en el número y posición de las colonias en la placa.
4. Caracterizar Supervivencia de la Infección
- Ensayo de mortalidad después de la inyección.
- Coloque moscas infectadas y controles heridos en viales frescas y mantener en una incubadora a una temperatura deseada (25 ° C con un lig 12:12ht: Se recomienda oscuridad ciclo). No ponga más de 15 moscas en un solo vial como se hace difícil contar más de 15 moscas de vida.
- Cuente el número de moscas vivas y muertas cada día, o con mayor frecuencia si es apropiado.
- Con el fin de mantener la calidad de los alimentos, voltear las moscas a la nueva comida en un horario regular.
- Si el vial contiene sólo los machos, transferirlos a viales frescas cada tres días. Si el vial contiene hembras, transferir a viales frescos cada dos días porque la progenie larval se licuar los alimentos, lo que aumenta el riesgo de que las moscas adultas pueden atascarse y resultando en tasas sobreestimado de mortalidad debido a la infección.
- Analizar estadísticamente los datos.
- Supervivencia parcela como una curva de Kaplan-Meier, que indica la probabilidad de que un individuo sobreviva a una inyección medido puesto punto de tiempo. 18 Para las curvas de supervivencia que no crucen, realizar comparaciones por pares utilizando un Log-Rank Test (también llamada prueba de Mantel Cox) o realizar análisis más complejos utilizando un modelo de riesgos proporcionales de Cox, que puede incorporar varios factores y sus interacciones. Para las curvas de supervivencia que se cruzan, realizar un análisis de Cox estratificado. 17
5. Ensayo bacteriana Cargar post-infección
- Mida la carga bacteriana.
- En una post-inyección de tiempo prescrito, repita el procedimiento utilizado para evaluar la dosis infecciosa para determinar la carga bacteriana en el transcurso de la infección (ver protocolo 3.3).
NOTA: Si utiliza el dispensador en espiral, diluir homogeneizados de manera que la suspensión bacteriana cae dentro de un rango de 1.000 - 100.000 bacterias por ml.
- En una post-inyección de tiempo prescrito, repita el procedimiento utilizado para evaluar la dosis infecciosa para determinar la carga bacteriana en el transcurso de la infección (ver protocolo 3.3).
- Analizar los datos.
- Si la carga bacteriana es no normal, o bien transformar los datos para aproximar mejor una distribución normal o analizar los datos mediante el análisis estadístico no paramétrico (por ejemplo, la prueba de Mann-Whitney). Utilice un análisis de Box-Cox para find la transformación óptima; registro natural o de base -10 transformaciones de registro suelen ser eficaces. 19
- Si los datos están suficientemente distribuyen normalmente y sólo hay dos tratamientos que se están contrastados, realizar una prueba t para determinar si los dos tratamientos dan lugar a diferentes cargas bacterianas medias. Si hay varias variables experimentales u otros posibles factores predictivos, utilice análisis de varianza (ANOVA) para determinar qué factores son predictores significativos de la carga bacteriana. 19
6. Ensayo de Transcripción de activación de los genes del sistema inmune
- Para visualizar toscamente activación inmune después de la infección, infectar moscas transgénicas que expresan la proteína verde fluorescente (GFP) bajo el control de un promotor de un gen de péptido antimicrobiano como se describe anteriormente. 18
- Ver las moscas infectadas debajo de un microscopio de fluorescencia capaz; Inducción GFP debe convertirse visible en el cuerpo de grasa dentro de la primera 6-10 horas después de la infección.
- Para la cuantificación más precisa de la activación inmune, utilizar PCR cuantitativa a la plantilla de cDNA (qRT-PCR) para medir la abundancia de las transcripciones de genes antimicrobianos péptido.
NOTA: La expresión de genes inmunes se puede medir en cualquier momento después de la infección (o antes). Hablando en general, la inducción de la expresión génica inmune comienza aproximadamente 4 hr después de la inyección y aumenta durante el próximo 24 hr.- Anestesiar moscas utilizando CO 2.
- Coloque 15 moscas en un tubo de microcentrífuga para cada extracción de RNA.
NOTA: Se recomienda para recoger al menos tres muestras replicadas para cada condición de tratamiento. - Extracto de ARN de las moscas y generar primera cadena de ADNc utilizando cualquiera de una serie de procedimientos estándar o kits comerciales. ARN tienda a -80 ° C. ADNc tienda a -20 ° C por períodos de unas pocas semanas y a -80 ° C para almacenamiento a largo plazo. Antes de la extracción de RNA, tienda de fse encuentra a -80 ° C.
- Realizar PCR cuantitativa (qPCR) en los genes diana de interés utilizando el ADNc como plantilla. Consulte la Tabla 1 para las secuencias de cebadores para amplificar los genes de péptidos antibacterianos Diptericin A, Drosomycin, defensinas, Attacin A y Metchnikowin así como la rp49 gen de control de limpieza (también conocido como RPL32).
NOTA: Los genes que codifican los péptidos antimicrobianos Diptericin A y Drosomycin proporcionan muy buenas lecturas de D. melanogaster actividad inmune inducida principalmente a través de las vías del IMD y de peaje, respectivamente. Con el fin de controlar la variación de muestra a muestra en el rendimiento de ARN y la eficiencia de la transcripción reversa, estandarizar la expresión de genes diana registrado contra un gen de mantenimiento de referencia cuya expresión no se espera que cambie con la infección tales como rp49 (también conocidos como RPL 32). - Analizar los datos.
- Para aproximación de las diferencias de expresión, calcular la relación de la cantidad de partida (SQ) valor obtenido a partir del gen de ensayo (por ejemplo, Diptericin A) en relación con el valor SQ obtenido a partir del gen de referencia (por ejemplo, rp49) para cada muestra (calculado como SQ - DPTA / SQ - rp49). Escala estos ratios a un tratamiento de control de línea de base, tales como un control de manejo no infectada. Fijar arbitrariamente el nivel de expresión de control igual a 1,0 y visualizar tratamientos experimentales como cambios veces relativos. Estimar el valor SQ para cada gen frente a una curva estándar generada a partir de una serie de dilución de cDNA conocida en la cantidad.
NOTA: El análisis estadístico de las relaciones puede ser complicado, por lo que este enfoque es mejor para aproximación rápida que para un análisis riguroso. Si la eficiencia de PCR es baja, el diseño de nuevos cebadores para mejorar la cinética de la PCR, si es posible. Para las reacciones de qPCR con eficiencia casi perfecta (adoubling de producto de PCR en cada ciclo), el ciclo umbral (C T) puede ser sustituido por el valor SQ. - Para los experimentos simples con amplificación óptimamente eficiente, los datos pueden ser analizados usando el método ΔΔC T. 19 Para cada muestra, restar el valor C T del gen de referencia (por ejemplo, rp49) de la C T del gen de ensayo (por ejemplo., Diptericin A) para producir un? C T. Luego reste la T? C del control de línea de base de la T? C para cada muestra experimental para producir un valor ΔΔC T para cada muestra; este ΔΔC T es indicativo de diferencias relativas en los niveles de expresión génica entre los tratamientos, donde 2 (-ΔΔCT) se aproxima el cambio veces en la expresión.
NOTA: Este análisis mal puede desestimar plegable cambio en la expresión del gen diana si la PCR el gen de prueba o la referenciagen tiene una baja eficiencia. - Para el análisis más riguroso, llevar a cabo análisis de varianza (ANOVA) utilizando la expresión estimado del gen de ensayo (por ejemplo Diptericin A) como la variable de respuesta y expresión estimado del gen de control (por ejemplo, rp49) y otros factores experimentales como variables explicativas.
NOTA: Este enfoque es relativamente robusto a la ineficiencia en la amplificación por PCR y permite el análisis de los más complicados diseños experimentales.
- Para aproximación de las diferencias de expresión, calcular la relación de la cantidad de partida (SQ) valor obtenido a partir del gen de ensayo (por ejemplo, Diptericin A) en relación con el valor SQ obtenido a partir del gen de referencia (por ejemplo, rp49) para cada muestra (calculado como SQ - DPTA / SQ - rp49). Escala estos ratios a un tratamiento de control de línea de base, tales como un control de manejo no infectada. Fijar arbitrariamente el nivel de expresión de control igual a 1,0 y visualizar tratamientos experimentales como cambios veces relativos. Estimar el valor SQ para cada gen frente a una curva estándar generada a partir de una serie de dilución de cDNA conocida en la cantidad.
Resultados
Esta sección ilustra los resultados que se pueden obtener después de la infección bacteriana de Drosophila melanogaster. Figura 1 muestra que dosis de infección varía con la densidad óptica de la suspensión bacteriana utilizada para la inyección, y que la dosis administrada puede ser estimado de manera fiable por homogeneización y el chapado vuela inmediatamente después de la inyección . Como se ilustra en la Figura 2, diferentes patógenos pueden causar diferentes niveles de mortalidad host (Figura 2A) y la mortalidad huésped puede ser (Figura 2B) dependiente de la dosis. Es importante destacar que este protocolo permite diferentes tipos de infecciones que deben alcanzarse: Providencia rettgeri puede causar una infección crónica, subletal que persiste durante 20 días o más (Figura 3A). Sin embargo, otras bacterias como Escerichia coli mayormente se borrarán por la mosca de acogida dentro de seis horas después de la infección (Figura 3B). La inducción de los sys inmunesTEM se puede estimar a través de aislamiento de ARN y posterior qRT-PCR de los transcritos de péptidos antibacterianos (Figura 4A y B). Análogamente pero menos cuantitativamente, las moscas que expresan GFP bajo el control de promotores de genes de péptido antimicrobiano puede ser utilizado para visualizar la inducción del sistema inmune (Figura 4C).
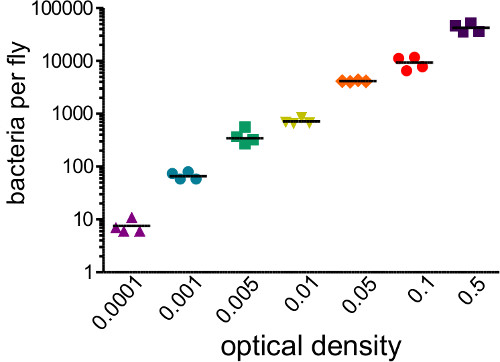
. Figura 1: Determinación de la dosis infecciosa Las moscas fueron inyectados con 50 nl de suspensiones bacterianas que cubren una gama de densidades ópticas (0,0001 a 0,05). Las moscas fueron inmediatamente homogeneizada y se sembraron para determinar el número de bacterias introducido por la inyección. Carga bacteriana inicial se correlaciona fuertemente con OD inicial inyectada (r 2 = 0,96)
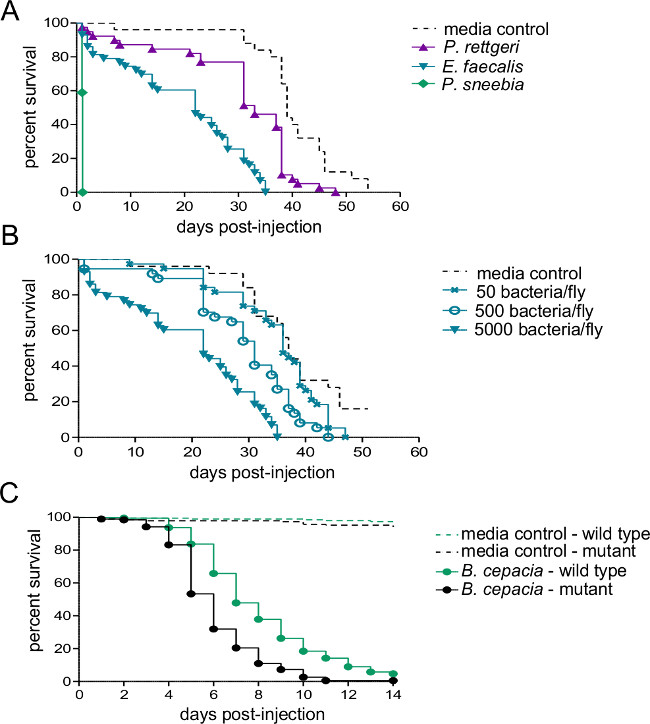
Figura 2:. supervivencia después de la inyección con patógenos bacterianos Cinco a siete machos viejos día se inyectaron con 50 nl de cualquiera de suspensión bacteriana o medios estériles y se controló para la supervivencia. (A) Tipo de moscas salvajes fueron inyectados con aproximadamente 5.000 bacterias de de una de las tres especies diferentes. La tasa de mortalidad huésped depende en gran medida de las especies bacterianas usadas para la infección. (B) Tipo moscas salvajes fueron inyectados con tres dosis diferentes de Enterococcous faecalis - 50, 500, y 5000 bacterias por mosca. Las moscas mueren más rápidamente cuando se infectan con dosis más altas infecciosas (C) Un mutante sistema inmune y su línea de control isogénicas de tipo salvaje fueron inyectados con aproximadamente 500 Burkholderia cepacia. Una comparación por parejas Log-Rank muestra que la mosca de tipo salvaje sobrevive a la infección significativamente mejor que el mutante (χ 2 = 59,02, df = 1, p <0,0001).
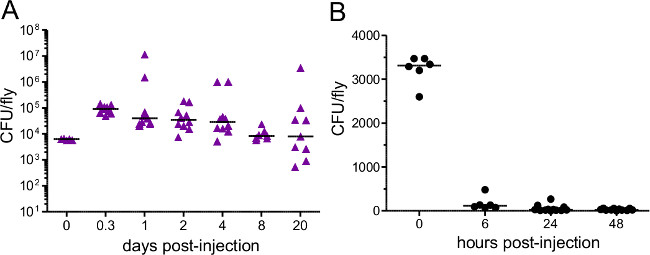
Figura 3:. Carga bacteriana después de la inyección Las moscas fueron inyectados con aproximadamente (A) 5000 P. rettgeri (B) 3400 E. coli. La carga bacteriana se determinó inmediatamente después de la inyección y en varios puntos de tiempo posteriores. Cada punto de datos representa la carga bacteriana de una sola mosca. E. coli se elimina rápidamente de anfitriones impugnados mientras que P. rettgeri persiste durante el resto de la vida del anfitrión ,.
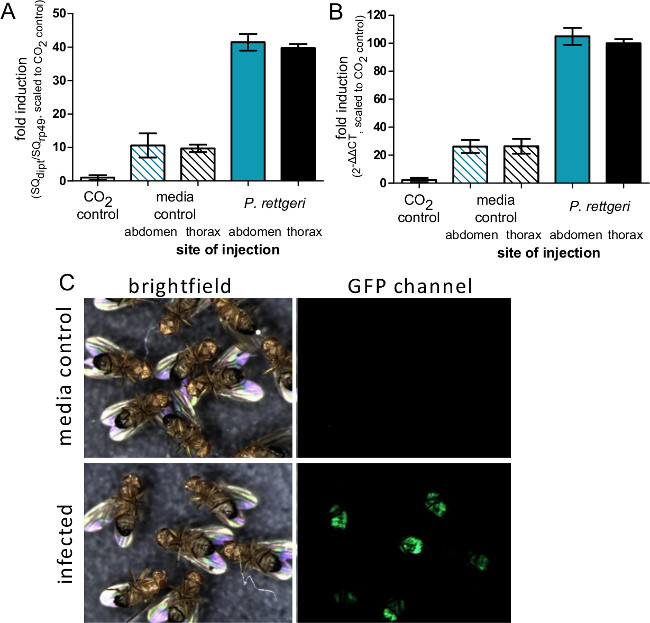
Figura 4: Inducción de la expresión génica inmune después de la inyección. Las moscas (A) se inyectaron con 50 nl de P. PBS rettgeri o estéril, ya sea en el abdomen o el tórax, o se dejaron sin manipular aparte de CO 2 anestesia. Seis horas después de la infección, las moscas fueron recolectados para el aislamiento de ARN y la expresión de la Diptericin Un gen se determinó utilizando qRT-PCR. (A) Los niveles de expresión se representan gráficamente como la relación de Diptericin Una transcripción de transcripción rp49 y ampliarse de manera que el control de CO 2 se define como tener un nivel de expresión de 1. Las barras representan la media y el error estándar de las proporciones de cada condición (n = 4). Niveles (B) de expresión se grafican como ΔΔCT 2 con el valor promedio de C T de CO 2 de control de moscas aesthesia utilizados como la condición no inducido estándar. Las barras representan el error medio y estándar de ΔΔC T de cada condición (n = 4). Mientras que no hay diferencia en la inducción de la transcripción debido a sitio de la inyección, la comparación de los paneles A y B muestra cómo el método ΔΔC T potencialmente puede sobreestimar los niveles de inducción. (C) Moscas que expresan GFP bajo el control del Diptericin Un promotor se inyectaron con 50 nl de P. rettgeri (OD = 0,1) y luego fotografiada 7 días más tarde. El panel de GFP muestra la expresión de GFP en el cuerpo la grasa abdominal de moscas infectadas, lo que indica la activación de la Diptericin Un promotor en las moscas infectadas por bacterias, pero no los controles con inyección de medios de comunicación.
| Gene | Adelante | Reverse |
| rp49 (también llamado RPL32) | 5 'AGGCCCAAGATCGTGAAGAA 3' | 5 'GACGCACTCTGTTGTCGATACC 3' |
| Diptericin A | 5 'GCGGCGATGGTTTTGG 3' | 5 'CGCTGGTCCACACCTTCTG 3' |
| Drosomycin | 5 'CTGCCTGTCCGGAAGATACAA 3 ' | 5 'TCCCTCCTCCTTGCACACA 3' |
| Defensina | 5 'GAGGATCATGTCCTGGTGCAT 3' | 5 'TCGCTTCTGGCGGCTATG 3' |
| Attacin A | 5 'CGTTTGGATCTGACCAAGG 3' | 5 'AAAGTTCCGCCAGGTGTGAC 3' |
| Metchnikowan | 5 'AACTTAATCTTGGAGCGATTTTTCTG 3' | 5 'ACGGCCTCGTATCGAAAATG 3' |
Tabla 1: Los cebadores para QRT-PCR.
Discusión
El procedimiento descrito aquí produce infección rigurosa y de alta calidad de Drosophila melanogaster. Los ejemplos ilustrados se centraron principalmente en la infección con Providencia rettgeri y E. coli, pero el protocolo es altamente adaptable y se puede aplicar a las infecciones con diversas bacterias sobre un rango de condiciones de cría de acogida y de mantenimiento.
Los detalles de un enfoque experimental óptima dependerá de la bacteria utilizada para la infección, el genotipo del huésped, y las condiciones experimentales generales. Se recomienda encarecidamente a prueba piloto nuevas condiciones experimentales antes de iniciar los proyectos más ambiciosos. Un buen punto de partida es poner a prueba tres dosis de infección en un rango de 100 veces. Altamente patógenos virulentos son a menudo mejor introdujeron en dosis infecciosas muy bajas, del orden de 10 a 100 células bacterianas por mosca. Patógenos más moderadas pueden ser inyectados con dosis más altas de alrededor de 1.000 bacterias por fly, y los no patógenos pueden ser inyectados con dosis de hasta 10.000 bacterias por mosca. A menudo es instructiva para definir la cinética de nuevas infecciones por el seguimiento de la carga de patógenos, la mortalidad de acogida, y la actividad del sistema inmune a través de una serie de tiempo longitudinal. Dado que la medición de la carga de patógenos y la expresión génica de acogida son ensayos destructivos, es necesario para infectar las moscas distintas desde el principio del experimento para cada punto de tiempo que se va a medir.
Al decidir si utilizar pinchazo o inyección a base de microcapilar, es importante tener en cuenta que hay ventajas y limitaciones de cada enfoque. Inyección capilar introduce un volumen de líquido en la marcha, que tanto aumenta la presión de turgencia y modestamente introduce sales u otras moléculas que están suspendidos o disueltos en el vehículo. Inyección capilar también requiere el acceso a un centro de inyección o compra de los equipos necesarios. Pinchazo séptico no requiere equipo e introduce especialmedios insignificantes en la marcha, y es típicamente más eficiente para infectar a un gran número de moscas. Sin embargo, las infecciones pinchazo no permiten el control preciso sobre dosis de infección que se puede lograr con la inyección capilar. El presente protocolo se centró en un aparato de inyección que regula mecánicamente volumen de inyección, pero también hay sistemas de inyección basado en pulsos discretos de aire a presión. 20,21 Estos son típicamente más caros que el aparato ofrece aquí y requieren de calibración del impulso de aire a cada aguja con el fin de asegurar volúmenes de inyección consistentes.
Existe un considerable debate, pero muy pocos datos sobre cómo las moscas se convierten sistémicamente infectado con bacterias en el medio silvestre. Algunos investigadores postulan que la mayoría de las infecciones naturales se producen cuando Drosophila ingerir bacterias patógenas y las bacterias son capaces de escapar posteriormente el intestino para establecer una infección sistémica. Sin embargo, hay muy Febacterias w sabe que son capaces de atravesar el intestino de D. melanogaster, y los que sí tienen esta capacidad son altamente letal para las moscas 22,23. Una teoría alternativa es que vuela regularmente sufrir lesiones cuticulares través de escapar de los intentos fallidos de depredación o ataque de ácaros ectoparásitos. Esta hipótesis está apoyada por la recogida frecuente de salvaje D. melanogaster teniendo manchas melanization que son indicativos de heridas cicatrizadas (observaciones no publicadas). Los ácaros se han demostrado para transmitir infecciones bacterianas en Drosophila y 24 heridas dejadas por los ácaros pueden ser secundariamente infectadas por bacterias en las abejas de miel 25. Sin embargo, la frecuencia en la naturaleza de la infección-ácaros impulsado o de otra manera oportunista de D. melanogaster través de las infracciones de la cutícula no se conoce. El protocolo descrito aquí permite la introducción de bacterias directamente en la hemolinfa través de la inyección cuantitativa que evita cualquier barreras epiteliales o Immu de comportamientonidad. Métodos para la alimentación de las bacterias patógenas a D. melanogaster han sido descritos en Vodovar et al. 22 y Nehme et al. 23.
Muchas bacterias entomopatógenos representan poco o ningún riesgo para la salud humana, lo que permite a los investigadores a trabajar con ellos cómodamente. Además, muy pocas bacterias tienen la capacidad de infectar a Drosophila en contacto sin intervención experimental, por lo que el riesgo de "epidemia" propagación de la infección bacteriana a través de un laboratorio a través de superficies contaminadas o escaparon moscas es generalmente muy baja. No obstante, es recomendable asegurarse de que las medidas de contención adecuadas en el lugar para evitar que las moscas infectadas se escape y para recuperar cualquier moscas escaparon. El laboratorio debe ser equipado a un nivel de seguridad biológica en consonancia con la de los agentes patógenos que se utiliza, y se debe emplear las mejores prácticas estándar en microbiología.
El infecti experimentalen el método descrito aquí permite infecciones de Drosophila melanogaster con cualquier dosis de cualquier bacteria arbitraria. Una vez que la infección se ha establecido, es sencillo para medir la cinética de proliferación o la eliminación de bacterias, el seguimiento de la mortalidad acogida, y para ensayo de inducción del sistema inmune del huésped. Moscas infectadas pueden ser fácilmente sometidos a otros ensayos fenotípicos, incluyendo pruebas de funciones fisiológicas que pueden dar forma o se forma por la infección. Los procedimientos descritos son de bajo costo, requieren relativamente poco equipo especializado, y se aprenden fácilmente, haciéndolos susceptibles para su uso en diversos proyectos a través de una amplitud de laboratorios de investigación y docencia.
Divulgaciones
None of the authors have competing interests or conflicting interests.
Agradecimientos
We would like to thank the entire Lazzaro lab, and especially Susan Rottschaefer, for their help in both reviewing and testing these protocols. This is a product of their cumulative expertise. Work in the Lazzaro lab is supported by grants R01 AI083932 and R01 AI064950 from the US National Institutes of Health.
Materiales
| Name | Company | Catalog Number | Comments |
| Incubator | Powers Scientific, Inc | DROS52SD | |
| Paintbrush | |||
| CO2 Flypads | FlyStuff | 59-114 | |
| CO2 | Airgas | CD FG50 | |
| Drosophila rearing mix | |||
| 6 oz Square Bottom Bottles, polypropylene | Genesee Scientific | 32-130 | |
| Nosterile Extra Large Cotton Balls | Fisher brand | 22-456-882 | |
| Microscope | Olympus Corporation | SZ51 | |
| Drosophila Vials polystyrene | VWR international | 89092-720 | |
| Nosterile Large Cotton Balls | Fisher brand | 22-456-883 | |
| 2 L flask | VWR international | 89000-370 | |
| Petri Dishes with Clear Lids, Raised Ridge; 100 x 15 mm; | VWR international | 25384-302 | |
| LB Agar, Miller | Difco | 244520 | |
| Innoculing Loop | VWR international | 80094-488 | |
| Rainin Clasic Pipettes in various sizes 0.1 µl to 2 µl, 2 µl to 20 µl, 20 µl to 200 µl, 100 µl to 1,000 µl | Rainin | PR-2 PR-20 PR-200 PR-1000 | |
| Micropipette tips (assorted sizes) | VWR international | 30128-376 53503-810 16466-008 | |
| Luria Broth Base, Miller | Difco | 241420 | |
| Disposable Culture Tubes Borosilicate Glass | VWR international | 47729-576 | |
| S-500 Orbital Shaker | VWR international | 14005-830 | |
| Centrifuge | VWR international | 37001-300 | |
| PBS pH 7.4 10X | Invitrogen | 70011044 | |
| SmartSpec 3000 Spectrophotometer | Bio-Rad | 170-2501 | |
| Semimicrovolume Cuvettes | Bio-Rad | 223-9955 | |
| Vertical Capillary Puller | Kopf Needle Pipette Puller | ||
| 3.5'' Replacement glass Capillaries for Nanojet II | Drummond Sientific Company | 3-000-203-G/X | |
| Nanoject II | Drummond Sientific Company | 3-000-204 | |
| Forceps | Fine Science Tools | 11255-20 | |
| 10 ml Syringe | BD | 309604 | |
| Mineral Oil, White, light | Macron Fine Chemicals | 6358-10 | |
| Minutein pins | Fine Science Tools | 26002-10 | |
| 1.5 ml Microcentrifuge tubes; Seal Rite | USA Scientific Inc. | 1615-5500 | |
| Motorized Pestle; Talboys Laboratory Stirrer | Troemner | 103 | |
| Talboys High Throughput Homogenizer | OPS Diagnostics | 930145 | |
| 5/32'' Grinding Balls | OPS Diagnostics | GBSS 156-5000-01 | |
| Vortex Genie | Scientific indurstries inc. | G560 | |
| Multichannel Pipettor (10 μl - 300 μl) | Sartorius | 730360 | |
| WASP2 Whitley Automated Spiral Plater | Microbiology International | ||
| ProtoCOL automated colony counter / plate counter/ plate reader | Microbiology International | ||
| TRIzol | Life Technologies | 15596-026 | |
| qPCR tubes; Low-Profile 0.2 ml 8-Tube Strips | Bio-Rad | TLS0801 | |
| qPCR caps; Optical Flat 8-Cap Strips | Bio-Rad | TCS0803 | |
| RQ1 RNase-Free DNase | Promega | m610a | |
| M-MLV Reverse Transcriptase | Promega | m170b | |
| dNTPs | Promega | U1240 | |
| Oligo-dT | IDT | ||
| SsoAdvanced SYBR Green Supermix | Bio-Rad | 172-5260 | |
| CFX Connect Real-Time PCR Detection System | Bio-Rad | 185-5200 | |
| RNasin Ribonuclease Inhibitor | Promega | N2115 |
Referencias
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual review of immunology. 25, 697-743 (2007).
- Dionne, M. S., Schneider, D. S. Models of infectious diseases in the fruit fly Drosophila melanogaster. Disease models & mechanisms. 1 (1), 43-9 (2008).
- Rutschmann, S., Jung, A. C., Hetru, C., Reichhart, J. M., Hoffmann, J. A., Ferrandon, D. The Rel protein DIF mediates the antifungal but not the antibacterial host defense in Drosophila. Immunity. 12 (5), 569-580 (2000).
- Ayres, J. S., Freitag, N., Schneider, D. S. Identification of Drosophila mutants altering defense of and endurance to Listeria monocytogenes infection. Genetics. 178 (3), 1807-1815 (2008).
- Cronin, S. J. F., et al. Genome-wide RNAi screen identifies genes involved in intestinal pathogenic bacterial infection. Science. 325 (5938), 340-343 (2009).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. , (2014).
- Dionne, M. S., Pham, L. N., Shirasu-Hiza, M., Schneider, D. S. Akt and FOXO dysregulation contribute to infection-induced wasting in Drosophila. Current biology CB. 16 (20), 1977-1985 (2006).
- McKean, K. a., Yourth, C. P., Lazzaro, B. P., Clark, A. G. The evolutionary costs of immunological maintenance and deployment. BMC evolutionary biology. 8 (1), 76 (2008).
- Kuo, T. -. H., Pike, D. H., Beizaeipour, Z., Williams, J. A. Sleep triggered by an immune response in Drosophila is regulated by the circadian clock and requires the NFkappaB Relish. BMC neuroscience. 11, 17 (2010).
- Panayidou, S., Ioannidou, E., Apidianakis, Y. Human pathogenic bacteria, fungi, and viruses in Drosophila: disease modeling, lessons, and shortcomings. Virulence. 5 (2), 253-269 (2014).
- Keebaugh, E. S., Schlenke, T. A. Insights from natural host–parasite interactions: The Drosophila model. Developmental & Comparative Immunology. 42 (1), 111-123 (2014).
- Howick, V. M., Lazzaro, B. P. Genotype and diet shape resistance and tolerance across distinct phases of bacterial infection. BMC evolutionary biology. 14 (1), 56 (2014).
- Babin, A., Kolly, S., Kawecki, T. J. Virulent bacterial infection improves aversive learning performance in Drosophila. Brain, behavior, and immunity. , (2014).
- Chambers, M. C., Song, K. H., Schneider, D. S. Listeria monocytogenes infection causes metabolic shifts in Drosophila melanogaster. PLoS ONE. 7 (12), e50679 (2012).
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular ecology. 19 (7), 1462-1468 (2010).
- Stone, E. F., Fulton, B. O., Ayres, J. S., Pham, L. N., Ziauddin, J., Shirasu-Hiza, M. M. The circadian clock protein timeless regulates phagocytosis of bacteria in Drosophila. PLoS pathogens. 8 (1), e1002445 (2012).
- Chambers, M. C., Jacobson, E., Khalil, S., Lazzaro, B. P. Thorax injury lowers resistance to infection in Drosophila melanogaster. Infection and immunity. , (2014).
- Rich, J. T., Neely, J. G., Paniello, R. C., Voelker, C. C. J., Nussenbaum, B., Wang, E. W. A practical guide to understanding Kaplan-Meier curves. Otolaryngology--head and neck surgery official journal of American Academy of Otolaryngology-Head and Neck Surgery. 143 (3), 331-336 (2010).
- Sokal, R. R., Rohlf, F. J., Freeman, W. H. . Biometry. , (1995).
- Frydman, H. Wolbachia bacterial infection in Drosophila. Journal of visualized experiments JoVE. (2), 158 (2007).
- Kuo, T. -. H., Handa, A., Williams, J. A. Quantitative measurement of the immune response and sleep in Drosophila. Journal of visualized experiments JoVE. (70), e4355 (2012).
- Vodovar, N., et al. Drosophila host defense after oral infection by an entomopathogenic Pseudomonas species. Proceedings of the National Academy of Sciences of the United States of America. 102 (32), 11414-11419 (2005).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS pathogens. 3 (11), e173 (2007).
- Jaenike, J., Polak, M., Fiskin, A., Helou, M., Minhas, M. Interspecific transmission of endosymbiotic Spiroplasma by mites. Biology. 3 (1), 23-25 (2007).
- Kanbar, G., Engels, W. Ultrastructure and bacterial infection of wounds in honey bee ( Apis mellifera) pupae punctured by Varroa mites. Parasitology research. 90 (5), 349-354 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados