Method Article
Systemische bakterielle Infektion und Immunabwehr Phänotypen in
In diesem Artikel
Zusammenfassung
Drosophila melanogaster is an outstanding model organism for studying innate immune systems and the physiological consequences of infection and disease. This protocol describes how to deliver robust and quantitatively repeatable bacterial infections to D. melanogaster, and how to subsequently measure infection severity and quantify the host immune response.
Zusammenfassung
Die Fruchtfliege Drosophila melanogaster ist einer der führenden Modellorganismen zur Untersuchung der Funktion und Evolution der Immunabwehr. Viele Aspekte der angeborenen Immunität zwischen Insekten und Säugetieren konserviert, und da Drosophila leicht genetisch und experimentell manipuliert werden, stark für die Untersuchung der Funktion des Immunsystems und die physiologischen Folgen der Krankheit sind. Das hier gezeigte Verfahren ermöglicht Infektion von Fliegen durch die Einführung von Bakterien direkt in die Körperhöhle, unter Umgehung Epithelbarrieren und passive Formen der Verteidigung und damit Fokussierung auf systemische Infektion. Das Verfahren umfasst Protokolle für die Messrate der Wirts Mortalität, systemische Keimmenge und der Grad der Induktion von dem Immunsystem des Wirts. Diese Infektion Verfahren ist preiswert, robust und quantitativ reproduzierbar und kann in Studien der funktionellen Genetik, evolutionäre Lebensgeschichte und Physiologie verwendet werden.
Einleitung
Die Fruchtfliege Drosophila melanogaster ist einer der führenden Modellorganismen zur Untersuchung der Funktion und Evolution der Immunabwehr. Drosophila sind billig und leicht nach hinten, sind sehr offen für experimentelle Manipulation und werden von einer umfangreichen wissenschaftlichen Gemeinschaft, die ein breites entwickelt hat, gesichert Reihe von Forschungswerkzeuge. Viele Aspekte der angeborenen Immunität zwischen Insekten und Säugetieren 1,2 konserviert, einschließlich Signaltransduktion von Toll-like Rezeptoren und NF-kB-Familie Transkriptionsfaktoren, JAK / STAT-Signalisierung und JNK-Weg vermittelten Reaktionen. Die Funktion dieser Gene und Signalwege können in D. abgefragt werden melanogaster mit Mutationen oder RNAi Niederschläge, Zunahme oder Abnahme Weg Aktivitäten. 3 - 6 Zusätzlich Drosophila kann verwendet werden, um die physiologischen Folgen der Infektion und Krankheit zu untersuchen, auch im Rahmen der Evolutionstheorie Lebensgeschichte werden 7.- 9. Allen diesen Untersuchungen ist jedoch abhängig von der Fähigkeit, zuverlässig zu infizieren Versuchslinie unter definierten Behandlungsbedingungen. Das hier beschriebene Verfahren stellt einen methodischen Rahmen für die Bereitstellung von robusten und wiederholbare bakterielle Infektionen zu Drosophila melanogaster und anschließend Messen Infektion Schwere und die Quantifizierung der Immunantwort des Wirts.
Drosophila können natürlich und experimentell durch eine große Vielzahl von Parasiten und Krankheitserreger, wie Bakterien, Pilze, Viren, Nematoden und Parasitenwespen infiziert werden. Das aktuelle Protokoll wird auf die Bereitstellung von systemischen bakteriellen Infektion konzentriert. Viele verschiedene Bakterien verwendet werden, um Fliegen zu infizieren, und die Wahl des Experimentators sollte über die genauen wissenschaftlichen Fragen auf der Grundlage aufgefordert werden. Zum Beispiel können menschliche klinische Isolate verwendet, um bakterielle Virulenzmechanismen 10 zu untersuchen, oder ökologisch relevanten Isolate liebsten mit seind für evolutionäre Studie. 11 Einige Bakterien sind Krankheitserreger der zuständigen D. melanogaster, wuchernden bei Infektion und verursacht Host Krankheit oder Tod. Andere Bakterien werden effektiv durch das Immunsystem des Wirts verwaltet und innerhalb von wenigen Tagen vollständig. In dieser Demonstration werden Providencia rettgeri als proliferative Krankheitserreger, der Host Sterblichkeit verursachen und bleibt in lebenden Hosts. Escherichia coli wird als nicht-pathogen, die vom Immunsystem des Wirtes freigegeben wird, verwendet werden, verwendet werden.
Infektion wird durch die Einführung von Bakterien direkt in die Körperhöhle des Fliegen hergestellt werden. Dieser Ansatz umgeht Epithelbarrieren und Schutzverhalten, so dass Untersuchung der systemischen Infektion unabhängig von der natürlichen Form der Übertragung. Es gibt grundsätzlich zwei Methoden zur Festlegung experimentell systemische Infektion. In der ersten, eine nanoinjector und zog Glaskapillare Nadeln verwendet werden, um eine genaue Anzahl von injizierenBakterien in der Fliege. Dieses Verfahren hat den Vorteil, dass sie einen großen dynamischen Bereich der Infektionsdosis und der quantitativ höchst reproduzierbar. Der zweite Ansatz ist, um eine Infektion mit einem septischen Nadelstich zu liefern. Dieser Ansatz hat den Vorteil, dass eine schnelle und keine spezielle Ausrüstung erforderlich ist. Sobald die Infektion festgestellt werden, wird es möglich, die systemische Belastung Erreger, Wirt Mortalität und induzierbare Aktivität des Immunsystems zu messen. Natürlich könnte eine beliebige Anzahl von zusätzlichen Phänotypen denkbar in infizierten D. mess melanogaster, auch nach der Infektion Fruchtbarkeit 12, Lernfähigkeit 13, 14 Stoffwechsellage oder praktisch jede andere Eigenschaft, die man sich vorstellen kann.
Protokoll
1. Sammeln und Vorbereiten Flies
- Rück D. melanogaster unter den gewünschten experimentellen Bedingungen. Darauf achten, dass die Fliegen während der Aufzucht überladen und stellen Sie sicher, dass Larvendichten sind konsistent über Behandlungen, da Umgebungsbedingungen während des Larvenstadiums kann tief im erwachsenen Stadium Einfluss auf die Immunabwehr Phänotypen. 15
- Sammeln experimentellen Fliegen 0-3 Tage nach dem Schlüpfen aus der Puppenhülle und übertragen diese auf frisches Medium.
- Haus die gesammelten Fliegen auf einer gewünschten Temperatur (Temperaturen zwischen 22 ° C und 28 ° C sind in der Regel nicht geeignet), bis sie alt sind 5-7 Tage nach dem Schlüpfen.
HINWEIS: Dies ermöglicht genügend Zeit für die Fliegen zu Metamorphose zu vollenden und zu reifen Erwachsenen, sondern auch vor dem Altern beginnt. - Die gewünschte Anzahl von Fliegen zu sortieren in einen separaten Fläschchen vor der Infektion, wieder darauf achten, dass Überfüllung zu vermeiden.
HINWEIS: Nur males sind in dieser Demonstration infiziert ist aber ebenso möglich, Weibchen mit dem beschriebenen Verfahren zu infizieren.
2. Bereiten Sie Kultur und Bakterien
- Bereiten Sie eine Masterplatte der ausgewählten Bakterien mindestens 2 Tage vor der Infektion. Streak die Bakterien von einem 15% Glycerin Bestand auf unbegrenzte Zeit bei -80 ° C gelagert. Bewahren Sie die Master-Platte bei 4 ° C für bis zu 2 Wochen. Immer streak die Masterplatten direkt aus dem gefrorenen Glycerin Lager. Vermeiden serielle Passage von Bakterien von Platte zu Platte, als wiederholte Passage in Kultur kann dazu führen, Bakterien abgeschwächte Virulenz entwickeln.
Hinweis: Dieses Beispiel macht von Providencia rettgeri und Escherichia coli. - Gehen Sie folgendermaßen vor, um eine Bakteriensuspension zur Injektion vorzubereiten.
- Wachsen einem 2 ml Bakterienkultur durch Impfen steriles Medium mit einer Einzelkolonie von der Master-Platte isoliert. Wachsen die Bakterien bis zur stationären Phase (zB O / N Wachstum bei 37 ° C).
HINWEIS: Sowohl P. rettgeri und E. coli wachsen gut in Luria Broth bei Temperaturen von 20 bis 37 ° C unter leichtem Schütteln. - Sobald die Kultur die stationäre Phase erreicht, pelletieren sanft Zellen von ca. 600 & mgr; l der Kultur in einer Tischzentrifuge (3 min bei 5000 × g), der Überstand verworfen, und die Bakterien zu resuspendieren in ca. 1.000 & mgr; l steriler Phosphat-gepufferter Salzlösung (PBS; 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 PO 4, 1,8 mM KH 2 PO 4, pH = 7,4).
- Verdünne die resuspendierten Zellen in sterilem PBS auf eine optische Dichte (OD) für das Bakterium falls verwendet wird, mit einem Spektrophotometer als die Absorption bei 600 nm gemessen, zu erreichen. Mit dieser Suspension, um die Fliegen zu infizieren.
HINWEIS: A 600 = 0,1 oder 1,0 entspricht jeweils etwa 10 8 und 10 9 Providencia rettgeri oder E. coli pro ml. Da beide leben einnd toten Bakterien beitragen, optische Dichte, ist es wichtig, in den frühen Kulturen der stationären Phase geerntet, bevor Bakterienleichen ansammeln und zu verzerren, das die Beziehung zwischen der optischen Dichte und der Anzahl der lebensfähigen Bakterien während der Infektion eingebracht.
- Wachsen einem 2 ml Bakterienkultur durch Impfen steriles Medium mit einer Einzelkolonie von der Master-Platte isoliert. Wachsen die Bakterien bis zur stationären Phase (zB O / N Wachstum bei 37 ° C).
3. infizieren den Flies
HINWEIS: Wie Drosophila Immunität durch zirkadianen Rhythmus beeinflußt, ist es wichtig, um Infektionen bei einer ähnlichen Tageszeit in Experimentwiederholungen durchführen 16.
3.1) mit Nanoinjector
- Bereiten Sie die Glasnadeln für eine Infektion.
- Bereiten Sie eine Glasnadel durch Ziehen eines Borosilikatglas Kapillare mit einer Mikropipette Abzieher.
- Mit einer Pinzette, brechen Sie die Spitze der Nadel, um eine Öffnung von ca. 50 & mgr; m Durchmesser zu schaffen, um den Ausstoß von Flüssigkeit zu ermöglichen.
- Montieren Sie den Injektor.
- Setzen Sie den O-Ring-Abdichtung und dann die weiße spacer (große Grübchen nach außen) auf die Metall Kolben.
- Füllen Sie das Glas Nadel mit Mineralöl mit einer Spritze mit einer 30-G-Nadel.
- Den gefüllten Glas Nadel durch die Spannzange und platzieren Sie den größeren O-Ring um seine Basis, etwa 1 mm von dem stumpfen Ende der Nadel dann.
- Schieben Sie die Nadel auf die Metallkolben und vorsichtig aufschrauben, bis der Spannzange sicher.
- Auswerfen meisten des Mineralöls aus dem Injektor, aber sicherzustellen, dass noch eine geringe Menge an Öl in der Nadel, um als Barriere zwischen dem Injektor und der Bakteriensuspension einwirken. Stellen Sie sicher, dass sich keine Luftblasen im Mineralöl oder Bakteriensuspension, oder zwischen den beiden Flüssigkeiten.
- Stellen Sie den Injektor auf das gewünschte Volumen für die Injektion (zwischen 9 und 50 nl nl).
- Generieren Verwundung Kontrollen.
- Füllen der Düsennadel mit sterilem PBS durch vorsichtiges Einführen der Spitze der Kapillarnadel in einer Röhre der Medien und pressing auf die Schaltfläche "füllen" auf dem Injektor.
HINWEIS: Sterile bakterielle Wachstumsmedien können auch eine verletzte Kontrolle verwendet werden, wenn das Experiment erfordert Injektion von Bakterien in ihrem Wachstumsmedium suspendiert. Da bakterielle Wachstumsmedien enthält Komponenten, die das Immunsystem stimulieren oder andere Effekte auf die Wirts kann, ist jedoch eine inerten Träger wie PBS bevorzugt. - Anaesthetize die gewünschte Anzahl der Fliegen unter einem Lichtstrom von CO 2.
- Injizieren Sie die Fliegen in der vorderen Unterleib auf der ventrolateralen Oberfläche mit sterilem PBS.
Hinweis: Es ist auch möglich, Fliegen an anderen Stellen, wie beispielsweise die sternopleural Platte des Thorax zu injizieren, aber es ist wichtig, um die Injektionsstelle konsistent in jedem Experiment halten 17. - Zeigen injizierten Fliegen in frische Röhrchen mit neuen Medium, über die Fläschchen auf ihrer Seite, bis alle Fliegen aus der Narkose erholt haben, um die Fliegen aus immer auf das Essen stecken zu verhindern.
Hinweis: Es wird empfohlen, die PBS Kontrollfliegen vor der Injektion Bakterien experimentellen Fliegen so die gleiche Nadel kann für beide Behandlungen verwendet werden, zu injizieren. Es wird nicht immer möglich sein, die gleiche Nadel für eine ganze Experiment zu verwenden. In diesem Fall kann es wünschenswert sein, aufzuzeichnen, welche Nadel verwendet wurde, mit dem Fliegen und Nadel Identität als experimentelle Faktor in der statistischen Analyse einzuschließen.
- Füllen der Düsennadel mit sterilem PBS durch vorsichtiges Einführen der Spitze der Kapillarnadel in einer Röhre der Medien und pressing auf die Schaltfläche "füllen" auf dem Injektor.
- Spritzen Sie die bakteriellen Erreger.
- Werfen Sie die restlichen sterilen Medien aus dem Injektor und füllen Sie die gleiche Nadel mit der Bakteriensuspension.
- Das obige Verfahren (3.1.3), jetzt die Injektion die Fliegen mit der Bakteriensuspension in Verfahren 2.2 vorbereitet.
3.2) mit septischem Pinprick
- Bereiten Sie die Nadel zum Einstechen.
- Schmelzen Sie das Ende einer 200 ul Mikropipettenspitze und legen Sie eine 0,15 mm Insekten minutien Stift in die Kunststoffschmelze. Lassen Sie den Kunststoff zu verfestigen, such, dass der Stift an Ort und Stelle mit ungefähr 0,5 cm von Stift, der sich aus dem Kunststoff gehalten werden.
- Generieren Verwundung Kontrollen.
- Anaesthetize die gewünschte Anzahl der Fliegen unter einem Lichtstrom von CO 2.
- Stechen Sie die Fliegen in der sternopleural Platte des Thorax mit der Nadel, die Vermeidung der Befestigungsstellen der Flügel und Beine. Falls erforderlich, entfernen Sie vorsichtig entfernt vom minutien Stift mit weichem Pinzette.
. HINWEIS: Es ist auch möglich, um die Fliegen an anderen Stellen, beispielsweise der vorderen Unterleib auf dem ventrolateralen Oberfläche zu stechen, aber es ist wichtig, die Injektionsstelle konsistent innerhalb jedes Experiments halten 17 Stechen durch die Kutikula des Bauches offenbar stärker schwieriger als Stechen des Thorax und ist daher weniger häufig. - Legen Sie die gestochen Fliegen in eine frische Flasche mit neuen fly Medium, über das Fläschchen auf seiner Seite, bis alle Fliegen aus der Narkose erholt haben, um die Fliegen aus zu verhindernkommen, um die Lebensmittel stecken.
- Einführung der bakteriellen Infektion.
- Anaesthetize die gewünschte Anzahl der Fliegen unter einem Lichtstrom von CO 2.
- Stechen Sie jedes Haar in der gleichen Position wie die Mediensteuerung, Eintauchen der Spitze des Stifts in die Bakteriensuspension in Verfahren 2.2 vor stechen jede Fliege vorbereitet.
- Legen Sie die gestochen Fliegen in eine frische Flasche mit neuen fly Medium, über das Fläschchen auf seiner Seite, bis alle Fliegen sind aus der Narkose erholt, um die Fliegen aus immer auf das Essen stecken zu verhindern.
3.3) Bewertung der Infektionsdosis Lieferung
- Infizieren eine Reihe von Fliegen, wie oben in beiden Verfahren 3.1 oder 3.2 nur anstatt die Fliegen auf Nahrung Fläschchen aus der Narkose erholen beschrieben, legen Sie jeweils Fliegen in einem Mikrozentrifugenröhrchen auf Eis.
- Fügen Sie 250 ul PBS in jedes Röhrchen und homogenisieren die Fliegen entweder unter Verwendung von Stößel oder einen Wulst beater.
- Platte des Homogenats auf einer LB-Agarplatte, entweder unter Verwendung eines Spiralplattierers oder eine serielle Verdünnung.
- An der Platte mit Verdünnungsreihe, übertragen jede Fliege Homogenat zu der ersten Reihe einer 96-Well-Platte.
- Füllen jeder Vertiefung der restlichen Zeilen mit 90 ul PBS.
- Mit einer Mehrkanal Pipette 10 ul von der ersten Zeile mit Fliegen Homogenat und verzichten in der zweiten Reihe.
- Pipette nach oben und unten mindestens 10-mal, um gründlich zu mischen, und dann 10 & mgr; l und Transfer in der dritten Reihe. Wiederholen Sie diesen Vorgang mit den restlichen Zeilen.
- Ausgehend von der unteren Reihe (die meisten verdünnten Bakteriensuspension), verwenden Sie die Mehrkanalpipette bis 10 & mgr; l aus jeder Vertiefung und sich auf eine LB-Platte nehmen, darauf achten, dass die Proben als diskrete Flecken, die sich nicht gegenseitig berühren verzichtet. Wiederholen, bis alle Vertiefungen haben aus jeder Zeile abgetastet worden, Abgabe in absteigender Reihenfolge der Verdünnung auf der LB-Platte.
- Lassen Sie die Platte bei Raumtemperatur, bis die Flecken vollständig in die LB-Platte eingeweicht.
ANMERKUNG: Das Trocknen der LB-Platte für ein paar Tage bei RT vor der Verwendung wird empfohlen, um sicherzustellen, dass die Flüssigkeit leicht absorbiert wird, die Wahrscheinlichkeit einer Berührung zwischen Probenflecken minimiert wird.
- Inkubieren Sie die Platten O / N, kümmert sich nicht um die Platten so überwuchern Kolonien klein und diskret bleiben.
HINWEIS: Je nach der bakteriellen Wachstumsmedium und Bruttemperatur verwendet wird, können Kolonien von endogenen Darmflora der Fliege abgeleitet schließlich auf der Platte erscheinen. Allerdings sind die meisten Bakterien, die für pathogene Infektion viel schneller wachsen als die Darmflora auf LB-Agar bei 37 ° C. - Platten entfernen aus dem Inkubator, wenn die experimentellen Bakterien sichtbare Kolonien gewachsen (in der Regel 8 bis 12 h), aber vor Drosophila Darmflora Kolonien erscheinen (etwa 36 h). Für langsam wachsende experimentelle Bakterien, verwenden Sie eine selektiveAntibiotikum, das in der LB-Agar, alle Kolonien von der Darmflora zu entfernen.
- Die Anzahl der Kolonien pro Homogenat.
- Für Spiralplatten, zählen die Kolonien, die mit Hilfe eines automatisierten Kolonie-Zähler, der die bakterielle Belastung pro ml Homogenat der Grundlage der Anzahl und Position der Kolonien auf der Platte zu schätzen wachsen kann.
HINWEIS: Spiral Zählungen genaueste wenn die Konzentration der Bakterien im Bereich von 5 x von 02 bis 05 Oktober x 10 4 Bakterien pro ml. - Für Tüpfelplatten, manuell die Kolonien für jede Fliege aus welcher Verdünnung enthält 30 zählen - 300 Kolonien und berechnen Sie die Anzahl der Bakterien pro ml original Homogenat.
- Für Spiralplatten, zählen die Kolonien, die mit Hilfe eines automatisierten Kolonie-Zähler, der die bakterielle Belastung pro ml Homogenat der Grundlage der Anzahl und Position der Kolonien auf der Platte zu schätzen wachsen kann.
4. Charakterisieren Hinterbliebeneninfektions
- Assay Sterblichkeit nach der Injektion.
- Linie infiziert Fliegen und verwundet Steuerelemente in frische Fläschchen und Aufrechterhaltung in einem Inkubator bei einer gewünschten Temperatur (25 ° C bei einem 12:12 light: Dunkel-Zyklus wird empfohlen). Legen Sie nicht mehr als 15 Fliegen in einer einzigen Ampulle so wird es schwierig, mehr als 15 Wohn Fliegen zählen.
- Zählen Sie die Anzahl der lebenden und toten Fliegen täglich oder öfter, wenn angemessen.
- Um die Lebensmittelqualität zu gewährleisten, schlagen die Fliegen auf neue Lebensmittel auf einem regelmäßigen Zeitplan.
- Wenn das Fläschchen enthält nur Männer, übertragen sie an die frische Fläschchen alle drei Tage. Wenn das Fläschchen enthält Weibchen, übertragen an die frische Fläschchen alle zwei Tage, weil Larven Nachkommen die Nahrung zu verflüssigen, wodurch das Risiko, dass adulte Fliegen kann stecken bleiben und was zu überschätzen Sterberate aufgrund von Infektionen.
- Statistische Auswertung der Daten.
- Plot Überleben als Kaplan-Meier-Kurve, die die Wahrscheinlichkeit, dass ein Individuum zu einem Messzeitpunkt nach der Injektion mit einem Log-Rank T überleben. 18 Für Überlebenskurven, die nicht kreuzen, führen paarweise Vergleiche anzeigt,est (auch als Mantel Cox Test) durchzuführen oder komplexere Analysen mit Hilfe eines Cox-Modell, das von mehreren Faktoren und ihre Wechselwirkungen übernehmen können. Überlebenskurven, die zu überqueren, führen Sie eine geschichtete Cox-Analyse. 17
5. Assay bakterielle Belastung nach der Infektion
- Messen Sie bakterielle Belastung.
- Zu einer vorgeschriebenen Zeit nach der Injektion wiederholt, das zur Bewertung infektiöse Dosis, um bakterielle Belastung über den Verlauf der Infektion zu bestimmen durch (siehe Protokoll 3.3).
HINWEIS: Bei Verwendung der Spirale plater verdünnen Homogenate, so dass die Bakteriensuspension in einem Bereich von 1000 fällt - 100.000 Bakterien pro ml.
- Zu einer vorgeschriebenen Zeit nach der Injektion wiederholt, das zur Bewertung infektiöse Dosis, um bakterielle Belastung über den Verlauf der Infektion zu bestimmen durch (siehe Protokoll 3.3).
- Analysieren Sie die Daten.
- Wenn bakterielle Belastung ist nicht normal, entweder Transformation der Daten, um eine bessere Annäherung an eine Normalverteilung oder die Daten unter Verwendung von nicht-parametrischen statistischen Analyse (zB Mann-Whitney U-Test) zu analysieren. Verwenden Sie eine Box-Cox-Analyse, um find die optimale Transformation; natürlichen Logarithmus oder Base -10 log Transformationen sind oft wirksam. 19
- Wenn die Daten ausreichend normal verteilt und es gibt nur zwei Behandlungen ist gegenüber, führen eine t -test, um zu bestimmen, ob die beiden Behandlungen ergeben unterschiedliche mittlere Bakterienbelastungen. Wenn es mehrere experimentelle Variablen oder andere potentiell prädiktive Faktoren, benutzen Varianzanalyse (ANOVA), um festzustellen, welche Faktoren signifikante Prädiktoren für bakterielle Belastung sind. 19
6. Assay Transkriptionsaktivierung des Immunsystems Genes
- Zur Aktivierung des Immunsystems nach Infektion grob zu visualisieren, zu infizieren transgene Fliegen, die grün fluoreszierendes Protein (GFP) unter der Kontrolle eines Promotors von einem antimikrobiellen Peptid exprimieren, wie vorstehend beschrieben. 18
- Sehen Sie sich die infizierten Fliegen unter dem Fluoreszenzmikroskop-fähig; GFP Induktion sollte sich visible im Fettkörper innerhalb der ersten 6 bis 10 Stunden nach der Infektion.
- Für eine genauere Quantifizierung der Immunaktivierung, benutzen quantitative PCR auf cDNA-Matrize (qRT-PCR), um die Fülle der antimikrobiellen Peptids Gentranskripten messen.
HINWEIS: Die Expression von Immungenen kann zu jeder Zeit nach (oder vor) der Infektion gemessen werden. Generell Induktion von Immun Genexpression beginnt etwa 4 Stunden nach der Injektion und steigt in den nächsten 24 Stunden.- Betäuben entfernt unter Verwendung von CO 2.
- Platzieren Sie 15 Fliegen in ein Mikrozentrifugenröhrchen für jede RNA-Extraktion.
HINWEIS: Es wird empfohlen, mindestens drei Parallelproben für jede Behandlung erhalten zu sammeln. - Extrahieren von RNA aus den Fliegen und erzeugen Erststrang-cDNA unter Verwendung einer Anzahl von Standardverfahren oder kommerzielle Kits. Speicher RNA bei -80 ° C. Speicher cDNA bei -20 ° C für einen Zeitraum von ein paar Wochen und bei -80 ° C zur Langzeitlagerung. Vor der RNA-Extraktion, speichern fliegt bei -80 ° C.
- Führen quantitative PCR (qPCR) auf Zielgene von Interesse unter Verwendung der cDNA als Matrize. Siehe Tabelle 1 für die Primer-Sequenzen, um die antibakterielle Peptid-Gene Diptericin A, Drosomycin, Defensin, Attacin A und Metchnikowin sowie die Zimmerreinigung Kontrollgens rp49 (auch als rpL32 bekannt) zu verstärken.
HINWEIS: Die Gene, die die antimikrobielle Peptide Diptericin A und Drosomycin codieren, sehr gute Positionsanzeigen von D. melanogaster Immunaktivität vor allem durch die IMD und Toll Wege induziert sind. Um von Probe zu Probe Variation der RNA-Ausbeute und die Effizienz der reversen Transkription zu steuern, zu standardisieren, die aufgezeichnet Expression von Zielgenen gegen eine Referenz Housekeeping-Gen, dessen Expression nicht zu erwarten, mit einer Infektion verändern, wie rp49 (auch als RPL bekannt 32). - Analysieren Sie die Daten.
- Für grobe Approximation Expressionsunterschiede wird das Verhältnis des von dem Testgens erhaltenen Ausgangsgröße (SQ) Wert (zB Diptericin A) relativ zu dem von der Referenz Gen erhalten SQ Wert (zB rp49) für jede Probe (berechnet als SQ - DPTA / SQ - rp49). Skalieren Sie diese Verhältnisse zu einer Baseline Steuerbehandlung, wie einem nicht infizierten Kontroll Handhabung. Willkürlich die Steuerexpressionsniveau gleich 1,0 eingestellt und zu visualisieren experimentelle Behandlungen als relative fache Veränderungen. Schätzen Sie die SQ-Wert für jedes Gen gegen eine Standardkurve aus einer Verdünnungsreihe von bekannten cDNA-Menge erzeugt.
HINWEIS: Die statistische Analyse der Verhältnisse kann kompliziert sein, so ist dieser Ansatz besser für die schnelle Annäherung als für strenge Analyse. Wenn PCR Effizienz gering, entwerfen neue Primer, um, wenn möglich, PCR-Kinetik verbessern. Für qPCR Reaktionen mit nahezu perfekte Effizienz (adoubling des PCR-Produkts in jedem Zyklus) kann die Schwellenzyklus (C T) für die SQ-Wert ersetzt werden. - Für einfache Experimente mit optimal effiziente Amplifikation können Daten unter Verwendung des ΔΔC T-Verfahren analysiert werden. 19 Für jede Probe subtrahieren die C T -Wert des Referenzgens (zB rp49) aus dem C T des Testgens (z. B. Diptericin A), um eine & Delta; C T zu erhalten. Dann ziehen Sie die & Delta; C T der Grundlinie Steuer vom & Dgr; C T für jede Versuchsprobe, eine ΔΔC T-Wert für jede Probe zu erhalten; Diese ΔΔC T anzeigt relativen Unterschiede der Genexpression zwischen den Behandlungen, wobei 2 (-ΔΔCT) approximiert die fache Veränderung der Expression.
ANMERKUNG: Diese Analyse kann schlecht misestimate-fache Veränderung der Expression des Zielgens, wenn die PCR entweder des Test-Gens oder des ReferenzGen hat geringe Effizienz. - Für den strengsten Analysen kann Varianzanalyse (ANOVA) unter Verwendung der geschätzten Expression des Testgens (zB Diptericin A) als Reaktionsvariable und der geschätzten Expression des Kontrollgens (zB rp49) und andere experimentelle Faktoren als erklärende Variablen.
HINWEIS: Diese Vorgehensweise ist relativ robust zu Ineffizienz in der PCR-Amplifikation und ermöglicht Analyse komplizierter experimentellen Designs.
- Für grobe Approximation Expressionsunterschiede wird das Verhältnis des von dem Testgens erhaltenen Ausgangsgröße (SQ) Wert (zB Diptericin A) relativ zu dem von der Referenz Gen erhalten SQ Wert (zB rp49) für jede Probe (berechnet als SQ - DPTA / SQ - rp49). Skalieren Sie diese Verhältnisse zu einer Baseline Steuerbehandlung, wie einem nicht infizierten Kontroll Handhabung. Willkürlich die Steuerexpressionsniveau gleich 1,0 eingestellt und zu visualisieren experimentelle Behandlungen als relative fache Veränderungen. Schätzen Sie die SQ-Wert für jedes Gen gegen eine Standardkurve aus einer Verdünnungsreihe von bekannten cDNA-Menge erzeugt.
Ergebnisse
Dieser Teil zeigt Ergebnisse, die nach der bakteriellen Infektion von Drosophila melanogaster, erhalten werden kann. Figur 1 zeigt, dass die Infektionsdosis variiert mit der optischen Dichte der bakteriellen Suspension zur Injektion verwendet werden, und dass das gelieferte zuverlässig durch Homogenisieren und Plattieren abschätzen Dosis fliegt unmittelbar nach der Injektion . Wie in Figur 2 dargestellt ist, kann verschiedene Erreger verschiedenen Ebenen der Host Mortalität (2A) und Host-Sterblichkeit führen kann dosisabhängig (2B) ist. Wichtig ist, ermöglicht dieses Protokoll für verschiedene Typen von Infektionen erreicht werden: Providencia rettgeri kann eine chronische subletaler Infektion, für 20 Tage oder länger (3A) besteht verursachen. Aber auch andere Bakterien wie Escerichia coli wird meist durch den Host-fly innerhalb von sechs Stunden nach der Infektion (3B) gelöscht werden. Induktion der Immun system kann durch RNA-Isolierung und anschließende qRT-PCR von antibakteriellen Peptid-Transkripte (4A und B) geschätzt werden. Analog, jedoch weniger quantitativ, Fliegen, die GFP unter der Kontrolle des antimikrobiellen Peptids Genpromotoren verwendet werden, um die Induktion des Immunsystems (4C) zu visualisieren.
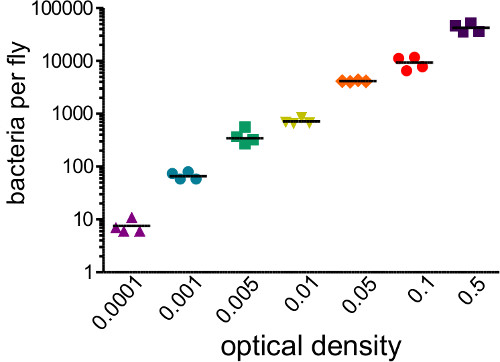
. Abbildung 1: Bestimmung Infektionsdosis Fliegen wurden mit 50 nl von Bakteriensuspensionen, die einen Bereich von optischen Dichten (0,0001 bis 0,05) injiziert. Die Fliegen wurden sofort homogenisiert und ausplattiert, um die Zahl der Bakterien durch die Injektion eingeführt zu bestimmen. Initial bakterielle Belastung korreliert stark mit Anfangs-OD injiziert (r 2 = 0,96)
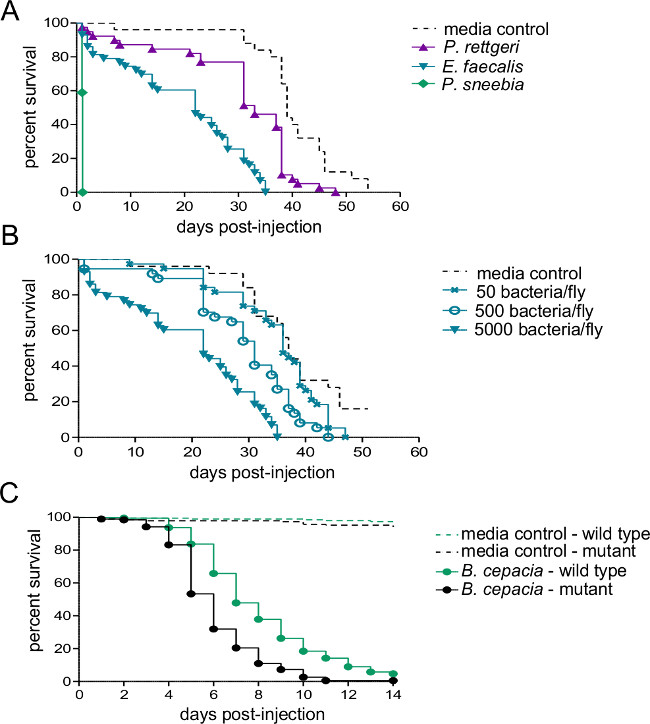
Abbildung 2:. Überleben nach der Injektion mit bakterieller Pathogene Fünf bis sieben Tage alte Männer wurden mit 50 nl entweder bakteriellen Suspension oder sterile Medien eingespritzt und für das Überleben überwacht. (A) Wildtyp-Fliegen wurden mit etwa 5.000 Bakterien aus einer von drei verschiedenen Spezies injiziert. Die Rate des Host Mortalität hängt stark von den für die Infektion verwendeten Bakterienspezies. 50, 500 und 5.000 Bakterien pro fly - (B) Wildtyp-Fliegen wurden mit drei verschiedenen Dosen von Enterococcous faecalis injiziert. Fliegen sterben schneller, wenn mit höheren infektiösen Dosen (C) infiziert Ein Immunsystem Mutanten und ihre Wildtyp-isogenen Steuerleitung wurden mit etwa 500 Burkholderia cepacia injiziert. Eine paarweise Log-Rank-Vergleich zeigt, dass die Wildtyp-fly die Infektion deutlich besser als der Mutante (χ 2 = 59.02, df = 1, p <0,0001) überlebt.
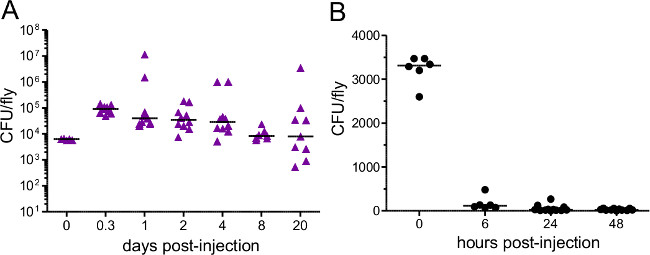
Abb. 3: bakterielle Belastung nach der Injektion Fliegen wurden mit etwa (A) 5000 P. injiziert rettgeri (B) 3400 E. coli. Bakterielle Belastung wurde unmittelbar nach der Injektion und bei verschiedenen nachfolgenden Zeitpunkte bestimmt. Jeder Datenpunkt stellt die bakterielle Belastung einer einzigen Fliege. E. coli schnell von Hosts in Frage gestellt, während P. gelöscht rettgeri bleibt für den Rest des Hosts Leben ,.
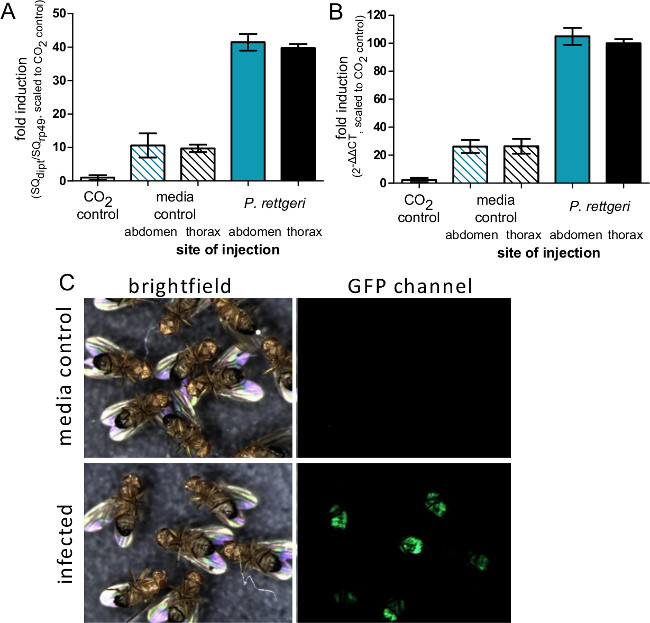
Abbildung 4: Induktion von Immun Gene Expression nach der Injektion. (A) Die Fliegen wurden mit 50 nl injiziert P. rettgeri oder sterilem PBS entweder in den Bauch oder Brustkorb, oder wurden aus CO links unmanipulated beiseite 2 Anästhesie. Sechs Stunden nach der Infektion wurden die Fliegen für die RNA-Isolierung und Expression des Diptericin Ein Gen wurde mit qRT-PCR bestimmt gesammelt. (A) Expressionsniveaus werden als das Verhältnis der Diptericin graphisch dargestellt, um ein Transkript rp49 Transkript und skaliert, dass die CO 2 Steuerung als eine Expressionsniveau 1. Die Balken stellen den Mittelwert und Standardfehler von Verhältnissen von jeder Bedingung definiert (n = 4). (B) Die Expressionsniveaus werden als 2 ΔΔCT mit der durchschnittlichen C T-Wert von CO 2 aesthesia Kontrollfliegen als Standard nicht-induzierten Zustand gebraucht grafisch dargestellt. Die Balken stellen den Mittelwert und Standardfehler der ΔΔC T von jedem Zustand (n = 4). Zwar gibt es keinen Unterschied in der Niederschrift Induktion aufgrund der Injektionsstelle, Vergleich der Platten A und B zeigt, wie die ΔΔC T Methode kann potenziell zu überschätzen Induktionsniveaus. (C) Fliegt, die GFP unter der Kontrolle des Promotors Diptericin A wurden mit 50 nl injiziert P. rettgeri (OD = 0,1) und dann abgebildet wird 7 Tage später. Die GFP-Panel zeigt die Expression von GFP in der Bauchfettkörper der infizierten Fliegen, was die Aktivierung des Diptericin Ein Promotor in bakteriell infizierten Fliegen, aber nicht medien injizierten Kontrollen.
| Gen | Vorwärts | Rückwärts |
| rp49 (auch genannt rpL32) | 5'AGGCCCAAGATCGTGAAGAA 3' | 5'GACGCACTCTGTTGTCGATACC 3' |
| Diptericin A | 5'GCGGCGATGGTTTTGG 3' | 5'CGCTGGTCCACACCTTCTG 3' |
| Drosomycin | 5 'CTGCCTGTCCGGAAGATACAA 3 ' | 5'TCCCTCCTCCTTGCACACA 3' |
| Defensin | 5'GAGGATCATGTCCTGGTGCAT 3' | 5'TCGCTTCTGGCGGCTATG 3' |
| Attacin A | 5'CGTTTGGATCTGACCAAGG 3' | 5'AAAGTTCCGCCAGGTGTGAC 3' |
| Metchnikowan | 5'AACTTAATCTTGGAGCGATTTTTCTG 3' | 5'ACGGCCTCGTATCGAAAATG 3' |
Tabelle 1: Primer für qRT-PCR.
Diskussion
Das hier beschriebene Verfahren ergibt strenge und hohe Qualität Infektion von Drosophila melanogaster. Die dargestellten Beispiele in erster Linie auf eine Infektion mit Providencia rettgeri und E. konzentriert coli, aber das Protokoll ist sehr anpassungsfähig und kann zu Infektionen mit verschiedenen Bakterien über einen Bereich von Wirts Aufzucht und Wartungsbedingungen angewendet werden.
Die Einzelheiten einer optimalen Versuchsansatz wird auf dem Bakterium zur Infektion verwendet, dem Genotyp des Wirts, und der allgemeinen experimentellen Bedingungen abhängen. Es wird dringend Pilotversuch keine neuen Versuchsbedingungen vor Einleitung ehrgeiziger Projekte empfohlen. Ein guter Ausgangspunkt ist es, drei Infektion Dosen über einen 100-fachen Bereich zu testen. Hoch virulenten Erreger sind oft am besten bei sehr niedrigen infektiösen Dosen eingebracht, in der Größenordnung von 10 bis 100 Bakterienzellen pro fly. Moderater Erreger können bei höheren Dosen von etwa 1.000 Bakterien pro fl injiziert werdeny, und nicht-Pathogene in Dosen bis zu 10.000 Bakterien pro Fliege injiziert werden. Es ist oft hilfreich, die besonderen Kinetik neuartiger Infektionen durch Verfolgen Keimmenge sorgt Mortalität und Aktivität des Immunsystems über einen Längenzeitreihe zu definieren. Weil Messung Keimmenge und Wirts Genexpression sind destruktiv Assays ist es notwendig, verschiedene entfernt zu Beginn des Experiments für jeden Zeitpunkt, der zu messen ist, zu infizieren.
Bei der Entscheidung über Nadelstich oder Mikrokapillare-basierte Einspritz verwenden, ist es wichtig zu beachten, gibt es Vorteile und Grenzen zu jedem Ansatz. Kapillarinjektion führt ein Flüssigkeitsvolumen in die Fliege, die beide geringfügig erhöht Turgor und führt Salze oder andere Moleküle, die suspendiert sind, oder in dem Träger gelöst. Kapillarinjektion erfordert auch den Zugang zu einer Einspritzeinrichtung oder Kauf der erforderlichen Ausrüstung. Septic Nadelstich erfordert keine spezielle Ausrüstung und stelltvernachlässigbar Medien in die Fliege und ist typischerweise effizienter zu infizieren eine große Anzahl von Fliegen. Allerdings haben pinprick Infektionen erlauben die genaue Kontrolle über die Infektionsdosis, die mit Kapillarinjektion erreicht werden kann. Das vorliegende Protokoll das sich auf einer Einspritzvorrichtung, die mechanisch reguliert Injektionsvolumen, es gibt aber auch Einspritzsysteme Basis diskreter Impulse von Druckluft. 20,21 Dies sind in der Regel teurer ist als die Vorrichtung, die hier gekennzeichnet und erfordern eine Kalibrierung des Luftimpulses zu jedem Nadel, um eine konsistente Injektionsvolumina zu gewährleisten.
Es gibt beträchtliche Debatte aber nur sehr wenig Daten darüber, wie Fliegen werden systemisch infizierten mit Bakterien in der Wildnis. Einige Forscher postulieren, daß die Mehrzahl der natürlichen Infektionen auftritt, wenn Drosophila einnehmen pathogene Bakterien und die Bakterien werden anschließend in der Lage, den Darm zu entkommen, um eine systemische Infektion zu etablieren. Es gibt jedoch sehr few Bakterien bekannt, dass in der Lage, den Darm von D. überqueren melanogaster, und diejenigen, die diese Fähigkeit zu tun sind sehr tödlich Fliegen 22,23. Eine alternative Theorie ist, dass regelmäßig fliegt aufrecht kutikulären Verletzungen durch Flucht aus dem gescheiterten Raubversuchen oder Angriffen durch ektoparasitären Milben. Diese Hypothese wird durch die häufige Sammlung von Wild D. unterstützt melanogaster Lager Melanisierung sichtbare Flecken weisen auf geheilten Wunden (unveröffentlichte Beobachtungen) sind. Milben wurde gezeigt, dass bakterielle Infektionen in Drosophila 24 übertragen und Wunden durch Milben links sekundär durch Bakterien bei der Honigbiene 25 infiziert werden. Die Häufigkeit in der Natur von milben angetrieben oder anderweitig opportunistische Infektion von D. melanogaster durch Kutikula Verletzungen ist nicht bekannt. Das hier beschriebene Protokoll ermöglicht Einführung der Bakterien direkt in die Hämolymphe durch quantitative Injektion, die keine Epithelbarrieren oder Verhaltens immu umgehtschaft. Verfahren zum Zuführen von pathogenen Bakterien zu D. melanogaster in Vodovar et al. 22 und Nehme et al. 23 beschrieben worden.
Viele entomopathogenen Bakterien darstellen wenig oder gar keine Gefährdung der menschlichen Gesundheit, so dass die Forscher mit ihnen bequem arbeiten. Außerdem haben nur sehr wenige Bakterien die Fähigkeit, auf Drosophila Kontakt ohne experimentelle Intervention zu infizieren, so das Risiko einer "Epidemie" Ausbreitung der bakteriellen Infektion durch eine Labor über kontaminierte Flächen oder entkam Fliegen ist in der Regel sehr gering. Dennoch ist es ratsam, um sicherzustellen, dass angemessene Eindämmungsmaßnahmen vorhanden sind, um infizierte Fliegen Flucht zu verhindern und für die Rückeroberung jede entgangen Fliegen. Das Labor sollte in einem biologischen Sicherheitsniveau im Einklang mit, dass der Erreger verwendet ausgestattet werden, und Standard-Best Practices in der Mikrobiologie sollte eingesetzt werden.
Die experimentelle infectihier beschriebene Verfahren ermöglicht Infektionen von Drosophila melanogaster mit jeder Dosis von jedem beliebigen Bakterium. Tretener Infektion festgestellt wurde, ist es einfach, die Kinetik der bakterielle Proliferation oder Luft mißt, die Wirts-Sterblichkeit zu verfolgen und die Induktion von dem Immunsystem des Wirts zu testen. Infizierten Fliegen können leicht auf andere phänotypischen Assays, einschließlich Tests der physiologischen Funktionen, die Form oder durch die Infektion förmigen, zu unterziehen. Die beschriebenen Verfahren sind kostengünstig, erfordern relativ wenig spezialisierte Ausrüstung, und sind leicht zu erlernen, so dass sie zugänglich für die Verwendung in verschiedenen Projekten in einer Breite von Forschung und Lehre Labors.
Offenlegungen
None of the authors have competing interests or conflicting interests.
Danksagungen
We would like to thank the entire Lazzaro lab, and especially Susan Rottschaefer, for their help in both reviewing and testing these protocols. This is a product of their cumulative expertise. Work in the Lazzaro lab is supported by grants R01 AI083932 and R01 AI064950 from the US National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Incubator | Powers Scientific, Inc | DROS52SD | |
| Paintbrush | |||
| CO2 Flypads | FlyStuff | 59-114 | |
| CO2 | Airgas | CD FG50 | |
| Drosophila rearing mix | |||
| 6 oz Square Bottom Bottles, polypropylene | Genesee Scientific | 32-130 | |
| Nosterile Extra Large Cotton Balls | Fisher brand | 22-456-882 | |
| Microscope | Olympus Corporation | SZ51 | |
| Drosophila Vials polystyrene | VWR international | 89092-720 | |
| Nosterile Large Cotton Balls | Fisher brand | 22-456-883 | |
| 2 L flask | VWR international | 89000-370 | |
| Petri Dishes with Clear Lids, Raised Ridge; 100 x 15 mm; | VWR international | 25384-302 | |
| LB Agar, Miller | Difco | 244520 | |
| Innoculing Loop | VWR international | 80094-488 | |
| Rainin Clasic Pipettes in various sizes 0.1 µl to 2 µl, 2 µl to 20 µl, 20 µl to 200 µl, 100 µl to 1,000 µl | Rainin | PR-2 PR-20 PR-200 PR-1000 | |
| Micropipette tips (assorted sizes) | VWR international | 30128-376 53503-810 16466-008 | |
| Luria Broth Base, Miller | Difco | 241420 | |
| Disposable Culture Tubes Borosilicate Glass | VWR international | 47729-576 | |
| S-500 Orbital Shaker | VWR international | 14005-830 | |
| Centrifuge | VWR international | 37001-300 | |
| PBS pH 7.4 10X | Invitrogen | 70011044 | |
| SmartSpec 3000 Spectrophotometer | Bio-Rad | 170-2501 | |
| Semimicrovolume Cuvettes | Bio-Rad | 223-9955 | |
| Vertical Capillary Puller | Kopf Needle Pipette Puller | ||
| 3.5'' Replacement glass Capillaries for Nanojet II | Drummond Sientific Company | 3-000-203-G/X | |
| Nanoject II | Drummond Sientific Company | 3-000-204 | |
| Forceps | Fine Science Tools | 11255-20 | |
| 10 ml Syringe | BD | 309604 | |
| Mineral Oil, White, light | Macron Fine Chemicals | 6358-10 | |
| Minutein pins | Fine Science Tools | 26002-10 | |
| 1.5 ml Microcentrifuge tubes; Seal Rite | USA Scientific Inc. | 1615-5500 | |
| Motorized Pestle; Talboys Laboratory Stirrer | Troemner | 103 | |
| Talboys High Throughput Homogenizer | OPS Diagnostics | 930145 | |
| 5/32'' Grinding Balls | OPS Diagnostics | GBSS 156-5000-01 | |
| Vortex Genie | Scientific indurstries inc. | G560 | |
| Multichannel Pipettor (10 μl - 300 μl) | Sartorius | 730360 | |
| WASP2 Whitley Automated Spiral Plater | Microbiology International | ||
| ProtoCOL automated colony counter / plate counter/ plate reader | Microbiology International | ||
| TRIzol | Life Technologies | 15596-026 | |
| qPCR tubes; Low-Profile 0.2 ml 8-Tube Strips | Bio-Rad | TLS0801 | |
| qPCR caps; Optical Flat 8-Cap Strips | Bio-Rad | TCS0803 | |
| RQ1 RNase-Free DNase | Promega | m610a | |
| M-MLV Reverse Transcriptase | Promega | m170b | |
| dNTPs | Promega | U1240 | |
| Oligo-dT | IDT | ||
| SsoAdvanced SYBR Green Supermix | Bio-Rad | 172-5260 | |
| CFX Connect Real-Time PCR Detection System | Bio-Rad | 185-5200 | |
| RNasin Ribonuclease Inhibitor | Promega | N2115 |
Referenzen
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual review of immunology. 25, 697-743 (2007).
- Dionne, M. S., Schneider, D. S. Models of infectious diseases in the fruit fly Drosophila melanogaster. Disease models & mechanisms. 1 (1), 43-9 (2008).
- Rutschmann, S., Jung, A. C., Hetru, C., Reichhart, J. M., Hoffmann, J. A., Ferrandon, D. The Rel protein DIF mediates the antifungal but not the antibacterial host defense in Drosophila. Immunity. 12 (5), 569-580 (2000).
- Ayres, J. S., Freitag, N., Schneider, D. S. Identification of Drosophila mutants altering defense of and endurance to Listeria monocytogenes infection. Genetics. 178 (3), 1807-1815 (2008).
- Cronin, S. J. F., et al. Genome-wide RNAi screen identifies genes involved in intestinal pathogenic bacterial infection. Science. 325 (5938), 340-343 (2009).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. , (2014).
- Dionne, M. S., Pham, L. N., Shirasu-Hiza, M., Schneider, D. S. Akt and FOXO dysregulation contribute to infection-induced wasting in Drosophila. Current biology CB. 16 (20), 1977-1985 (2006).
- McKean, K. a., Yourth, C. P., Lazzaro, B. P., Clark, A. G. The evolutionary costs of immunological maintenance and deployment. BMC evolutionary biology. 8 (1), 76 (2008).
- Kuo, T. -. H., Pike, D. H., Beizaeipour, Z., Williams, J. A. Sleep triggered by an immune response in Drosophila is regulated by the circadian clock and requires the NFkappaB Relish. BMC neuroscience. 11, 17 (2010).
- Panayidou, S., Ioannidou, E., Apidianakis, Y. Human pathogenic bacteria, fungi, and viruses in Drosophila: disease modeling, lessons, and shortcomings. Virulence. 5 (2), 253-269 (2014).
- Keebaugh, E. S., Schlenke, T. A. Insights from natural host–parasite interactions: The Drosophila model. Developmental & Comparative Immunology. 42 (1), 111-123 (2014).
- Howick, V. M., Lazzaro, B. P. Genotype and diet shape resistance and tolerance across distinct phases of bacterial infection. BMC evolutionary biology. 14 (1), 56 (2014).
- Babin, A., Kolly, S., Kawecki, T. J. Virulent bacterial infection improves aversive learning performance in Drosophila. Brain, behavior, and immunity. , (2014).
- Chambers, M. C., Song, K. H., Schneider, D. S. Listeria monocytogenes infection causes metabolic shifts in Drosophila melanogaster. PLoS ONE. 7 (12), e50679 (2012).
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular ecology. 19 (7), 1462-1468 (2010).
- Stone, E. F., Fulton, B. O., Ayres, J. S., Pham, L. N., Ziauddin, J., Shirasu-Hiza, M. M. The circadian clock protein timeless regulates phagocytosis of bacteria in Drosophila. PLoS pathogens. 8 (1), e1002445 (2012).
- Chambers, M. C., Jacobson, E., Khalil, S., Lazzaro, B. P. Thorax injury lowers resistance to infection in Drosophila melanogaster. Infection and immunity. , (2014).
- Rich, J. T., Neely, J. G., Paniello, R. C., Voelker, C. C. J., Nussenbaum, B., Wang, E. W. A practical guide to understanding Kaplan-Meier curves. Otolaryngology--head and neck surgery official journal of American Academy of Otolaryngology-Head and Neck Surgery. 143 (3), 331-336 (2010).
- Sokal, R. R., Rohlf, F. J., Freeman, W. H. . Biometry. , (1995).
- Frydman, H. Wolbachia bacterial infection in Drosophila. Journal of visualized experiments JoVE. (2), 158 (2007).
- Kuo, T. -. H., Handa, A., Williams, J. A. Quantitative measurement of the immune response and sleep in Drosophila. Journal of visualized experiments JoVE. (70), e4355 (2012).
- Vodovar, N., et al. Drosophila host defense after oral infection by an entomopathogenic Pseudomonas species. Proceedings of the National Academy of Sciences of the United States of America. 102 (32), 11414-11419 (2005).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS pathogens. 3 (11), e173 (2007).
- Jaenike, J., Polak, M., Fiskin, A., Helou, M., Minhas, M. Interspecific transmission of endosymbiotic Spiroplasma by mites. Biology. 3 (1), 23-25 (2007).
- Kanbar, G., Engels, W. Ultrastructure and bacterial infection of wounds in honey bee ( Apis mellifera) pupae punctured by Varroa mites. Parasitology research. 90 (5), 349-354 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten