Method Article
Infection bactérienne systémique et défense immunitaire phénotypes
Dans cet article
Résumé
Drosophila melanogaster is an outstanding model organism for studying innate immune systems and the physiological consequences of infection and disease. This protocol describes how to deliver robust and quantitatively repeatable bacterial infections to D. melanogaster, and how to subsequently measure infection severity and quantify the host immune response.
Résumé
La mouche Drosophila melanogaster est l'un des organismes modèles de choix pour l'étude de la fonction et l'évolution de la défense immunitaire. De nombreux aspects de l'immunité innée sont conservées entre les insectes et les mammifères, et depuis la drosophile peut facilement être manipulé génétiquement et expérimentalement, ils sont puissants pour étudier la fonction du système immunitaire et les conséquences physiologiques de la maladie. La procédure démontré ici permet l'infection des mouches par l'introduction de bactéries directement dans la cavité du corps, en contournant les barrières épithéliales et des formes plus passives de défense et permet de se concentrer sur l'infection systémique. La procédure comprend les protocoles pour mesurer les taux de mortalité de l'hôte, la charge systémique de l'agent pathogène, et le degré d'induction du système immunitaire de l'hôte. Cette procédure d'infection est peu coûteux, robuste et quantitativement reproductible, et peut être utilisé dans des études fonctionnelles de la génétique, l'histoire évolutive de vie et la physiologie.
Introduction
La mouche des fruits Drosophila melanogaster est l'un des organismes modèles de choix pour l'étude de la fonction et l'évolution de la défense immunitaire. Drosophila sont peu coûteux et facile à l'arrière, sont extrêmement sensibles à la manipulation expérimentale, et sont soutenus par une communauté scientifique approfondie qui a développé un large gamme d'outils de recherche. De nombreux aspects de l'immunité innée sont conservées entre les insectes et les mammifères, y compris la transduction du signal médiée par les récepteurs Toll-like et NF-kB facteurs de transcription de la famille, la signalisation JAK / STAT, et les réponses de la voie JNK. 1,2 La fonction de ces gènes et les voies pouvez être interrogé dans D. melanogaster en utilisant des mutations ou ARNi passes rabattues qui augmentent ou voie de diminution des activités 3 - 6. En outre, la drosophile peut être utilisée pour étudier les conséquences physiologiques de l'infection et la maladie, y compris dans le contexte de la théorie de l'histoire de la vie évolutive 7.- 9 Toutes ces études, toutefois, dépendent de la capacité d'infecter de manière fiable mouches expérimentales dans des conditions de traitement définies. La procédure décrite ici présente un cadre méthodologique pour la prestation des infections bactériennes robustes et reproductibles à Drosophila melanogaster et ensuite mesurer gravité de l'infection et de quantifier la réponse immunitaire de l'hôte.
Drosophila peut être naturellement infectés expérimentalement et par une grande variété de parasites et d'agents pathogènes, y compris les bactéries, les champignons, les virus, les nématodes et les guêpes parasites. Le protocole actuel est axé sur la prestation de l'infection bactérienne systémique. Beaucoup de bactéries différentes peuvent être utilisés pour infecter des mouches, et le choix de l'expérimentateur devraient être fondées sur les questions scientifiques précises posées. Par exemple, des isolats cliniques humains peuvent être utilisés pour étudier les mécanismes de virulence bactériennes 10, ou écologiquement isolats pertinents peuvent être prefererd pour l'étude de l'évolution. 11 Certaines bactéries sont pathogènes compétentes de D. melanogaster, la prolifération lors de l'infection et causant la maladie ou la mort de l'hôte. D'autres bactéries sont gérées efficacement par le système immunitaire de l'hôte et effacés en quelques jours. Dans cette démonstration, Providencia rettgeri sera utilisé comme un agent pathogène qui peut provoquer la prolifération de l'hôte et la mortalité persiste dans des hôtes survivantes. Escherichia coli est utilisé comme un non-pathogène qui est interceptée par le système immunitaire de l'hôte.
L'infection est établie par l'introduction de bactéries directement dans la cavité du corps de la mouche. Cette approche contourne les barrières épithéliales et les comportements de protection, permettant l'étude de l'infection systémique quel que soit le mode naturel de transmission. Il existe deux méthodes principales pour établir expérimentalement l'infection systémique. Dans la première, et un nanoinjector tiré aiguilles capillaires en verre sont utilisés pour injecter un nombre précis debactéries dans la volée. Cette méthode a l'avantage de permettre une large gamme dynamique de doses d'infection et d'être quantitativement hautement reproductible. La seconde approche est de fournir une infection par une piqûre septique. Cette approche a l'avantage d'être rapide et ne nécessitant aucun équipement spécial. Une fois que les infections sont établis, il devient possible de mesurer la charge systémique d'agents pathogènes, la mortalité de l'hôte, et l'activité immunitaire du système inductible. Bien entendu, un certain nombre de phénotypes supplémentaires pourrait éventuellement être mesurée D. infectée melanogaster, y compris post-infection fécondité 12, la capacité d'apprentissage 13, état métabolique 14, ou quasiment tout autre trait qui peut être imaginé.
Protocole
1. Recueillir et préparer mouches
- D. arrière melanogaster dans les conditions expérimentales souhaitées. Prenez soin de ne pas surcharger les mouches pendant l'élevage et assurez-vous que les densités larvaires sont compatibles pour tous les traitements, car les conditions environnementales durant le stade larvaire peuvent affecter profondément phénotypes de défense immunitaire lors de l'étape adulte. 15
- Recueillir mouches expérimentales 0 - 3 jours après l'éclosion de la coque de nymphose et de les transférer sur un milieu frais.
- Maison vol recueillies à une température souhaitée (températures comprises entre 22 ° C et 28 ° C conviennent généralement) jusqu'à ce qu'ils soient âgés de 5 - 7 jours après l'éclosion.
NOTE: Ce laisse suffisamment de temps pour les mouches pour compléter la métamorphose et devenir des adultes matures, mais est bien avant le début de la sénescence. - Triez le nombre souhaité de mouches dans un flacon séparé avant l'infection, en prenant également soin d'éviter la surpopulation.
NOTE: Seulement males sont infectés dans cette démonstration, mais est également possible d'infecter les femmes utilisant la procédure décrite.
2. Culture et préparer des bactéries
- Préparer une plaque de maître des bactéries choisies au moins 2 jours avant l'infection. Streak les bactéries à partir d'un stock de glycérol 15% stockées indéfiniment à -80 ° C. Conservez la plaque de maître à 4 ° C pendant 2 semaines. Toujours série plaques maîtresses directement à partir du stock de glycérol congelés. Évitez passage en série de bactéries de plaque en plaque, comme le passage répété dans la culture peut causer des bactéries d'évoluer virulence atténuée.
NOTE: Cet exemple fait usage de Providencia rettgeri et Escherichia coli. - Utilisez la procédure suivante pour préparer une suspension bactérienne pour l'injection.
- Cultiver une culture de 2 ml de bactéries par inoculation d'un milieu stérile avec une seule colonie isolée à partir de la plaque maîtresse. Cultiver les bactéries à la phase stationnaire (par exemple, O / N croissance à 37 ° C).
REMARQUE: Les deux P. rettgeri et E. coli poussent bien dans du bouillon de Luria à des températures de 20 à 37 ° C en agitant doucement. - Une fois que la culture a atteint la phase stationnaire, culot en douceur les cellules à partir d'env. 600 pl de la culture dans une centrifugeuse de table (3 min à 5000 xg), jeter le surnageant et remettre en suspension les bactéries dans env. 1000 pl de solution saline tamponnée au phosphate stérile (PBS; NaCl 137 mM, 2,7 mM de KCl, 10 mM de Na 2 PO 4, 1,8 mM de KH 2 PO 4 à pH = 7,4).
- Diluer les cellules remises en suspension dans du PBS stérile pour obtenir une densité optique (DO) correspondant pour la bactérie utilisée, mesurée avec un spectrophotomètre en tant que l'absorbance à 600 nm. Utiliser cette suspension pour infecter les mouches.
NOTE: A 600 = 0,1 ou 1,0 correspond respectivement à environ 10 8 et 10 9 Providencia rettgeri ou E. coli par ml. Parce que les deux vivent unee bactéries mortes contribuent à la densité optique, il est important de récolter des cultures au début de la phase stationnaire avant cadavres bactériens accumuler et déformer la relation entre la densité optique et le nombre de bactéries viables introduites au cours de l'infection.
- Cultiver une culture de 2 ml de bactéries par inoculation d'un milieu stérile avec une seule colonie isolée à partir de la plaque maîtresse. Cultiver les bactéries à la phase stationnaire (par exemple, O / N croissance à 37 ° C).
3. Infect les mouches
NOTE: Comme l'immunité chez la drosophile est influencée par le rythme circadien, il est important d'effectuer les infections à la même époque de la journée à travers les répétitions expérimentales 16.
3.1) Utilisation d'un Nanoinjector
- Préparer les aiguilles de verre pour l'infection.
- Préparer une aiguille de verre en tirant un capillaire en verre de borosilicate à l'aide d'un extracteur de micropipette.
- En utilisant des pinces, brisez la pointe de l'aiguille pour créer une ouverture d'environ 50 um de diamètre pour permettre l'éjection de liquide.
- Monter l'injecteur.
- Placez le joint torique puis l'sp blancacer (grande fossette vers l'extérieur) sur le piston de métal.
- Remplir l'aiguille de verre avec de l'huile minérale en utilisant une seringue avec une aiguille 30 G.
- Mettez l'aiguille de verre rempli par la pince, puis placez le joint torique plus grande autour de sa base, d'environ 1 mm de l'extrémité émoussée de l'aiguille.
- Faites glisser l'aiguille sur le piston métallique et vissez doucement sur le collet jusqu'à sécurisé.
- Ejecter la plupart de l'huile minérale de l'injecteur, mais assurez-vous qu'il ya encore un petit volume d'huile dans l'aiguille à agir comme une barrière entre l'injecteur et la suspension bactérienne. Assurez-vous qu'il n'y a pas de bulles d'air dans l'huile minérale ou de la suspension bactérienne, ou entre les deux liquides.
- Réglez l'injecteur au volume désiré pour injection (entre 9 et 50 nl nl).
- Générer contrôles blessant.
- Remplissez l'aiguille d'injecteur avec PBS stérile en insérant avec précaution la pointe de l'aiguille capillaire dans un tube des médias et pressing le bouton "remplir" sur l'injecteur.
REMARQUE: Les milieux de culture stérile bactérienne peut également être utilisé si un contrôle blessant l'expérience requiert l'injection de bactéries en suspension dans leur milieu de croissance. Cependant, parce que le milieu de croissance bactérienne contient des composants qui peuvent stimuler le système immunitaire ou avoir d'autres effets sur l'hôte, un support inerte tel que du PBS est préférable. - Anesthésier le nombre souhaité de mouches sous un flux lumineux de CO 2.
- Injecter les mouches dans l'abdomen antérieure sur la surface ventrolatérale avec le PBS stérile.
NOTE: Il est également possible d'injecter des mouches à d'autres sites, tels que la plaque sternopleural du thorax, mais il est important de garder le site d'injection cohérente au sein de chaque expérience 17. - Placez mouches injectés dans des flacons frais avec nouveau support, portant les flacons de leur côté jusqu'à ce que toutes les mouches ont récupéré de l'anesthésie pour empêcher les mouches de se coincer à la nourriture.
NOTE: Il est recommandé d'injecter vol de contrôle PBS avant d'injecter des bactéries aux mouches expérimentales de sorte que la même aiguille peut être utilisé pour les deux traitements. Il ne sera pas toujours possible d'utiliser la même aiguille pour une expérience entière. Dans ce cas, il peut être souhaitable d'enregistrer aiguille qui a été utilisé avec laquelle les mouches et d'inclure aiguille identité en tant que facteur expérimental dans l'analyse statistique.
- Remplissez l'aiguille d'injecteur avec PBS stérile en insérant avec précaution la pointe de l'aiguille capillaire dans un tube des médias et pressing le bouton "remplir" sur l'injecteur.
- Injecter la bactérie pathogène.
- Éjecter le média stérile reste de l'injecteur et de remplir la même aiguille avec la suspension bactérienne.
- Répétez la procédure ci-dessus (3.1.3), en injectant maintenant les mouches avec la suspension bactérienne préparée dans la procédure 2.2.
3.2) Avec septique Pinprick
- Préparer l'aiguille pour piquer.
- Faire fondre l'extrémité d'une pointe de micropipette 200 pi et insérer une broche insecte minuties 0,15 mm dans le plastique fondu. Laissez le plastique se solidifier such que la broche est maintenu en place avec environ 0,5 cm de tige étendant à partir de la matière plastique.
- Générer contrôles blessant.
- Anesthésier le nombre souhaité de mouches sous un flux lumineux de CO 2.
- Piquer les mouches dans la plaque sternopleural du thorax avec l'aiguille, en évitant les sites de fixation des ailes et les jambes. Si nécessaire, retirez délicatement les mouches de la broche minuties l'aide de pinces molles.
REMARQUE:. Il est également possible de piquer les mouches à d'autres sites, comme l'abdomen antérieur sur la surface ventrolatérale, mais il est important de conserver le site d'injection conforme à l'intérieur de chaque expérience 17 Piquage à travers la cuticule de l'abdomen a tendance à être plus difficile que de piquer du thorax et est donc moins commun. - Placez les mouches dressées dans un nouveau flacon par un nouveau milieu de volée, portant le flacon sur le côté jusqu'à ce que toutes les mouches ont récupéré de l'anesthésie pour empêcher les mouches de soitvenue collé à l'aliment.
- Présentez l'infection bactérienne.
- Anesthésier le nombre souhaité de mouches sous un flux lumineux de CO 2.
- Piquer chaque mouche dans le même endroit que les commandes multimédia, plongeant la pointe de la broche dans la suspension bactérienne préparée dans la procédure 2.2 avant de piquer chaque volée.
- Placez les mouches dressées dans un nouveau flacon par un nouveau milieu de volée, portant le flacon sur le côté jusqu'à ce que toutes les mouches ont récupéré de l'anesthésie pour empêcher les mouches de se coincer à la nourriture.
3.3) évaluer la dose infectieuse Livré
- Infecter un groupe de mouches comme décrit ci-dessus dans les deux procédures 3.1 ou 3.2, seulement au lieu de retourner à vol flacon alimentaire pour récupérer de l'anesthésie, placez chaque mouche dans un tube à centrifuger sur la glace.
- Ajouter 250 ul de PBS à chaque tube et homogénéiser vol soit au moyen d'un pilon ou un batteur à billes.
- Plaque le broyat sur une plaque de gélose LB, soit en utilisant un laminoir à spirale ou une dilution en série.
- À la plaque en utilisant une dilution en série, transférer chaque homogénat de volée à la première ligne d'une plaque de 96 puits.
- Remplir chaque puits des rangées restantes avec 90 ul de PBS.
- En utilisant une pipette multicanaux, prendre 10 pi de la première ligne contenant voler homogénat et distribuer dans la deuxième rangée.
- Pipette de haut en bas au moins 10 fois pour bien mélanger, puis prendre 10 pi et de transférer à la troisième rangée. Répétez cette procédure en utilisant les lignes restantes.
- A partir de la rangée du bas (les plus diluer suspension de bactéries), utiliser la pipette multicanaux de prendre 10 pi de chaque puits et le dépôt sur une plaque LB, en prenant soin que les échantillons sont distribués sous forme de taches discrètes qui ne se touchent pas. Répétez jusqu'à ce que tous les puits ont été échantillonnés à partir de chaque rangée, les distribuer dans l'ordre décroissant de dilution sur la plaque LB.
- Laissez la plaque à température ambiante jusqu'à ce que les taches ont complètement trempée dans la plaque LB.
REMARQUE: Le séchage de la plaque LB pendant quelques jours à la température ambiante avant utilisation est recommandé de veiller à ce que le liquide est rapidement absorbé, ce qui minimise les risques de contact accidentel entre les taches de l'échantillon.
- Incuber les plaques O / N, en prenant soin de ne pas envahir les plaques de manière colonies restent petites et discret.
NOTE: Selon le milieu de croissance et température d'incubation bactérienne utilisée, colonies dérivées de la flore intestinale endogène de la mouche peuvent se déposer sur la plaque. Cependant, la plupart des bactéries utilisées pour l'infection pathogène se développent beaucoup plus vite que le microbiote intestinal sur gélose LB à 37 ° C. - Retirer les plaques de l'incubateur lorsque les bactéries expérimentales ont grandi colonies visibles (généralement 8 à 12 h), mais avant la drosophile colonies intestin du microbiote apparaissent (environ 36 h). Pour les bactéries expérimentales à croissance lente, utiliser un sélectiveantibiotique de la gélose LB pour éliminer les colonies de la flore intestinale.
- Comptez le nombre de colonies pour chaque homogénat.
- Pour les plaques en spirale, compter les colonies qui poussent à l'aide d'un compteur de colonies automatisé qui permet d'estimer la charge bactérienne par ml d'homogénat basé sur le nombre et la position des colonies sur la plaque.
REMARQUE: nombre de spirales sont plus précis quand la concentration bactérienne est de l'ordre de 5 x 10 2 à 5 x 10 4 bactéries par ml. - Pour les plaques de place, compter manuellement les colonies pour chaque volée de dilution selon contient de 30 à 300 colonies et calculer le nombre de bactéries par ml d'homogénat d'origine.
- Pour les plaques en spirale, compter les colonies qui poussent à l'aide d'un compteur de colonies automatisé qui permet d'estimer la charge bactérienne par ml d'homogénat basé sur le nombre et la position des colonies sur la plaque.
4. Caractériser survie des maladies infectieuses
- la mortalité de dosage post-injection.
- Placez mouches infectées et les contrôles blessés dans des flacons frais et maintenir dans un incubateur à une température souhaitée (25 ° C avec une lig 12h12ht: cycle d'obscurité est recommandé). Ne mettez pas plus de 15 mouches dans un seul flacon comme il devient difficile de compter plus de 15 mouches de vie.
- Comptez le nombre de vivants et morts vol chaque jour, ou plus fréquemment si nécessaire.
- Afin de maintenir la qualité des aliments, retourner les mouches à de nouveaux aliments sur une base régulière.
- Si le flacon contient seulement les hommes, de les transférer dans des flacons frais tous les trois jours. Si le flacon contient femelles, transférer dans des flacons frais tous les deux jours parce que la progéniture des larves se liquéfier la nourriture, ce qui augmente le risque que les mouches adultes peuvent se coincer et entraînant des taux de mortalité surestimés en raison de l'infection.
- Analyser statistiquement les données.
- la survie de l'intrigue comme une courbe de Kaplan-Meier, qui indique la probabilité qu'un individu va survivre à une post-injection de temps point mesuré. 18 Pour les courbes de survie qui ne se croisent pas, effectuer des comparaisons par paires en utilisant un Log-Rank Test (aussi appelé test Mantel Cox) ou effectuer des analyses plus complexes en utilisant un modèle des risques proportionnels de Cox, qui peut intégrer plusieurs facteurs et de leurs interactions. Pour les courbes de survie qui se croisent, effectuer une analyse Cox stratifié. 17
5. essai bactérien Chargez post-infection
- Mesurer la charge bactérienne.
- Lors d'une post-injection de temps prescrite, répéter la procédure utilisée pour évaluer la dose infectieuse pour déterminer la charge bactérienne au cours de l'infection (voir le protocole 3.3).
NOTE: Si vous utilisez le plaqueur en spirale, diluer homogénats de sorte que la suspension bactérienne situe dans une fourchette de 1000 - 100.000 bactérienne par ml.
- Lors d'une post-injection de temps prescrite, répéter la procédure utilisée pour évaluer la dose infectieuse pour déterminer la charge bactérienne au cours de l'infection (voir le protocole 3.3).
- Analyser les données.
- Si la charge bactérienne est non-normale, soit transformer les données afin de mieux approximer une distribution normale ou analyser les données en utilisant une analyse statistique non paramétrique (par exemple test de Mann-Whitney U). Utilisez une analyse de Box-Cox à find la transformation optimale; journaux ou de base naturelle -10 transformations journaux sont souvent efficaces. 19
- Si les données sont suffisamment distribués normalement et il ya seulement deux traitements étant contrastées, effectuer un t -test de déterminer si les deux traitements se traduisent par différentes charges bactériennes moyennes. Si il ya plusieurs variables expérimentales ou à d'autres facteurs potentiellement prédictifs, utiliser l'analyse de variance (Anova) pour déterminer quels sont les facteurs prédicteurs significatifs de la charge bactérienne. 19
6. Essai activation transcriptionnelle des gènes du système immunitaire
- Pour visualiser grossièrement activation immunitaire après une infection, infecter mouches transgéniques qui expriment la protéine fluorescente verte (GFP) sous le contrôle d'un promoteur d'un gène du peptide antimicrobien tel que décrit précédemment. 18
- Voir les mouches infectées sous un microscope de fluorescence capable; GFP induction devrait devenir Visible dans le corps gras dans les 6 premiers - 10 heures après l'infection.
- Pour la quantification plus précise de l'activation immunitaire, utiliser la PCR quantitative sur le modèle d'ADNc (qRT-PCR) pour mesurer l'abondance des antimicrobiens transcrits du gène peptide.
NOTE: L'expression des gènes immunitaires peut être mesuré à tout moment après (ou avant) infection. D'une manière générale, l'induction de l'expression du gène immunitaire commence environ 4 h après l'injection et augmente au cours de la prochaine 24 heures.- Anesthésier vol utilisant le CO 2.
- Passer vol 15 dans un tube de microcentrifugation, pour chaque extraction d'ARN.
NOTE: Il est recommandé de prélever au moins trois échantillons répétés pour chaque condition de traitement. - Extraire l'ARN de vol et générer un ADNc premier brin en utilisant un quelconque d'un certain nombre de modes opératoires standard ou des kits commerciaux. ARN de magasin à -80 ° C. ADNc de magasin à -20 ° C pour des périodes de quelques semaines et à -80 ° C pour le stockage à long terme. Avant extraction de l'ARN, un magasin fse situe à -80 ° C.
- Effectuer la PCR quantitative (qPCR) sur des gènes cibles d'intérêt en utilisant l'ADNc comme matrice. Reportez-vous au tableau 1 pour les séquences d'amorces pour amplifier les gènes de peptides antibactériens Diptericin A, drosomicine, défensines, attacine A, et Metchnikowin ainsi que la rp49 de contrôle du gène de ménage (aussi connu comme rpl32).
Remarque: les gènes codant pour les peptides antimicrobiens Diptericin A et drosomicine fournissent de très bons afficheurs de D. melanogaster activité immunitaire induite essentiellement par les voies IMD et Toll, respectivement. Afin de contrôler les variations échantillon à échantillon dans le rendement de l'ARN et l'efficacité de la transcription inverse, de normaliser l'expression enregistrée de gènes cibles contre un gène de ménage de référence dont l'expression ne devrait pas changer avec infection comme rp49 (aussi connu comme RPL 32). - Analyser les données.
- Pour approximation des différences d'expression, calculer le rapport de la quantité de départ (SQ) valeur obtenue à partir du gène d'essai (par exemple, Diptericin A) par rapport à la valeur de SQ obtenue à partir du gène de référence (par exemple, rp49) pour chaque échantillon (calculée en tant que SQ - DPTA / SQ - rp49). Echelle ces rapports à un traitement de commande de ligne de base tel qu'un contrôle de la manipulation non infecté. Fixer arbitrairement le niveau d'expression de contrôle égal à 1,0 et de visualiser des traitements expérimentaux que les changements relatifs de pliage. Estimer la valeur de la SQ pour chaque gène contre une courbe standard générée à partir d'une série de dilution de la quantité connue-ADNc.
REMARQUE: L'analyse statistique des rapports peut être compliqué, donc cette approche est meilleure pour approximation rapide que pour une analyse rigoureuse. Si l'efficacité PCR est faible, concevoir de nouvelles amorces pour améliorer la cinétique de PCR si possible. Pour les réactions de qPCR avec une efficacité quasi-parfaite (adoubling de produit PCR à chaque cycle), le cycle de seuil (C T) peut être remplacé par la valeur de la SQ. - Pour les expériences simples avec amplification d'une efficacité optimale, les données peuvent être analysés en utilisant la méthode ΔΔC T. 19 Pour chaque échantillon, il faut soustraire la valeur C T du gène de référence (par exemple, rp49) de la C T du gène de test (par exemple., Diptericin A) pour donner un Ac T. Puis soustraire l'Ac T de la commande de base de l'Ac T pour chaque échantillon expérimental pour donner une valeur ΔΔC T pour chaque échantillon; ce ΔΔC T est révélateur des différences relatives dans les niveaux d'expression des gènes entre les traitements, où 2 (-ΔΔCT) se rapproche le changement fois de l'expression.
NOTE: changement rabattable Cette analyse peut mal misestimate dans l'expression du gène cible si le PCR soit le gène de test ou la référencegène a une faible efficacité. - Pour l'analyse le plus rigoureux, effectuer une analyse de variance (ANOVA) en utilisant l'expression estimée du gène d'essai (par exemple Diptericin A) comme variable de réponse et d'expression d'environ le gène de contrôle (par exemple, rp49) et d'autres facteurs expérimentaux comme variables explicatives.
NOTE: Cette approche est relativement robuste à l'inefficacité dans l'amplification PCR et permet l'analyse des modèles expérimentaux plus complexes.
- Pour approximation des différences d'expression, calculer le rapport de la quantité de départ (SQ) valeur obtenue à partir du gène d'essai (par exemple, Diptericin A) par rapport à la valeur de SQ obtenue à partir du gène de référence (par exemple, rp49) pour chaque échantillon (calculée en tant que SQ - DPTA / SQ - rp49). Echelle ces rapports à un traitement de commande de ligne de base tel qu'un contrôle de la manipulation non infecté. Fixer arbitrairement le niveau d'expression de contrôle égal à 1,0 et de visualiser des traitements expérimentaux que les changements relatifs de pliage. Estimer la valeur de la SQ pour chaque gène contre une courbe standard générée à partir d'une série de dilution de la quantité connue-ADNc.
Résultats
Cette section montre les résultats qui peuvent être obtenus après une infection bactérienne de Drosophila melanogaster. La figure 1 montre que la dose d'infection varie en fonction de la densité optique de la suspension bactérienne utilisée pour l'injection, et en ce que la dose délivrée peut être estimée de manière fiable par homogénéisation et le placage vole immédiatement après l'injection . Comme illustré sur la figure 2, les différents agents pathogènes peuvent causer différents niveaux de mortalité hôte (Figure 2A) et de la mortalité de l'hôte peut être dépendante de la dose (figure 2B). Surtout, ce protocole permet à différents types d'infections à atteindre: Providencia rettgeri peut provoquer une infection chronique, sous-létale qui persiste pendant 20 jours ou plus (figure 3A). Cependant, d'autres bactéries comme Escerichia coli seront principalement effacés par la mouche de l'hôte dans les six heures post-infection (figure 3B). Induction des sys immunitairessystème peut être estimée par l'isolement de l'ARN et ultérieur qRT-PCR de transcrits de peptides antibactériens (Figure 4A et B). De manière analogue, mais moins quantitativement, les mouches exprimant la GFP sous le contrôle de promoteurs de gènes de peptide antimicrobien peut être utilisé pour visualiser l'induction du système immunitaire (figure 4C).
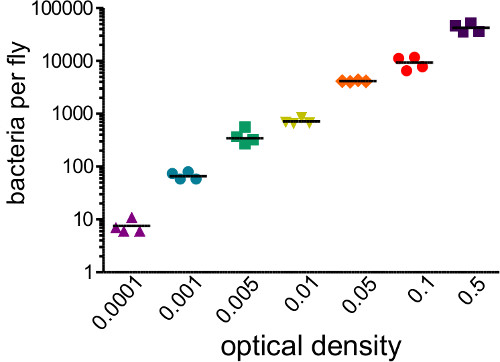
. Figure 1: Détermination de la dose infectieuse mouches ont été injectés avec 50 nl de suspensions bactériennes couvrant une gamme de densités optiques (de 0,0001 à 0,05). Les mouches ont été immédiatement homogénéisé et étalées pour déterminer le nombre de bactéries introduite par l'injection. La charge bactérienne initiale fortement corrélé avec la DO initiale injecté (r 2 = 0,96)
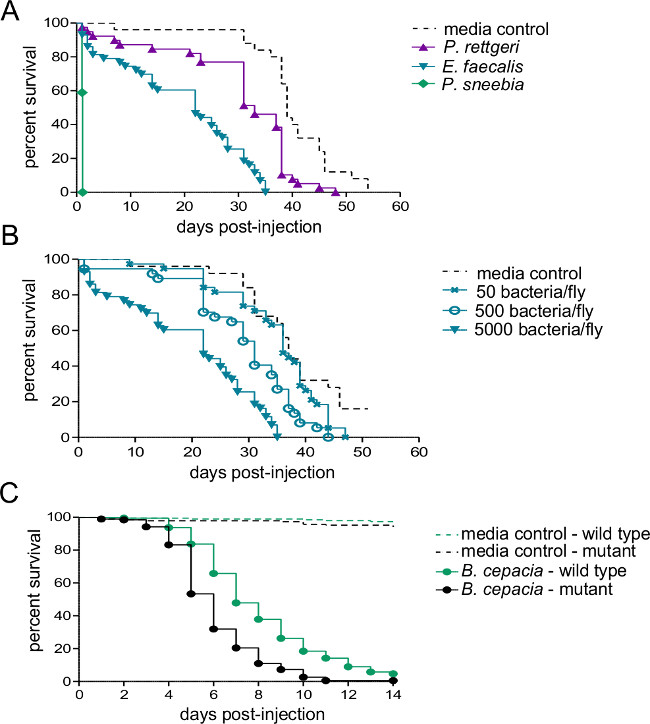
Figure 2:. La survie après injection avec bactéries pathogènes Cinq à sept jours vieux mâles ont été injectés avec 50 nl soit suspension bactérienne ou milieux stériles et surveillé pour la survie. (A) de type sauvage vol ont été injectés avec environ 5.000 bactéries à partir de l'un des trois espèces différentes. Le taux de mortalité de l'hôte dépend fortement des espèces bactériennes utilisées pour l'infection. (B) de type sauvage vol ont été injectés avec trois doses différentes de Enterococcous faecalis - 50, 500 et 5000 bactéries par mouche. Les mouches meurent plus rapidement lorsqu'ils sont infectés par des doses supérieures infectieuses (C) Un mutant du système immunitaire et sa ligne de contrôle isogénique de type sauvage ont été injectés avec environ 500 Burkholderia cepacia. Une comparaison par paires Log-Rank montre que la mouche de type sauvage survit à l'infection nettement mieux que le mutant (χ 2 = 59,02, df = 1, p <0,0001).
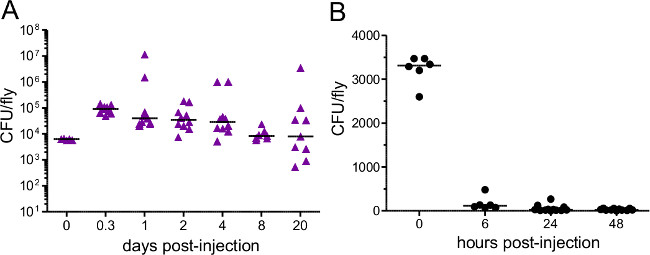
Figure 3: la charge bactérienne. Après l'injection mouches ont été injectés avec environ (A) 5000 P. rettgeri (B) 3400 E. coli. Charge bactérienne a été déterminé immédiatement après l'injection et à différents points de temps ultérieurs. Chaque point de données représente la charge bactérienne d'une seule mouche. E. coli est rapidement effacé à partir d'hôtes contesté, alors que P. rettgeri persiste pour le reste de la vie de l'hôte ,.
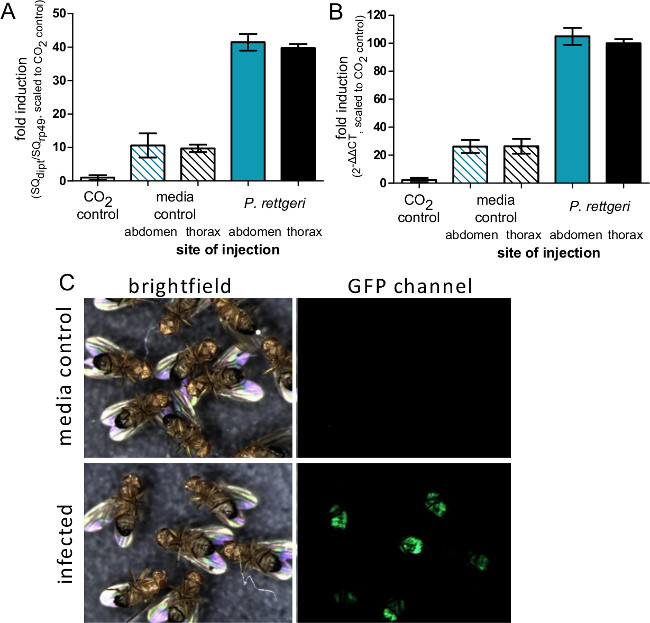
Figure 4: L'induction de l'expression du gène immunitaire après injection. (A) Les mouches ont été injectés avec 50 nl de P. PBS rettgeri ou stériles soit dans l'abdomen ou le thorax, ou ont été laissés de côté non manipulée de CO 2 anesthésie. Six heures après l'infection, les mouches ont été recueillis pour l'isolement de l'ARN et l'expression du gène Diptericin A a été déterminée par qRT-PCR. (A) Les niveaux d'expression sont représentées graphiquement comme le rapport de Diptericin Une transcription pour la transcription de rp49 et échelonnés de façon que le contrôle du CO 2 est défini comme ayant un niveau de 1. d'expression Les barres représentent la moyenne et l'erreur standard des rapports de chaque condition (n = 4). Niveaux (B) d'expression sont représentées graphiquement comme un 2 ΔΔCT à la valeur moyenne C T de CO 2 Aesthesia vol de contrôle utilisés comme condition non induit standard. Les barres représentent la moyenne et l'erreur type de ΔΔC T de chaque état (n = 4). Bien qu'il n'y ait pas de différence dans la transcription en raison de l'induction site d'injection, la comparaison des panneaux A et B montre comment la méthode ΔΔC T peut potentiellement surestimer les niveaux d'induction. (C) Mouches exprimant la GFP sous le contrôle du Diptericin Un promoteur ont été injectés avec 50 nl de P. rettgeri (OD = 0,1) et ensuite imagé 7 jours plus tard. Le panneau de la GFP montre l'expression de GFP dans le corps de la graisse abdominale de vol infectés, ce qui indique une activation de la Diptericin Un promoteur en vol bactéries infectées mais pas les contrôles injectés médias.
| Gène | Vers L'Avant | Inverse |
| rp49 (également appelé rpl32) | 5 'AGGCCCAAGATCGTGAAGAA 3' | 5 'GACGCACTCTGTTGTCGATACC 3' |
| Un Diptericin | 5 'GCGGCGATGGTTTTGG 3' | 5 'CGCTGGTCCACACCTTCTG 3' |
| Drosomicine | 5 'CTGCCTGTCCGGAAGATACAA 3 ' | 5 'TCCCTCCTCCTTGCACACA 3' |
| Defensin | 5 'GAGGATCATGTCCTGGTGCAT 3' | 5 'TCGCTTCTGGCGGCTATG 3' |
| Un attacine | 5 'CGTTTGGATCTGACCAAGG 3' | 5 'AAAGTTCCGCCAGGTGTGAC 3' |
| Metchnikowan | 5 'AACTTAATCTTGGAGCGATTTTTCTG 3' | 5 'ACGGCCTCGTATCGAAAATG 3' |
Tableau 1: Amorces pour qRT-PCR.
Discussion
La procédure décrite ici donne l'infection rigoureuse et de haute qualité de Drosophila melanogaster. Les exemples illustrés principalement axées sur l'infection par Providencia rettgeri et E. coli, mais le protocole est très souple et peut être appliqué à diverses infections par des bactéries sur une plage de conditions d'élevage de l'hôte et de maintenance.
Les détails d'une approche expérimentale optimale dépendra de la bactérie utilisée pour l'infection, le génotype de l'hôte, et les conditions expérimentales générales. Il est fortement recommandé de test pilote de nouvelles conditions expérimentales avant de lancer des projets plus ambitieux. Un bon point de départ est de tester trois doses d'infection sur une plage de 100 fois. Hautement pathogènes virulents sont souvent les mieux introduits à des doses infectieuses très faibles, de l'ordre de 10 à 100 cellules bactériennes par la mouche. Les agents pathogènes les plus modérés peuvent être injectés à des doses plus élevées de près de 1000 bactéries par fly, et non pathogènes peuvent être injectés à des doses aussi élevées que 10 000 bactéries par volée. Il est souvent intéressant de définir les cinétiques de nouvelles infections par le suivi de la charge d'agents pathogènes, la mortalité de l'hôte, et l'activité du système immunitaire au cours d'une série chronologique longitudinal. Parce que la mesure de la charge de l'agent pathogène et l'expression des gènes de l'hôte sont destructrices des dosages, il est nécessaire d'infecter vol distinctes dès le début de l'expérience pour chaque point dans le temps qui doit être mesuré.
Lorsque vous décidez d'utiliser piqûre ou une injection à base de micro-capillaire, il est important de noter qu'il ya des avantages et des limites de chaque approche. injection capillaire présente un volume de liquide dans la volée, ce qui à la fois augmente légèrement la pression de turgescence et introduit des sels ou d'autres molécules qui sont en suspension ou dissous dans le véhicule. injection capillaire nécessite également l'accès à un centre d'injection ou l'achat de l'équipement nécessaire. Piqûre septique nécessite aucun équipement et introduit spécialemédias négligeables dans la volée, et est généralement plus efficace pour infecter un grand nombre de mouches. Cependant, les infections piqûre ne permettent pas un contrôle précis sur la dose infectieuse qui peut être atteint avec l'injection capillaire. Le présent protocole axé sur un dispositif d'injection qui régule mécaniquement le volume d'injection, mais il ya également des systèmes d'injection basé sur des impulsions discrètes de l'air sous pression. 20,21 Ce sont généralement plus coûteux que l'appareil présenté ici et nécessitent un étalonnage de l'impulsion de l'air à chaque aiguille afin d'assurer les volumes d'injection cohérentes.
Il ya un débat considérable, mais très peu de données sur la façon dont les mouches deviennent infection systémique avec des bactéries à l'état sauvage. Certains chercheurs avancent que la majorité des infections naturelles se produisent lorsque la drosophile ingérer des bactéries pathogènes et les bactéries sont ensuite en mesure d'échapper à l'intestin pour établir une infection systémique. Toutefois, il existe très few bactéries connues pour être capable de traverser l'intestin de D. melanogaster, et ceux qui ont cette capacité sont hautement létale aux mouches 22,23. Une théorie alternative est ce qui vole régulièrement subir des blessures cuticulaires travers évasion de tentatives de prédation échoué ou attaque par des acariens ectoparasites. Cette hypothèse est soutenue par la collecte fréquente de D. sauvage melanogaster portant des taches de mélanisation qui sont indicatifs des plaies cicatrisées (observations non publiées). Les acariens ont été montrés pour transmettre des infections bactériennes chez la drosophile et 24 blessures laissées par les acariens peuvent être secondairement infecté par des bactéries dans les abeilles 25. Toutefois, la fréquence de la nature de l'infection acariens ou autrement entraîné opportuniste de D. melanogaster travers violations de la cuticule est pas connue. Le protocole décrit ici permet l'introduction de bactéries directement dans l'hémolymphe par injection quantitative qui contourne toutes les barrières épithéliales ou immu comportementalesnité. Des procédés pour l'alimentation des bactéries pathogènes à D. melanogaster ont été décrits dans Vodovar et al. 22 et Nehme et al. 23.
Beaucoup de bactéries entomopathogènes posent peu ou pas de risque pour la santé humaine, ce qui permet aux chercheurs de travailler avec eux confortablement. En outre, très peu de bactéries ont la capacité d'infecter la drosophile au contact sans intervention expérimentale, de sorte que le risque de "épidémie" propagation de l'infection bactérienne par un laboratoire par des surfaces contaminées ou échappés vol est généralement très faible. Néanmoins, il est conseillé de veiller à ce que des mesures de confinement adéquates sont en place pour empêcher les mouches infectées de fuir et de reprendre tout vol échappé. Le laboratoire doit être équipé à un niveau de sécurité biologique en rapport avec celle des agents pathogènes utilisés, et les meilleures pratiques standard en microbiologie devrait être utilisé.
Le infecti expérimentalela méthode décrite ici permet infections de Drosophila melanogaster avec toute dose de toute bactérie arbitraire. Une fois que l'infection a été établie, il est simple de mesurer la cinétique de prolifération bactérienne ou dégagement, de suivre la mortalité de l'hôte, et de doser l'induction du système immunitaire de l'hôte. Mouches infectées peuvent facilement être soumis à d'autres tests phénotypiques, y compris les tests des fonctions physiologiques qui peuvent être de forme ou façonnés par l'infection. Les procédures décrites sont peu coûteux, exigent relativement peu d'équipement spécialisé, et sont faciles à apprendre, ce qui les rend prête pour une utilisation dans divers projets à travers une largeur de laboratoires de recherche et d'enseignement.
Déclarations de divulgation
None of the authors have competing interests or conflicting interests.
Remerciements
We would like to thank the entire Lazzaro lab, and especially Susan Rottschaefer, for their help in both reviewing and testing these protocols. This is a product of their cumulative expertise. Work in the Lazzaro lab is supported by grants R01 AI083932 and R01 AI064950 from the US National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Incubator | Powers Scientific, Inc | DROS52SD | |
| Paintbrush | |||
| CO2 Flypads | FlyStuff | 59-114 | |
| CO2 | Airgas | CD FG50 | |
| Drosophila rearing mix | |||
| 6 oz Square Bottom Bottles, polypropylene | Genesee Scientific | 32-130 | |
| Nosterile Extra Large Cotton Balls | Fisher brand | 22-456-882 | |
| Microscope | Olympus Corporation | SZ51 | |
| Drosophila Vials polystyrene | VWR international | 89092-720 | |
| Nosterile Large Cotton Balls | Fisher brand | 22-456-883 | |
| 2 L flask | VWR international | 89000-370 | |
| Petri Dishes with Clear Lids, Raised Ridge; 100 x 15 mm; | VWR international | 25384-302 | |
| LB Agar, Miller | Difco | 244520 | |
| Innoculing Loop | VWR international | 80094-488 | |
| Rainin Clasic Pipettes in various sizes 0.1 µl to 2 µl, 2 µl to 20 µl, 20 µl to 200 µl, 100 µl to 1,000 µl | Rainin | PR-2 PR-20 PR-200 PR-1000 | |
| Micropipette tips (assorted sizes) | VWR international | 30128-376 53503-810 16466-008 | |
| Luria Broth Base, Miller | Difco | 241420 | |
| Disposable Culture Tubes Borosilicate Glass | VWR international | 47729-576 | |
| S-500 Orbital Shaker | VWR international | 14005-830 | |
| Centrifuge | VWR international | 37001-300 | |
| PBS pH 7.4 10X | Invitrogen | 70011044 | |
| SmartSpec 3000 Spectrophotometer | Bio-Rad | 170-2501 | |
| Semimicrovolume Cuvettes | Bio-Rad | 223-9955 | |
| Vertical Capillary Puller | Kopf Needle Pipette Puller | ||
| 3.5'' Replacement glass Capillaries for Nanojet II | Drummond Sientific Company | 3-000-203-G/X | |
| Nanoject II | Drummond Sientific Company | 3-000-204 | |
| Forceps | Fine Science Tools | 11255-20 | |
| 10 ml Syringe | BD | 309604 | |
| Mineral Oil, White, light | Macron Fine Chemicals | 6358-10 | |
| Minutein pins | Fine Science Tools | 26002-10 | |
| 1.5 ml Microcentrifuge tubes; Seal Rite | USA Scientific Inc. | 1615-5500 | |
| Motorized Pestle; Talboys Laboratory Stirrer | Troemner | 103 | |
| Talboys High Throughput Homogenizer | OPS Diagnostics | 930145 | |
| 5/32'' Grinding Balls | OPS Diagnostics | GBSS 156-5000-01 | |
| Vortex Genie | Scientific indurstries inc. | G560 | |
| Multichannel Pipettor (10 μl - 300 μl) | Sartorius | 730360 | |
| WASP2 Whitley Automated Spiral Plater | Microbiology International | ||
| ProtoCOL automated colony counter / plate counter/ plate reader | Microbiology International | ||
| TRIzol | Life Technologies | 15596-026 | |
| qPCR tubes; Low-Profile 0.2 ml 8-Tube Strips | Bio-Rad | TLS0801 | |
| qPCR caps; Optical Flat 8-Cap Strips | Bio-Rad | TCS0803 | |
| RQ1 RNase-Free DNase | Promega | m610a | |
| M-MLV Reverse Transcriptase | Promega | m170b | |
| dNTPs | Promega | U1240 | |
| Oligo-dT | IDT | ||
| SsoAdvanced SYBR Green Supermix | Bio-Rad | 172-5260 | |
| CFX Connect Real-Time PCR Detection System | Bio-Rad | 185-5200 | |
| RNasin Ribonuclease Inhibitor | Promega | N2115 |
Références
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual review of immunology. 25, 697-743 (2007).
- Dionne, M. S., Schneider, D. S. Models of infectious diseases in the fruit fly Drosophila melanogaster. Disease models & mechanisms. 1 (1), 43-9 (2008).
- Rutschmann, S., Jung, A. C., Hetru, C., Reichhart, J. M., Hoffmann, J. A., Ferrandon, D. The Rel protein DIF mediates the antifungal but not the antibacterial host defense in Drosophila. Immunity. 12 (5), 569-580 (2000).
- Ayres, J. S., Freitag, N., Schneider, D. S. Identification of Drosophila mutants altering defense of and endurance to Listeria monocytogenes infection. Genetics. 178 (3), 1807-1815 (2008).
- Cronin, S. J. F., et al. Genome-wide RNAi screen identifies genes involved in intestinal pathogenic bacterial infection. Science. 325 (5938), 340-343 (2009).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. , (2014).
- Dionne, M. S., Pham, L. N., Shirasu-Hiza, M., Schneider, D. S. Akt and FOXO dysregulation contribute to infection-induced wasting in Drosophila. Current biology CB. 16 (20), 1977-1985 (2006).
- McKean, K. a., Yourth, C. P., Lazzaro, B. P., Clark, A. G. The evolutionary costs of immunological maintenance and deployment. BMC evolutionary biology. 8 (1), 76 (2008).
- Kuo, T. -. H., Pike, D. H., Beizaeipour, Z., Williams, J. A. Sleep triggered by an immune response in Drosophila is regulated by the circadian clock and requires the NFkappaB Relish. BMC neuroscience. 11, 17 (2010).
- Panayidou, S., Ioannidou, E., Apidianakis, Y. Human pathogenic bacteria, fungi, and viruses in Drosophila: disease modeling, lessons, and shortcomings. Virulence. 5 (2), 253-269 (2014).
- Keebaugh, E. S., Schlenke, T. A. Insights from natural host–parasite interactions: The Drosophila model. Developmental & Comparative Immunology. 42 (1), 111-123 (2014).
- Howick, V. M., Lazzaro, B. P. Genotype and diet shape resistance and tolerance across distinct phases of bacterial infection. BMC evolutionary biology. 14 (1), 56 (2014).
- Babin, A., Kolly, S., Kawecki, T. J. Virulent bacterial infection improves aversive learning performance in Drosophila. Brain, behavior, and immunity. , (2014).
- Chambers, M. C., Song, K. H., Schneider, D. S. Listeria monocytogenes infection causes metabolic shifts in Drosophila melanogaster. PLoS ONE. 7 (12), e50679 (2012).
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular ecology. 19 (7), 1462-1468 (2010).
- Stone, E. F., Fulton, B. O., Ayres, J. S., Pham, L. N., Ziauddin, J., Shirasu-Hiza, M. M. The circadian clock protein timeless regulates phagocytosis of bacteria in Drosophila. PLoS pathogens. 8 (1), e1002445 (2012).
- Chambers, M. C., Jacobson, E., Khalil, S., Lazzaro, B. P. Thorax injury lowers resistance to infection in Drosophila melanogaster. Infection and immunity. , (2014).
- Rich, J. T., Neely, J. G., Paniello, R. C., Voelker, C. C. J., Nussenbaum, B., Wang, E. W. A practical guide to understanding Kaplan-Meier curves. Otolaryngology--head and neck surgery official journal of American Academy of Otolaryngology-Head and Neck Surgery. 143 (3), 331-336 (2010).
- Sokal, R. R., Rohlf, F. J., Freeman, W. H. . Biometry. , (1995).
- Frydman, H. Wolbachia bacterial infection in Drosophila. Journal of visualized experiments JoVE. (2), 158 (2007).
- Kuo, T. -. H., Handa, A., Williams, J. A. Quantitative measurement of the immune response and sleep in Drosophila. Journal of visualized experiments JoVE. (70), e4355 (2012).
- Vodovar, N., et al. Drosophila host defense after oral infection by an entomopathogenic Pseudomonas species. Proceedings of the National Academy of Sciences of the United States of America. 102 (32), 11414-11419 (2005).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS pathogens. 3 (11), e173 (2007).
- Jaenike, J., Polak, M., Fiskin, A., Helou, M., Minhas, M. Interspecific transmission of endosymbiotic Spiroplasma by mites. Biology. 3 (1), 23-25 (2007).
- Kanbar, G., Engels, W. Ultrastructure and bacterial infection of wounds in honey bee ( Apis mellifera) pupae punctured by Varroa mites. Parasitology research. 90 (5), 349-354 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon