Method Article
זיהום חיידקים מערכתי וחיסון ביטחון פנוטיפים ב
In This Article
Summary
Drosophila melanogaster is an outstanding model organism for studying innate immune systems and the physiological consequences of infection and disease. This protocol describes how to deliver robust and quantitatively repeatable bacterial infections to D. melanogaster, and how to subsequently measure infection severity and quantify the host immune response.
Abstract
זבוב הפירות דרוזופילה melanogaster הוא אחד יצורים המודל המוביל ללימוד הפונקציה והאבולוציה של הגנה חיסונית. היבטים של חסינות מולדת רבים נשמרים בין חרקים ויונקים, ומאז תסיסנית יכולה בקלות להיות מניפולציות גנטית וניסיוני, הם רבי עוצמה ללימוד תפקוד מערכת חיסונית ואת ההשלכות הפיזיולוגיות של מחלה. ההליך הפגין כאן מאפשר זיהום של זבובים על ידי הקדמה של חיידקים ישירות לתוך חלל הגוף, תוך עקיפת מחסומי אפיתל וצורות פסיביות יותר של הגנה ומאפשר התמקדות בזיהום מערכתי. ההליך כולל פרוטוקולים לשיעורי תמותה של מדידת מארח, עומס הפתוגן מערכתי, ותואר של אינדוקציה של המערכת החיסונית המארח. הליך זיהום זה הוא זול, חזק וכמותית הדיר, וניתן להשתמש בו במחקרי גנטיקה תפקודית, ההיסטוריה האבולוציונית חיים, ופיזיולוגיה.
Introduction
זבוב הפירות דרוזופילה melanogaster הוא אחד יצורים המודל המוביל ללימוד הפונקציה והאבולוציה של הגנה חיסונית. דרוזופילה הם זולים וקלים לאחוריים, הם נוחים מאוד למניפולציה ניסויית, ומגובים על ידי קהילה מדעית נרחבת שהתפתחה רחב מערך של כלי מחקר. היבטים של חסינות מולדת רבים נשמרים בין חרקים ויונקים, כוללים העברת אותות בתיווכו של קולטני-כמו אגרה וגורמי שעתוק משפחת NF-kB, איתות JAK / STAT, ותגובות מסלול JNK. 1,2 הפונקציה של גנים והמסלולים יכולים אלה תשאול בד melanogaster באמצעות מוטציות או RNAi knockdowns פעילויות עלייה או ירידת מסלול ש-- 3. 6 בנוסף, תסיסנית יכולה לשמש כדי לחקור את ההשלכות הפיזיולוגיות של זיהומים ומחלות, כולל בהקשר של תאוריה האבולוציונית היסטורית חיים 7.- 9 כל המחקרים כאלה, לעומת זאת, תלויים ביכולת להדביק באופן מהימן זבובים ניסיוניים בתנאי טיפול מוגדרים. ההליך המתואר כאן מציג מסגרת המתודולוגית להעברת זיהומים חיידקיים חזקים ודיר לתסיסנית melanogaster ולאחר מכן מדידת חומרת זיהום וכימותי התגובה החיסונית המארח.
תסיסנית יכולה להיות נגועה באופן טבעי וניסיוני על ידי מגוון רחב של טפילים ופתוגנים, כוללים חיידקים, פטריות, וירוסים, נמטודות וצרעות טפילות. הפרוטוקול הנוכחי מתמקד באספקת זיהום חיידקים מערכתי. חיידקים רבים ושונים יכולים לשמש כדי להדביק זבובים, והבחירה של הנסיין צריכה להיות מבוססת על השאלות המדעיות המדויקות שבקשה. לדוגמא, המבודדים קלינית בבני אדם יכול להיות מועסק ללמוד מנגנוני אלימות של חיידקי 10, או מבחינה אקולוגית מבודדים רלוונטיים עשוי להיות preferreד למחקר האבולוציוני. 11 חיידקים חלקם פתוגנים המוסמכים של ד melanogaster, מתרבים על זיהום וגרימת מחלה מארח או מוות. חיידקים אחרים מנוהלים ביעילות על ידי המערכת החיסונית המארח ופינו תוך כמה ימים. בהפגנה זו, rettgeri Providencia ישמש כמחולל מחל שגשוג שיכול לגרום לתמותת מארח ונמשך במארחים ששרדו. Coli Escherichia ישמש כאינו פתוגן שאינו מסומנת על ידי המערכת החיסונית המארח.
זיהום יוקם על ידי הקדמה של חיידקים ישירות לתוך חלל הגוף של הזבוב. גישה זו עוקפת מחסומי אפיתל והתנהגויות מגוננות, המאפשרת חקירה של זיהום מערכתי ללא קשר למצב הטבעי של שידור. קיימות שתי שיטות עיקריות לניסוי הקמת זיהום מערכתי. בתחילה, מחטי nanoinjector ונימי זכוכית משך משמשות להזריק מספרם מדויק שלחיידקים לזבוב. לשיטה זו היתרונות של מאפשר טווח דינמי גדול של מנות זיהום ולהיות כמותית הדיר מאוד. הגישה השנייה היא לספק זיהום עם דקירת סיכה ספיגה. גישה זו יש יתרונות של להיות מהירים ואינו דורשים ציוד מיוחד. ברגע שהזיהומים הוקמו, הוא הופך להיות אפשרי למדוד עומס מערכתי הפתוגן, תמותת מארח, ופעילות מערכת חיסון מושרה. כמובן, כל מספר של פנוטיפים נוספים יכול להעלות על הדעת להימדד בד הנגוע melanogaster, כולל פוריות 12, יכולת למידה לאחר זיהום 13, מצב המטבולי 14, או כמעט כל תכונה אחרת שאפשר להעלות על דעת.
Protocol
1. איסוף והכן זבובים
- האחורי ד melanogaster תחת תנאי ניסוי הרצויים. יש להיזהר שלא לגדוש הזבובים במהלך גידול ולוודא כי צפיפות זחל היא עקביות בטיפולים, שכן תנאים סביבתיים בשלב הזחל עמוק יכולים להשפיע על פנוטיפים הגנה חיסוניים בשלב בוגר. 15
- לאסוף זבובים ניסיוניים 0-3 ימים לאחר eclosion מהמקרה גלמי ולהעביר אותם על מדיום חדש.
- בית הזבובים שנאספו בטמפרטורה רצויה (טמפרטורות שבין 22 ° C ו 28 ° C הם בדרך כלל מתאימות) עד שהם בגילי 5 - 7 ימים לאחר eclosion.
הערה: זה מאפשר מספיק זמן לזבובים כדי להשלים מטמורפוזה והפך אנשים מבוגרים, אבל גם הוא לפני ההזדקנות מתחילה. - מיין את המספר הרצוי של זבובים לתוך בקבוקון נפרד לפני ההדבקה, לוקח שוב טיפול, כדי למנוע צפיפות.
הערה: רק males נגוע בהפגנה זו, אך באותה מידה אפשר להדביק נשים באמצעות ההליך המתואר.
2. תרבות והכן חיידקים
- הכן צלחת מאסטר של החיידקים שנבחרו לפחות 2 ימים לפני הזיהום. פס החיידקים ממניות גליצרול 15% ללא הגבלת זמן מאוחסנים ב -80 ° C. אחסן את צלחת ההורים על 4 מעלות צלזיוס עד 2 שבועות. תמיד פס צלחות אדון ישירות ממניות גליצרול הקפואות. הימנע מעבר סידורי של חיידקים מצלחת לצלחת, כמעבר חוזר ונשנה בתרבות יכול לגרום לחיידקים להתפתח אלימות מוחלשת.
הערה: בדוגמה זו עושה שימוש בrettgeri Providencia וcoli Escherichia. - השתמש בהליך הבא כדי להכין השעיה חיידקים להזרקה.
- לגדול תרבות 2 מיליליטר של חיידקים על ידי ייחסת בינוני סטרילי עם מושבה אחת מבודדת מהצלחת השני. לגדל את החיידקים לשלב נייח (למשל O / N צמיחה על 37 מעלות צלזיוס).
הערה: שני פ coli rettgeri וא לגדול גם בוריא מרק בטמפרטורות 20-37 מעלות צלזיוס עם רעד עדין. - ברגע שהגיעה לתרבות שלב נייח, בעדינות גלולה תאים מכ. 600 μl של התרבות בצנטריפוגה שולחן (3 דקות ב XG 5000), לבטל את supernatant, וresuspend החיידקים בכ. 1,000 μl של נאגר מלוח פוספט סטרילי (PBS; 137 מ"מ NaCl, 2.7 מ"מ KCl, 10 מ"מ Na 2 PO 4, 1.8 מ"מ KH 2 PO 4, pH = 7.4).
- לדלל את תאי resuspended ב PBS סטרילי כדי להשיג צפיפות אופטית (OD) מתאימה לחיידק בשימוש, נמדדה בספקטרופוטומטר כספיגה ב 600 ננומטר. השתמש השעיה זה להדביק את הזבובים.
הערה: 600 = 0.1 או 1.0 מתאימה בהתאמה לכ 10 8 ו -10 9 rettgeri Providencia או E. coli לכל מיליליטר. מכיוון שגם לחיותND חיידקים מתים לתרום לצפיפות אופטית, חשוב למסוק תרבויות המוקדמות בשלב נייח לפני גופות חיידקים להצטבר ולעוות את מערכת היחסים בין צפיפות האופטית ואת מספר חיידקי קיימא הציגו במהלך זיהום.
- לגדול תרבות 2 מיליליטר של חיידקים על ידי ייחסת בינוני סטרילי עם מושבה אחת מבודדת מהצלחת השני. לגדל את החיידקים לשלב נייח (למשל O / N צמיחה על 37 מעלות צלזיוס).
3. להדביק את הזבובים
הערה: כחסינות תסיסנית מושפעת מקצב צירקדי, חשוב לבצע זיהומים בזמן דומה של יום על פני משכפל ניסיוני 16.
3.1) שימוש Nanoinjector
- הכן את מחטי זכוכית לזיהום.
- הכן מחט זכוכית על ידי משיכת נימי זכוכית בורוסיליקט באמצעות חולץ micropipette.
- בעזרת מלקחיים, לנתק את קצה המחט כדי ליצור פתיחה של כ -50 מיקרומטר קוטר כדי לאפשר פליטה של נוזל.
- הרכב את המזרק.
- מניחים את O-הטבעת ולאחר מכן sp הלבן איטוםACER (גומה גדולה הפונה כלפי חוץ) על בוכנת המתכת.
- מלא את מחט הזכוכית עם שמן מינרלים באמצעות מזרק עם מחט 30 G.
- שים את מחט זכוכית מלאה בקולט ולאחר מכן למקם את טבעת O הגדולה סביב הבסיס שלה, על 1 מ"מ מהקצה הקהה של המחט.
- חלק את המחט על בוכנת המתכת ועדינות לדפוק על קולט עד מאובטח.
- הוצא ביותר של שמן מינרלים מהמזרק, אבל לוודא שיש עדיין נפח קטן של שמן במחט לפעול כמחסום בין המזרק והשעית החיידקים. ודא שאין בועות אוויר בתוך שמן מינרלים או ההשעיה חיידקים, או בין שני הנוזלים.
- הגדר את המזרק לנפח הרצוי להזרקה (בין 9 NL ו -50 NL).
- צור פצעו בקרות.
- מלא את מחט המזרק עם PBS סטרילי על ידי הוספה בזהירות את קצה מחט הנימים בצינור של התקשורת וpressing על הכפתור "למלא" במזרק.
יכולה לשמש גם תקשורת צמיחת חיידקי סטרילי שליטה פצעה אם הניסוי דורש הזרקה של חיידקים תלויים במדיום הגידול שלהם: הערה. עם זאת, מכיוון שתקשורת צמיחת חיידקים מכילה רכיבים שעלולים לעורר את המערכת החיסונית או להיות השפעות אחרות על המארח, מוביל אינרטי כגון PBS עדיף. - לטשטש את המספר הרצוי של זבובים תחת זרימת אור של CO 2.
- להזריק את הזבובים בבטן הקדמית על פני השטח ventrolateral עם PBS סטרילי.
הערה: ניתן גם להזריק זבובים באתרים אחרים, כגון צלחת sternopleural של בית החזה, אך חשוב לשמור על אתר ההזרקה עקבי בכל ניסוי 17. - הנח זבובים מוזרקים לתוך צלוחיות טריות עם מדיום חדש, הנחת הבקבוקונים בצד שלהם, עד שכל הזבובים התאוששו מההרדמה כדי למנוע זבובים מלהיות תקוע למזון.
הערה: מומלץ להזריק את זבובי שליטת PBS לפני הזרקת חיידקים לזבובים ניסיוניים כך אותה המחט יכולה לשמש לשני הטיפולים. זה לא יהיה תמיד אפשר להשתמש באותה המחט לכל ניסוי. במקרה זה, זה עשוי להיות רצוי כדי להקליט שמחט היה בשימוש עם שטסה ולכלול זהות מחט כגורם ניסיוני בניתוח סטטיסטי.
- מלא את מחט המזרק עם PBS סטרילי על ידי הוספה בזהירות את קצה מחט הנימים בצינור של התקשורת וpressing על הכפתור "למלא" במזרק.
- להזריק את הפתוגן בקטריאלי.
- הוצא את המדיה סטרילי שנותרה מהמזרק ולמלא אותה המחט עם ההשעיה החיידקים.
- חזור על התהליך לעיל (3.1.3), עכשיו הזרקת הזבובים עם ההשעיה החיידקים מוכנות בהליך 2.2.
3.2) עם ספיגה דקירת סיכה
- הכן את המחט ללדקור.
- ממסים את הקצה של קצה micropipette 200 μl ולהכניס סיכת minutien החרקים 0.15 מ"מ לפלסטיק המותך. לאפשר הפלסטיק לביסוס suפרק שהסיכה נערכה במקום עם כ 0.5 סנטימטר של פינים המשתרעים מהפלסטיק.
- צור פצעו בקרות.
- לטשטש את המספר הרצוי של זבובים תחת זרימת אור של CO 2.
- דקור את הזבובים בצלחת sternopleural של בית החזה עם המחט, הימנעות האתרים המצורף של הכנפיים והרגליים. במידת צורך, להסיר בעדינות זבובים מפיני minutien באמצעות מלקחיים רכים.
הערה:. כמו כן, ניתן לדקור את הזבובים באתרים אחרים, כגון בטן הקדמית על פני השטח ventrolateral, אך חשוב לשמור על אתר ההזרקה עקבי בכל ניסוי 17 דקירה באמצעות הציפורן של הבטן נוטה להיות יותר קשה מאשר לדקור של בית החזה, ולכן פחות נפוצה. - מניחים את הזבובים דקרו לתוך בקבוקון טרי עם מדיום לטוס חדש, הנחת הבקבוקון על צידו עד שכל הזבובים התאוששו מההרדמה כדי למנוע הזבובים מBEבוא נדבק למזון.
- להציג את זיהום החיידקים.
- לטשטש את המספר הרצוי של זבובים תחת זרימת אור של CO 2.
- דקור כל לטוס באותו המיקום כמו פקדי המדיה, טובל את הקצה של הסיכה להשעית החיידקים מוכנות בהליך 2.2 לפני לדקור כל זבוב.
- מניחים את הזבובים דקרו לתוך בקבוקון טרי עם מדיום לטוס חדש, הנחת הבקבוקון על צידו עד שכל הזבובים התאוששו מההרדמה כדי למנוע זבובים מלהיות תקוע למזון.
3.3) הערכת מינון זיהומיות נמסר
- להדביק קבוצה של זבובים כפי שתואר לעיל בכל הליך 3.1 או 3.2, רק במקום לחזור לזבובי בקבוקון מזון להתאושש מהרדמה, למקם כל לטוס לתוך צינור microcentrifuge על קרח.
- הוסף 250 μl PBS על צינור אחד וhomogenize הזבובים או באמצעות העלי או מקצף חרוז.
- פלייט homogenate על צלחת אגר LB, או באמצעות plater ספירלה או דילול סדרתי.
- לצלחת באמצעות דילול סדרתי, להעביר את כל homogenate לטוס לשורה הראשונה של צלחת גם 96.
- מלא היטב בכל השורות שנותרו עם 90 μl של PBS.
- בעזרת פיפטה רבה, לקחת 10 μl מהשורה הראשונה המכילה לטוס homogenate ולוותר לשורה השנייה.
- פיפטה מעלה ומטה לפחות 10 פעמים כדי לערבב ביסודיות, ולאחר מכן לקחת 10 μl ולהעביר לשורה השלישית. חזור על תהליך זה באמצעות השורות שנותרו.
- החל מהשורה התחתונה (רוב לדלל השעיה חיידקים), להשתמש בפיפטה הרבה לקחת 10 μl מכל טוב ופיקדון על צלחת LB, דואג שהדגימות לוותר ככתמים דיסקרטיים שלא נוגעים זה בזה. חזור על פעולה עד כל הבארות כבר שנדגמו מכל שורה, מחלק אותם בסדר יורד של דילול על צלחת LB.
- השאר את הצלחת על RT עד הכתמים ספגו לחלוטין לתוך צלחת LB.
הערה: ייבוש צלחת LB לכמה ימים בRT לפני השימוש מומלץ על מנת להבטיח שהנוזל נספג בקלות, ולהפחית את הסיכויים של קשר מקרי בין נקודות דגימה.
- דגירה צלחות O / N, נזהרת שלא לגדול יותר צלחות כך מושבות יישארו קטנות ודיסקרטית.
הערה: בהתאם לחום בינוני צמיחה ודגירה של חיידקים המשמש, מושבות החיידקים הנגזרות מבטן אנדוגני של הזבוב יכולות סופו של דבר יופיעו בצלחת. עם זאת, רוב החיידקים המשמשים לזיהום פתוגניים לגדול הרבה יותר מהר מאשר חיידקי מעיים על אגר LB על 37 מעלות צלזיוס. - הסר צלחות מן החממה כאשר חיידקי הניסוי גדלו מושבות גלויות (בדרך כלל 8-12 שעות), אבל לפני מושבות חיידקי מעיים תסיסנית מופיעות (כ 36 שעות). לחיידקים ניסוי גדלו איטיים, להשתמש סלקטיביתאנטיביוטיקה באגרה LB כדי להסיר כל מושבות חיידקי מעיים מ.
- לספור את מספר מושבות לכל homogenate.
- לצלחות ספירלה, לספור את המושבות שלגדול באמצעות דלפק מושבה אוטומטי שיכול להעריך את עומס חיידקים לכל מיליליטר של homogenate המבוסס על המספר והמיקום של המושבות על הצלחת.
הערה: ספירת ספירלה היא מדויקת ביותר כאשר ריכוז החיידקים הוא בטווח של 5 x 10 x 2 עד 5 10 4 חיידקים למ"ל. - לצלחות מקום, לספור ידני המושבות לכל זבוב מהדילול לפי מכיל 30-300 מושבות ולחשב את מספר חיידקים לכל מיליליטר של homogenate המקורי.
- לצלחות ספירלה, לספור את המושבות שלגדול באמצעות דלפק מושבה אוטומטי שיכול להעריך את עומס חיידקים לכל מיליליטר של homogenate המבוסס על המספר והמיקום של המושבות על הצלחת.
4. לאפיין הישרדות של זיהום
- תמותת assay לאחר הזרקה.
- הנח זבובים נגועים ובקרות נפצעו בבקבוקונים טריים ולשמור בחממה בטמפרטורה רצויה (25 מעלות צלזיוס עם lig 00:12HT: מחזור כהה מומלץ). אין לשים יותר מ -15 זבובים לתוך בקבוקון אחד כפי שהוא הופך להיות קשה לספור יותר מ -15 זבובי חיים.
- לספור את מספר זבובי חיים ומתים בכל יום, או בתדירות גבוהה יותר אם מתאים.
- על מנת לשמור על איכות מזון, להעיף את הזבובים למזון חדש על לוח זמנים קבועים.
- אם הבקבוקון מכיל זכרים בלבד, להעביר אותם לצלוחיות טריות כל שלושה ימים. אם הבקבוקון מכיל נקבות, להעביר לצלוחיות טריות כל יומיים כי צאצאי זחל יהיה נוזל המזון, מעלה את הסיכון שהזבובים הבוגרים עלולים להיתקע וכתוצאה מכך שיעורי הערכה של תמותה עקב זיהום.
- סטטיסטית לנתח את הנתונים.
- הישרדות עלילה כעקומת קפלן-מאייר, המצביעה על ההסתברות שפרט ישרוד לזמן לאחר הזרקת נקודות מדודה. 18 לעקומות הישרדות שלא לחצות, לבצע השוואות זוג חכם באמצעות T-התחבר דירוגest (המכונה גם מבחן קוקס מנטל) או לבצע ניתוחים מורכבים יותר באמצעות מפגעי דגם קוקס פרופורציונלי, אשר יכול לשלב מספר גורמים ויחסי הגומלין שלהם. לעקומות הישרדות שחוצות, לבצע ניתוח קוקס ריבוד. 17
5. Assay קטריאלי טען פוסט-זיהום
- למדוד עומס חיידקים.
- בלאחר הזרקת מועד שנקבע, לחזור על התהליך המשמש להערכת מינון זיהומיות על מנת לקבוע עומס חיידקים במהלך הזיהום (ראה פרוטוקול 3.3).
הערה: אם משתמש בplater הספירלה, לדלל homogenates כך שהשעית החיידקים נופלת בטווח של 1,000 - 100,000 מיליליטר לחיידקים.
- בלאחר הזרקת מועד שנקבע, לחזור על התהליך המשמש להערכת מינון זיהומיות על מנת לקבוע עומס חיידקים במהלך הזיהום (ראה פרוטוקול 3.3).
- לנתח את הנתונים.
- אם עומס חיידקים הוא לא נורמלי, או לשנות את הנתונים לבקירוב טוב יותר התפלגות נורמלית או לנתח את הנתונים באמצעות ניתוח הלא פרמטרית סטטיסטית (מבחן מאן-וויטני U למשל). השתמש ניתוח התיבה-קוקס לFind השינוי האופטימלי; -10 תמורות יומן היומן או בסיס טבעי הן לעתים קרובות יעילות. 19
- אם הנתונים מספיק מתפלגים נורמלי ויש רק שני טיפולים שניגוד, לבצע -test לא כדי לקבוע אם שני הטיפולים לגרום להמון חיידקים ממוצעים שונים. אם יש משתנים ניסיוניים מרובים או גורמים פוטנציאליים חזוי אחרים, להשתמש בניתוח שונה (ANOVA) כדי לקבוע אילו גורמים מנבאים משמעותיים של עומס חיידקים. 19
6. Assay תעתיק הפעלה של גני המערכת החיסונית
- גס כדי להמחיש הפעלה חיסונית לאחר הדבקה, להדביק זבובים מהונדסים המבטאים חלבון פלואורסצנטי ירוק (GFP) תחת שליטתו של יזם מגן פפטיד מיקרוביאלית כפי שתואר לעיל. 18
- צפה זבובים הנגועים תחת מיקרוסקופ פלואורסצנטי-מסוגל; האינדוקציה GFP צריכה להיות visible בגוף השומן בתוך הראשונות 6 - 10 שעות לאחר הדבקה.
- לכימות מדויק יותר של הפעלה חיסונית, להשתמש PCR כמו בתבנית cDNA (qRT-PCR) כדי למדוד את השפע של תמלילי גן פפטיד מיקרוביאלית.
הערה: הביטוי של גני חיסון ניתן למדוד בכל עת לאחר הדבקה (או לפני). באופן כללי, אינדוקציה של ביטוי גנים חיסוני מתחילה כ -4 שעות לאחר הזרקה ועלייה מעל שעות 24 הבאות.- הרדימי זבובים באמצעות CO 2.
- מניחים 15 זבובים לתוך צינור microfuge לכל הפקת RNA.
הערה: מומלץ לאסוף לפחות שלוש דגימות לשכפל לכל מצב טיפול. - לחלץ RNA מהזבובים וליצור cDNA ראשון גדיל באמצעות כל מספר הנהלים סטנדרטיים או ערכות מסחריות. RNA החנות ב -80 ° C. cDNA החנות ב -20 ° C לתקופות של כמה שבועות וב -80 ° C לאחסון ארוך טווח. לפני מיצוי RNA ו חנות,טמון ב -80 ° C.
- לבצע PCR כמותית (QPCR) על גני המטרה של עניין באמצעות cDNA כתבנית. עיין בטבלה 1 לרצפי פריימר כדי להגביר את הגנים פפטיד אנטיבקטריאלי Diptericin, Drosomycin, Defensin, Attacin, וMetchnikowin כמו גם rp49 שליטת משק בית הגן (הידוע גם בrpL32).
הערה: הגנים מקודדים פפטידים מיקרוביאלית Diptericin וDrosomycin לספק קריאות טובות מאוד של ד melanogaster פעילות חיסונית הנגרמת בעיקר באמצעות מסלולי IMD ואגרה, בהתאמה. כדי לשלוט על וריאציה בתשואת RNA ומדגם למדגם את היעילות של שעתוק לאחור, לתקנן את הביטוי של גנים שנרשם יעד נגד גן משק התייחסות הביטוי שאינו צפוי להשתנות עם זיהום כגון rp49 (הידוע גם בRPL 32). - לנתח את הנתונים.
- להערכה גסה של הבדלי ביטוי, לחשב את היחס של כמות התחלת הערך (SQ) המתקבל מהבדיקה הגנטית (למשל, Diptericin) ביחס לערך SQ מתקבל מגן ההתייחסות (למשל, rp49) עבור כל דגימה (מחושב כ SQ - DptA / SQ - rp49). קנה מידה של יחסים אלה לטיפול שליטה בסיסית כגון שליטת טיפול נגוע. באופן שרירותי להגדיר את רמת ביטוי השליטה שווה 1.0 ולדמיין טיפולים ניסיוניים כשינויים ביחס של פי. לאמוד את שווי SQ עבור כל גן נגד עקומת סטנדרט שנוצרה מסדרת דילול ידועה-כמות cDNA.
הערה: ניתוח סטטיסטי של יחסים יכולה להיות מסובכת, ולכן גישה זו היא טובה יותר לקירוב מהיר יותר לניתוח קפדני. אם יעילות PCR היא נמוכה, לתכנן פריימרים חדשים כדי לשפר את קינטיקה PCR אם אפשר. לתגובות qPCR עם יעילות כמעט מושלמת (מודעהoubling של מוצר ה- PCR בכל מחזור), מחזור הסף (C T) ניתן להחליף את ערך SQ. - לניסויים פשוטים עם הגברה יעילה בצורה אופטימלית, נתוני ניתן לנתח בשיטת ΔΔC T. 19 עבור כל דגימה, לחסר ערך C T של גן ההתייחסות (למשל, rp49) מT C של גן הבדיקה (לדוגמא., Diptericin ) להניב T ΔC. אחר כך להפחית את T ΔC של השליטה הבסיסית מT ΔC עבור כל דגימת ניסוי להניב ערך ΔΔC T עבור כל דגימה; ΔΔC T זה מעיד על הבדלים יחסי ברמות ביטוי גנים בין טיפולים, שבו 2 (-ΔΔCT) קרובים לשינוי הקיפול בביטוי.
הערה: בניתוח זה קשה יכול misestimate לקפל-שינוי בביטוי של גן המטרה אם PCR של שני גני המבחן או ההתייחסותיש גן יעילות נמוכה. - לניתוח הקפדני ביותר, לבצע ניתוח של שונות (ANOVA) באמצעות הביטוי המשוער של גן המבחן (למשל Diptericin) כמשתנה התגובה וביטוי משוער של גן השליטה (למשל rp49) וגורמים אחרים ניסיוניים כמשתני מסבירים.
הערה: גישה זו היא חזקה יחסית לחוסר יעיל בהגברת PCR ומאפשרת ניתוח של עיצובים ניסיוניים יותר מסובכים.
- להערכה גסה של הבדלי ביטוי, לחשב את היחס של כמות התחלת הערך (SQ) המתקבל מהבדיקה הגנטית (למשל, Diptericin) ביחס לערך SQ מתקבל מגן ההתייחסות (למשל, rp49) עבור כל דגימה (מחושב כ SQ - DptA / SQ - rp49). קנה מידה של יחסים אלה לטיפול שליטה בסיסית כגון שליטת טיפול נגוע. באופן שרירותי להגדיר את רמת ביטוי השליטה שווה 1.0 ולדמיין טיפולים ניסיוניים כשינויים ביחס של פי. לאמוד את שווי SQ עבור כל גן נגד עקומת סטנדרט שנוצרה מסדרת דילול ידועה-כמות cDNA.
תוצאות
סעיף זה ממחיש תוצאות שניתן להשיג לאחר זיהום חיידקים של תסיסנית melanogaster. איור 1 מראה כי מינון זיהום משתנה עם צפיפות אופטית של ההשעיה חיידקים המשמשת להזרקה, וכי המינון נמסר ניתן לאמוד באופן מהימן על ידי homogenizing וציפוי עף מייד לאחר הזרקה . כפי שמודגם באיור 2, פתוגנים שונים יכולים לגרום לרמות של תמותת מארח (איור 2 א) ותמותת מארח שונות יכול להיות תלוי מינון (איור 2). חשוב לציין, פרוטוקול זה מאפשר לסוגים שונים של זיהומים שיושגו: rettgeri Providencia יכול לגרום לזיהום כרוני, תת-קטלני שנמשך במשך 20 ימים או (איור 3 א) ארוכים יותר. עם זאת, חיידקים אחרים כמו coli Escerichia יהיו בעיקר להיות מסומנות על ידי זבוב המארח בתוך שש שעות לאחר פגיעה (איור 3). אינדוקציה של sys חיסוניTEM ניתן לאמוד באמצעות בידוד RNA וqRT-PCR הבא של תמלילי אנטיבקטריאלי פפטיד (איור 4 א 'וב'). באנלוגיה אבל פחות כמותית, זבובים להביע GFP בשליטת יזמי גן פפטיד מיקרוביאלית יכול לשמש כדי לחזות אינדוקציה של המערכת החיסונית (איור 4C).
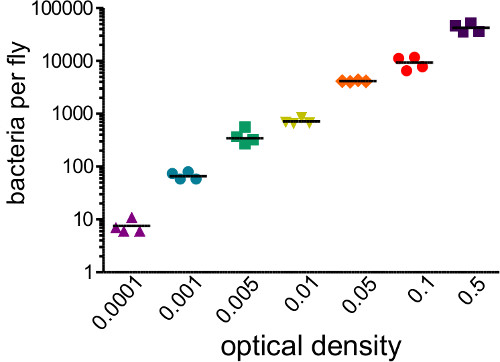
. איור 1: זבובים קביעת זיהומיות מנה הוזרקו 50 NL של השעיות חיידקי מכסים מגוון של צפיפויות אופטיות (.0001-0.05). הזבובים היו הומוגני ומייד מצופים כדי לקבוע את מספר החיידקים שהוצג על ידי ההזרקה. עומס חיידקים ראשוני מאוד בקורלציה עם OD הראשוני מוזרק (r 2 = 0.96)
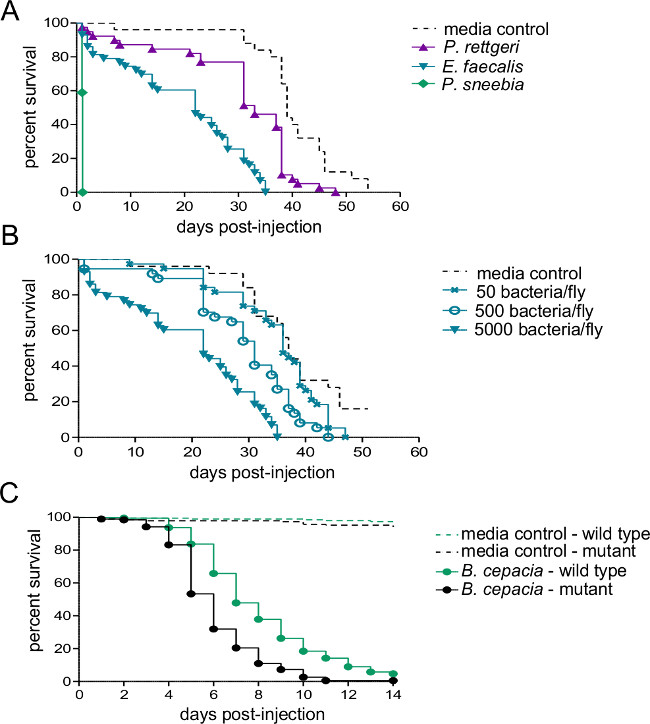
טרונג> איור 2:. הישרדות לאחר הזרקה עם חיידקים פתוגנים חמישה לשבעה ישנים זכרים היום הוזרקו 50 NL של שתי השעיה חיידקים או מדיה סטרילית ופיקוח על הישרדות. (א) זבובי סוג בר הוזרקו כ -5,000 חיידקים משל אחד משלושה מינים שונים. שיעור תמותת מארח תלוי במידה רבה על מיני חיידקים המשמשים לזיהום. זבובי סוג (B) Wild הוזרקו שלושה מינונים שונים של faecalis Enterococcous - 50, 500, ו5,000 חיידקים לזבוב. זבובים למות מהר יותר כאשר נגועים במינונים גבוהים יותר זיהומיות (C) מוטציה מערכת חיסונית וקו שליטת isogenic הפראי-סוגה הוזרקו כ -500 cepacia Burkholderia. השוואה התחבר דרגה pairwise מראה כי זבוב wild-type שורד את הזיהום משמעותי יותר מאשר המוטציה (χ 2 = 59.02, df = 1, p <0.0001).
FO: לשמור-together.within עמודים = "תמיד"> 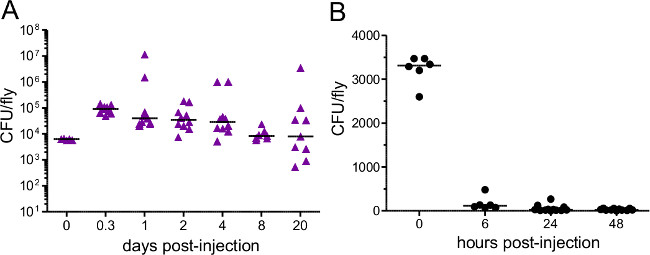
איור 3:. עומס חיידקים לאחר הזרקת זבובים הוזרק כ () 5,000 פ rettgeri (ב) 3,400 א coli. עומס חיידקים נקבע מייד לאחר הזרקה ובנקודתי זמן שלאחר מכן שונות. כל נקודת נתונים מייצגת את עומס החיידקים של זבוב אחד. א coli מנוקה במהירות ממארחים תיגר תוך פ rettgeri נמשך לשארית חייו של המארח ,.
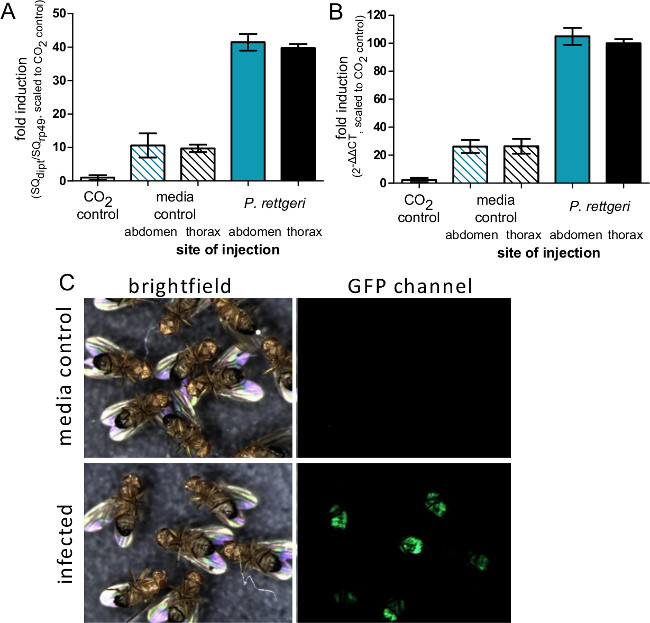
איור 4: אינדוקציה של ביטוי גני החיסון לאחר הזרקה. זבובים () הוזרקו 50 NL של פ PBS rettgeri או סטרילי באו הבטן או חזה, או נותרו unmanipulated מלבד CO 2 הרדמה. שש שעות לאחר ההדבקה, זבובים נאספו עבור בידוד RNA וביטוי של Diptericin גן נקבע באמצעות qRT-PCR. רמות ביטוי () הם בגרף כיחס Diptericin תמליל לתמליל rp49 וטפסו באופן שהשליטה CO 2 מוגדרת כבעל רמת ביטוי של 1. הברים מייצגים את הממוצע וסטיית התקן של יחסים מכל מצב (n = 4). רמות ביטוי (ארוחת בוקר) בגרף כΔΔCT 2 עם ערך C T הממוצע מזבובי שליטת 2 aesthesia CO משמשים כתנאי uninduced הסטנדרטי. הברים מייצגים את השגיאה הממוצעת וסטנדרטית של ΔΔC T מכל מצב (n = 4). אמנם אין הבדל באינדוקצית תמליל בשל אתר הזרקה, השוואה של לוחות A ו- B מראה כיצד שיטת ΔΔC T עלולה להפריז בהערכת רמות אינדוקציה. (C) זבובים להביע GFP בשליטה של Diptericin אמרגן הוזרק 50 NL של פ rettgeri (OD = 0.1) ולאחר מכן צילם 7 ימים לאחר מכן. פנל ה- GFP מראה ביטוי של ה- GFP בגוף שומן הבטן של זבובים נגועים, המצביע על הפעלה של Diptericin אמרגן בזבובי bacterially נגועים אך לא שולט מוזרק תקשורת.
| גן | קדימה | הפוך |
| rp49 (המכונה גם rpL32) | 5 'AGGCCCAAGATCGTGAAGAA 3' | 5 'GACGCACTCTGTTGTCGATACC 3' |
| Diptericin | 5 'GCGGCGATGGTTTTGG 3' | 5 'CGCTGGTCCACACCTTCTG 3' |
| Drosomycin | 5 'CTGCCTGTCCGGAAGATACAA 3 ' | 5 'TCCCTCCTCCTTGCACACA 3' |
| Defensin | 5 'GAGGATCATGTCCTGGTGCAT 3' | 5 'TCGCTTCTGGCGGCTATG 3' |
| Attacin | 5 'CGTTTGGATCTGACCAAGG 3' | 5 'AAAGTTCCGCCAGGTGTGAC 3' |
| Metchnikowan | 5 'AACTTAATCTTGGAGCGATTTTTCTG 3' | 5 'ACGGCCTCGTATCGAAAATG 3' |
טבלה 1: צבעי יסוד לqRT-PCR.
Discussion
ההליך המתואר כאן מניב זיהום איכות קפדנית וגבוה של תסיסנית melanogaster. דוגמאות מאוירות התמקדו בעיקר בזיהום עם Providencia rettgeri וא coli, אך הפרוטוקול הוא ישים מאוד ויכול להיות מיושם לזיהומים בחיידקים שונים על פני טווח של תנאי גידול מארח ותחזוקה.
הפרטים של גישה ניסויית אופטימלית יהיו תלויים בחיידק המשמש לזיהום, גנוטיפ של המארח, ותנאי ניסוי הכוללים. מומלץ מאוד למבחן טייס כל תנאי ניסוי חדשים לפני ביצוע פרויקטים שאפתניים יותר. נקודת התחלה טובה היא לבדוק שלוש מנות זיהום על פני טווח של פי 100. מאוד פתוגנים ארסיים לעתים קרובות הציגו הטוב ביותר במינונים נמוכים מאוד מדבקים, בסדר הגודל של 10-100 תאי חיידקים לזבוב. ניתן להזריק פתוגנים מתונים יותר במינונים גבוהים יותר של כ -1,000 חיידקים לfly, ולא פתוגנים ניתן להזריק במינונים גבוהים כמו 10,000 חיידקים לזבוב. זה לעתים קרובות מאלף להגדיר קינטיקה של זיהומי רומן על ידי מעקב עומס הפתוגן, תמותת מארח, ופעילות מערכת חיסונית על סדרת אורך זמן. בגלל מדידה של עומס הפתוגן וביטוי גני המארח הם מבחני הרסניים, יש צורך להדביק זבובים שונים בתחילת הניסוי עבור כל נקודת זמן שיימדד.
כאשר מחליטים אם להשתמש בדקירת סיכה או הזרקה מבוססת microcapillary, חשוב לשים לב שיש יתרונות ומגבלות לכל גישה. הזרקת נימים מציגה נפח של נוזל לתוך הזבוב, ששניהם בצניעות מגביר לחצו טורגור ומציג מלחים או מולקולות אחרות שמושעות או מומסים במנשא. הזרקת נימים דורשת גם גישה למתקן הזרקה או רכישה של הציוד הנדרש. דקירת סיכה ספיגה לא דורשת ציוד מיוחד ומציגתקשורת זניחה לזבוב, והוא בדרך כלל יעילה יותר להדבקת מספר גדול של זבובים. עם זאת, זיהומי דקירת סיכה אינם מאפשרים שליטה המדויקת במינון זיהום שניתן להשיג עם הזרקת נימים. הפרוטוקול הנוכחי התמקד במנגנון הזרקה מכאנית שמסדיר עוצמת זריקה, אבל יש גם מערכות הזרקה מבוססת על פעימות של אוויר דחוס בדידות. 20,21 אלה הם בדרך כלל יקרים יותר מאשר מנגנון ההשתתפות כאן ודורשים כיול של דופק האוויר לכל מחט כדי להבטיח כרכי הזרקה עקביים.
יש ויכוח רב אבל מעט מאוד נתונים על איך הזבובים להיות מערכתי נגועים בחיידקים בטבע. חוקרים אחדים להניח שרוב הזיהומים טבעיים להתרחש כאשר תסיסנית לבלוע חיידקים פתוגניים והחיידקים לאחר מכן הצליחו להימלט הבטן להקים זיהום מערכתי. עם זאת, יש פה מאודחיידקי w הידועים כדי להיות מסוגלים לחצות את בטנו של ד ' melanogaster, ואלה שיש לי יכולת זו שהם קטלני ביותר לזבובי 22,23. תאוריה חלופית היא שטס באופן קבוע לקיים פציעות cuticular דרך בריחה מניסיונות טריפה נכשלו או התקפה על ידי קרדית ectoparasitic. השערה זו נתמכת על ידי האוסף התכוף של ד הפראי melanogaster נושאות כתמי melanization שמעידים על פצעים הגלידו (תצפיות לא פורסמו). קרדית הוכח להעביר זיהומים חיידקיים בדרוזופילה 24 ופצעים שהותירו קרדית יכולים להיות נגועים באופן משני על ידי חיידקים בדבורים דבש 25. עם זאת, התדירות בטבע של זיהום מונע קרדית או אחר האופורטוניסטי של ד melanogaster דרך פרצות ציפורן אינו ידוע. הפרוטוקול המתואר כאן מאפשר הקדמה של חיידקים ישירות לתוך hemolymph באמצעות הזרקה כמותיים שעוקף כל מחסומי אפיתל או אימונוגלובולינ התנהגותאינסופיות. שיטות האכלה חיידקים פתוגניים לד melanogaster תוארו בVodovar et al. 22 וNehme et al. 23.
חיידקי entomopathogenic רבים מהווים סיכון לבריאות אדם קטן או לא, מאפשרים לחוקרים לעבוד איתם בנוחות. יתר על כן, יש מעט מאוד חיידקים היכולת להדביק תסיסנית על קשר ללא התערבות ניסיונית, כך הסיכון של התפשטות "מגיפה" של זיהום חיידקים דרך מעבדה באמצעות משטחים מזוהמים או נמלטו זבובים הוא בדרך כלל נמוך מאוד. עם זאת, מומלץ לוודא שצעדי בלימה הולמים נמצאים במקום כדי למנוע זבובים נגועים לברוח ולתפוס מחדש לכל נמלט זבובים. המעבדה צריכה להיות לבוש ברמת בטיחות ביולוגית בקנה אחד עם זו של פתוגנים בשימוש, ושיטות עבודה מומלצות סטנדרטית במיקרוביולוגיה צריכה להיות מועסקות.
Infecti הניסיוניבשיטה המתוארת כאן מאפשר זיהומים של דרוזופילה melanogaster עם כל מינון של כל חיידק שרירותי. ברגע שהזיהום כבר נקבע, זה פשוט למדוד את קינטיקה של התפשטות או אישור חיידקים, כדי לעקוב אחר תמותת מארח, וassay אינדוקציה של המערכת החיסונית המארח. בקלות יכולים להיות נתונה זבובים נגועים למבחני פנוטיפי אחרים, כוללים בדיקות של תפקודים פיסיולוגיים שעשויות לעצב או להיות מעוצב על ידי הזיהום. הנהלים המתוארים הם זולים, דורשים ציוד מיוחד קטן יחסית, והם בקלות למדו, מה שהופך אותם נוחים לשימוש בפרויקטים מגוונים ברחבי לרוחבה של מעבדות מחקר והוראה.
Disclosures
None of the authors have competing interests or conflicting interests.
Acknowledgements
We would like to thank the entire Lazzaro lab, and especially Susan Rottschaefer, for their help in both reviewing and testing these protocols. This is a product of their cumulative expertise. Work in the Lazzaro lab is supported by grants R01 AI083932 and R01 AI064950 from the US National Institutes of Health.
Materials
| Name | Company | Catalog Number | Comments |
| Incubator | Powers Scientific, Inc | DROS52SD | |
| Paintbrush | |||
| CO2 Flypads | FlyStuff | 59-114 | |
| CO2 | Airgas | CD FG50 | |
| Drosophila rearing mix | |||
| 6 oz Square Bottom Bottles, polypropylene | Genesee Scientific | 32-130 | |
| Nosterile Extra Large Cotton Balls | Fisher brand | 22-456-882 | |
| Microscope | Olympus Corporation | SZ51 | |
| Drosophila Vials polystyrene | VWR international | 89092-720 | |
| Nosterile Large Cotton Balls | Fisher brand | 22-456-883 | |
| 2 L flask | VWR international | 89000-370 | |
| Petri Dishes with Clear Lids, Raised Ridge; 100 x 15 mm; | VWR international | 25384-302 | |
| LB Agar, Miller | Difco | 244520 | |
| Innoculing Loop | VWR international | 80094-488 | |
| Rainin Clasic Pipettes in various sizes 0.1 µl to 2 µl, 2 µl to 20 µl, 20 µl to 200 µl, 100 µl to 1,000 µl | Rainin | PR-2 PR-20 PR-200 PR-1000 | |
| Micropipette tips (assorted sizes) | VWR international | 30128-376 53503-810 16466-008 | |
| Luria Broth Base, Miller | Difco | 241420 | |
| Disposable Culture Tubes Borosilicate Glass | VWR international | 47729-576 | |
| S-500 Orbital Shaker | VWR international | 14005-830 | |
| Centrifuge | VWR international | 37001-300 | |
| PBS pH 7.4 10X | Invitrogen | 70011044 | |
| SmartSpec 3000 Spectrophotometer | Bio-Rad | 170-2501 | |
| Semimicrovolume Cuvettes | Bio-Rad | 223-9955 | |
| Vertical Capillary Puller | Kopf Needle Pipette Puller | ||
| 3.5'' Replacement glass Capillaries for Nanojet II | Drummond Sientific Company | 3-000-203-G/X | |
| Nanoject II | Drummond Sientific Company | 3-000-204 | |
| Forceps | Fine Science Tools | 11255-20 | |
| 10 ml Syringe | BD | 309604 | |
| Mineral Oil, White, light | Macron Fine Chemicals | 6358-10 | |
| Minutein pins | Fine Science Tools | 26002-10 | |
| 1.5 ml Microcentrifuge tubes; Seal Rite | USA Scientific Inc. | 1615-5500 | |
| Motorized Pestle; Talboys Laboratory Stirrer | Troemner | 103 | |
| Talboys High Throughput Homogenizer | OPS Diagnostics | 930145 | |
| 5/32'' Grinding Balls | OPS Diagnostics | GBSS 156-5000-01 | |
| Vortex Genie | Scientific indurstries inc. | G560 | |
| Multichannel Pipettor (10 μl - 300 μl) | Sartorius | 730360 | |
| WASP2 Whitley Automated Spiral Plater | Microbiology International | ||
| ProtoCOL automated colony counter / plate counter/ plate reader | Microbiology International | ||
| TRIzol | Life Technologies | 15596-026 | |
| qPCR tubes; Low-Profile 0.2 ml 8-Tube Strips | Bio-Rad | TLS0801 | |
| qPCR caps; Optical Flat 8-Cap Strips | Bio-Rad | TCS0803 | |
| RQ1 RNase-Free DNase | Promega | m610a | |
| M-MLV Reverse Transcriptase | Promega | m170b | |
| dNTPs | Promega | U1240 | |
| Oligo-dT | IDT | ||
| SsoAdvanced SYBR Green Supermix | Bio-Rad | 172-5260 | |
| CFX Connect Real-Time PCR Detection System | Bio-Rad | 185-5200 | |
| RNasin Ribonuclease Inhibitor | Promega | N2115 |
References
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual review of immunology. 25, 697-743 (2007).
- Dionne, M. S., Schneider, D. S. Models of infectious diseases in the fruit fly Drosophila melanogaster. Disease models & mechanisms. 1 (1), 43-9 (2008).
- Rutschmann, S., Jung, A. C., Hetru, C., Reichhart, J. M., Hoffmann, J. A., Ferrandon, D. The Rel protein DIF mediates the antifungal but not the antibacterial host defense in Drosophila. Immunity. 12 (5), 569-580 (2000).
- Ayres, J. S., Freitag, N., Schneider, D. S. Identification of Drosophila mutants altering defense of and endurance to Listeria monocytogenes infection. Genetics. 178 (3), 1807-1815 (2008).
- Cronin, S. J. F., et al. Genome-wide RNAi screen identifies genes involved in intestinal pathogenic bacterial infection. Science. 325 (5938), 340-343 (2009).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. , (2014).
- Dionne, M. S., Pham, L. N., Shirasu-Hiza, M., Schneider, D. S. Akt and FOXO dysregulation contribute to infection-induced wasting in Drosophila. Current biology CB. 16 (20), 1977-1985 (2006).
- McKean, K. a., Yourth, C. P., Lazzaro, B. P., Clark, A. G. The evolutionary costs of immunological maintenance and deployment. BMC evolutionary biology. 8 (1), 76 (2008).
- Kuo, T. -. H., Pike, D. H., Beizaeipour, Z., Williams, J. A. Sleep triggered by an immune response in Drosophila is regulated by the circadian clock and requires the NFkappaB Relish. BMC neuroscience. 11, 17 (2010).
- Panayidou, S., Ioannidou, E., Apidianakis, Y. Human pathogenic bacteria, fungi, and viruses in Drosophila: disease modeling, lessons, and shortcomings. Virulence. 5 (2), 253-269 (2014).
- Keebaugh, E. S., Schlenke, T. A. Insights from natural host–parasite interactions: The Drosophila model. Developmental & Comparative Immunology. 42 (1), 111-123 (2014).
- Howick, V. M., Lazzaro, B. P. Genotype and diet shape resistance and tolerance across distinct phases of bacterial infection. BMC evolutionary biology. 14 (1), 56 (2014).
- Babin, A., Kolly, S., Kawecki, T. J. Virulent bacterial infection improves aversive learning performance in Drosophila. Brain, behavior, and immunity. , (2014).
- Chambers, M. C., Song, K. H., Schneider, D. S. Listeria monocytogenes infection causes metabolic shifts in Drosophila melanogaster. PLoS ONE. 7 (12), e50679 (2012).
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular ecology. 19 (7), 1462-1468 (2010).
- Stone, E. F., Fulton, B. O., Ayres, J. S., Pham, L. N., Ziauddin, J., Shirasu-Hiza, M. M. The circadian clock protein timeless regulates phagocytosis of bacteria in Drosophila. PLoS pathogens. 8 (1), e1002445 (2012).
- Chambers, M. C., Jacobson, E., Khalil, S., Lazzaro, B. P. Thorax injury lowers resistance to infection in Drosophila melanogaster. Infection and immunity. , (2014).
- Rich, J. T., Neely, J. G., Paniello, R. C., Voelker, C. C. J., Nussenbaum, B., Wang, E. W. A practical guide to understanding Kaplan-Meier curves. Otolaryngology--head and neck surgery official journal of American Academy of Otolaryngology-Head and Neck Surgery. 143 (3), 331-336 (2010).
- Sokal, R. R., Rohlf, F. J., Freeman, W. H. . Biometry. , (1995).
- Frydman, H. Wolbachia bacterial infection in Drosophila. Journal of visualized experiments JoVE. (2), 158 (2007).
- Kuo, T. -. H., Handa, A., Williams, J. A. Quantitative measurement of the immune response and sleep in Drosophila. Journal of visualized experiments JoVE. (70), e4355 (2012).
- Vodovar, N., et al. Drosophila host defense after oral infection by an entomopathogenic Pseudomonas species. Proceedings of the National Academy of Sciences of the United States of America. 102 (32), 11414-11419 (2005).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS pathogens. 3 (11), e173 (2007).
- Jaenike, J., Polak, M., Fiskin, A., Helou, M., Minhas, M. Interspecific transmission of endosymbiotic Spiroplasma by mites. Biology. 3 (1), 23-25 (2007).
- Kanbar, G., Engels, W. Ultrastructure and bacterial infection of wounds in honey bee ( Apis mellifera) pupae punctured by Varroa mites. Parasitology research. 90 (5), 349-354 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved