Method Article
全身細菌感染や免疫防御表現型
要約
Drosophila melanogaster is an outstanding model organism for studying innate immune systems and the physiological consequences of infection and disease. This protocol describes how to deliver robust and quantitatively repeatable bacterial infections to D. melanogaster, and how to subsequently measure infection severity and quantify the host immune response.
要約
果実はキイロショウジョウバエは、免疫防御の機能と進化を研究するための最高のモデル生物の一つで飛びます。自然免疫の多くの側面は、昆虫および哺乳動物の間で保存され、 ショウジョウバエを容易に遺伝的および実験的に操作することができるので、それらは免疫系の機能と疾患の生理学的影響を研究するための強力です。ここで実証された手順は、上皮障壁と防衛のより受動的な形態をバイパスし、全身感染にフォーカスを可能にする、直接体腔内に細菌を導入することによってハエの感染を可能にします。手順は、ホストの死亡率、全身病原体負荷、および宿主免疫系の誘導の程度の測定速度のためのプロトコルを含みます。この感染手順は、安価で堅牢で再現性がある定量的、および機能的遺伝学、進化の生活史、および生理学の研究に使用することができます。
概要
フルーツフライ、キイロショウジョウバエは、免疫防御の機能と進化を研究するための最高のモデル生物の一つである。 ショウジョウバエ 、安価で、背面に簡単で、実験操作に非常に適している、と幅広いを開発した大規模な科学コミュニティが付いています研究ツールの配列。 Toll様受容体によって媒介されるシグナル伝達およびNF-kBのファミリー転写因子、JAK / STATシグナル、およびJNK経路の応答を含む、昆虫、哺乳類間で保存されている自然免疫の多くの側面。1,2これらの遺伝子および経路の機能することができますDに照会しますショウジョウバエの変異を使用して、またはRNAiは、その増減経路活動をノックダウン3 - 。さらに6、 ショウジョウバエは、進化の生活史理論の文脈を含め、感染および疾患の生理学的結果を研究するために使用することができます7。- 9すべてのこのような研究は、しかし、確実に定義された処理条件の下で実験的なハエに感染する能力に依存します。ここで説明する手順は、 キイロショウジョウバエに堅牢かつ反復細菌感染を配信し、その後、感染の重症度を測定し、宿主免疫応答を定量化するための方法論的枠組みを提示します。
ショウジョウバエは、天然及び実験細菌、真菌、ウイルス、線虫および寄生蜂の寄生生物および病原体を含む多種多様なにより感染され得ます。現在のプロトコルは、全身細菌感染を提供することに焦点を当てています。多くの異なる細菌は、ハエに感染させるために使用することができ、実験者の選択が求められている正確な科学的質問に基づくべきです。例えば、ヒトの臨床分離株は、細菌の病原性機構10を研究するために使用され得る、または生態学的に関連する分離株はpreferreであってもよいです進化の研究のためのD。11一部の細菌は、Dの有能な病原体でありますショウジョウバエ、感染時に増殖し、ホスト病気や死を引き起こします。他の細菌は、効果的に宿主の免疫系によって管理され、数日以内にクリアされます。このデモでは、 プロビデンシアrettgeriは、ホストの死亡率の原因となり、ホストの存続に固執することができる増殖性病原体として使用されます。 大腸菌は、宿主免疫系によってクリアされた非病原体として使用されます。
感染は直接ハエの体腔内への細菌の導入によって確立されます。このアプローチは関係なく、変速機の固有モードの全身感染の調査を可能にする、上皮障壁や防御行動をバイパスします。実験的に全身感染を確立するための2つの主要な方法があります。最初にナノインジェクタと引っ張らガラスキャピラリ針の正確な数を注入するために使用されハエへの細菌。この方法は、感染用量の大きなダイナミックレンジを可能にし、定量的に高度に反復可能であるという利点を有します。第2のアプローチは、敗血症性針を刺したの感染を提供することです。この手法は、迅速であり、かつ特別な装置を必要としないという利点を有します。感染が確立されると、それは全身の病原体負荷、ホスト死亡率、および誘導性免疫系の活性を測定することが可能となります。もちろん、追加の表現型の任意の数の考えられる感染D.で測定することができ感染後の産卵数12、学習能力13、代謝状態14、または想像することができ、実質的に任意の他の形質を含むメラノ 。
プロトコル
1.ハエを収集し、準備します
- リアD.希望の実験条件下でメラノ 。飼育中にハエが混雑し、幼虫期中の環境条件が深く大人の段階で免疫防御表現型に影響を与えることができるので、幼虫密度は、治療間で一貫していることを確認してくださいしないように注意してください。15
- 蛹のケースから3日後に羽化し、新鮮な培地にそれらを転送する - 0実験ハエを収集します。
- ポスト羽化7日 - 彼らは5歳になるまで家は、所望の温度で収集したハエは(22℃と28℃の間の温度は、一般的に適切です)。
注:これは変態を完了し、成熟した大人になるためのハエのための十分な時間を可能にするが、老化が始まる前によくあります。 - 再び過密を避けるように注意しながら、感染前に別のバイアルの中にハエの希望数を並べ替えます。
注:唯一のMAレこのデモで感染が、記載された手順を用いて、女性に感染することも可能であるしています。
2.文化や細菌を準備
- 少なくとも2日間感染前に選択された細菌のマスタープレートを準備します。ストリーク-80℃で無期限に保存された15%のグリセロールストックからの細菌。 2週間まで4℃でのマスタープレートを保管してください。常にストリーク凍結グリセロールストックから直接マスタープレート。文化の中で繰り返される通路は、細菌が弱毒性を進化させることができるように、プレートにプレートからの細菌の連続継代を避けます。
注:この例では、 プロビデンシアrettgeri大腸菌を利用します。 - 注射のために細菌懸濁液を準備するために、次の手順を実行します。
- マスタープレートから単離された単一コロニーを滅菌培地に接種することにより、細菌の2ミリリットルの文化を育てます。 例えば (固定相への細菌を育てます O / Nの増加)。
注:両方のP.穏やかに振盪しながら37℃ - rettgeri、大腸菌は 20の温度でルリアブロスでよく育ちます。 - 培養が定常期に達した後、緩やかに約から細胞をペレット化。卓上遠心分離機での培養の600μlの(5,000×gで3分間)、上清を捨て、そして約内の細菌を再懸濁します。滅菌リン酸緩衝生理食塩水1,000μL(PBS; 137mMの塩化ナトリウム、2.7mMの塩化カリウム、10mMののNa 2 PO 4、1.8mMのKH 2 PO 4、pH値= 7.4)。
- 600 nmの吸光度として分光光度計で測定使用される細菌のための適切な光学密度(OD)を達成するために、滅菌PBS中で再懸濁した細胞を希釈します。ハエに感染させるためにこの懸濁液を使用します。
注:600 = 0.1または1.0は、約10 8〜10 9 プロビデンシアrettgeriまたはEにそれぞれ対応します1ml当たり大腸菌 。両方が住んでいるのでND死菌は光学密度に貢献、それは細菌の死体が蓄積する前に、初期の定常期における培養を収穫し、光学密度および感染の間に導入された生菌数との関係を歪曲することが重要です。
- マスタープレートから単離された単一コロニーを滅菌培地に接種することにより、細菌の2ミリリットルの文化を育てます。 例えば (固定相への細菌を育てます O / Nの増加)。
3.ハエに感染
NOTE: ショウジョウバエ免疫は概日リズムに影響されるように、それは実験の反復を横切る日の同様の時間で感染を行うことが重要である16。
3.1)ナノインジェクタを使用しました
- 感染のためにガラス針を準備します。
- マイクロピペットプラーを使用してホウケイ酸ガラスキャピラリーを引いて、ガラス針を準備します。
- 鉗子を使用して、液体の吐出を可能にするために約50ミクロンの直径の開口部を作成するために、針の先端を断ちます。
- インジェクタを組み立てます。
- シールOリング、次に白SPを配置エイサーは、金属プランジャー上に(大ディンプルは外側に向かって)。
- 30 G針と注射器を使用して、鉱物油とガラス針を埋めます。
- コレットを介して充填されたガラス針を入れ、針の鈍端から約1mm、その基部の周りに大きなOリングを配置します。
- 金属プランジャ上に針をスライドさせ、ゆっくりと安全なまでコレットのネジ。
- インジェクタからミネラルオイルのほとんどを取り出し、それでもインジェクタと細菌懸濁液との間の障壁として機能するように、針中の油の小容量があることを確認してください。空気の泡が鉱物油や細菌懸濁液中の、または二つの液体の間がないことを確認します。
- (9 NLと50 NLの間の)注射のための所望の体積に注射器を設定します。
- 負傷のコントロールを生成します。
- 注意深く培地とpressiのチューブにキャピラリ針の先端を挿入することにより、滅菌PBSで注射器の針を塗りつぶしインジェクタの「塗りつぶし」ボタンをngの。
注記:この実験は、それらの増殖培地中に懸濁した細菌の注入を必要とする場合、滅菌細菌増殖培地はまた、創傷コントロールを使用することができます。細菌の増殖培地は、免疫系を刺激するか、ホスト上の他の効果を有することができる成分を含んでいるのでしかし、PBSなどの不活性担体が好ましいです。 - CO 2の光の流れの下でハエの希望数を麻酔し。
- 滅菌PBSで腹外側表面上の前方腹部にハエを注入します。
注:これは、このような胸部のsternopleural板などの他の部位でのハエを注入することも可能であるが、それは各実験内で一貫注射部位を維持することが重要である17 - ハエの全てまで、彼らの側にバイアルを敷設、新しいメディアとの新鮮なバイアルに注入したハエを置き、食品にこだわっなってからハエを防ぐために、麻酔から回復しました。
注:これは、同じ針が両方の処置のために使用することができるように、実験的なハエへの細菌を注入する前に、PBS対照ハエを注入することをお勧めします。それは、常に全体の実験のために、同じ針を使用できないことがあります。その場合には、その統計的分析の実験因子として針IDを含むように飛ぶと一緒に使用した針を記録することが望ましい場合があります。
- 注意深く培地とpressiのチューブにキャピラリ針の先端を挿入することにより、滅菌PBSで注射器の針を塗りつぶしインジェクタの「塗りつぶし」ボタンをngの。
- 細菌性病原体を注入します。
- インジェクタから残りの滅菌メディアを取り出し、細菌懸濁液と同じ針を補充します。
- 今の手順2.2で調製した細菌懸濁液でハエを注入し、上記の手順(3.1.3)を繰り返します。
3.2)浄化槽針を刺したと
- 穿刺用の針を準備します。
- 200μlのマイクロピペットチップの先端を溶融し、溶融プラスチックに0.15ミリメートル昆虫minutienピンを挿入します。プラスチックはSUを固化することを許可しますピンがプラスチックから延びるピンの約0.5センチメートルで所定の位置に保持されているCH。
- 負傷のコントロールを生成します。
- CO 2の光の流れの下でハエの希望数を麻酔し。
- 翼と脚の結合部位を避けて、針で胸部のsternopleural板でハエを刺します。必要に応じて、優しくソフトな鉗子を使用してminutienピンからハエを除去。
注:これは、このような腹外側表面上の前部腹部など他のサイト、でハエを刺すことも可能ですが、それは各実験内で一貫注射部位を維持することが重要である17腹部のクチクラを通して穿刺よりになる傾向があります胸部の刺すため、あまり一般的であるよりも難しいです。 - ハエのすべてがBEからハエを防ぐために、麻酔から回復するまで、その側にバイアルを敷設、新しいフライ媒体を新鮮なバイアルに刺しハエを置き食品にこだわってきます。
- 細菌感染をご紹介します。
- CO 2の光の流れの下でハエの希望数を麻酔し。
- それぞれがそれぞれのフライを刺す前に、手順2.2で調製した細菌懸濁液にピンの先端を浸漬、メディアのコントロールと同じ場所に飛んで刺します。
- その側にバイアルを敷設、新しいフライ媒体を新鮮なバイアルに刺しハエを置き、食品にこだわっなってからハエを防ぐために、麻酔から回復したハエの全てまで。
3.3)感染量は、配信を評価します
- 手順3.1または3.2のいずれかに上記のようにハエのセットを感染のみの代わりに、麻酔から回復するために食品のバイアルにハエを返し、それぞれが氷上でマイクロ遠心チューブに飛んで配置します。
- 各チューブに250μlのPBSを加え、乳棒またはビーズビーターを使用してハエのいずれかを均質化します。
- LB寒天プレート上にホモジネートをプレート、いずれかのスパイラルプレーターまたは連続希釈を使用して。
- 連続希釈を用いて、プレートに、96ウェルプレートの最初の行に、各フライホモジネートを転送します。
- PBSの90μlの残りの行の各ウェルを埋めます。
- マルチチャンネルピペットを使用して、ホモジネートを飛び、2行目に分配含む最初の行から10μLを取ります。
- ピペットは、上下に少なくとも10回は、完全に混合し、その後、10μLを取り、3行目に転送します。残りの行を使用してこの手順を繰り返します。
- 一番下の行から(ほとんどの細菌懸濁液を希釈)、サンプルが互いに接触しない個別のスポットとして分配されることに注意しながら、各ウェルのLBプレート上の堆積物から10μLを取るためにマルチチャンネルピペットを使用しています。全てのウェルは、LBプレート上に希釈の降順にそれらを分配する、各行からサンプリングされるまで繰り返します。
- スポットは完全にLBプレートに浸漬するまで、室温でプレートにしておきます。
注:使用前に室温で数日間LBプレートの乾燥は、サンプルスポットとの間の偶発的な接触の可能性を最小限に抑え、液体を容易に吸収されていることを確認することをお勧めします。
- コロニーは小さく、個別の残るようにプレートを過剰成長しないように注意しながら、O / N培養します。
注:使用する細菌の増殖培地およびインキュベーション温度に依存して、ハエの内因性の腸内細菌叢から由来するコロニーは、最終的にプレートに表示されることがあります。しかし、病原性の感染のために使用されるほとんどの細菌は、37℃でLB寒天上腸内微生物叢よりもはるかに速く成長します。 - 実験的細菌が見えるコロニー成長しているインキュベーターからプレートを取り外します(典型的には8から12時間)が、 ショウジョウバエ腸内細菌叢のコロニーは(約36時間)表示されるまでに。成長の遅い実験細菌については、選択を使用します腸内細菌叢から任意のコロニーを除去するLB寒天中の抗生物質。
- 各ホモジネートのためのコロニーの数を数えます。
- スパイラルプレートは、プレート上のコロニーの数と位置に基づいてホモジネート1ml当たりの細菌負荷を推定することができる自動コロニーカウンターを用いて成長するコロニーをカウントします。
注:細菌濃度は、1mlあたり5×10 2〜4×10 5の細菌の範囲内にあるときにスパイラル数が最も正確です。 - スポットプレートの場合は、手動で希釈が30含まれている方から、各フライ用のコロニーカウント - 300個のコロニーを、元のホモジネート1ml当たりの細菌の数を計算します。
- スパイラルプレートは、プレート上のコロニーの数と位置に基づいてホモジネート1ml当たりの細菌負荷を推定することができる自動コロニーカウンターを用いて成長するコロニーをカウントします。
感染の4特徴付けサバイバー
- アッセイ死亡後噴射。
- 12時12 LIGと新鮮なバイアルに感染したハエや負傷したコントロールを配置し、所望の温度のインキュベーターに維持する(25°CHT:暗サイクルを推奨)。それは15以上の生活ハエをカウントすることが困難になるような単一バイアルに15以上のハエを入れないでください。
- 毎日の生活と死んだハエの数をカウント、またはより頻繁に適切な場合。
- 、食品の品質を維持するため、定期的に新しい食べ物にハエを反転させるために。
- バイアルは男性のみが含まれている場合は、3日ごとに新鮮なバイアルに移します。バイアルは、女性が含まれている場合は、幼虫の子孫が、その大人のハエが立ち往生し、感染による死亡の過大評価率をもたらすことができるリスクを増加させる、食品を液化しますので、2日ごとに新鮮なバイアルに移します。
- データを統計的に分析します。
- 個人が測定された時点注射後に生存する確率を示すカプランマイヤー曲線としてプロット生存。交差しない生存曲線18は 、ログランクTを使用して対比較を行いますEST(もマンテルコックステストと呼ばれる)、または、いくつかの要因とその相互作用を組み込むことができるコックス比例ハザードモデルを使用して、より複雑な分析を行います。交差生存曲線については、成層コックス分析を行う。17
5.アッセイ細菌感染後のロード
- 細菌負荷を測定します。
- 所定時間後の注射では、感染の過程で細菌負荷を決定するために、感染用量を評価するために使用される手順を繰り返し(プロトコル3.3を参照)。
注: - ミリリットル100,000細菌細菌懸濁液が1000の範囲内に収まるようにスパイラルプレーターを使用している場合、ホモジネートを希釈します。
- 所定時間後の注射では、感染の過程で細菌負荷を決定するために、感染用量を評価するために使用される手順を繰り返し(プロトコル3.3を参照)。
- データを分析します。
- 細菌負荷が非正常であれば、より良い正規分布に近似またはノンパラメトリック統計分析( 例えば、マン·ホイットニーU検定)を使用してデータを分析するためにデータを変換するのいずれか。 FへのBox-Coxの分析を使用してください最適な変換をindは。自然対数またはベース-10ログ変換は、多くの場合、効果的である。19
- データが十分に正常に配布され、対比されている唯一の2つの処理がされている場合は、2つの処理が異なる平均細菌負荷をもたらすかどうかを判断するためのt検定を行います。複数の実験的変数または他の潜在的予測因子が存在する場合、因子が細菌負荷の有意な予測因子であるかを決定するために分散分析(ANOVA)を使用。19
免疫系遺伝子の6アッセイ転写活性化
- 粗感染後の免疫活性化を可視化するために、前述のように抗菌ペプチド遺伝子からのプロモーターの制御下で緑色蛍光タンパク質(GFP)を発現するトランスジェニックハエを感染18
- 蛍光可能な顕微鏡下で感染したハエを見ます。 GFPの誘導はvisibになるべき感染後10時間 - 第6内の脂肪体でル。
- 免疫活性化のより正確な定量化のために、抗菌ペプチド遺伝子の転写産物の存在量を測定するために、cDNAテンプレート(定量RT-PCR)で定量PCRを使用しています。
注:免疫遺伝子の発現が(または前)感染後の任意の時点で測定することができます。一般的に言えば、免疫遺伝子発現の誘導は、次の24時間かけて注入し、増加した後、約4時間を開始します。- CO 2を使用してハエを麻酔。
- 各RNA抽出用のマイクロチューブに15ハエを置きます。
注:これは、各処理条件のために少なくとも3つの複製サンプルを収集することをお勧めします。 - ハエからRNAを抽出し、標準的な手順または市販のキットのうちのいずれかを使用して、第一鎖cDNAを生成します。 -80℃で保存したRNA。数週間の期間のための-20℃での長期保存のための-80℃で保存したcDNA。 RNA抽出の前に、店舗F-80℃です。
- cDNAをテンプレートとして使用して、目的の標的遺伝子の定量的PCR(定量PCR)を行います。抗菌ペプチド遺伝子Diptericin A、Drosomycin、デフェンシン、Attacin A、およびMetchnikowinならびに(もrpL32として知られている)のハウスキーピング制御遺伝子rp49を増幅するためのプライマー配列については表1を参照してください。
注:抗菌ペプチドDiptericin AとDrosomycinをコードする遺伝子は、Dの非常に良好な読み出しを提供しますそれぞれ、IMDとトール経路を介して、主に誘導された免疫活性をショウジョウバエ 。サンプル間のRNA収量の変動と逆転写の効率を制御するために、その発現がそのようなrp49(またRPLとして知られているような感染に変化しないと予想される基準ハウスキーピング遺伝子に対する標的遺伝子の記録された発現を標準化32)。 - データを分析します。 <オール>
- 発現差の概算については、のように算出された各サンプルについて、参照遺伝子( 例えば、rp49)から入手したSQ値に試験遺伝子( 例えば、Diptericin A)相対(から得られた出発量(SQ)値の比を計算しますSQ - DPTA / SQ - rp49)。このような非感染ハンドリング制御などのベースライン対照治療にこれらの比率を拡大縮小。任意に1.0に等しい制御発現レベルを設定し、相対的な倍率変化などの実験治療を可視化します。既知量のcDNAの希釈系列から作成した標準曲線に対する各遺伝子のSQ値を推定します。
注:比率の統計的分析は、複雑になる場合がありますので、このアプローチは、厳密な分析のためのより迅速な近似のためのより良いです。 PCR効率が低い場合には、可能な場合はPCR反応速度を向上させるために、新しいプライマーを設計します。完璧に近い効率(広告付きqPCR反応のためのPCR産物のoublingサイクル毎)、閾値サイクル(C T)は SQ値に置換することができます。 - 最適に効率的な増幅を有する簡単な実験では、データは、ΔΔCT法を用いて分析することができる。19を各試料について、試験遺伝子のC T( 例えば、Diptericinから参照遺伝子のC T値 ( 例えば、rp49)を差し引きますA)ΔCTを得ました。その後、各サンプルのΔΔCT値を生成する各実験サンプルについてΔCTからベースラインコントロールのΔCTを引きます。このΔΔCT 2(-ΔΔCT) は発現の倍数変化を近似する処理、との間の遺伝子発現レベルの相対的な差の指標です。
注:試験遺伝子または参照のいずれかのPCRの場合、標的遺伝子の発現におけるこの分析することができますひどく誤った評価倍率変化遺伝子は、効率が低いです。 - 最も厳密な分析のために、応答変数として試験遺伝子( 例えばDiptericin A)の推定式や説明変数として制御遺伝子( 例えば、rp49)と他の実験要因の推定式を用いて、分散分析(ANOVA)を行っています。
注:この方法は、PCR増幅中の非効率性に比較的強く、より複雑な実験計画の分析を可能にします。
結果
このセクションでは、1感染用量を注入するために使用される細菌懸濁液の光学濃度に応じて変化することを示す図 。キイロショウジョウバエの細菌感染後に得られる結果を示しており、確実に均質化し、めっきすることによって推定することができる送達用量は、注射直後に飛ぶこと。 図2に示すように、異なる病原体は、宿主の死亡率( 図2A)の異なるレベルを引き起こすことができ、宿主の死亡率は、用量依存的( 図2B)とすることができます。重要なのは、このプロトコルは、達成すべき感染症の様々なタイプを可能にする: プロビデンシアrettgeriは 20日以上( 図3A)持続する慢性、亜致死感染を引き起こす可能性があります。しかし、Escerichiaコリのような他の細菌は、ほとんどが6時間後に感染( 図3B)内のホストフライによってクリアされます。免疫SYSの誘導TEMは、抗菌性ペプチド転写物( 図4AおよびB)のRNAの単離およびその後の定量RT-PCRによって推定することができます。同様あまり定量的、免疫系( 図4C)の誘導を可視化するために使用することができる抗菌ペプチド遺伝子プロモーターの制御下でGFPを発現するハエ。
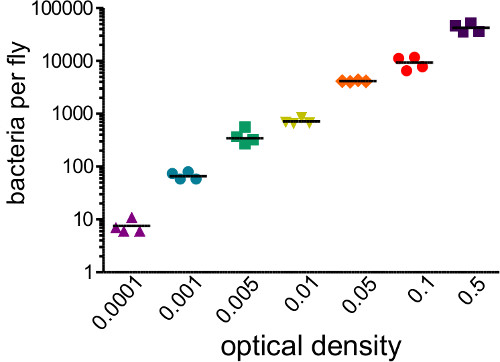
。図1:感染量を決定するハエは、光学密度(0.0001から0.05)の範囲をカバーする細菌懸濁液の50 NLを注射しました。ハエは、すぐに注射によって導入細菌の数を決定するために、均質化し、プレーティングしました。初期の細菌負荷が強く、初期ODが注入さと相関した(r 2 = 0.96)
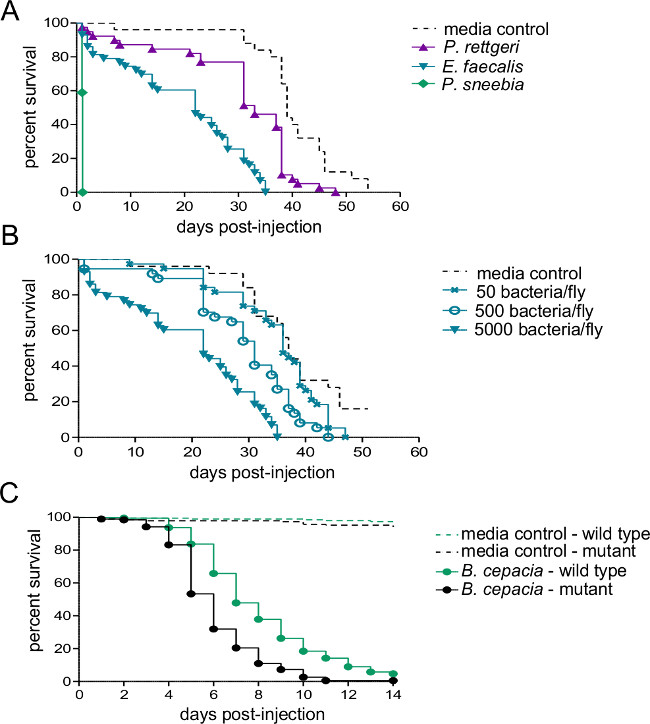
図2:生存細菌性病原体の注射後には5〜7日齢の雄は、細菌懸濁液または滅菌媒体のいずれかの50 NLを注射し、生存をモニターしました。 (A)野生型のハエは、3つの異なる種のいずれかからの約5,000の細菌を注射しました。ホストの死亡率は、感染のために使用細菌種に大きく依存します。 50、500、およびフライ5,000細菌- (B)野生型のハエは、3つの異なるEnterococcousフェカリスの投与量を注射しました。免疫系の変異体およびその野生型同質遺伝子の制御線は約500 セパシア菌を注射した高い感染量(C)に感染したときにハエがより早く死にます。ペアごとのログランク比較は、野生型のハエは、変異体よりも有意に良好感染(χ2 = 59.02、DF = 1、P <0.0001)が生き残っていることを示しています。
キープtogether.withinページ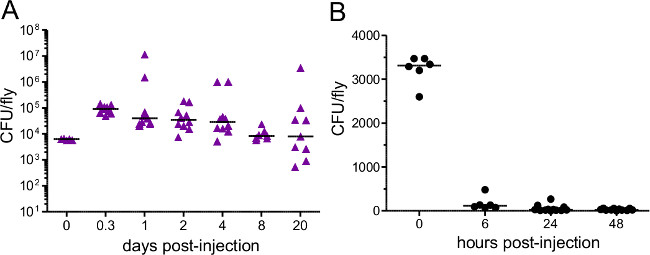
図3:注入後の細菌負荷ハエは約(A)5,000 P.注射しましたrettgeri(B)3,400 E.大腸菌 。細菌負荷は、注射直後及びその後の様々な時点で測定しました。各データ点は、単一のハエの細菌負荷を表す。E. P.ながらコリを速やかに挑戦ホストからクリアされますrettgeriは、ホストの人生の残りのために持続します、。
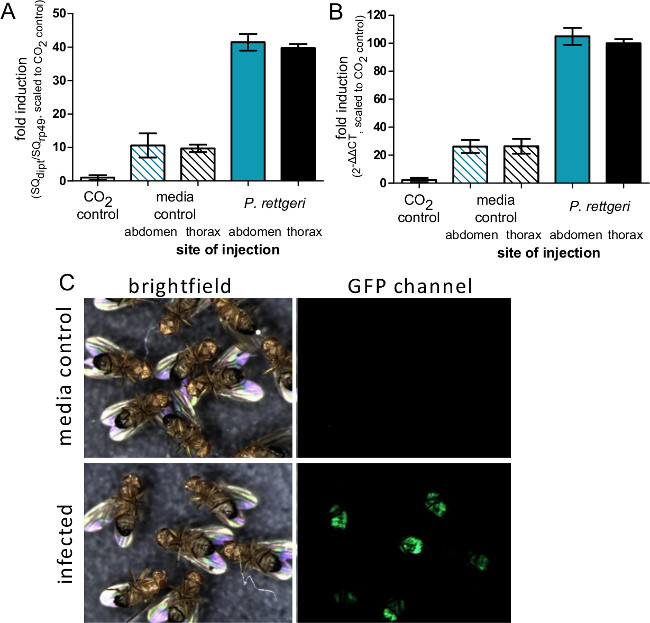
図4:注射後の免疫遺伝子発現の誘導 。 (A)ハエはP. 50 NLを注射しました腹部や胸部のいずれかでrettgeriまたは滅菌PBS、 またはCOは別に操作されていない残っていました 2麻酔UB。六時間の感染後、ハエ遺伝子は定量RT-PCRを用いて決定したDiptericinのRNAの単離および発現のために収集しました。 (A)の発現レベルは、Diptericinの比としてrp49転写物に転写物をグラフ化し、N(CO 2制御をバーは、各条件の比率の平均値と標準誤差を表す1の発現レベルを有するとして定義されるようにスケーリングされ= 4)。 (B)発現レベルは、標準的な非誘導条件としてCO 2 aesthesia制御ハエからの平均C T値との2ΔΔCTとしてグラフ化されています。バーは、各条件からΔΔCTの平均値と標準誤差を表す(N = 4)。による注射部位への転写誘導に差がないが、パネルAおよびBの比較は、ΔΔCT法は、潜在的に誘導レベルを過大評価する方法を示しています。 (Cは)Diptericin Aプロモーターの制御下でGFPを発現しているハエは、Pの50 NLを注射しましたその後rettgeri(OD = 0.1)および7日後に画像化しました。 GFPパネルはDiptericinの活性化細菌に感染したハエ中のプロモーターではなく、メディアを注射のコントロールを示し、感染したハエの腹部脂肪体におけるGFPの発現を示します。
| 遺伝子 | フォワード | リバース |
| rp49(もrpL32呼ばれます) | 5 'AGGCCCAAGATCGTGAAGAA 3' | 5 'GACGCACTCTGTTGTCGATACC 3' |
| Diptericin A | 5 'GCGGCGATGGTTTTGG 3' | 5 'CGCTGGTCCACACCTTCTG 3' |
| Drosomycin | 5 'CTGCCTGTCCGGAAGATACAA 3 ' | 5 'TCCCTCCTCCTTGCACACA 3' |
| デフェンシン | 5 'GAGGATCATGTCCTGGTGCAT 3' | 5 'TCGCTTCTGGCGGCTATG 3' |
| Attacin A | 5 'CGTTTGGATCTGACCAAGG 3' | 5 'AAAGTTCCGCCAGGTGTGAC 3' |
| Metchnikowan | 5 'AACTTAATCTTGGAGCGATTTTTCTG 3' | 5 'ACGGCCTCGTATCGAAAATG 3' |
表1:定量RT-PCRのためのプライマー。
ディスカッション
ここで説明する手順は、 キイロショウジョウバエの厳格な、高品質の感染をもたらします。図示の例は、主にプロビデンシアrettgeriとEでの感染に焦点を当て大腸菌が、プロトコルは、高度に適応可能であり、ホストの飼育および維持条件の範囲に亘って多様な細菌の感染に適用することができます。
最適な実験的アプローチの詳細については、感染のために使用される細菌は、宿主の遺伝子型、および全体的な実験条件に依存するであろう。それは強く、新しい実験条件より野心的なプロジェクトを開始する前に、パイロットテストに推奨されます。出発点は、100倍の範囲にわたって3感染用量を試験することです。フライあたり100細菌細胞 - 高病原性の病原体は、多くの場合、最善の10程度で、非常に低い感染量で導入されます。より穏やかな病原体は、FLあたり約1,000の細菌の高用量で注入することができますyおよび非病原体フライ10,000細菌などの高用量で注射することができます。これは、縦方向の時系列の上に病原体負荷、ホストの死亡率、および免疫系の活動を追跡することによって、新たな感染症の動態を定義することがしばしば有益です。病原体負荷および宿主遺伝子発現の測定は、破壊的なアッセイであるので、測定されるすべての時点について、実験の開始時に異なるハエに感染することが必要です。
針を刺しまたはマイクロキャピラリーベースの注入を使用するかどうかを決定する際には、各アプローチには利点と制限があります注意することが重要です。キャピラリー注入は両方が適度膨圧を増加させ、担体中に懸濁または溶解された塩またはその他の分子を導入するハエへの液体の量を導入します。キャピラリー注射も注入設備や必要な機器の購入にアクセスする必要があります。浄化槽の針を刺しは、特別な機器や紹介を必要としません無視できる程度のフライにメディア、一般的にハエを大量に感染させるための、より効率的です。しかし、針で刺す感染症は、毛細管注入で達成することができる感染量を正確に制御することはできません。本プロトコルは、機械的に注入量を調節する噴射装置に焦点を当てたが、加圧された空気の離散パルスに基づいて噴射システムも存在する。20,21、これらは一般的に装置は、ここで紹介さよりも高価であり、それぞれの空気パルスのキャリブレーションを必要とします一貫性の注入量を確保するために、針。
ハエは、野生での細菌と全身感染する方法にかなりの議論が、非常に少ないデータがあります。一部の研究者は、 ショウジョウバエの病原性細菌を摂取するとき、自然感染の大部分が発生し、細菌が、その後全身感染を確立するために、腸を脱出することができることを断定します。しかし、非常にFEがありますD.の腸を横断できることが知られている細菌のw ショウジョウバエ 、およびこの能力を持っているものは、ハエ22,23に対して非常に致死的です。代替理論は、定期的に失敗した捕食試行または外部寄生虫ダニによる攻撃からの脱出を介してクチクラ負傷飛ぶことです。この仮説は、野生Dの頻繁なコレクションでサポートされていますメラノ治癒創傷(未発表の観察)の指標であるメラニンのスポットを有します。ダニは、 ショウジョウバエ 24で細菌感染を送信することが示されており、ダニが残した傷は二ミツバチ25中の細菌に感染することができます。しかし、Dのダニ·ドリブンまたはその他の日和見感染症の自然の中で、周波数キューティクルの侵害を介してメラノは知られていません。ここで説明するプロトコルは、直接、任意の上皮障壁または行動IMMUをバイパスし、定量注入による血リンパへの細菌の導入を可能にします無限大。 Dに病原性細菌を供給するための方法ショウジョウバエは Vodovar ら 22及びNehme ら 23に記載されています。
多くの昆虫病原性細菌は、研究者が快適に彼らと一緒に作業できるように、ほとんど、あるいは全く人間の健康上のリスクをもたらします。また、非常に少数の細菌が実験介入なしに接触したショウジョウバエに感染する能力、その汚染された表面を介して実験室を介して細菌感染の「流行」の広がりの危険性を持っているか、一般的に非常に低いハエを脱出しました。それにもかかわらず、適切な封じ込め対策が逃げるの感染ハエを防ぐために、所定の位置に、任意のハエを免れ奪還するためのものであることを保証することをお勧めします。研究室では、使用されている病原体のそれに見合った生物学的に安全なレベルで装備されるべきであり、微生物学における標準的なベストプラクティスを採用すべきです。
実験infectiここに記載の方法に任意の細菌のいずれかの用量でキイロショウジョウバエの感染を可能にします。感染が確立されると、それは、細菌の増殖またはクリアランスの速度を測定するために宿主の死亡率を追跡するため、および宿主免疫系の誘導をアッセイすることは簡単です。感染したハエは、容易に形作るか、または感染によって成形することが生理学的機能の試験を含む他の表現型アッセイにかけることができます。記載された手順は、安価で比較的少ない特殊な装置を必要とし、容易に研究と教育ラボの幅全体で多様なプロジェクトでの使用に適して作り、学習されます。
開示事項
None of the authors have competing interests or conflicting interests.
謝辞
We would like to thank the entire Lazzaro lab, and especially Susan Rottschaefer, for their help in both reviewing and testing these protocols. This is a product of their cumulative expertise. Work in the Lazzaro lab is supported by grants R01 AI083932 and R01 AI064950 from the US National Institutes of Health.
資料
| Name | Company | Catalog Number | Comments |
| Incubator | Powers Scientific, Inc | DROS52SD | |
| Paintbrush | |||
| CO2 Flypads | FlyStuff | 59-114 | |
| CO2 | Airgas | CD FG50 | |
| Drosophila rearing mix | |||
| 6 oz Square Bottom Bottles, polypropylene | Genesee Scientific | 32-130 | |
| Nosterile Extra Large Cotton Balls | Fisher brand | 22-456-882 | |
| Microscope | Olympus Corporation | SZ51 | |
| Drosophila Vials polystyrene | VWR international | 89092-720 | |
| Nosterile Large Cotton Balls | Fisher brand | 22-456-883 | |
| 2 L flask | VWR international | 89000-370 | |
| Petri Dishes with Clear Lids, Raised Ridge; 100 x 15 mm; | VWR international | 25384-302 | |
| LB Agar, Miller | Difco | 244520 | |
| Innoculing Loop | VWR international | 80094-488 | |
| Rainin Clasic Pipettes in various sizes 0.1 µl to 2 µl, 2 µl to 20 µl, 20 µl to 200 µl, 100 µl to 1,000 µl | Rainin | PR-2 PR-20 PR-200 PR-1000 | |
| Micropipette tips (assorted sizes) | VWR international | 30128-376 53503-810 16466-008 | |
| Luria Broth Base, Miller | Difco | 241420 | |
| Disposable Culture Tubes Borosilicate Glass | VWR international | 47729-576 | |
| S-500 Orbital Shaker | VWR international | 14005-830 | |
| Centrifuge | VWR international | 37001-300 | |
| PBS pH 7.4 10X | Invitrogen | 70011044 | |
| SmartSpec 3000 Spectrophotometer | Bio-Rad | 170-2501 | |
| Semimicrovolume Cuvettes | Bio-Rad | 223-9955 | |
| Vertical Capillary Puller | Kopf Needle Pipette Puller | ||
| 3.5'' Replacement glass Capillaries for Nanojet II | Drummond Sientific Company | 3-000-203-G/X | |
| Nanoject II | Drummond Sientific Company | 3-000-204 | |
| Forceps | Fine Science Tools | 11255-20 | |
| 10 ml Syringe | BD | 309604 | |
| Mineral Oil, White, light | Macron Fine Chemicals | 6358-10 | |
| Minutein pins | Fine Science Tools | 26002-10 | |
| 1.5 ml Microcentrifuge tubes; Seal Rite | USA Scientific Inc. | 1615-5500 | |
| Motorized Pestle; Talboys Laboratory Stirrer | Troemner | 103 | |
| Talboys High Throughput Homogenizer | OPS Diagnostics | 930145 | |
| 5/32'' Grinding Balls | OPS Diagnostics | GBSS 156-5000-01 | |
| Vortex Genie | Scientific indurstries inc. | G560 | |
| Multichannel Pipettor (10 μl - 300 μl) | Sartorius | 730360 | |
| WASP2 Whitley Automated Spiral Plater | Microbiology International | ||
| ProtoCOL automated colony counter / plate counter/ plate reader | Microbiology International | ||
| TRIzol | Life Technologies | 15596-026 | |
| qPCR tubes; Low-Profile 0.2 ml 8-Tube Strips | Bio-Rad | TLS0801 | |
| qPCR caps; Optical Flat 8-Cap Strips | Bio-Rad | TCS0803 | |
| RQ1 RNase-Free DNase | Promega | m610a | |
| M-MLV Reverse Transcriptase | Promega | m170b | |
| dNTPs | Promega | U1240 | |
| Oligo-dT | IDT | ||
| SsoAdvanced SYBR Green Supermix | Bio-Rad | 172-5260 | |
| CFX Connect Real-Time PCR Detection System | Bio-Rad | 185-5200 | |
| RNasin Ribonuclease Inhibitor | Promega | N2115 |
参考文献
- Lemaitre, B., Hoffmann, J. The host defense of Drosophila melanogaster. Annual review of immunology. 25, 697-743 (2007).
- Dionne, M. S., Schneider, D. S. Models of infectious diseases in the fruit fly Drosophila melanogaster. Disease models & mechanisms. 1 (1), 43-9 (2008).
- Rutschmann, S., Jung, A. C., Hetru, C., Reichhart, J. M., Hoffmann, J. A., Ferrandon, D. The Rel protein DIF mediates the antifungal but not the antibacterial host defense in Drosophila. Immunity. 12 (5), 569-580 (2000).
- Ayres, J. S., Freitag, N., Schneider, D. S. Identification of Drosophila mutants altering defense of and endurance to Listeria monocytogenes infection. Genetics. 178 (3), 1807-1815 (2008).
- Cronin, S. J. F., et al. Genome-wide RNAi screen identifies genes involved in intestinal pathogenic bacterial infection. Science. 325 (5938), 340-343 (2009).
- Neyen, C., Bretscher, A. J., Binggeli, O., Lemaitre, B. Methods to study Drosophila immunity. Methods. , (2014).
- Dionne, M. S., Pham, L. N., Shirasu-Hiza, M., Schneider, D. S. Akt and FOXO dysregulation contribute to infection-induced wasting in Drosophila. Current biology CB. 16 (20), 1977-1985 (2006).
- McKean, K. a., Yourth, C. P., Lazzaro, B. P., Clark, A. G. The evolutionary costs of immunological maintenance and deployment. BMC evolutionary biology. 8 (1), 76 (2008).
- Kuo, T. -. H., Pike, D. H., Beizaeipour, Z., Williams, J. A. Sleep triggered by an immune response in Drosophila is regulated by the circadian clock and requires the NFkappaB Relish. BMC neuroscience. 11, 17 (2010).
- Panayidou, S., Ioannidou, E., Apidianakis, Y. Human pathogenic bacteria, fungi, and viruses in Drosophila: disease modeling, lessons, and shortcomings. Virulence. 5 (2), 253-269 (2014).
- Keebaugh, E. S., Schlenke, T. A. Insights from natural host–parasite interactions: The Drosophila model. Developmental & Comparative Immunology. 42 (1), 111-123 (2014).
- Howick, V. M., Lazzaro, B. P. Genotype and diet shape resistance and tolerance across distinct phases of bacterial infection. BMC evolutionary biology. 14 (1), 56 (2014).
- Babin, A., Kolly, S., Kawecki, T. J. Virulent bacterial infection improves aversive learning performance in Drosophila. Brain, behavior, and immunity. , (2014).
- Chambers, M. C., Song, K. H., Schneider, D. S. Listeria monocytogenes infection causes metabolic shifts in Drosophila melanogaster. PLoS ONE. 7 (12), e50679 (2012).
- Fellous, S., Lazzaro, B. P. Larval food quality affects adult (but not larval) immune gene expression independent of effects on general condition. Molecular ecology. 19 (7), 1462-1468 (2010).
- Stone, E. F., Fulton, B. O., Ayres, J. S., Pham, L. N., Ziauddin, J., Shirasu-Hiza, M. M. The circadian clock protein timeless regulates phagocytosis of bacteria in Drosophila. PLoS pathogens. 8 (1), e1002445 (2012).
- Chambers, M. C., Jacobson, E., Khalil, S., Lazzaro, B. P. Thorax injury lowers resistance to infection in Drosophila melanogaster. Infection and immunity. , (2014).
- Rich, J. T., Neely, J. G., Paniello, R. C., Voelker, C. C. J., Nussenbaum, B., Wang, E. W. A practical guide to understanding Kaplan-Meier curves. Otolaryngology--head and neck surgery official journal of American Academy of Otolaryngology-Head and Neck Surgery. 143 (3), 331-336 (2010).
- Sokal, R. R., Rohlf, F. J., Freeman, W. H. . Biometry. , (1995).
- Frydman, H. Wolbachia bacterial infection in Drosophila. Journal of visualized experiments JoVE. (2), 158 (2007).
- Kuo, T. -. H., Handa, A., Williams, J. A. Quantitative measurement of the immune response and sleep in Drosophila. Journal of visualized experiments JoVE. (70), e4355 (2012).
- Vodovar, N., et al. Drosophila host defense after oral infection by an entomopathogenic Pseudomonas species. Proceedings of the National Academy of Sciences of the United States of America. 102 (32), 11414-11419 (2005).
- Nehme, N. T., et al. A model of bacterial intestinal infections in Drosophila melanogaster. PLoS pathogens. 3 (11), e173 (2007).
- Jaenike, J., Polak, M., Fiskin, A., Helou, M., Minhas, M. Interspecific transmission of endosymbiotic Spiroplasma by mites. Biology. 3 (1), 23-25 (2007).
- Kanbar, G., Engels, W. Ultrastructure and bacterial infection of wounds in honey bee ( Apis mellifera) pupae punctured by Varroa mites. Parasitology research. 90 (5), 349-354 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved