Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una nueva aplicación de la eléctrica Penetración Gráfico (EPG) para la adquisición y medición de señales eléctricas en el floema Tamiz Elementos
En este artículo
Resumen
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Resumen
Propiedades electrofisiológicas de las células se estudian a menudo in vitro, después de disociar desde sus ambientes nativos. Sin embargo, el estudio de la transmisión eléctrica entre las células distantes en un organismo requiere in vivo, grabaciones libres de artefactos de células embebidas dentro de su entorno nativo. La transmisión de señales eléctricas de herida de áreas ilesos en una planta ha puesto mucho despertado el interés de los botánicos. El floema, la parte viva de la vasculatura planta que se extendió por toda la planta, se ha postulado como un pañuelo de papel importante en la transmisión eléctrica en las plantas. La falta de métodos electrofisiológicos adecuados plantea muchos retos para el estudio de las propiedades eléctricas de las células del floema en vivo. Aquí presentamos un nuevo enfoque para la electrofisiología intracelular de elementos de tamiz (PE) que utiliza los áfidos vivos o de otros insectos hemípteros de alimentación floema, integrada en el gra penetración eléctricaph (EPG) de circuito. La versatilidad, robustez y precisión de este método han permitido registrar y estudiar en detalle las señales eléctricas inducidas por la herida en las SE de las venas centrales de la planta modelo Arabidopsis thaliana 1. Aquí nos muestran que la EPG-electrodos se pueden implementar fácilmente intracelulares registros electrofisiológicos de las PE en las venas marginales, así como para el estudio de la capacidad de las PE a responder con señales eléctricas a varios estímulos externos. El enfoque EPG aplicado a electrofisiología intracelular de PE puede ser implementado a una amplia variedad de especies de plantas, en un gran número de combinaciones de plantas / insectos, y para muchos de investigación pretende.
Introducción
La capacidad de producir señales eléctricas de larga distancia es un rasgo ventajoso de los organismos multicelulares que permite respuestas eficientes a los estímulos externos. Este rasgo ha evolucionado independientemente en plantas y animales, y por lo tanto representa un caso de evolución convergente. Dado que las señales eléctricas se acoplan con funciones importantes en animales tales como la transmisión neural y la contracción muscular, la base molecular, el mecanismo de transmisión, y la función de señales eléctricas estímulos inducidos en animales son sujetos de investigación intensiva. Por el contrario, los estímulos inducidos por la señalización eléctrica en plantas ha recibido poca atención de la investigación. Aunque las plantas no tienen nervios o músculos, parece que hay suficiente evidencia para suponer que las señales eléctricas estímulos inducidos en las plantas juegan un papel clave en sus respuestas a los factores ambientales.
El floema, el componente viviente de la vasculatura de la planta, se ha postulado como un sub importanteStrate para la transmisión de señales eléctricas estímulos inducidos, desde estimulado / dañado a las áreas no estimulados / 2 no dañadas. Las principales células del floema son los elementos de criba (SES), células relativamente simple, alargados. Los extremos de las PE están conectados a otra SE, formando una baja resistencia continua, sistema de tubos de tamiz que se extendió por toda la planta. Hay, sin embargo, muy pocos estudios sobre las propiedades eléctricas de estas células altamente especializadas. En estos estudios anteriores, los investigadores acceder a las PE, ya sea con vidrio micro-electrodos 3 estiletes o con electrodos de vidrio que fueron acoplados a plantar insertados-de áfidos, después stylectomy (corte) 4. Microelectrodos de vidrio están hechos de capilares de vidrio que se extraen en un extremo con calor en una punta fina de menos de 1 micra de diámetro, y luego se llena con una solución de KCl. A Ag / AgCl o platino alambre, se inserta en el electrodo de vidrio llenos de KCl se conecta entonces a la entrada del amplificador, y un referenteelectrodo se inserta en el baño que rodea a la célula de interés, completando el circuito. Esta configuración registra la diferencia de potencial entre el electrodo extracelular referente y el electrodo de medición intracelular, es decir, el potencial de membrana de la célula 5. Con este método, Umrath hizo la primera grabación intracelular de una célula de planta, utilizando las algas Nitella 6,7. Nitella es un organismo relativamente simple con células grandes, y por lo tanto susceptibles de experimentos de electrofisiología intracelulares. En contraste, la inserción de electrodos de vidrio intracelulares en las pequeñas células de plantas terrestres multi-celulares, tridimensionales es técnicamente exigente, requiere un investigador altamente cualificado, así como la visualización sofisticado, micromanipulación, y equipo anti-vibración. Aunque electrodos de vidrio son adecuados para grabar a partir de células superficiales en plantas, tales como células epidérmicas de la raíz 8, recordin intracelulargs de células profundamente arraigados en el tejido de la planta, tales como las SE, las respuestas inducidas por daños por causas muy probables, confundiendo los resultados. En 1989, Fromm y Eschrich informaron el uso de un método alternativo, llamado el "método pulgón ', en la que los electrodos de vidrio se acoplan a estiletes áfidos después stylectomy 4. El método áfido es mínimamente invasivo, porque estiletes flexibles no causan daño tejido o célula como electrodos de vidrio hacen. Estiletes áfidos son gran invento de la naturaleza para la penetración de la planta, y los áfidos son considerablemente más hábiles que los seres humanos en la búsqueda de la SE. Desafortunadamente, este método pulgón también es muy exigente en términos de experiencia y el equipo técnico. Además, el éxito de cada experimento que implementa esta técnica depende enteramente de la áfido estar en modo de alimentación - con el estilete insertado en una forma estable SE, en el momento de stylectomy. Pensando en retrospectiva, uno puede ver que las probabilidades de éxito de esta técnica podría haber sido improved mediante la adición a la configuración experimental de un instrumento que permite identificar si o no el estilete áfido está en el SE al aplicar stylectomy.
En 1964, McLean y Kinsey describen un "sistema de vigilancia electrónica" para el estudio del comportamiento de alimentación de los pulgones en tiempo real 9,10. En este sistema, el pulgón y la planta estilete-penetrado fueron integrados en un circuito eléctrico. Más tarde, en 1978, Tjallingii ideó una versión modificada del sistema, llamado sistema 'eléctrico Penetración Graph' (EPG) 11,12. Considerando que el sistema de monitorización electrónica original era sensible a los potenciales de resistencia originada solamente, con el sistema EPG, la fuerza electromotriz (fem) se originó potenciales, es decir, generados en la planta o en el insecto, se podrían registrar además de los potenciales derivados de la resistencia (R) en el insecto. Esto representa una mejora importante, debido a que tanto la señal de componentes, fem y R,proporcionar biológica información pertinente sobre los acontecimientos durante la penetración planta por áfidos. Lo que hace que el preamplificador EPG sensibles a los componentes R es su relativamente baja resistencia de entrada de 1 GΩ, que es cerca de la media de la resistencia de la planta / pulgón. Una tensión de offset pequeño (Figura 1, V) de aproximadamente 100 mV se aplica a la planta, que luego se divide a través de plantas e insectos en un lado, y la resistencia de entrada en el otro. Las tensiones y sus cambios se miden en un punto (Figura 1A, B) entre el insecto y la resistencia de entrada. Por lo tanto, los componentes R representan modulaciones de resistencia-áfido de plantas de la tensión de offset, mientras que los componentes son emf una cierta fracción de los potenciales de la planta en la punta del estilete y potenciales causados en el insecto. Los potenciales de plantas - más relevantes aquí - son potenciales principalmente de membrana de las células vegetales pinchados por los estiletes de áfidos. Los potenciales de insectos parecen ser principalmentelos potenciales de transmisión causados por los movimientos de fluidos dentro de los dos canales del estilete, es decir, la comida y los canales salivales; no hay potenciales de los nervios o músculos internos se registran en la EPG. En la práctica, las funciones de la punta del estilete como una punta de electrodo. Todas las células vegetales están cargados negativamente en el interior respecto al exterior positivo de la célula. La corriente eléctrica (es decir, el movimiento de iones cargados en solución acuosa) que fluye desde el interior hacia el exterior y vice versa es muy limitada debido a la alta resistencia de la membrana celular. Normalmente, el potencial de reposo se mantiene constante. Sin embargo, cuando los iones negativos se mueven hacia fuera o iones positivos se mueven a través de la membrana celular, el potencial de membrana se reduce, es decir, es despolariza '. La despolarización se produce en el caso de la excitación celular. Los iones entonces se mueven dentro o fuera cuando los canales de iones específicos en la membrana se abren o cuando la membrana está dañada y los iones de fugas dentro y fuera. Todas las células tienen canales iónicos y bombas en tque la membrana plasmática que llevar el potencial de membrana a su nivel de reposo mediante la restauración de la concentración original de diversos iones dentro de la célula. El potencial de reposo y sus cambios son componentes emf, y por lo tanto, la técnica de EPG es adecuado para medir ellos.
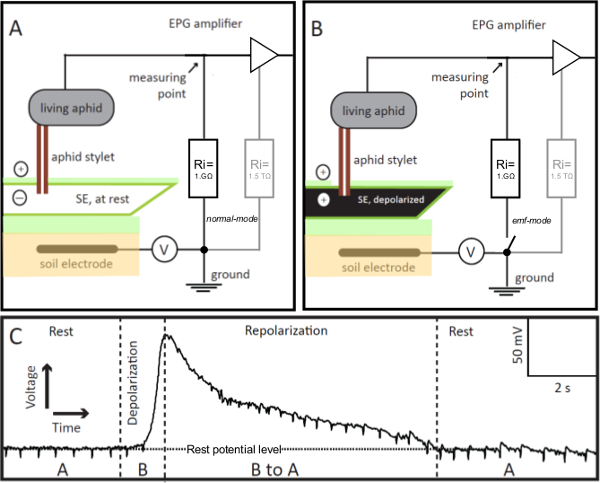
Figura 1. EPG-electrodos. La EPG-electrodo es un áfido de estar integrado en el circuito eléctrico Penetración Graph (EPG), cuyo estilete se inserta en un elemento de tamiz (SE) en el modo de alimentación estable. Si el estilete SE-empalado está en reposo (panel A), el voltaje en el circuito, registrado por EPG, es estable y en el nivel de potencial de reposo (Panel C, Rest). Si la SE es excitado, sus despolariza la membrana (panel B), que se visualiza en la EPG como un incremento gradual en el voltaje (panel C, despolarización). Como el equilibrio iónico en la SE vuelve a descansar, es decir, repolarizes, la tensión registrada por EPG disminuye gradualmente al nivel potencial de reposo (Grupo C, repolarización). En el panel C, "A" y "B" se refieren a los escenarios que se muestran en los paneles A y B, respectivamente. V = Ajustable fuente de tensión de offset. Ri = resistencia de entrada. En paralelo a la resistencia externa 1 GΩ, el amplificador tiene una interna (en el OpAmp) de alta resistencia de 1,5 TΩ (paneles A y B, en gris). Por control remoto del interruptor de la pre-amplificador EPG se puede cambiar de normal a EMF-mode, que permite obtener valores de tensión de alta precisión. Por favor, haga clic aquí para ver una versión más grande de esta figura.
En la siguiente sección, ofrecemos al lector con un protocolo básico para la realización de experimentos de EPG que es válido tanto para los estudios de insectos centrado y enfocado en plantas.
Protocolo
1. Pulgón Crianza
Nota: La elección de las especies vegetales y de áfidos para grabaciones EPG depende de la finalidad de la investigación. Para los estudios en Arabidopsis thaliana, el brassicae Brevicoryne pulgón es apropiado.
- Posterior B. áfidos brassicae en un invernadero en Brassica oleracea. Mantener las plantas utilizadas para la cría de áfido en jaulas, con el fin de evitar la contaminación de otras plantas. Mantenga las plantas de áfidos crianza y plantas experimentales (en nuestro caso B. oleracea y A. thaliana) en habitaciones separadas, con el fin de evitar la contaminación de las plantas experimentales con pulgones.
- Traslado áfidos de las plantas frescas sobre cada 2 semanas, antes de causar daños a las plantas significativa, o llegar a la superpoblación. Traslado 10-20 pulgones adultos a una planta de cría fresco para iniciar una nueva colonia.
- Supervisar la crianza plantas regularmente para la contaminación por especies no deseadas de áfidos, otros insectos herbívoros, parasitoides de áfidos y fungi que puedan afectar a la salud de la colonia de áfidos.
- Recoger adultos, áfidos sin alas hasta una semana después de su última muda para la grabación EPG.
- Después de los experimentos, devolver las plantas experimentales que no estaban acostumbrados a la cámara de crecimiento, ya que a menudo tienen algún descendiente que se ha producido durante la grabación, que inadvertidamente podría contaminar otras plantas.
2. Insecto de cableado para la grabación EPG
- Para electrodos de insectos, obtener patillas del conector de latón (clavos, Ø 1,2 mm), alambre de cobre fino (Ø 0,2 mm), de alambre de oro muy fina (aprox Ø 20 micras), pegamento plata a base de agua, un perno de soldadura pequeño y sencillo con fluido de soldadura y alambre de soldadura con núcleo de resina, microscopio estereoscópico con aumento 10X, pequeñas tijeras o bisturí, dos pinzas finas, y una hoja de espuma de poliestireno o caja. Nota: Un mezclador de vórtice podría ser útil. Nota: El protocolo paso a paso para hacer electrodos se indica en la Figura 2.
- Para áfidomanipulación y aplicación de cola, obtenemos: un pequeño cepillo de pelo de camello y suave acuarela (tamaño 2 o menor) y los pasadores de insectos tales como los utilizados para colecciones de insectos, aunque una aguja de coser fino o palillo de dientes pueden funcionar tan bien. Paso 4 muestra cómo iniciar la grabación EPG.
- Paso 1.
Nota: Los pasos 1 y 2 a continuación muestran cómo preparar electrodos de insectos menos el pulgón. Paso 3 muestra cómo conectar un áfido al electrodo. Se recomienda vacío fijación del pulgón durante el cableado, pero no siempre se requiere para las especies de movimiento lento (por ejemplo, B. brassicae).- Encienda el perno de soldadura y derretir un poco de alambre de soldadura en la punta (Figura 2A). Humedezca la cabeza de la clavija de conexión de latón con un poco de líquido de soldadura (Figura 2B) e introducirlo en la soldadura de metal fundido (Figura 2C).
- Aplicar una funda de metal de soldadura fundida en un extremo de una pieza larga 1-2 cm del alambre de cobre fino (Figura2D). Luego, lleve el alambre pasador y cobre juntos contra el perno caliente (Figura 2E) y moverlos juntos lejos enfriar y solidificar (Figura 2F).
- Paso 2.
- Agite (o vórtice) el vial con pegamento plata durante varios minutos hasta que se muestre una emulsión suave. Cut (tijeras o bisturí) algunas piezas de alambre de oro (de aproximadamente 1,5 cm de longitud) en la placa objeto de la estereoscópico (Figura 2G).
- Tome un pin de latón con hilo de cobre soldada (hecho en la sección 2.3) y sumergir el extremo libre del cable de cobre en el pequeño depósito de cola de plata que se han reunido en el interior de la tapa del vial después de abrirlo (Figura 2H). Nota: Sólo se necesita una pequeña gota.
- Mueva el extremo de cola de cruce del hilo de cobre a la pieza de hilo de oro, mientras levanta un extremo para evitar manchar el pegamento sobre la placa objeto estereomicroscopio. Trate de solapar copper y alambre de oro para unos pocos mm (Figura 2I), distribuyendo el pegamento a lo largo de la superposición de los dos cables.
- Espere hasta que el pegamento se haya secado lo suficiente para mantener los cables unidos. Compruebe el contacto del pegamento después del secado y añadir un poco de pegamento fresco con un pequeño alfiler u otro trozo de alambre de cobre, si algunas partes de los cables unidos muestran partes sin pegamento.
- Después de que el electrodo de insectos está listo, almacenarla, por ejemplo se inserta en un pedazo de espuma de poliestireno.
Nota: La longitud del hilo de oro determinará la libertad de movimiento del pulgón: si es demasiado corto (menos de 5 mm), el pulgón puede sentirse limitado y no comportarse normalmente; si es demasiado largo (> 2 cm), el áfido se moverá libremente. Los áfidos tienden a moverse hacia el lado adaxial de las hojas, si se le permite. Si el hilo de oro toca la hoja, la señal estará en cortocircuito.
- Paso 3.
- El pulgón puede mantenerse en su lugar por medio de succión luz, usando un vacío; en este caso, instalar tque succionar dispositivo bajo el microscopio estereoscópico. Coloque la abertura de aspiración en el centro del campo.
- Agite el vial con pegamento plata durante varios minutos (o torbellino) hasta que se forma una emulsión suave. Reunir un áfido con el cepillo pequeño.
- Encienda el dispositivo de succión y montar el pulgón de la abertura de succión (Figura 2J), con la parte posterior del abdomen se volvió hacia el experimentador. Con el pincel fino, eliminar cualquier cera de la superficie del abdomen (abundante en los áfidos de col).
- Abra el vial pegamento y mojar un pasador con una muy pequeña gota de pegamento de plata (Figura 2K). Aplicar la gotita de la cola de plata en la parte posterior del abdomen de la áfido (Figura 2L-M). Que esta gotita completamente seco durante varios minutos, agitar enérgicamente el vial pegamento de nuevo y añadir una segunda gota de pegamento de plata en la parte superior de la primera. Nota: Mientras que el pegamento de plata es un conductor eléctrico, que no causa significativadaños a la cutícula del insecto.
- Después de cerrar el frasco de pegamento, inserte el extremo libre del alambre de oro en la gotita húmedo y mantener el cable todavía al tiempo que permite que el pegamento se seque por completo (Figura 2 N). Evite manchar pegamento en las piernas o antenas y descartar un áfido si esto ha sucedido.
- Apague el dispositivo de fijación de succión y levante con cuidado el insecto (Figura 2O). Si es necesario, utilizar un pincel fino para ayudar en el levantamiento del áfido del dispositivo de succión.
Nota: El cableado B. brassicae no requiere un vacío, ya que pueden ser cableados en una pieza de un tejido de precisión de laboratorio, la superficie rugosa de las cuales proporciona el pulgón con suficiente agarre de modo que no será levantado después de aplicar una gota de pegamento húmedo a su abdomen. Después del secado el pegamento se puede levantar el áfido del tejido con la ayuda de un pincel fino. - Inserte el pasador de latón con el insecto por cable en la espuma de poliestireno y, si es necesario, continuarel cableado de todos los otros insectos que se utilizará para la sesión de grabación EPG.
Nota: Estos protocolos para el cableado de áfidos funcionan bien para nosotros. El usuario puede encontrar a su / su propio método para el cableado de los áfidos.
- Paso 4.
- Ponga plantas en la jaula de Faraday (Figura 2P) sobre un soporte no conductor: utilizar placas de Petri o una placa de vidrio o plástico.
- Inserte un electrodo de planta en el suelo de cada maceta. Inserte el pasador de bronce del insecto por cable en el conector de entrada del preamplificador EPG (Figura 2Q). Nota: el electrodo de suelo no se corresponde con el electrodo de tierra utilizado en otras técnicas electrofisiológicas. Tiene la tensión de desplazamiento necesario para ajustar y compensar las tensiones de polarización del electrodo.
- En la interfaz del software de adquisición de estilete +, con frecuencia de muestreo fijo de 100 Hz, introduzca un nombre de archivo, especifique el tiempo de grabación, y escribir texto para especificar los detalles del experimento (tratamiento, planta / inse especies ct, etc.) en líneas de comentario 2 y 3.
- Baje los insectos en una zona de aterrizaje adecuada de la planta e iniciar la sesión de grabación haciendo clic en el botón Inicio de la interfaz de software de adquisición (estilete +).
Nota 1: un máximo de 8 canales se puede utilizar de forma simultánea en una EPG configurar. Una EPG-electrodo o varios electrodos de EPG por planta pueden ser utilizados.
Nota 2: cuando el enfoque del estudio es el comportamiento de áfidos, iniciar la grabación antes de acceso a la planta de los pulgones para evitar perder las primeras actividades de penetración de la planta. - Para el estudio de las respuestas electrofisiológicas de las PE a los estímulos, espere por lo menos 10 minutos después de que el pulgón ha entrado en fase de floema, con el fin de garantizar que el pulgón se encuentra en una fase de la ingestión floema sostenida, y que la línea de base de la señal es estable. Sólo entonces, comenzar cualquier experimento estimulación planta.
tp_upload / 52826 / 52826fig2.jpg "/>
Figura 2. Hacer EPG-electrodos con pulgones y otros insectos hemípteros de gráfico penetración eléctrica (EPG) grabaciones. Haga clic aquí para ver una versión más grande de esta figura.
Paneles de AI, los pasos necesarios para preparar la EPG-electrodos menos el pulgón. En primer lugar, fundir una pieza de metal de soldadura en la punta de un perno de soldadura (A). Luego, sumerja la cabeza del pasador de latón en una gota de líquido de soldadura (B), y póngase en contacto con el metal fundido en la punta del perno de soldadura (C). Inmediatamente después de este paso, póngase en contacto con el extremo de un cable de cobre a la punta del perno de soldadura, con el fin de la cola a la cabeza del pasador de latón (EF). Con un bisturí o una cuchilla, cortar un trozo de alambre de oro (G). Inmersiónel extremo libre del hilo de cobre (unido en el otro extremo a la clavija de latón) en el pegamento de plata (H), y rápidamente se unen al alambre de oro a él (I) antes de la plata se seca. El alambre de oro es un excelente conductor, y puede ser polarizada. En realidad, en la mayoría de los casos la polarización es demasiado pequeño para ser detectado, y si es así, puede ser compensada con la tensión de offset (V).
Paneles JO, los pasos necesarios para conectar un áfido (u otro insecto hemipteran) al electrodo. En primer lugar, levante con cuidado un áfido con un pincel de acuarela fino y colocarlo en la apertura del dispositivo de succión de vacío (J). Encienda la bomba de vacío y cubra el orificio de la válvula de aire con un pedazo de papel para aplicar succión. Sumerja la punta del pasador de insectos en la cola de plata (K), y poner una pequeña gota de pegamento en la parte superior del abdomen del pulgón, bajo un microscopio estereoscópico (LM). Dentro depróxima ~ 20 seg, antes de la gota de pegamento de plata en que se seque el pulgón, inserte el extremo del hilo de oro del electrodo de insectos en la gotita húmedo de cola de plata, y mantenerlo en su lugar durante 1-3 minutos, hasta que el pegamento plata tiene completamente seca al aire (N). En este punto, deshabilitar aspiración quitando el pedazo de papel que cubre el agujero de la válvula de aire del dispositivo de succión y retire con cuidado el pulgón, desde el dispositivo de aspiración: levantar el pulgón después cableado menudo requiere un poco de ayuda de un pincel fino (O).
Panel P muestra una vista general de toda la EPG configurado dentro de la jaula de Faraday, y Panel Q muestra una visión general de la combinación planta-áfido de EPG. Vea la sección 2 más arriba para una explicación más detallada de este proceso.
Las letras minúsculas son etiquetas que se refieren a los elementos que uno tiene que hacer EPG-electrodos: a: perno de soldadura; b: fundió el metal de soldadura;c: El líquido de soldadura; d: latón pin conector (uñas); e: alambre de cobre; f: hilo de oro 18μm Ø; g: dispositivo de succión; h: pulgón; i: pegamento plata a base de agua; j: Jaula de Faraday; k: electrodo planta; l: conector de entrada (BNC) de la pre-amplificador EPG.
Resultados
En un estudio anterior, se implementó la técnica de EPG-electrodo con el fin de caracterizar las señales eléctricas producidas en las SE de la vena media durante el ataque de oruga 1. El nervio central es un sitio de inserción preferido para electrodos de vidrio convencionales, así como para los electrodos de vidrio-estilete, porque es SE-densa, relativamente robusto y, por lo tanto susceptible a la fijación necesaria para la aplicación de estas técnicas. Aquí, nos aprovechamos de la versatilidad de...
Discusión
Este artículo proporciona un protocolo detallado para la toma eléctrica Penetración Gráfico (EPG) grabaciones. La técnica EPG está bien establecida, con 100 a 200 usuarios activos en todo el mundo, y se ha implementado para muchos estudios sobre diferentes temas, por ejemplo: a) resistencia de la planta huésped de pulgones y otros insectos portadores de estilete 13; mecanismos de transmisión b) virus de plantas y patógenos 14; c) el modo de insecticidas de acción, (toxicidad y cambios de ...
Divulgaciones
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
Agradecimientos
VSR fue apoyado por una subvención Marie Curie del IIF (HERIDA EN LA TIERRA, acrónimo de: Herida inducida por señales eléctricas en Arabidopsis thaliana).
Materiales
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Referencias
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados