Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une nouvelle application de l'électrique pénétration Graphique (EPG) pour l'acquisition et la mesure des signaux électriques dans le phloème Sieve Elements
Dans cet article
Résumé
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Résumé
Propriétés électrophysiologiques des cellules sont souvent étudiés in vitro, après les dissocier de leurs environnements natifs. Cependant, l'étude de la transmission électrique entre les cellules lointaines dans un organisme nécessite in vivo, des enregistrements sans artefact de cellules intégrées dans leur environnement natif. La transmission des signaux électriques à partir blessé aux zones non blessés dans une usine a depuis longtemps suscité l'intérêt des botanistes. Le phloème, la partie vivante de la vascularisation de la plante qui se propage dans toute la plante, a été postulé comme un tissu important dans la transmission électrique dans les usines. L'absence de méthodes électrophysiologiques appropriés pose de nombreux défis pour l'étude des propriétés électriques des cellules du phloème in vivo. Ici, nous présentons une nouvelle approche pour l'électrophysiologie intracellulaire des éléments de tamis (SE) qui utilise les pucerons vivants, ou d'autres insectes hémiptères phloème alimentation, intégrée dans la pénétration gra électriqueph (EPG) circuit. La polyvalence, la robustesse et la précision de cette méthode ont permis d'enregistrer et d'étudier en détail les signaux électriques induits plaies dans les SE des veines centrales de la plante modèle Arabidopsis thaliana 1. Ici, nous montrons que les EPG-électrodes peuvent être facilement mises en œuvre pour les enregistrements électrophysiologiques intracellulaires des SE dans les veines marginales, ainsi que d'étudier la capacité des PME à répondre avec des signaux électriques à plusieurs stimuli externes. L'approche EPG appliquée à l'électrophysiologie intracellulaire de SE peut être mise en œuvre à une grande variété d'espèces végétales, dans un grand nombre de combinaisons plantes / insectes, et pour beaucoup, la recherche vise.
Introduction
La capacité de produire des signaux électriques à longue distance est un trait avantageux d'organismes multi-cellulaires qui permet des réponses efficaces à des stimuli externes. Ce trait a évolué de façon indépendante dans les plantes et les animaux, et représente donc un cas d'évolution convergente. Étant donné que les signaux électriques sont couplés avec des fonctions importantes chez les animaux tels que la transmission neuronale et la contraction musculaire, la base moléculaire, le mécanisme de transmission, et en fonction de signaux électriques induits stimulus chez l'animal sont des sujets de recherche intensive. En revanche, induite stimulus-signalisation électrique dans les usines a reçu peu d'attention de la recherche. Bien que les plantes ont pas de nerfs ou des muscles, il semble y avoir suffisamment de preuves pour supposer que les signaux électriques induits relance dans les plantes jouent un rôle clé dans leurs réponses à des facteurs environnementaux.
Le phloème, la composante vivante de la vascularisation de la plante, a été postulé comme un sous majeureStrate pour la transmission de signaux électriques induits par stimulus, de stimulé / endommagé dans des zones non stimulées / 2 non endommagés. Les principales cellules du phloème sont les éléments de tamis (SES), des cellules simples et relativement allongées. Les extrémités de SES sont connectés à d'autres PME, la formation d'une, de faible résistance continue, le système de tube tamis qui se propage dans toute la plante. Il ya, cependant, très peu d'études sur les propriétés électriques de ces cellules hautement spécialisées. Dans ces études précédentes, les chercheurs accessibles SE soit avec verre micro-électrodes 3 stylets ou avec des électrodes de verre qui ont été couplées à planter-insérés de pucerons, après stylectomy (coupe) 4. Microélectrodes de verre sont fabriqués à partir de capillaires en verre qui sont tirés à une extrémité avec la chaleur en une fine pointe de moins de 1 m de diamètre, puis remplis avec une solution de KCl. Un Ag / AgCl ou de platine métallique, inséré dans l'électrode de verre rempli de KCl est ensuite reliée à l'entrée de l'amplificateur, et un référentélectrode est inséré dans le bain environnant la cellule d'intérêt, l'achèvement du circuit. Cette configuration enregistre la différence de potentiel entre l'électrode extracellulaire référent et l'électrode de mesure intracellulaire, à savoir, le potentiel de membrane de la cellule 5. Avec cette méthode, Umrath fait le premier enregistrement intracellulaire d'une cellule de plante, en utilisant la 6,7 Nitella algues. Nitella est un organisme relativement simple à grandes cellules, et donc prête à des expériences électrophysiologiques intracellulaires. En revanche, l'insertion d'électrodes de verre intracellulaires dans les petites cellules de plantes terrestres multi-cellulaires, en trois dimensions est techniquement exigeante, nécessite un chercheur hautement qualifiée, ainsi que la visualisation sophistiquées, micromanipulation, et de l'équipement anti-vibration. Bien que les électrodes de verre sont aptes à enregistrer à partir de cellules superficielles dans les plantes, telles que des cellules de l'épiderme de la racine 8, recordin intracellulairegs de cellules profondément ancrées dans les tissus de la plante, tels que SES, très susceptible de causer des dommages-réponses induites, confondant les résultats. En 1989, Fromm et Eschrich rapporté l'utilisation d'une autre méthode, appelée «méthode de pucerons», dans lequel des électrodes de verre sont couplés à des stylets de pucerons après stylectomy 4. La méthode de puceron est peu invasive, parce stylets souples ne causent pas de tissus ou de cellules de dégâts que des électrodes de verre font. stylets de pucerons sont grande invention de la nature pour la pénétration de l'usine, et les pucerons sont beaucoup plus qualifiés que les humains à trouver SE. Malheureusement, cette méthode de pucerons est également très exigeant en termes d'expertise et de l'équipement technique. De plus, le succès de chaque expérience, qui met en oeuvre cette technique dépend entièrement du puceron étant en mode d'alimentation - de manière stable avec le stylet inséré dans une SE, au moment de stylectomy. Penser en rétrospective, on peut voir que les chances de succès de cette technique auraient pu improved en ajoutant au dispositif expérimental d'un instrument qui permet d'identifier si oui ou non le mandrin de pucerons se trouve dans la SE lors de l'application stylectomy.
En 1964, McLean et Kinsey ont décrit un «système de surveillance électronique» pour l'étude du comportement d'alimentation des pucerons en temps réel 9,10. Dans ce système, le puceron et l'usine de stylet-pénétré ont été intégrés dans un circuit électrique. Plus tard, en 1978, Tjallingii conçu une version modifiée du système, appelé le système «traversées électriques Graph» (EPG) 11,12. Alors que le système électronique de surveillance initiale était sensible aux potentiels de résistance-son origine seulement, avec le système EPG, la force électromotrice (fem) originaire potentiels, à savoir, généré dans l'usine ou dans l'insecte, pourraient être enregistrées en plus à des potentiels découlant de résistance (R) dans l'insecte. Cela représente une amélioration importante, parce que les deux composantes du signal, EMF et R,fournir des informations pertinentes sur les événements biologiques lors de la pénétration de l'usine par les pucerons. Ce qui rend le pré-amplificateur EPG sensible aux R-composants est relativement faible résistance d'entrée de 1 GQ, qui est proche de la moyenne de la résistance plante / puceron. Une petite tension de décalage (figure 1, V) d'environ 100 mV est appliqué sur la plante, qui est ensuite divisé pour plantes et les insectes d'un côté, et la résistance d'entrée de l'autre. Les tensions et leurs changements sont évalués à un point (figure 1A, B) entre l'insecte et la résistance d'entrée. Par conséquent, les R-composants représentent résistance modulations de plantes-pucerons de la tension de décalage, alors que les EMF-composants sont d'une certaine fraction du potentiel de la plante à la pointe du stylet et des potentiels causés dans l'insecte. Les potentiels de plantes les plus pertinents - - ici sont principalement des potentiels membranaires des cellules végétales poinçonnés par les stylets de pucerons. Les potentiels d'insectes semblent être principalementpotentiels d'écoulement causées par des mouvements fluides dans les deux canaux stylet, à savoir, la nourriture et les canaux salivaires; aucun nerveuses ou musculaires potentiels internes sont enregistrées dans l'EPG. Dans la pratique, les fonctions de pointe de stylet comme une pointe d'électrode. Toutes les cellules végétales sont chargées négativement à l'intérieur par rapport à l'extérieur de la cellule positif. Le courant électrique (par exemple, le mouvement des ions chargés en solution aqueuse) découlant de l'intérieur vers l'extérieur et vice versa est très limitée en raison de la forte résistance de la membrane cellulaire. Normalement, le potentiel de repos est maintenue constante. Toutefois, lorsque des ions négatifs ou des ions quittent positifs se déplacent en travers de la membrane cellulaire, le potentiel de la membrane est réduite, à savoir, ce dépolarise. Dépolarisation se produit en cas d'excitation de la cellule. Ions se déplacent ensuite ou lorsque des canaux ioniques spécifiques dans la membrane sont ouvertes ou lorsque la membrane est endommagée et des ions de fuite dans et hors. Toutes les cellules ont des canaux ioniques et des pompes à til plasma membrane qui apportent le potentiel de membrane à son niveau de repos en rétablissant la concentration initiale de divers ions dans la cellule. Le potentiel de repos et ses changements sont des éléments EMF, et par conséquent, la technique EPG est adapté pour les mesurer.
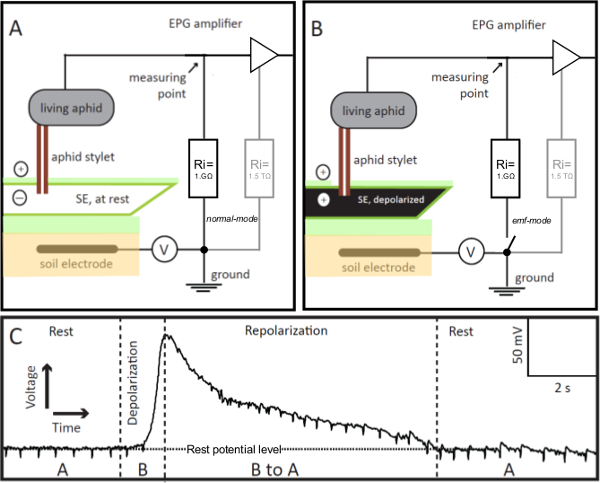
Figure 1. EPG-électrodes. L'EPG-électrode est un puceron vivant intégré dans le circuit électrique de pénétration Graphique (EPG), dont le stylet est inséré dans un élément de tamis (SE) en mode d'alimentation stable. Si le stylet-empalé SE est au repos (panneau A), la tension dans le circuit, enregistrée par EPG, est stable et au niveau potentiel de repos (Groupe C, repos). Si le SE est excité, ses dépolarise la membrane (panneau B), qui est visualisé dans l'EPG comme une augmentation progressive de la tension (panneau C, dépolarisation). Comme l'équilibre ionique dans la SE revient au repos, à savoir, il repolarizes, la tension enregistrée par EPG diminue progressivement au niveau potentiel de repos (Groupe C, repolarisation). Dans le panneau C, «A» et «B» font référence aux scénarios présentés dans les panneaux A et B, respectivement. V = source de tension de décalage réglable. Ri = résistance d'entrée. En parallèle à la résistance externe 1 GQ, l'amplificateur a une interne (dans le OpAmp) haute résistance de 1,5 TΩ (panneaux A et B, en gris). Par la télécommande de l'interrupteur de la pré-ampli EPG peut être modifié à la normale aux CEM-mode, qui permet d'obtenir des valeurs de tension très précis. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Dans la section suivante, nous fournissons le lecteur avec un protocole de base pour réaliser des expériences EPG qui est valable pour les deux études insectes concentré et végétales ciblée.
Protocole
1. Puceron Élevage
Remarque: Le choix des espèces végétales et pucerons pour les enregistrements EPG dépend du but de la recherche. Pour les études sur Arabidopsis thaliana, le puceron du brassicae Brevicoryne est approprié.
- Arrière B. pucerons brassicae dans une serre sur Brassica oleracea. Gardez les plantes utilisées pour le puceron élevage dans des cages, afin d'éviter de contaminer d'autres plantes. Gardez les plantes de pucerons élevage et de plantes expérimentales (dans notre cas B. oleracea et A. thaliana) dans des chambres séparées, afin d'éviter la contamination des plantes expérimentales avec des pucerons.
- Transfert pucerons aux plantes fraîches à propos de toutes les 2 semaines, avant de causer des dommages de l'usine importante, ou d'atteindre la surpopulation. Transfert 10-20 pucerons adultes à une usine d'élevage frais d'initier une nouvelle colonie.
- Surveiller l'élevage plantes régulièrement pour contamination par des espèces indésirables de pucerons, d'autres insectes herbivores, parasitoïdes de pucerons, et Fungi qui peuvent affecter la santé de la colonie de pucerons.
- Recueillir adultes, les pucerons aptères jusqu'à une semaine après leur mue finale pour l'enregistrement EPG.
- Après les expériences, retourner les plantes expérimentales qui ne sont pas utilisés pour la chambre de croissance, car ils ont souvent une progéniture qui a été produite au cours de l'enregistrement, ce qui pourrait contaminer par inadvertance d'autres plantes.
2. Insecte de câblage pour l'enregistrement EPG
- Pour faire électrodes insectes, obtenir broches du connecteur en laiton (clous, Ø 1,2 mm), fil de cuivre mince (Ø 0,2 mm), très mince fil d'or (Ø ca. 20 um), de la colle d'argent à base d'eau, un boulon à souder petite simple avec fluide de soudure et fils à souder résine fourré, stéréomicroscope avec un grossissement de 10X, petits ciseaux ou un scalpel, deux pinces fines, et une feuille de mousse de polystyrène ou de la boîte. Remarque: Un vortex pourrait être utile. Remarque: Le protocole étape par étape pour faire électrodes est indiqué dans la figure 2.
- Contre le puceronmanipulation et l'application de colle, d'obtenir: une petite et douce aquarelle poils de chameau brosse (taille 2 ou plus petit) et les broches d'insectes tels que ceux utilisés pour les collections d'insectes, bien que d'une aiguille à coudre amende ou cure-dent peuvent fonctionner aussi bien. Étape 4 montre comment démarrer l'enregistrement EPG.
- Étape 1.
Remarque: Les étapes 1 et 2 ci-dessous montrent comment préparer électrodes insectes moins le puceron. Étape 3 montre comment connecter un puceron à l'électrode. Vacuum fixation du puceron est recommandé pendant le câblage, mais pas toujours exigé pour les espèces lents (par exemple, B. brassicae).- Mettez sur le boulon à souder et faire fondre un peu de fil à souder à son extrémité (figure 2A). Mouiller la tête de la broche du connecteur en laiton avec un peu de liquide de soudure (figure 2B) et le tremper dans la soudure métal fondu (figure 2C).
- Appliquer une gaine de métal fondu de soudure sur une extrémité d'un long morceau de fil de cuivre mince 1-2 cm (Figure2D). Ensuite, mettre le fil de la broche et du cuivre ensemble contre le boulon à chaud (figure 2E) et les déplacer ensemble loin refroidir et se solidifier (figure 2F).
- Étape 2.
- Secouez (ou vortex) le flacon avec de la colle d'argent pendant plusieurs minutes jusqu'à obtenir une émulsion lisse est montré. Cut (ciseaux ou d'un scalpel) quelques morceaux de fil d'or (d'environ 1,5 cm de longueur) sur la plaque de l'objet de la loupe binoculaire (figure 2G).
- Prenez une broche de laiton avec du fil de cuivre soudé (faite à l'article 2.3) et trempez l'extrémité libre du fil de cuivre dans le petit réservoir de colle d'argent qui se sont rassemblés à l'intérieur du couvercle de la fiole après son ouverture (figure 2H). Remarque: Seule une petite gouttelette est nécessaire.
- Déplacez la fin de colle immersion du fil de cuivre pour le morceau de fil d'or, tout en soulevant une extrémité pour éviter les traînées de colle sur la plaque de l'objet stéréoscopique. Essayez de chevaucher copper et fil d'or de quelques mm (figure 2I), la distribution de la colle le long du chevauchement des deux fils.
- Attendez jusqu'à ce que la colle a été séché suffisamment pour maintenir les fils unie. Vérifier le contact de colle après séchage et ajouter un peu de colle fraîche avec une épingle ou un morceau de fil de cuivre si certaines parties des fils jointes montrent les pièces sans colle.
- Après l'électrode insecte est prêt, stocker, par exemple inséré dans un morceau de mousse de polystyrène.
Remarque: La longueur du fil d'or sera de déterminer la liberté de mouvement du puceron: si elle est trop courte (moins de 5 mm), le puceron peut se sentir contraint et ne sera pas se comporter normalement; si elle est trop longue (> 2 cm), le puceron se déplacer librement. Les pucerons ont tendance à se déplacer vers le côté adaxial de feuilles, si on les laisse. Si le fil d'or touche la feuille, le signal sera court-circuitée.
- Étape 3.
- Le puceron peut être maintenu en place par des moyens d'aspiration de lumière, en utilisant un vide; dans ce cas, installez til Dispositif d'aspiration sous la loupe binoculaire. Placer l'ouverture d'aspiration dans le centre du champ.
- Bien agiter le flacon avec de la colle d'argent pendant plusieurs minutes (ou vortex) jusqu'à obtenir une émulsion lisse. Recueillir un puceron avec la petite brosse.
- Allumez le dispositif d'aspiration et monter le puceron sur l'ouverture d'aspiration (Figure 2J), avec le dos de l'abdomen se sont tournés vers l'expérimentateur. Avec le pinceau, enlever la cire de l'abdomen (abondants dans les pucerons du chou) de surface.
- Ouvrir le flacon de colle humide et d'une broche avec une très petite goutte de colle à l'argent (Figure 2K). Appliquer la gouttelette de la colle d'argent sur le dos de l'abdomen du puceron (Figure 2L-M). Laissez cette goutte complètement sec pendant plusieurs minutes, agiter vigoureusement le flacon de colle à nouveau et ajouter une deuxième goutte de colle d'argent sur le dessus de la première. Remarque: Bien que la colle d'argent est un conducteur électrique, il ne provoque pas significativedommages à la cuticule de l'insecte.
- Après la fermeture du flacon de colle, insérer l'extrémité libre du fil d'or dans la gouttelette humide et toujours garder le fil tout en permettant à la colle de sécher complètement (Figure 2N). Évitez les bavures de colle sur les jambes ou les antennes et jetez un puceron si cela se produit.
- Éteignez le dispositif de fixation d'aspiration et soulevez délicatement l'insecte (Figure 2O). Si nécessaire, utilisez un pinceau fin pour aider à la levée du puceron du dispositif d'aspiration.
Remarque: câblage B. brassicae ne nécessite pas un vide, car ils peuvent être connectés sur un morceau d'un tissu de laboratoire de précision, la surface rugueuse de ce qui fournit le puceron avec suffisamment de poignée de façon que celle-ci ne soit élevé après l'application d'une goutte de colle humide à son abdomen. Après séchage de la colle, on peut soulever le puceron du tissu à l'aide d'un pinceau. - Insérez la broche de laiton avec l'insecte filaire dans le styromousse et, si nécessaire, continuerle câblage de tous les autres insectes à utiliser pour la session d'enregistrement EPG.
Remarque: Ces protocoles pour le câblage de pucerons fonctionnent bien pour nous. L'utilisateur peut trouver son / sa propre méthode pour le câblage de pucerons.
- Étape 4.
- Mettre des plantes dans la cage de Faraday (Figure 2P) sur un support non conducteur: utiliser des boîtes de Pétri ou une plaque de verre ou de plastique.
- Insérez une électrode de la plante dans le sol de chaque pot. Insérez la broche de laiton de l'insecte par câble dans le connecteur du pré-amplificateur EPG (Figure 2T) entrée. Remarque: l'électrode de terre ne correspond pas à l'électrode de masse utilisée dans d'autres techniques électrophysiologiques. Il a la tension de décalage nécessaire pour ajuster et compenser les tensions de polarisation d'électrode.
- Sur l'interface du logiciel d'acquisition Stylet +, avec une fréquence d'échantillonnage fixe de 100 Hz, entrez un nom de fichier, spécifiez le temps d'enregistrement, et écrire un texte pour préciser les détails de l'expérience (traitement, plante / inse espèces de ct, etc.) en commentaire les lignes 2 et 3.
- Abaisser les insectes sur une aire d'atterrissage convenable de l'usine et commencer la session d'enregistrement en cliquant sur le bouton Démarrer du logiciel d'acquisition (Stylet +) de l'interface.
Note 1: un maximum de 8 canaux peuvent être utilisés simultanément dans un EPG mis en place. Un EPG-électrode ou plusieurs électrodes EPG par plante peuvent être utilisés.
Note 2: lorsque l'objet de l'étude est le comportement des pucerons, commencer l'enregistrement avant que l'accès de l'usine des pucerons pour éviter de manquer les premières activités de pénétration de l'usine. - Pour étudier les réponses électrophysiologiques de SE aux stimuli, attendre au moins 10 minutes après le puceron est entré en phase phloème, afin de veiller à ce que le puceron est dans une phase phloème soutenue de l'ingestion, et que la ligne de base du signal est stable. Seulement alors, commencer toute expérience de stimulation de l'usine.
tp_upload / 52826 / 52826fig2.jpg "/>
Figure 2. Faire EPG-électrodes avec des pucerons ou d'autres insectes hémiptères pour électrique graphique de pénétration (EPG) des enregistrements. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
Panneaux AI, étapes nécessaires pour préparer EPG électrodes moins le puceron. Tout d'abord, faire fondre un morceau de métal à souder sur la pointe d'un boulon de soudure (A). Ensuite, plonger la tête de la broche en laiton dans une goutte de liquide à souder (B), et contactez-le avec le métal fondu à l'extrémité du boulon de soudure (C). Immédiatement après cette étape, contacter l'extrémité d'un fil de cuivre à la pointe de la vis de soudure, afin de coller à la tête de la broche de laiton (EF). Avec un scalpel ou une lame, couper un morceau de fil d'or (G). Trempettel'extrémité libre du fil de cuivre (joint à l'autre extrémité de la tige de laiton) sur la colle à l'argent (H) et rejoignent rapidement le fil d'or à ce (I) avant l'argent se dessèche. Le fil d'or est un excellent conducteur, et peut être polarisée. En réalité, dans la plupart des cas, la polarisation est trop faible pour être détecté, le cas échéant, il peut être compensée par la tension de décalage (V).
Panneaux Jo, étapes nécessaires pour connecter un puceron (ou d'un autre insecte hémiptère) à l'électrode. Tout d'abord, soulevez délicatement un puceron avec un pinceau à aquarelle fine et placez-le sur l'ouverture du dispositif d'aspiration (J). Tournez sur la pompe à vide et couvrir le trou de la valve d'air avec un morceau de papier pour appliquer une aspiration. Tremper le bout de la tige de l'insecte dans la colle d'argent (K), et de mettre une petite goutte de colle sur le dessus de l'abdomen du puceron, sous un stéréomicroscope (LM). Dans le~ 20 prochaines secondes, avant que la goutte de colle d'argent sur les sèche de pucerons, insérer l'extrémité du fil d'or de l'électrode d'insectes dans la gouttelette humide de colle d'argent, et de garder en place pendant 1-3 min, jusqu'à ce que la colle d'argent a complètement séché à l'air (N). À ce stade, désactiver aspiration en retirant la feuille de papier qui recouvre le trou de la valve d'air du dispositif d'aspiration et enlevez soigneusement le puceron, du dispositif d'aspiration: soulever le puceron après le câblage nécessite souvent une aide par un pinceau fin (O).
Groupe P donne un aperçu de l'ensemble du EPG mis en place à l'intérieur de la cage de Faraday, et le Groupe Q donne un aperçu de la combinaison de plantes pucerons pour EPG. Voir la section 2 ci-dessus pour une explication plus détaillée de ce processus.
Les petites lettres sont des étiquettes renvoyant aux articles que l'on doit faire EPG-électrodes: a: boulon à souder; b: le métal fondu à souder;c: fluide à souder; d: laiton broches du connecteur (clou); e: fil de cuivre; f: Ø 18μm fil d'or; g: dispositif d'aspiration; h: pucerons; i: de la colle d'argent à base d'eau; j: cage de Faraday; k: électrode de plante; l: connecteur d'entrée (BNC) du pré-amplificateur EPG.
Résultats
Dans une étude précédente, nous avons implémenté la technique EPG-électrode dans le but de caractériser les signaux électriques produits en SE de la nervure médiane pendant chenille attaque 1. La nervure médiane est un site d'insertion préféré pour des électrodes de verre classiques, ainsi que pour les électrodes verre-stylet, parce qu'il est SE-dense et relativement robuste, donc soumis à la fixation nécessaire pour mettre en oeuvre ces techniques. Ici, nous avons profité de la poly...
Discussion
Cet article fournit un protocole détaillé pour la fabrication de traversées électriques Graphique (EPG) enregistrements. La technique EPG est bien établi, avec 100-200 utilisateurs actifs dans le monde, et il a été mis en œuvre pour de nombreuses études sur différents sujets, par exemple: a) la résistance de la plante hôte aux pucerons et autres insectes de stylet portant 13; mécanismes de transmission b) de virus pathogènes des plantes et 14; c) mode d'action insecticide, (toxici...
Déclarations de divulgation
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
Remerciements
TRSB a été soutenue par une subvention Marie Curie IIF (blessure dans TERRE, acronyme pour: Blessure induite signaux électriques dans Arabidopsis thaliana).
matériels
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Références
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon